Строение органических соединений. Причины их многообразия. Анализ соединений. метан
advertisement
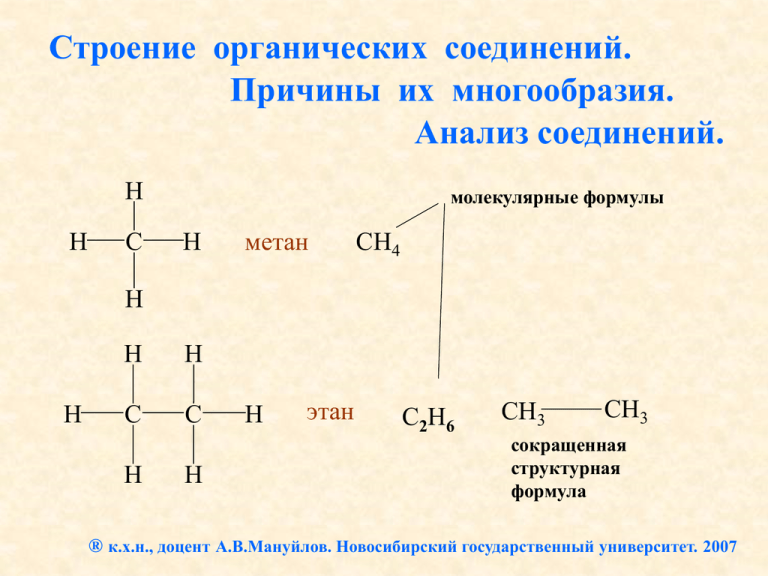
Строение органических соединений. Причины их многообразия. Анализ соединений. H H C молекулярные формулы H метан СН4 H H H H C C H H H этан С2Н6 CH3 CH3 сокращенная структурная формула ® к.х.н., доцент А.В.Мануйлов. Новосибирский государственный университет. 2007 CH3 CH2 CH3 пропан CH3 CH2 CH2 CH3 С3Н8 бутан С4Н10 H3C CH CH3 изобутан H3C Изомеры: имеют одинаковую молекулярную формулу, но разное строение. С …2s2 2p2 H .. .. .. H .. H .. H :H : : : : O C C C H: C .. .. .. .. .. HHHH . .C . . + CH3 .H .H .H .H H .. H: C .. :H H CH2 .. O .. CH2 CH2 бутанол (спирт) H Энергии химических связей (кДж/моль): Lange’s Handbook of Chemistry, 15-th ed. by Dean J.A., 1999. 368 H3C CH2 CH3 HO 418 .. O .. CH 682 H2C CH2 962 HC CH CH CH2 214 .. O .. OH .. O .. Цепи из молекул кислорода неустойчивы. Валентность (II) не позволяет существовать изомерам. Энергии химических связей (кДж/моль): Lange’s Handbook of Chemistry, 15-th ed. by Dean J.A., 1999. H3C 368 272 CH3 S4R2 C4H8R2 CH2 R .. S .. R CH2 CH2 SH SH .. S .. R Такие цепи уже устойчивы, но нет изомеров! CH2 CH2 .. S .. .. S .. R R CH3 CH2 CH R CH2 CH2 R CH3 CH CH2 CH2 CH2 Здесь – много изомеров R и т.д. Энергии химических связей (кДж/моль): Lange’s Handbook of Chemistry, 15-th ed. by Dean J.A., 1999. H3C C 368 + H H3Si CH3 + Si H 2.55 2.1 1.8 2.1 электроотрицательность атомов 339 SiH3 SiH4 - силан SiH3 SiH3 SiH3 SiH2 SiH3 …………………… SiH3 (SiH2)4 SiH3 (больше нет) Силаны – весьма реакционноспособные соединения и в земных условиях сразу превращаются в другие вещества: 2Si4H10 + 13O2 = 8SiO2 + 10H2O (самопроизвольно); Si2H6 + 6H2O = 2H2SiO3 + 7H2 (например, в морской воде: pH > 7). 368 H3C CH H2C 682 418 CH2 962 HC кДж H2N CH3 297 CH NH2 HN Затратили: 418·3 = 1254 кДж Выиграли: 3·(962 – 682) = 3·280 = 840 кДж 456 NH 946 N N Итог: проиграли (1254 – 840) = 414 кДж CH H H H H C H C C C C C H H C C C + H C H C C H H H распад невыгоден 368 H3C CH H2C 682 418 кДж CH3 CH NH2 HN 456 NH 946 N N Затратили: 297·3 = 891 кДж CH2 962 HC H2N 297 Выиграли: 3·(946 – 456) = 3·490 = 1470 кДж CH Итог: выиграли (1470 – 891) = 579 кДж N N N N N N + N N N N N N распад выгоден! Академик В. А. Коптюг H H C H C C C C H H C H В энергиях связей причина того, что существуют углеродные цепи: C CH2 (карбин) C C C CH2 CH2 (алканы) и т.д. CH2 CH2 CH2 C C И не существуют подобные соединения: N N N N N NH N NH NH N N N N N NH NH N NH Алканы (СН4 С2Н6 С3Н8 С4Н10 и т.д.): CnH2n+2 Большинство из них существует в виде изомеров, например: CH3 CH3 CH2 CH2 CH3 бутан CH3 CH CH3 изобутан - изомеры С4Н10 Изомеры пентана С5Н12 CH3 CH3 CH2 CH2 CH2 CH3 CH3 CH CH2 CH3 CH3 CH3 C CH3 CH3 н-пентан изопентан неопентан Число изомеров алканов CnH2n+2 в зависимости от n n Число изомеров 1 1 CH4 2 1 CH3 CH3 3 1 CH3 CH2 CH3 4 2 5 3 10 75 15 4 347 20 366 319 25 36 797 588 или другое изображение: C10H22 C15H32 C20H42 C25H52 Анализ органических соединений методом сожжения: C2H5OH + O2 = CO2 + H2O спирт Весь водород образца теперь в Н2О Масса С в образце = = (масса СО2)·12/44 Масса Н = = (масса Н2О)·2/18 C2 H6 O + O2 = CO2 + H2O Весь углерод образца оказывается в СО2 Пример: сожгли образец вещества массой 2,3 г. Получили: СО2 – 4,4 г, Н2О – 2,7 г. Масса углерода в образце: (4,4·12/44) = 1,2 г. Масса водорода в образце: (2,7·2/18) = 0,3 г. 1,5 г Кислорода в образце: 2,3 г – 1,5 г = 0,8 г. Образец (масса известна) О2 нагревают, чтобы поджечь образец поглотитель СО2 (NaOH) поглотитель Н2О (CaCl2 прокаленный) Итак: С - 1,2 г. Н - 0,3 г. О - 0,8 г. Тогда соотношение атомов в молекуле: 1,2 г 0,3 г : 0,8 г : С:Н:О= 1 16 12 г на моль атомов = 0,1 : 0,3 : 0,05 теперь достаточно разделить на меньшее из этих чисел (0,05) С:Н:О=2:6:1 Получили формулу С2Н6О Это – эмпирическая формула (показывает соотношение атомов в молекуле) поглотитель СО2 (NaOH) поглотитель Н2О (CaCl2 прокаленный) В данном случае эмпирическая формула совпадает с истинной – молекулярной формулой : С2Н6О. (соединения С4Н12О2, С6Н18О3 и т.д. не существуют!) Но в общем случае молекулярная формула может быть кратна эмпирической. А вот структурную формулу (строение данного вещества) мы сможем выяснить только дополнительными экспериментами: изомеры С2Н6О CH3 CH2 OH + Na = CH3 CH2 ONa спирт CH3 O CH3 + Na эфир нет реакции + H2 выделение водорода Современные методы установления строения Газовый хроматомасс-спектрометр Agilent 5973N EI/PCI на Факультете естественных наук НГУ Как устроен хромато-масс спектрометр? Робот для вкалывания смесей органических соединений Виалы со смесями, которые ждут очереди на анализ Термошкаф Тонкий кварцевый капилляр длиной 30 м Робот для загрузки проб в хроматограф Виалы (контейнеры) со смесями для анализа Шприц робота, который автоматически прокалывает резиновые крышечки контейнеров с пробами и вкалывает их в хроматограф Сюда робот подает смесь органических веществ Здесь разделенные вещества по очереди покидают колонку и попадают в детектор Здесь, проходя долгий путь по кварцевому капилляру, смесь разделяется Детектор записывает – сколько прошло вещества, через какое время после вкалывания смеси в хроматограф. Количество вещества пропорционально площади пика на графике. Такой график называется хроматограммой: 92 минуты 60 минут 96 минут 0 минут (время удерживания вещества в колонке) Из детектора разделенные вещества по очереди попадают в масс-спектрометр: Масс-спектр отправляется в компьютер с базой данных на 300 тыс. соединений Как устроен масс-спектрометр? Ионы попадают в магнит Сюда попадает вещество Здесь оно подвергается электронному удару: М + е = М+ + 2е Здесь регистрируется слабый ток ионов детектор Чем меньше масса иона, тем сильнее он отклоняется магнитным полем Прибор различает массы ионов по месту их попадания на пластину детектора Так выглядит масс-спектр: Массспектр вещества Массспектр эталона из базы данных Рассмотрим: масс-спектр детальнее В детекторе C12H26 - алкан с молекулярной массой 170 а.е.м. «осколки» молекулы В баночке – фракция нефти. Какие задачи позволяет решать такой метод? Вот что получилось после прохождения смеси через прибор: Хроматограмма всей смеси Масс-спектр одного из веществ смеси (додекана С12Н24) Хроматограмма нефтяной фракции на Agilent 5973N EI/PCI Abundance TIC: MAN4.D 3800000 3600000 3400000 3200000 3000000 2800000 2600000 2400000 2200000 2000000 1800000 1600000 1400000 1200000 1000000 800000 600000 400000 200000 125 12.10 0.23 C:\Database\NIST02.L Heptylcyclohexane 44142 005617-41-4 78 Heptylcyclohexane 44140 005617-41-4 49 Cyclohexane, 2-propenyl10318 002114-42-3 49 126 12.50 0.16 C:\Database\NIST02.L Dodecane, 2,6,10-trimethyl64589 003891-98-3 91 Hexadecane, 2,6,10,14-tetramethyl- 107666 000638-36-8 86 Hexadecane, 2,6,10,14-tetramethyl- 107670 000638-36-8 64 127 12.81 0.31 C:\Database\NIST02.L Tetradecane 55008 000629-59-4 97 4.00 6.00 8.00 Time--> Гексадекан, 2,6,10,14-тетраметил или фитан: 10.00 12.00 14.00 16.00 18.00 C20H42 Фитан – свидетель биологического происхождения нефти? фитан C20H42 Современные методы анализа позволяют быстро решать сложные задачи на установление строения органических веществ! Хлорофилл α N N Mg N N O O O O O Фитановая боковая цепь C20 O Благодаря современным физическим методам установления строения органическая химия становится все более эффективной наукой Спасибо за внимание N N Mg N N O O O O





