Метод однократного испарения (ОИ)
advertisement

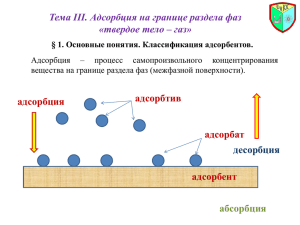
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ РАЗДЕЛЕНИЯ ГОРЮЧИХ ИСКОПАЕМЫХ И ПРОДУКТОВ ИХ ПЕРЕРАБОТКИ ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ МЕТОДОВ ОДНОКРАТНОГО ИСПАРЕНИЯ, РЕКТИФИКАЦИИ, АДСОРБЦИИ, АБСОРБЦИИ, ЭКСТРАКЦИИ, КРИСТАЛЛИЗАЦИИ, МЕМБРАННЫХ МЕТОДОВ РАЗДЕЛЕНИЯ Скорость перехода вещества пропорциональна степени отклонения от равновесия: * q KF C C C C где q – количество вещества, перешедшее из одной фазы в другую, кг/с; К – коэффициент пропорциональности (или коэффициент массопередачи, м/с); F – поверхность соприкосновения фаз, м2; 3 С – движущая сила массопередачи, кг/м ; С – фактическая концентрация компонента в одной из фаз; С* – равновесная концентрация компонента в той же фазе. Метод однократного испарения Метод однократного испарения (ОИ) многокомпонентной углеводородной смеси заключается в определении доли паров, которые образуются при нагревании исходной смеси до заданной температуры. Расчетное уравнение получают совместным решением уравнения материального баланса процесса ОИ по содержанию компонента i и уравнения равновесия фаз: ' XF i ' ' ' ' ' ' e yi (1 e ) xi yi Kp xi i K p Pi / П i при П < 0,4–0,5 МПа X F' i– мольная доля компонента i в исходной смеси; e' и (1 –e ') мольные доли паров (доля отгона) и жидкой фазы соответственно; K–р константа фазового равновесия компонента i. Pi – давление насыщенных паров компонента i при температуре ОИ; П – давление в системе, при котором производится ОИ. Совместным решением уравнений получаем: ' ' Xi xF xi / M i x 'i ( xi / M i ) i 1 e '( K р 1) i М M X 'F XF i Mi i M Мi– молекулярная масса компонента; М – средняя молекулярная масса сырья. 1 m XF i 1 M i i Ректификация Ректификацией называется массообменнный процесс разделения жидких смесей на чистые компоненты, различающиеся по температурам кипения, за счет противоточного многократного контактирования паров и жидкости. В работающей ректификационной колонне через каждую тарелку проходят 4 потока: 1) жидкость – флегма, стекающая с вышележащей тарелки; 2) пары, поступающие с нижележащей тарелки; 3) жидкость – флегма, уходящая на нижележащую тарелку; 4) пары, поднимающиеся на вышележащую тарелку. Схема потоков колонны: При установившемся режиме работы колонны уравнение материального баланса представляется в следующем виде: F=D+W, тогда для низкокипящего компонента FxF = DxD + WxW. Из полученных уравнений, при известных F и xF, определяют количество либо дистиллята D, либо кубового остатка W: FxF DxD ( F D) xW ( xF xW ) D F xD xW xF xD W F xW xD Адсорбция Адсорбция – это процесс концентрирования газов или жидкостей на поверхности твердых адсорбентов. Уравнение изотермы адсорбции Лэнгмюра mmax Api* m 1 Api* где m – количество вещества, поглощенное массовой (или об.) единицей сорбента; А – константа, зависящая от свойств сорбента и поглощаемого вещества; mmax – емкость монослоя (максимальная адсорбция при покрытии активных pi центров монослоя); – равновесное парциальное давление адсорбируемого i-го газа. Например, при восстановлении СО2 (в газогенераторе, доменных печах) по реакции С(Т) + СО2(Г) = 2СО(Г) K 1 хр * ( pCO )2 хр pCO2 * рCO 2 Р ΔН = –167,5 КДж, Кр * pCO хр2 Р 2 (1 хр ) Р Р хр2 Р 1 хр Основные различия между физической и химической адсорбцией Физическая адсорбция 1) Теплота адсорбции ~ 10 ÷ 30 кДж/моль 2) Скорость адсорбции W ~ a – число ударов о стенку 3) Температурная зависимость скорости W ~ a ~ T 4) Адсорбция неспецифична и ряд по адсорбируемости сохраняется на любом адсорбенте. Химическая адсорбция 1) ~ 100 ÷ 300 кДж/моль 2) W ae E RT , где Е > 80 ÷ 120 кДж/моль 3) Скорость процесса резко увеличивается с температурой 4) Адсорбция специфична. Данный газ может с одним адсорбентом реагировать, с другим – нет. Абсорбция Абсорбция – это процесс объемного поглощения газов и паров жидкостью с образованием раствора. Для абсорбционно-десорбционных процессов равновесие между газами и их растворами в жидкости выражается законом Генри: р ψN * где р* – равновесное парциальное давление поглощаемого компонент в газе; N – молярная доля поглощаемого компонента в растворе; ψ – постоянная Генри (размерность давления). Экстракция Движущая сила любого процесса, в том числе и при образовании раствора, характеризуется свободной энергией. Для любого раствора справедливо равенство G I T S Углеводородные системы можно рассматривать в первом приближении как идеальные, подчиняющиеся закону Рауля: 0 Pi Pi X i Коэффициент относительной летучести (α) растворяемых компонентов рассчитывается как отношение давлений насыщенного пара: P10 α 0 P2 При введении полярного растворителя система становится неидеальной: Pi γi Pi X i 0 Коэффициент относительной летучести (αр) разделяемых компонентов в присутствии растворителя 0 αp Селективность γ1P1 γ2 P20 αp γ1 S α γ2 Значение коэффициентов активности углеводородов различных гомологических рядов (при одинаковом числе углеродных атомов в молекуле) в полярных растворителях изменяется в ряду алканы > циклоалканы > алкены > алкадиены > арены. Максимальная селективность при данной температуре достигается при бесконечном разбавлении углеводородов: γ1 0 Smax γ2 0