Биосфера. Происхождение и эволюция
advertisement

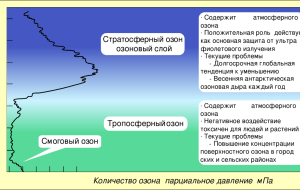
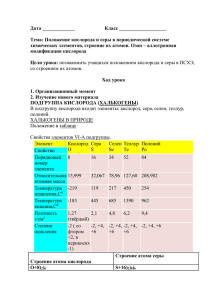
Биосфера. Происхождение и эволюция. Экологические системы: структура. Классификация, функционирование. Структура социоэкосистемы. Лекция на тему: “Гигиеническое значение естественных факторов на здоровье человека. Использование ее составляющих с лечебно-профилактической целью” Основной состав атмосферного воздуха: кислород (О2) азот (N) диоксид углерода (CO2) В состав атмосферного воздуха также входят: водород (Н2) метан (СН4) аммиак (NH4) сероводород (SH4) перекись водорода (Н2О2) Воздух N О2 СО2 Насыщение водяными парамы Атмосферный Воды от 1 78,97 20,7-20,9 0,03-0,04 до 30 г/мз Выдыхаемый 79,2 15,4-16 3,4-4,7 Насыщенный При уменьшении содержания кислорода ниже 16 % ускоряется частота дыхания и увеличивается количество сердечных ударов. При 7-8% кислорода эти компенсаторные явления не помогают, наступает асфиксия, снижение температуры тела, анурия или гематурия, потеря сознания и смерть. При вскрытии умерших наблюдается жировое перерождение внутренних органов. Тренированные люди, например, пилоты, могут в течение некоторое время выдерживать концентрации кислорода 10 % и ниже. Водолазы без вредных последствий дышат воздухом, который содержит 50 % кислорода. Так же безвредное вдыхание 30-50 % кислорода больными. Водород (Н) Образуется в высоких слоях атмосферы в результате фотохимического разложения молекул воды на кислород и водород. Метан (СН4) выделяется при анаэробном гниении органических соединений как составляющая природного газа. Концентрация его в атмосферном воздухе не превышает 0,00022% (Не поддерживает дыхания. При накоплении его в воздухе в больших концентрациях возможна смерть от асфиксии.) Аммиак (NH4) Его концентрация зависит от степени загрязненности данной территории: в чистом воздухе (вдали от населенных пунктов) – 0,003-0,005 мг/м3 Перекись водорода (Н2О2) Образуется в результате взаимодействия ультрафиолетовых лучей с молекулами воздуха и вместе с озоном способствует окислению органических веществ в атмосфере УГЛЕКИСЛЫЙ ГАЗ В ПРИРОДЕ 70% 22% 8% Моря і океани Мінеральні сполуки Тварини і рослини Содержание углекислоты во внешней атмосфере колеблется от 0,03 до 0,04%. Источники ее: дыхание людей, животных, горения, гниения, выделения из почвы, рудников, вулканов, некоторых минеральных источников. Рядом с образованием происходит расходование углекислоты. Растения, потребляя углекислоту, образуют в своих тканях углеводы, а при наличии азота и белки. Большие количества углекислоты выносятся из атмосферы с дождями. Повышены концентрации углекислоты негативно влияют на организм человека: а) при 3% наблюдается ускорение и углубление дыхания; б) при 4%, кроме этого, появляется ощущение сжатия председателя, головная боль, шум в ушах, психическое возбуждение, сердцебиение, замедление пульса, иногда блюет и обморок; в) при 6-8% - перечисленные явления усиливаются; г) при 10% наступает быстрое знепритомнення и остановка дыхания, хотя сердце еще некоторое время продолжает работать; д) при 20% через несколько секунд наступает паралич мозговых центров и смерть. ОЗОН за высоких концентрациях имеет запах, подобный запаху хлору, при умеренных - “запах электричества”. Оказывается обонянием при концентрации 0,002 мг/л. При взаемодействии з органическими веществами озон быстро розкладается /Оз → О2 + О /, окисляя их. Озон образуется в атмосфере из кислорода во время грозы /электроразряды/, под деянием ультрафиолетового луча солнца, в присутствии смолистых веществ, например, в хвойных лесах, и при испарении больших масс воды. Поэтому озон находят чаще на берегах морей, на опушке леса, после грозы. После грозы он оказывается даже в воздухе городов хотя обычно его там нет. Озон является показателем исключительной чистоты воздуха. Озон постоянно содержится в воздухе rentgen- и физиотерапевтические кабинеты, появляясь под воздействием quartz освещений, spark цифр, и иногда вызывает ряд болезненных явлений в персонале. Большие количества его действуют сонным.Концентрації 0,002- 0,005 мг/л: раздражают слизевые дыхательных путей вызывают головокружение слюнотечение усилено потение усталость. У мелких животных вдыхания воздуха, который содержит 0,01 мг/л озону, через несколько часов вызывает смерть. Озон при высоких концентрациях имеет запах, подобный запаху хлору, при умеренных - "запах электричества". Его запах проявляется при концентрации 0,002 мг/л. Эффект Озона на Бактериях 1 И Компьютерное изображение ячейки бактерий 2 И Увеличены молекулы озона, которые входят в контакт с бактериальной стенкой 3 И Озон проходит через бактериальную стенку 4 И Увеличены молекулы озона на стенке ячейки бактерий 5 И Бактериальная ячейка после нескольких молекул озона входит в контакт 6 И Разрушения ячейки после действия озона Азот - газ, мало растворимый в воде. Считают, что для человека азот индифферентен. Он служит словно для разбавления кислорода в атмосфере. Под воздействием электрических разрядов азот окисляется и в виде азотистых соединений из воздуха вымывается дождями в почву. Это повышает урожайность почвы. При повышенном давлении чистый азот действует как наркотик. Наблюдаются: возбуждение разговорчивость, Тяжесть в голове, плутаность думок, Забывчивость и иные нарушения Окиснул углероду (чадный газ) являет собой бесцветный газ, безвкусно, с едва ощутимым запахом, хоть многие исследователи считают, что он без запаха. Удельный вес его меньше, чем воздух, - 0,967. Окиснул углероду является продуктом неполного окисления углерода. Окиснул углероду горит синеватым пламенем. Чадный газ образуется везде, где происходит горение при недостаточности кислорода, потому что при достаточном количестве кислорода углерод во время горения окислялся бы к углекислоте. Окиснул углероду поступает в воздух из топок печей, при курении, от самоваров, керосиновых ламп, светильных свеч, при сгорании светильного газа в плитах, с выхлопными газами автомобильных и других моторов, от масляной краски в момент ее высыхания и тому подобное. Максимальные концентрации окиси углерода для человека 0,02%. Механизм отравления заключается в том, который окиснул углероду связывается с гемоглобином крови, образовывая карбоксигемоглобин. Окиснул углероду имеет в 250-300 раз большее родство к гемоглобину, чем кислород. Поэтому даже при сравнительно очень незначительном парциальном давлении окиснул углероду быстро вытесняет кислород из гемоглобина. В последние годы некоторые исследователи объясняют механизм отравления не столько большим родством CO к гемоглобину, сколько значительно более малым скоростью распада молекул карбоксигемоглобина. По их данным, гемоглобин крови напитывается окисью углерода в 10 раз медленнее, чем кислородом, но обратная диссоциация карбоксигемоглобина происходит в 3600 раз медленнее, чем оксигемоглобину. Аммиак - газ с щелочным вкусом и резким специфическим запахом, легко растворимый в воде. В атмосфере населенных мест он выделяется из веществ, которые гниют а последние в зоне населенных мест, - это чаще всего нечистоты. В значительных концентрациях этот газ есть в канализационных коллекторах. Может быть он и в производственных условиях при изготовлении кокса, при холодильном производстве, где применяется аммиак. Человек чувствует присутствие достаточно малых концентраций аммиака в воздухе. При концентрациях 0,1 мг/л аммиак вызывает раздражение дыхательных путей, при концентрациях более высоких (0,15-0,25 мг/л) наблюдается сильное раздражение конъюнктивы глаз, слизевой носа, чихание, слюнотечение, головная боль, потение. При больших концентрациях (от 3,5 до 7,0 мг/л) наступает смерть от отека легких. Во внешнем воздухе населенных мест обычно встречаются очень незначительные количества аммиака - до 0,0025 мг/л. Эти концентрации безвредны, хотя и могут быть ощутимые на запах. При этих концентрациях аммиак является показателем загрязнения воздуха. Сероводород - бесцветный газ с запахом тухлых яиц. Плотность його- 1,19, то есть он тяжелее воздуха. Поэтому в колодцах и ямах, где он образуется при гниении, сероводород накапливается в нижних слоях воздуха. При малых концентрациях сероводород ощутимый на запах, а при больших концентрациях запах почти не чувствуется в результате поражения окончаний обонятельных нервов в дыхательных путях. Сероводород встречается и как продукт гниения в канализационных каналах, ямах, тоннелях, а также на ряду производств, в лабораториях, при серистом окрашивании, где сера может выделяться в воздух, возобновляясь к H2s, в производстве кожи, при добыче некоторых сортов нефти, при изготовлении ультрамарина и во многих других производствах, где применяется сера. При концентрациях больших за 1 мг/л наступает молниеносное отравление, человек сразу теряет сознание и падает, как подкосимая, может наступить и смерть. Немного меньшие концентрации (от 1 до 0,7 мг/л) тоже опасны, однако при более длительном вдыхании (около часа). Обонянием оказываются очень малые концентрации-до 0,0028 мг/л. Санитарные нормы ограничивают концентрацию сероводороду в воздухе населенных мест в количестве 0,00015 мг/л. Серистый газ (серистый ангидрид), So2 И бесцветный газ с резким удушающим запахом, хорошо растворяется в воде, образовывая серистую и серную кислоты. Принадлежит к раздражающим газам. Осаждаясь, пыль и So2, действуют на людей, растения, одела и т.п. Растения могут погибнуть даже под действием незначительных концентраций серистого газа. Поэтому в воздухе городов не допускаются больше за 0,25 мг/м3 серистого газа. Концентрации 20- 50 мг/м3 раздражают гортань и конъюнктиву глаза. При некоторых метеорологических условиях серистый газ может наносить большой вред человеку и вызывать массовые заболевания и даже смерть. Особенно способствуют нагромождению в атмосфере вредных промышленных газов, и в частности So2, туманы. Увеличение концентрации So2 при наличии туманов приводит к повышенной заболеваемости и даже смертности, особенно у людей с заболеваниями легких и сердечно-сосудистой и системы, а также среди лиц пожилого возраста. Благодарю за внимание