Химическая термодинамика
advertisement
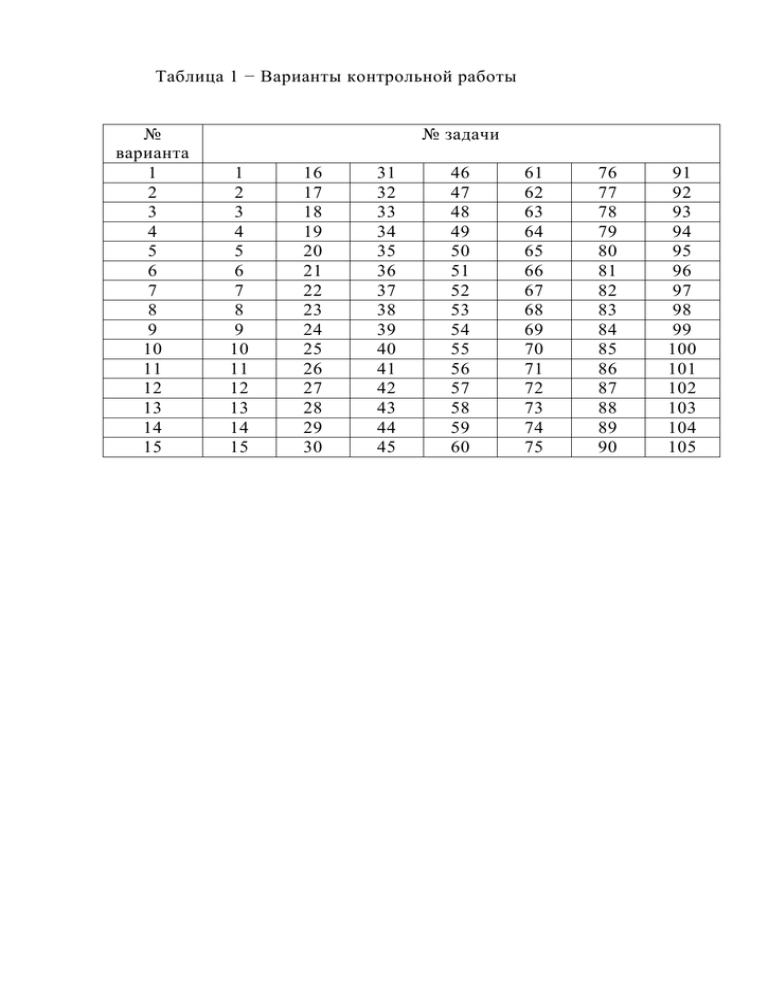
Таблица 1 − Варианты контрольной работы № варианта 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 № задачи 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 2 Задачи контрольной работы Газовые законы 1. Давление газа, занимающего при некоторой температуре объем 0,3 м3, равно 100 кПа. Каким будет давление, если при той же температуре увеличить объем газа до 0,6 м3? 2. Объем газа при температуре 350 К равен 105 м3. Определить его объем, если давление увеличивается в 2,5 раза. 3. Газ, находившийся под давлением 100 кПа, после повышения давления при той же температуре до 0,2 МПа занял объем 3 л. Вычислить начальный объем газа. 4. При 20 оС объем газа составляет 450 л. Какой объем займет тот же газ при 50 оС (р=const)? 5. Во сколько раз уменьшится объем газа, если при постоянном давлении уменьшить его температуру в 3 раза? 6. Газ при 298 К занимает объем 0,5 м3. Вычислить, при какой температуре объем газа станет равным 0,9 м3 (р=const). 7. В баллоне при 25 оС находится газ под давлением 3 МПа. Каким станет давление, если температура повысится до 50 оС? 8. При 20 оС давление в баллоне с азотом равно 105 кПа. При какой температуре давление станет равным 110 кПа? 9. На сколько градусов увеличится температура в баллоне с азотом, если при нагревании его от 19 оС давление возросло в 1,5 раза. 10. При 20 оС и 80 кПа газ занимает объем 0,7 л. Вычислить объем газа при 10 оС и давлении 100 кПа. 11. Привести к нормальным условиям (Т=0 оС, Р=1 атм) объем газа, который при давлении 0,7 атм и температуре 60 оС занимает объем 100 л. 12. Определить объем сжатого в компрессоре до 2 атм и нагретого до 55 оС воздуха, если поступивший воздух имел объем 200 м3, температуру 3 17 оС и находился под давлением 1 атм. 13. Средняя квадратичная скорость молекул углекислого газа равна 390 м/с. Каково давление газа, если в 20 л его находится 0,5 моль? 14. Вычислите давление азота, если 5 л его имеют массу 3 г. Средняя квадратичная скорость молекул азота равна 1064 м/с. 15. При какой температуре средняя квадратичная скорость молекул кислорода равна 400 м/с? На сколько градусов нужно повысить температуру, чтобы средняя квадратичная скорость молекул кислорода возросла в 2 раза? 16. Вычислите среднюю квадратичную скорость молекул азота при 18 °С. При какой температуре такую же среднюю квадратичную скорость будут иметь молекулы аммиака? 17. Во сколько раз средняя квадратичная скорость молекул водорода больше средней квадратичной скорости молекул бромоводорода при одинаковых условиях? 18. Вычислите давление водорода, если средняя кинетическая энергия его молекул, содержащихся в 1 л при 0 °С, равна 1,509∙103 Дж. 19. Вычислите среднюю кинетическую энергию молекул 1 моль одноатомного газа при 27 °С? 20. При какой температуре средняя кинетическая энергия 1 моль идеального газа равна 5∙103 Дж/моль? 21. Определите среднюю кинетическую энергию одной молекулы идеального газа при 100 °С. Химическая термодинамика 22. Какова будет работа адиабатического сжатия 1 моль азота, если при этом температура повысилась от 0 до 50 °С? 23. При адиабатическом сжатии кислорода объемом 0,002 м3 давление газа повысилось от 1,013∙105 до 2,026∙106 Па. Чему равен 4 конечный объем? 24. 1 моль одноатомного газа, взятого при 25 °С и давлении 1,013∙105 Па, адиабатически расширился до 0,05 м3. Каковы будут конечные давление и температура? 25. Гелий массой 10 г, взятый при 25 °С, адиабатически расширился от 0,01 до 0,005 м3. Определите работу, совершенную газом. 26. Аргон массой 10 г нагрели на 10 °С в одном случае при постоянном объеме, а в другом − при постоянном давлении. Какова будет разница в количестве затраченной при этом теплоты? 27. Взят азот массой 100 г при 0 °С и давлении 1,013∙105 Па. Определите количество сообщенной системе теплоты. Как изменилась внутренняя энергия и какова совершенная работа при: а) изотермическом расширении газа до объема в 0,1 м3; б) изохорическом сжатии до 2,026∙105 Па; в) изобарическом расширении объема в 3 раза? 28. При растворении гидроксида натрия массой 10 г в воде массой 250 г температура раствора повышается на 9,5 °С. Определите теплоту растворения гидроксида натрия, принимая удельную теплоемкость раствора равной 4,19 Дж/(г∙К). 29. Теплота растворения соли NH4NO3 равна 26,8 кДж. Определите, как и на сколько градусов Цельсия изменится температура при растворении соли массой 20 г в воде массой 180 г. Удельная теплоемкость полученного раствора равна 3,77 Дж/(г∙К). 30. При растворении безводного сульфата меди массой 32 г в воде массой 80 г выделяется 13,3 кДж теплоты, а при растворении CuSO4∙5Н2О массой 50 г в том же количестве воды поглощается 2,34 кДж. Определите теплоту гидратации сульфата меди. 31. Теплоты нейтрализации NaOH и NH4OH хлороводородной кислотой соответственно равны -57,3 кДж и -51,4 кДж. Определите теплоту диссоциации NH4OH, считая его практически недиссоциированным. 5 32. Как изменится энтропия 1моль гелия при нагревании его от 20 до 70 °С, если объем газа при этом изменился от 24 до 28,1 л? 33. Вода массой 100 г при 25 °С превращена в пар с температурой 150 °С и давлением 1,013∙105 Па. Вычислите изменение энтропии этого перехода, если удельная теплота испарения воды при 100 °С равна 2257 Дж/г, удельная теплоемкость воды 4,187 Дж/(г∙К), а удельная теплоемкость водяного пара при давлении 1,013∙105 Па равна 1,968 Дж/(г∙К). 34. Рассчитайте изменение энтропии при смешении 1 моль водорода с 1 моль азота при давлении 1,013∙105 Па и постоянной температуре. 35. Найдите изменение энтропии при переходе 3 моль кислорода от объема 0,0336 м3 под давлением 2,026∙105 Па к объему 0,0672 м3 под давлением 1,013∙106 Па. Молярная теплоемкость кислорода Ср равна 29,37 Дж/(моль∙К), температура постоянна. Термохимия 36. Рассчитайте энтальпию образования N2O5(г) температуре 298 К на основании следующих данных: 2NO(г) + O2(г) = 2NO2(г); ∆H1o = -114,3 кДж/моль; 4NO2(г) + O2(г) = 2N2O5(г); ∆H2o = -110,1 кДж/моль; N2(г) + O2(г) = 2NO(г); ∆H3o = 182,8 кДж/моль. 37. Вычислить тепловой эффект реакции восстановления оксида железа (II) водородом, пользуясь следующими данными: FeO + CO = Fe + CO2; ∆H1o = -13,2 кДж/моль; CO + ½ O2 = CO2; ∆H2o = -283 кДж/моль; 6 ∆H3o = -241,8 кДж/моль. H2 + ½ O2 = H2O; 38. Определить стандартную энтальпию образования CO2, используя приведенные ниже данные: C(тв) + ½ O2 = CO; ∆H1o = -110,5 кДж/моль; CO + ½ O2 = CO2; ∆H2o = -284,8 кДж/моль. 39. Найти тепловой эффект реакции 6C(г) + 6H(г) = C6H6 при температуре 25 oC и постоянном давлении, используя стандартные энтальпии образования веществ. 40. давлении Найти тепловой эффект реакции N2 + 3H2 = 2NH3 при постоянном и температуре 25 o C, используя стандартные энтальпии образования веществ. 41. Рассчитать стандартный тепловой эффект реакции Fe2O3(тв) + 3H2(г) = 2Fe(тв) + 3H2O(г) по величинам стандартных теплот образования веществ. 42. Рассчитать стандартный тепловой эффект реакции 2H2S(г) + O2(г) = 2H2O(ж) + 2S(моноклин) по известным величинам стандартных теплот образования исходных веществ и продуктов реакции. 43. Найти тепловой эффект реакции H2S(г) + ½ O2(г) = H2O(ж) + S(ромбич) по известным величинам стандартных теплот образования исходных веществ и продуктов реакции. Химическое равновесие 44. В закрытом сосуде при постоянной температуре смешано 2 моль азота и 6 моль водорода. В результате реакции к моменту наступления равновесия прореагировало 10 % первоначального количества азота. Как изменится в этом случае давление по сравнению с первоначальным? 45. Константа равновесия для реакции Н 2 + I 2 = 2 Н I при 445 °С 7 равна 50. Какое количество вещества водорода надо взять на 1 моль йода, чтобы 90 % последнего превратить в иодоводород? 46. При нагревании смеси углекислого газа и водорода в закрытом сосуде устанавливается равновесие СО2 + H2 = CO + Н2О. Константа равновесия при 850 °С равна единице. Какая массовая доля (%) углекислого газа подвергнется превращению в оксид углерода (II) при 850 °С, если смешать 1 моль СО2 и 5 моль Н2? 47. При синтезе аммиака в определенных условиях в равновесии находятся 1 моль водорода, 2 моль азота и 8 моль аммиака. Рассчитайте константу равновесия КС. Во сколько раз исходные количества азота и водорода больше равновесных их количеств? 48. Равновесие реакции Н2 + Вr2 = 2НВr установилось при некоторой температуре при следующих равновесных концентрациях: с(Н2) = 0,5 моль/л; с(Вr2) = 0,1 моль/л; с(НВr) = 1,6 моль/л. Найдите КС. Определите исходные концентрации водорода и брома. Молекулярные растворы 49. Определите атмосферное давление, если раствор, содержащий глицерин массой 1,5 г в воде массой 90 г, кипит при 99 °С. Давление водяного пара при той же температуре равно 977,3 гПа. 50. Какова масса свекловичного сахара в растворе, если давление пара его на 2 % меньше давления пара воды при той же температуре? 51. При 20 °С давление пара над чистым сероуглеродом равно 397,2 гПа, а над раствором, содержащим бензойную кислоту массой 5,168 г в сероуглероде массой 100 г, 390,8 гПа. Вычислите относительную молекулярную массу бензойной кислоты, сравните найденную величину с табличной и объясните полученный результат. 52. Вычислите давление пара над раствором, содержащим 8 дифениламин (C6H5)2NH массой 0,514 г в бензоле массой 50 г (раствор взят при 20 °С). Давление пара бензола при этой температуре равно 100,2 гПа. 53. Определите массовую долю глюкозы в растворе, если давление пара над ним равно при той же температуре давлению пара раствора, содержащего мочевину массой 1,56 г и воду массой 90 г. 54. Температура замерзания бензола 5,5 °С, а раствора, содержащего в бензоле массой 25,04 г неизвестное вещество массой 0,4678 г, 4,872 °С. Криоскопическая постоянная бензола 5,12 К∙кг/моль. Вычислите относительную молекулярную массу неизвестного вещества. 55. Сколько бензойной кислоты (С7Н6О2) растворено в уксусной кислоте массой 100 г, если температура замерзания последней понизилась на 0,824 °С? Криоскопическая постоянная уксусной кислоты 3,9 К∙кг/моль. 56. Нафталин массой 0,5685 г, растворенный в n-толуидине (C7H9N) массой 25 г, дал понижение точки замерзания раствора на 0,942 °С. Температура плавления чистого n-толуидина равна 43 °С. Определите криоскопическую постоянную и скрытую теплоту плавления n-толуидина. 57. Какова массовая доля водного раствора фруктозы, который замерзает при температуре -0,524°С? Криоскопическая постоянная воды 1,86 К∙кг/моль. 58. Температура плавления нафталина 80,1 °С. Она понижается на 0,832 °С при растворении серы массой 3,122 г в нафталине массой 100 г. Удельная теплота плавления нафталина равна 149,5 Дж/г. Найдите молекулярную формулу серы в нафталинном растворе. 59. Температура замерзания водного раствора глицерина равна -0,5 °С. Давление пара над чистой водой при этой температуре 5,89 гПа. Криоскопическая постоянная воды 1,86. Определите давление пара раствора. 60. Вычислите температуру замерзания водного раствора глюкозы, если давление пара его равно 98,5 % давления пара чистой воды при той 9 же температуре. Криоскопическая постоянная воды 1,86 К∙кг/моль. 61. Раствор, содержащий бензальдегид массой 1,612 г в эфире массой 100 г, кипит при температуре 34,806 °С. Температура кипения эфира равна 34,5 °С, а эбуллиоскопическая постоянная его равна 2. Вычислите относительную молекулярную массу бензальдегида и относительную ошибку опыта в процентах по сравнению с найденной в справочнике. 62. массой При растворении камфоры (С10Н15О) массой 0,298 г в бензоле 21,2 г температура кипения повысилась на 0,236 °С. Эбуллиоскопическая постоянная бензола 2,6. Вычислите относительную молекулярную массу камфоры и относительную ошибку опыта в процентах по сравнению с величиной, найденной в справочнике. 63. Определите температуру кипения раствора, содержащего 0,006 моль камфоры в ацетоне массой 20 г. Температура кипения ацетона 56,3 оС, а удельная теплота его испарения при этой температуре 540,0 Дж/г. 64. Раствор бензойной кислоты в эфире (массовой долей 2 %) кипит при такой же температуре, как раствор, содержащий неизвестное вещество массой 0,645 г в эфире массой 22,5 г. Вычислите относительную молекулярную массу неизвестного вещества. Эбуллиоскопическая постоянная эфира равна 2 К∙кг/моль. 65. Из опыта найдено, что при растворении бензила (С14Н10О2) массой 0,374 г в хлороформе массой 33,05 г повышение температуры кипения было равно 0,202 °С. Вычислите эбуллиоскопическую постоянную хлороформа и удельную теплоту его испарения при температуре кипения 61,2 °С. 66. Вычислите осмотическое давление раствора, содержащего в 250 мл воды 0,538 г фруктозы, при 27 °С? 67. Определите осмотическое давление 5 %-го раствора свекловичного сахара при 15 °С. Плотность раствора 1,019 г/см3. 68. Какова молярная концентрация раствора мочевины, если при 17 °С он производит давление, равное 86,6 кПа? 10 69. Сколько граммов глюкозы должно содержаться в растворе объемом 1 л, чтобы осмотическое давление его при 20 °С было равным 113,3 кПа? 70. При 15,5 °С осмотическое давление раствора, содержащего в 1 л воды свекловичный сахар массой 9,968 г, равно 69,8 кПа. Вычислите величину константы R. 71. При 20 °С осмотическое давление раствора, содержащего в 1 л раствора 71,19 г неизвестного вещества, равно 513,2 кПа. Вычислите относительную молекулярную массу неизвестного вещества. 72. При 0 °С осмотическое давление раствора, содержащего в 100 мл его 1 г свекловичного сахара, равно 66,86 кПа. Вычислите относительную молекулярную массу свекловичного сахара и относительную ошибку (в %) по сравнению с величиной, найденной в справочнике. 73. Осмотическое давление раствора, содержащего в 200 мл его 0,276 г мочевины, при 18 °С равно 57,05 кПа. Вычислите относительную молекулярную массу мочевины. Полученную величину сравните с величиной, найденной в справочнике. 74. -0,184 °С. Температура замерзания водного раствора глюкозы равна Вычислите осмотическое давление раствора при 0 °С. Криоскопическая постоянная воды 1,86 К∙кг/моль. 75. При 60 °С давления пара бензола и толуола соответственно равны 523 и 186 гПа. Смесь этих веществ практически идеальна. Вычислите ее состав в молярных долях (%), если общее давление равновесного с ней пара равно 333 гПа. Каков состав пара над этой смесью? 76. Вычислите активности и коэффициенты активности ацетона и хлороформа в растворе, содержащем ацетон молярной долей 65,5 %. При 55,1 °С парциальные давления паров ацетона и хлороформа над раствором равны соответственно 605 и 215 гПа, а давления паров чистых ацетона и хлороформа при той же температуре соответственно 989 и 844 гПа. Сравните 11 активности компонентов с молярными долями. 77. Раствор, содержащий тростниковый сахар массой 48,59 г в воде массой 100 г, замерзает при -3,052 °С. Криоскопическая постоянная воды 1,86. Определите активность сахара в растворе. 78. Водный раствор этилового спирта массовой долей 39 % замерзает при -28,7 °С. Криоскопическая постоянная воды 1,86. Определите активность этилового спирта в растворе. 79. При 25 °С коэффициент распределения хлорида ртути (II) между водой и бензолом равен 11,9. Найдите активность и коэффициент активности соли в водном растворе молярной концентрации 0,1578 моль/л. В бензольном растворе, находящемся в равновесии с водным, молярная концентрация HgCl2 равна 0,0122 моль/л, этот раствор можно считать идеальным. Растворы электролитов 80. калия Определите осмотическое давление при 25 °С раствора хлорида молярной концентрации 0,1 моль/л. Кажущаяся степень диссоциации КС1 в этом растворе 83 %. 81. Вычислите осмотическое давление при 17 °С раствора хлорида магния массовой долей 3,7 %. Плотность раствора равна 1,03 г/см3, а кажущаяся степень диссоциации соли 70,5 %. 82. При 18 °С осмотическое давление раствора хлорида натрия молярной концентрации 0,5 моль/л равно 2,1∙106 Па. Вычислите кажущуюся степень диссоциации NaCl в этом растворе. 83. Найдите молярную концентрацию раствора мочевины, который изотоничен с раствором хлорида бария молярной концентрации 0,01 моль/л при 20 °С. Кажущаяся степень диссоциации ВаС1 2 равна 87 %. 84. При 17 °С осмотическое давление раствора сульфата калия 12 молярной концентрации эквивалента 0,1 моль/л равно 300,8 кПа. Вычислите изотонический и осмотический коэффициенты. 85. Определите молярную концентрацию ионов А13+ и С1- в растворе хлорида алюминия молярной концентрации эквивалента 0,1 моль/л, если кажущаяся степень диссоциации соли равна 65 %. 86. Вычислите молярную концентрацию эквивалента сульфата калия, если кажущаяся степень диссоциации соли в этом растворе 63 %, а молярная концентрация иона К+ равна 0,315 моль/л. 87. Сколько безводного ацетата натрия нужно добавить к 0,5 л раствора с(СН3СООН) = 1 моль/л, чтобы рН раствора стал равным 4? Константа диссоциации уксусной кислоты К = 1,8∙10-5, (соли) = 1. 88. Определите рН смеси аммиака и хлорида аммония, если она приготовлена из растворов молярной концентрации, равной 0,1 моль/л этих веществ в отношении 1 : 9. КNH4ОН = 1,8∙10-5. Диссоциацию соли считать полной. 89. Найдите рН фосфатной буферной смеси, приготовленной из раствора NaH2PO4 объемом 50 мл молярной концентрации эквивалента 0,2 моль/л и раствора Na2HPO4 объемом 20 мл молярной концентрации эквивалента 0,4 моль/л. КН2РО4 = 1∙10-7. Степень диссоциации Na2HPO4 на ионы Na+ и НРО42- считать равной 1. 90. К раствору гидроксида аммония объемом 25 мл молярной концентрации 0,5 моль/л добавлен раствор хлороводородной кислоты объемом 25 мл молярной концентрации 0,1 моль/л. Определите рН полученного раствора, если КNH4OH = 1,8∙10-5. 91. К раствору уксусной кислоты объемом 100 мл молярной концентрации 0,3 моль/л, добавлен раствор едкого натра объемом 30 мл молярной концентрации, равной 0,1 моль/л. Найдите рН полученного раствора, если КСН3ООН = 1,8∙10-5. 92. Чтобы изменить рН на 1, к ацетатной буферной смеси объемом 13 10 мл потребовалось добавить раствор щелочи объемом 0,52 мл молярной концентрации 1 моль/л. Найти буферную емкость этой смеси. 93. Определите коэффициент активности и активности иона Na+ в растворе, содержащем 0,01 моль NaCl, 0,01 моль CuС12 и 0,002 моль ZnSO4 в 1 кг воды. 94. Воспользовавшись уравнением Дебая и Гюккеля, вычислите средний коэффициент активности ионов и их активность в растворе b(CuCl 2 /H2 O) = 0,001 моль/кг. А = 0,5117. 95. Применяя уравнение Дебая и Гюккеля, вычислите средний коэффициент активности K2SO4 в растворе, содержащем 0,001 моль K2SO4 и 0,002 моль MgCl2 в 1кг воды. А = 0,5117. 96. Растворимость РbI2 в воде равна 1,4∙10-3 моль/л. Вычислите произведение растворимости этой соли с учетом коэффициентов активности. 97. Растворимость Са(ОН)2 в воде равна 0,165 г в 100 г воды. Вычислите произведение растворимости Са(ОН)2 с учетом коэффициента активности. Кинетика химических реакций 98. Сколько времени потребуется для омыления гидроксидом натрия 99 % уксуснометилового эфира, если начальные молярные концентрации растворов эфира 0,015, а гидроксида натрия 0,03 моль/л? Константа скорости реакции равна 2,5 л∙моль-1∙мин-1. 99. Во сколько раз увеличится скорость реакции при повышении температуры на 100 °С, если температурный коэффициент скорости реакции равен 2? 100. Во сколько раз увеличится скорость химической реакции при повышении температуры от 200 до 500 °С, если температурный коэффициент скорости реакции равен 2? 101. При 150 °С химическая реакция заканчивается за 16 мин. 14 Принимая температурный коэффициент скорости реакции равным 2,5, рассчитайте, через сколько минут закончилась бы эта реакция при 200 °С и при 80 °С. 102. Скорость некоторой реакции при охлаждении с 60 до 30 °С уменьшилась в 8 раз. Чему равен температурный коэффициент этой реакции? 103. Скорость реакции при нагревании на 20 °С возросла в 9 раз. Определите температурный коэффициент скорости реакции. 104. Температурный коэффициент скорости реакции равен 2,5. При какой температуре следует проводить реакцию, если нужно скорость реакции, проводимой при 50 °С, уменьшить в 10 раз? 105. Реакция между А и В выражается уравнением А + 2В = С. Начальная концентрация с(А) равна 0,3моль/л, а с(В) − 0,5моль/л. Константа скорости реакции равна 0,4 л 2∙моль-2∙мин-1. Чему будет равна скорость реакции в момент ее начала и по истечении некоторого времени, когда с (А) уменьшится на 0,1 моль?
