Процесс В-С
advertisement

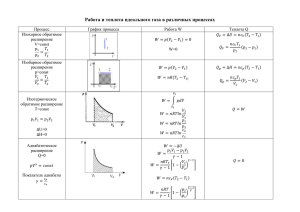
Теплоемкость идеального газа Изопроцессы Закон сохранения энергии для систем, в которых существенную роль играют тепловые процессы, называется первым началом термодинамики: Q U A Q dU A Внешняя работа системы Первый закон термодинамики связывает между собой: 1) изменение внутренней энергии системы, 2) количество поступающей в систему или отводимой от нее теплоты и 3) совершаемую внешнюю работу. Δli= рi · ΔVi для разреженных газов выражение для внутренней энергии для 1 моля: i i i U N kT N A kT RT 2 2 R 2 работа в месте расположения площадки ΔSi работа расширения системы p=const ΔAi= рi·ΔSi ·Δli ΔA = Σpi·ΔVi dA = F dl = p S dl = p dV V2 A = p(V2— V1) A pi Vi V1 или ΔVi = Δli ·ΔSi Sdl = dV изменение объема системы V2 A pdV V1 Внутренняя энергия и теплоемкость идеального газа Средняя энергия одной молекулы Т.к. молекулы идеального газа на расстоянии не взаимодействую, внутренняя энергия газа равна сумме внутренних энергий всех молекул i U kT 2 Для 1 моля, где N=NA i i U N AU N A kT RT 2 2 Внутренняя энергия произвольной массы m m mi U Um RT 2 Внутренняя энергия идеального газа зависит только от температуры Теплоемкость Теплоёмкость тела величина, равная количеству теплоты, которую надо сообщить телу, чтобы повысить его температуру на 1 градус: dQ cmdT если m=1кг dQ C dT Дж К Удельная теплоёмкость (с) – количество теплоты, необходимое для нагревания единицы массы вещества на один Дж градус. [с] = К кг Для газов удобно пользоваться молярной теплоемкостью Сμ количество теплоты, необходимое для нагревания 1 моля газа на 1 градус: Дж Сμ = с· μ К моль Молярные теплоемкости всех газов с одинаковым числом степеней свободы i равны, а удельные – различны (т.к. разные молярные массы μ) Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при нагревании. Наибольший интерес представляет теплоемкость для случаев, когда нагревание происходит при условии V=Const (cV) p=Const (cp) . V=Const (CV) Если газ нагревать при постоянном объёме, то всё подводимое тепло идёт на нагревание газа, то есть изменение его внутренней энергии. Работы над другими телами не совершается. A = p(V2— V1)=0 dQV = dU Т.к. для 1 моля (dА = 0) i U RT 2 dQ dU CV dT dT i CV R 2 Т.о. CV не зависит от температуры, а зависит только от числа степеней свободы i, т.е. от числа атомов в молекуле газа. p=Const (cp) Если нагревать газ при постоянном давлении (СР) в сосуде с поршнем, то подводимое тепло затрачивается и на нагревание газа, и на совершение работы. Поэтому, для повышения Т на 1 К понадобится больше тепла, чем в случае V=Const Следовательно, СР > СV Запишем I начало ТД для 1 моля газа разделим на dT Cp dQ p dT dU dQ p dU pdV CV dT p( dV dT ) p CV R Из уравнения Клапейрона-Менделеева имеем: pVμ=RT Vμ=RT/p Т.о. работа, которую совершает 1 моль идеального газа при повышении температуры на 1К равна газовой постоянной R. отношение Cp/Cv есть постоянная для каждого газа величина i Cp 2 R R 2 i2 1 i CV i i R 2 Число степеней свободы, проявляющееся в теплоемкости зависит от температуры. На рисунке показана качественная зависимость молярной теплоемкости СV от температуры для одноатомного газа аргона (Ar) и двухатомного газа водорода (H2) Поступательное + вращательное + колебательное Поступательное + вращательное Поступательное Формулы для CV и Cp верны для определенных температурных интервалов, причем каждому интервалу соответствует свое число степеней свободы. Применение первого начала термодинамики к изопроцессам Изопроцесс – процесс, проходящий при постоянном значении одного из основных термодинамических параметров – P, V или Т. 1) изохорический процесс, при котором объем системы остается постоянным (V = const). 2) изобарический процесс, при котором давление, оказываемое со стороны системы на окружающие тела, остается постоянным (р = const). 3) изотермический процесс, при котором температура системы остается постоянной (Т = const). 4) адиабатический процесс, при котором на протяжении всего процесса теплообмен с окружающей средой отсутствует (dQ = 0; Q = 0) ► Изотермический процесс – процесс, происходящий в физической системе при постоянной температуре (T = const). В идеальном газе при изотермическом процессе произведение давления на объем постоянно И зотер ма – закон Бойля Мариотта: PV const при T const . P T3 > T2 > T1 T3 T2 T1 Найдем работу газа при изотермическом процессе : V V2 A= V1 V2 0 RT V2 p1 pdV = dV = RTln RTln V V1 p2 V1 V1 V2 Используя формулу U = сVT , получаем dU = сV dT = 0 Следовательно, внутренняя энергия изотермическом процессе не меняется . Поэтому газа при Q A Значит, при изотермическом процессе вся теплота, сообщаемая газу, идет на совершение им работы над внешними телами. Поэтому m p1 Q = A = RTln M p2 Чтобы при расширении газа его температура не понижалась, к газу необходимо подводить количество теплоты, равное его работе над внешними телами. ► Изохорический процесс – процесс, происходящий в физической системе при постоянном объеме (V = const). P T const при V const - закон Шарля При изохорическом процессе механическая работа газом не совершается. Q U Изохорический процесс: V = const Из уравнения состояния идеального газа для двух температур T1 и T2 следует m p1V = RT1 M откуда T2 p2 = p1 T1 В процессе 1 В процессе 1 Изохор а . . . P m p2V = RT2 M 0 2 происходит нагревание газа 3 происходит охлаждение газа 2 1 3 V Пусть начальное состояние газа отвечает состоянию при нормальных условиях Т0 = 0°С = 273.15 °К, р0 = 1 атм, тогда для произвольной температуры Т давление в изохорическом процессе находится из уравнения T p = p0 T0 Давление газа пропорционально его температуре - Закон Шарля Поскольку dA = pdV = 0 , то при изохорическом процессе газ не совершает работу над внешними телами. При этом переданная газу теплота равна dQ = dА + dU = dU То есть при изохорическом процессе вся теплота, передаваемая газу, идет на увеличение его внутренней энергии. m d'Q = dU = cV dT M ► Изобарический процесс – процесс, происходящий в физической системе при постоянном давлении (P = const). V T const при P const Q U А - закон ГейЛюссака 2) Изобарический процесс: p = const В изобарическом процессе газ совершает работу Изобар а P V2 A= pdV = p(V 2 . -V1 ) 1 V1 Работа равна площади под прямой изобары. Из уравнения состояния идеального газа получаем m pV1 = RT1 M . 2 V 0 m pV2 = RT2 M m A = p(V2 -V1 ) = R(T2 T1 ) M V1 V2 Перепишем последнее соотношение в виде A R= ν(T2 - T1 ) Это равенство раскрывает физический смысл газовой постоянной R - она равна работе 1 моля идеального газа, совершаемой им при нагревании на 1 К в условиях изобарного расширения. Возьмем в качестве начального состояния - состояние идеального газа при нормальных условиях (Т0, V0), тогда объем газа V при произвольной температуре Т в изобарическом процессе равен T V = V0 T0 Объем газа при постоянном давлении пропорционален его температуре - закон Гей-Люссака. ► Адиабатный процесс – процесс, происходящий в физической системе без теплообмена с окружающей средой (Q = 0). PV const уравнение Пуассона. CP i 2 CV i γ – показатель адиабаты. А U 4) Адиабатический процесс : dQ = 0 При адиабатическом процессе теплообмен между газом и окружающей средой отсутствует. Из первого начала термодинамики получаем dA = - dU Поэтому в адиабатическом процессе работа газа над внешними телами совершается за счет убыли его внутренней энергии. Используя dU = сVdT ; dA = рdV находим рdV = -сV dT С другой стороны, из уравнения состояния идеального газа следует d(рV) = pdV + Vdp = RdT Исключая dT , получаем рdV = - сV (pdV + vdp)/R Откуда dp R dV dV = -( 1 + ) = -γ p cV V V Интегрируя, находим p2 V2 dp dV = -γ p p V V 1 1 p2 V2 ln( ) = -γln( ) p1 V1 Последнюю формулу можно переписать в виде p2 V1 = p1 V2 γ γ 1 1 γ 2 2 pV = pV Следовательно Адиабата P γ pV = const И зотер ма это уравнение адиабатического процесса - уравнение Пуассона γ pV = const 0 V1 V V2 Так как > 1 , то у адиабаты давление меняется от объема быстрее, чем у изотермы. pV=const Используя уравнение состояния преобразуем уравнение Пуассона к виду pV = νRT Значит или TV p νRTV (γ -1) (1-γ) (γ -1) идеального газа, = const = const γ T = const При адиабатическом расширении идеальный газ охлаждается, а при сжатии – нагревается. Политропический процесс Политропический процесс – процесс, протекающий при постоянной теплоёмкости, cm = const. где cm – молярная теплоемкость. pV const , n n c cp c cV где n - показатель политропы. , Найдем уравнение политропы для идеального газа. Из первого начала термодинамики следует d'Q = dU + pdV = νcm dT dU = νdU m = νcV dT откуда получаем ν(cm - cV )dT = pdV С другой стороны, из уравнения состояния идеального газа d(pV) = d(νRT) pdV +Vdp = νRdT Поэтому можно записать (cm - cV )(pdV + VdP) = pRdV (cm - cV - R)pdV + (cm - cV )Vdp = 0 Поскольку cP = cV + R то dV dp (cm - cP ) + (cm - cV ) = 0 V p cm - c P Обозначим n = cm - cV Интегрируем Следовательно , получим dV dp n + =0 V p V2 p1 nln = ln V1 p2 p2V2n = p1V1n n pV = const - уравнение политропы, n - показатель политропы. Все изопроцессы являются частным случаем политропического процесса: pV const , n адиабата. pV const , n 1 изотерма . p const , n 0 изобара . 1 n pV const , p V const , n n V const изохора. Энтропия Адиабатические процессы в термодинамических системах могут быть равновесными и неравновесными. Для характеристики равновесного адиабатического процесса можно ввести некоторую физическую величину, которая оставалась бы постоянной в течение всего процесса; ее назвали энтропией S. Энтропия есть такая функция состояния системы, элементарное изменение которой при равновесном переходе системы из одного состояния в другое равно полученному или отданному количеству теплоты, деленному на температуру, при которой произошел этот процесс для бесконечно малого изменения состояния системы dQ cmdT dS T T Изменение энтропии в изопроцессах Если система совершает равновесный переход из состояния 1 в состояние 2, то изменение энтропии: dQ dU A S 2 S1 , T T 1 1 2 ΔS12 2 Найдем изменения энтропии в процессах идеального газа. Так как m dU CV dT , μ а то m RT dA pdV dV , V 2 2 m dT mR ΔS S 2 S1 CV dV μ T 1 μV 1 Или T2 m V2 m ΔS Cv ln R ln μ T1 μ V1 Изменение энтропии S12 идеального газа при переходе его из состояния 1 в состояние 2 не зависит от пути перехода 1 2. изохорического процесса: изобарического процесса: T2 m ΔS CV ln , μ T1 V1 V2 T2 p1 = p2 m 2 dT2 m ΔS C p C p ln , μ T1 T1 μ T1 T изотермического процесса: V2 ΔS mR ln , V1 адиабатного процесса: dQ 0, ΔS 0, Т1 = Т2 Следовательно, S = const, адиабатный процесс по другому называют – изоэнтропийным процессом. Во всех случаях, когда система получает извне теплоту, то Q — положительно, следовательно, S2 > S1 и энтропия системы увеличивается. Если же система отдаст теплоту, то Q имеет отрицательный знак и, следовательно, S2 < S1; энтропия системы уменьшается. Энтропия системы пропорциональна массе (или числу частиц) этой системы Q=c m ΔT Масса системы представляется в виде суммы масс ее составных частей, поэтому энтропия всей системы будет равна сумме энтропии ее составных частей, т. е. энтропия есть аддитивная величина. Изопроцессы могут быть изображены графически в координатных системах, по осям которых отложены параметры состояния. давление p - объем V температура Т– объем V температура Т – давление p p1V1 p2V2 const T1 T2 V1 V2 T1 T2 p1 p2 const ( ) V1 V2 При адиабатическом расширении внешняя работа совершается только за счет внутренней энергии газа, вследствие чего внутренняя энергия, а вместе с ней и температура газа уменьшаются (Т2 < T1) При изотермическом процессе Т2 = T1 Удобство координатной системы р, V В масштабе чертежа внешняя работа изображается площадью, ограниченной кривой процесса 1—2 и ординатами начального и конечного состояний Круговые (замкнутые) процессы Совокупность термодинамических процессов, в результате которых система возвращается в исходное состояние, называется круговым процессом (циклом). Прямой цикл – работа за цикл A pdV 0 Обратный цикл – работа за цикл A pdV 0 Тепловая машина Циклически действующее устройство, превращающее теплоту в работу, называется тепловой машиной или тепловым двигателем. Q Н агреватель 1 Рабочее тело Q 2 Х олодильни к (Р Т ) А Q1 – тепло, получаемое РТ от нагревателя, Q2 – тепло, передаваемое РТ холодильнику, А – полезная работа (работа, совершаемая РТ при передаче тепла). 2 2 1 1 Q p a 1 b -Q Q 1 2 1 -Q 2 0 2 V В цилиндре находится газ – рабочее тело (РТ). Начальное состояние РТ на диаграмме p(V) изображено точкой 1. Цилиндр подключают к нагревателю, РТ нагревается и расширяется. Следовательно совершается положительная работа А1, цилиндр переходит в положение 2 (состояние 2). Процесс 1–2: – Q p 2 1 Q1 U 2 U 1 A1 a 1 -Q 0 первое начало термодинамики. b 2 V Работа А1 равна площади под кривой 1a2. Чтобы поршень цилиндра вернуть в исходное состояние 1, необходимо сжать рабочее тело, затратив при этом работу – А2. Q p 2 1 a 1 b -Q 0 Процесс 2–1: 2 V Для того чтобы поршень совершил полезную работу, необходимо выполнить условие: А2 < А1. С этой целью сжатие следует производить при охлаждении цилиндра, т.е. от цилиндра необходимо отводить к холодильнику тепло –Q2. Q2 U 1 U 2 A2 – первое начало термодинамики. Работа А2 равна площади под кривой 2b1. Q p 2 1 a Сложим два уравнения и получим: Q1 Q2 A1 A2 Aпол езная . b 1 -Q 0 2 V Рабочее тело совершает круговой процесс 1a2b1 – цикл. К.п.д. Аполезная Q1 Q2 Q2 1 . Q1 Q1 Q1 Q p 2 1 a m M pV RT T pV ; M Rm 1 b -Q 0 2 V при V const , pнагревателя p холодильника Т н Т х . Процесс возвращения рабочего тела в исходное состояние происходит при более низкой температуре. Следовательно, для работы тепловой машины холодильник принципиально необходим. Цикл Карно Никола Леонард Сади Карно – французский офицер инженерных войск, в 1824 г. опубликовал сочинение «Размышления о движущей силе огня и о машинах способных развить эту силу». Ввел понятие кругового и обратимого процессов, идеального цикла тепловых машин, заложил тем самым основы их теории. Пришел к понятию механического эквивалента теплоты. Карно вывел теорему, носящую теперь его имя: из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей и холодильников, наибольшим КПД обладают обратимые машины. Причем КПД обратимых машин, работающих при одинаковых температурах нагревателей и холодильников, равны друг другу и не зависят от конструкции машины. При этом КПД меньше единицы. Цикл Карно. Цикл Карно Процесс А-В – изотермическое расширение V1 A1 RT1ln Q1 , V0 Процесс В-С – γ 1 T1 V2 , T2 V1 адиабатическое расширение – коэффициент Пуассона. p1V1 (T1 T2 ) A2 ( 1)T1 RT1 T2 1 Цикл Карно Процесс С-D – изотермическое сжатие V3 A3 RT2ln Q2 V2 Процесс D-A – адиабатическое сжатие V3 V0 γ 1 T1 T2 R A4 (T1 T2 ) 1 V1 R (T1 T2 ) A RT1 ln V0 1 V3 R(T1 T2 ) RT2 ln V2 1 A Q1 Q2 Q2 T2 1 1 Q1 Q1 Q1 T1 T2 1 T1 Если Т2 = 0, то η = 1, что невозможно, т.к. абсолютный нуль температуры не существует. Если Т1 = ∞, то η = 1, что невозможно, т.к. бесконечная температура не достижима. КПД цикла Карно η < 1 и зависит от разности температур между нагревателем и холодильником (и не зависит от конструкции машины и рода рабочего тела). Q Цикл Карно в координатах S-T Изотермы: Q А-Б система получает извне теплоту, Q — положительно, следовательно, S2 > S1 и энтропия системы увеличивается. В-Г система отдает теплоту, Q имеет отрицательный знак и, следовательно, S2 < S1; энтропия системы уменьшается. Адиабаты: Б-В и Г-А dQ = 0, следовательно, S=0 Теоремы Карно. 1. К.п.д. η обратимой идеальной тепловой машины Карно не зависит от рабочего вещества. 2. К.п.д. необратимой машины Карно не может быть больше к.п.д. обратимой машины Карно.