Модуль 6
advertisement
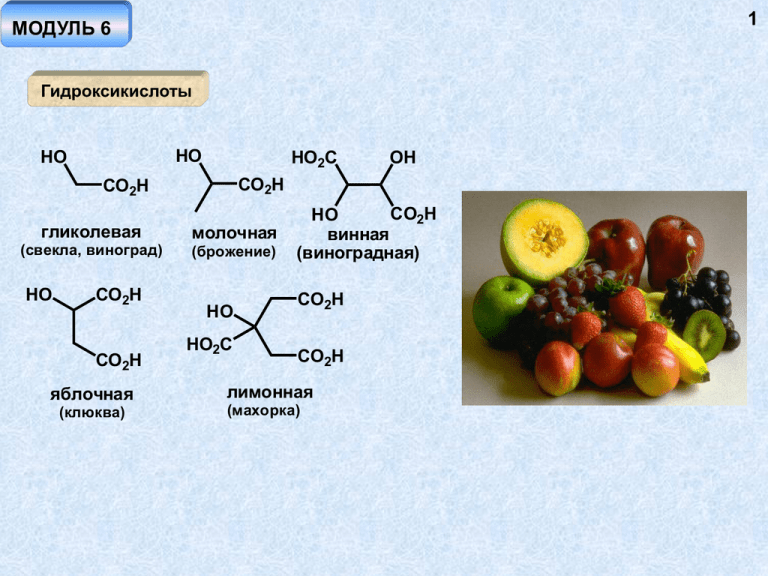
1 МОДУЛЬ 6 Гидроксикислоты HO HO HO2C CO2H CO2H гликолевая (свекла, виноград) HO CO2H CO2H яблочная (клюква) OH молочная (брожение) HO HO2C CO2H HO винная (виноградная) CO2H CO2H лимонная (махорка) 2 Методы получения -гидроксикислоты OH Br R CO2H H2O Штреккер RCHO HCN R N2+ H2O HOCO2H OH R R CO2H H3O+ R CO2H -гидроксикислоты OH OH R Ag2O CO2H R R альдоль CO2H R = Ph - миндальная кислота циангидрин CHO R OH H3O+ CN NH2 NaNO2 R 3 HO CO2H LiAlH4 H3O+ HO RCO3H O CO2H CO2H CO2H H3O+ OH HO CO2H -гидроксикислоты Cl 1. Mg/эфир O CO2H H3O+ O t 2. CO2 -бутиролактон гидроксикислоты O O RCO3H (CH2)n Реакция Байера-Виллигера O (CH2)n лактон H3O+ t HO (CH2)n+3 HO2C OH CO2H 4 Свойства гидроксикислот свойства спиртов + свойства кислот OH OH 1. Na2CO3 EtOH 2. CH3I CO2CH3 OH CO2H H+ SOCl2 - RO RCOCl Cl CO2Et CH3I OCH3 OCOR COCl OCH3 + H3O CO2CH3 CO2H CO2H OH R H CO2H OH + t OH OH2 R -H2O O R R + -H - CO O OH OH R RCHO 5 OH + H CO2H t R R CO2H Термические процессы -гидроксикислоты OH R R O O O O R лактид t CO2H -гидроксикислоты R CO2H t R CO2H OH -гидроксикислоты HO HO (CH2)3 CO2H (CH2)n CO2H n>4 O O t O O O t O (CH2)n O n t HO (CH2)4 CO2H 6 Ароматические гидроксикислоты Синтез Кольбе-Шмидт ONa OH CO2 OH > t,p CO2H салициловая кислота OH CO2 CO2К 230o OH NaO2 C OH KO2 C OH CO2 280o CO2Na HO2C OH 7 OH NH4HCO3 OH HO H2O, 100o OH CO2H OH COCH3 I2 CO2 H пиридин CO2H CO2H HNO3 H2SO4 PhCO2H SO3 H2SO4 SO3H O2N Fe HO- t H3O+ CO2H CO2H 1. NaNO2 / H3O+ NH2 2. H3O+, t OH 8 Свойства 1. Повышенная кислотность салициловой кислоты 2. Свойства кислот + свойства фенолов CO2H CO2H OCOCH3 CO2CH3 OH (CH3CO)2O OH CH3OH H+ ацетилсалициловая кислота (аспирин) 1. HO2. CH3I PhOH SOCl2 CO2CH3 CO2Ph CO2H OCH3 OH H3O OCH3 + салол OCH3 CO2H H3CO анисовая кислота OH OH HO2C ванилиновая кислота OH H3CO OH галловая кислота 9 Аминокислоты Методы получения -аминокислоты Br NH2 NH3 R CO2H R O CO2 H 1. HO-, t 2. H+ N-K+ O Br R O R N CO2Et CO2Et O O N-K+ CO2Et CO2Et Br2 Br CO2Et O CO2Et O N CO2Et CO2Et O 10 O CO2Et 1. EtO- N 2. RX NH2 + H3 O t CO2Et R = алкил R CO2H O CO2Et CO2Et NaNO2/EtOH CH3CO2H R NHCOCH3 EtO2C CO2Et CO2Et HON Zn/CH3CO2H CO2Et (CH3CO)2O EtO2C NH2 H3O+ t NHCOCH3 R CO2H Штреккер NH3 O HCN H2N CN H3O+ H2N CO2H 1. EtO- CO2Et 2. RX 11 -аминокислоты R CO2 H NH2 NH3 CO2 H R H3O+ t CO2H R CO2 H NH3 H2N CO2H R CO2H O N-K+ R CO2Et O O R N t CO2Et O NH2 H3O+ R CO2H 12 -аминокислоты O N-K+ Cl Cl (CH2)3 KCN Br O O (CH2)3 H3O+ t N NC CN O H2N CO2H O O NH3 O p,t NH лактам H3O+ t H2N CO2H 13 -аминокислоты O O NOH NH2OH (CH2)n (CH2)n CO2H H+ t + H2N H3O NH (CH2)n (CH2)n+3 HO2C O поликонденсация NH (CH2)5 n NH2 аминокапроновая кислота капрон Свойства аминокислот CO2 H H2N H R L-ряд CO2H H NH2 R D-ряд 14 Высокая растворимость в воде, низкая в неполярных растворителях Высокая температура плавления Амфотерность NH2 R CO2 NH2 ±H R анион увеличение рН CO2H NH3 ±H R CO2 NH3 ±H R CO2H катион Величина рН, при которой аминокислота не перемещается в электрическом поле, называется изоэлектрической точкой. Каждая аминокислота (и пептид) характеризуется своей изоэлектрической точкой pI = -lg(pH) Детектирование аминокислот с помощью нингидрина NH2 O OH R O CO2H N OH CO2H O нингидрин O N CO2H O O O нингидрин H3O+ O NH2 - R R CO2H O O R O O O N N -H+ O O O O интенсивно-синий краситель 16 17 Реакции аминокислот NH3 NH2 R CH3OH HCl CO2H R - Ag2O H2O CO2CH3 Cl NH2 R CO2CH3 R'X NHR R + + CO2H H2N NR3 NR2 R CO2H CO2H CH3I (изб.) NaHCO3 R N CO2H N(CH3)3 CO2- ClCH2CO2- бетаин (свекла) R' NH3 R Cl- COCl NH2 PCl5 R CO2H COR' HN R'COCl R Ac2O CO2H N O t R = H, R' = Ph - гиппуровая кислота R O азлактон NH2 NaNO2 + CO2H H3 O R NH2 CO2H R N N2 NaNO2 + CO2R' H3O R 18 OH N CO2R' R - H+ R CO2R' диазоэфир Термические превращения NH2 O O N H R t CO2 H - H2O R R H N дикетопиперазин NH2 R CO2H t R CO2H - NH3 NH2 R CO2H t - H2O R H N O 19 Пептидный синтез NH2 NH2 t + CO2H R R' смесь продуктов CO2H необходимы защитные группы и активация функциональных групп для снижения температуры реакции PhCH2OH COCl2 PhCH2OCOCl O O NH2 * R HN PhCH2OCOCl O Ph ClCO Et 2 * CO2H R HN O Ph * O OEt R CO2H бензилоксикарбонильная (БОК) защита R' O O NH2 * O HN CO2CH3 O H N * R O Ph * R' CO2H NH2 HBr CH3CO2H селективный гидролиз * R H N * O R' дипептид CO2H 20 Анализ пептидов O Ri H N R" N H O R' карбоксипептидаза NH2 O CO2H _ O Ri H N R" N H NH2 R' n-2 O CO2H N H NH2 R' H N R" NH2 n Ri R' n-1 O CO2H CO2H электрофорез "сборка" из фрагментов O NO2 O H N R" Ri H N R" N H R' O2N N H F O2N O NH O CO2H O2N NO2 H N гидролиз R" + CO2H O2N Ri NH2 CO2H Метод Эдмана Ph O Ri H N "R N H S R' O Ri H N HN n O PhNCS NH C N H CO2H R" O R' n n NH2 NH2 21 Ri CO2H Ph S N 22 S OH Ri H N C N H HN R" O H3O+ C HN R" N Ph + O Ri H N H2N O тиогидантоин Первичная структура инсулина (две субъединицы, 51 аминокислотный остаток 23 Вторичная структура белка Rk Ri N H Rk H O H N N Ri O H O O N N N H H O N N O H H Rj Rj 24 Третичная структура сывороточного Типы связей, возникающие между альбумина, состоящего из 607 аминокислотными остатками при формировании аминокислотных остатков третичной структуры белка Четвертичная структура белка Структура инсулина, Фредерик Сенгер, нобелевская премия за установление структуры, 1958 г. 25 Ароматические аминокислоты Синтез CO2H CO2H NO2 H2 / Pd NH2 O NH Свойства NH2 CO2 H CO2 H NaOCl HO-, H2O O CONH2 антраниловая кислота Амфотерность – менее основная аминогруппа – меньше цвиттер-ионной структуры – более высокая растворимость в органических растворителях и более низкая температура плавления, чем у алифатических аминокислот 26 CO2H CO2H CO2H NaNO2 NH2 + H3O N2 Cu2X2 X HX орто-изомер NH2 NH2 NH2 O HO2C HO3S витамин H1 - фактор роста микроорганизмов сульфаниловая кислота антивитамин S H2N O белый стрептоцид 27 Углеводы Cn(H2O)n n = 0 (CH2O) - не углевод простейшие углеводы при n = 3 CHO CHO H HO OH H O CH2OH CH2OH (+)-D-глицериновый альдегид (R)-глицериновый альдегид CH2OH (-)-L-глицериновый альдегид (S)-глицериновый альдегид CH2OH дигидроксиацетон кетоза (кетотриоза) альдоза (альдотриоза) CHO тетрозы D-ряда CHO H OH H OH H OH H OH CH2OH D-эритроза CH2OH D-треоза 28 альдопентозы CHO CHO H OH HO H OH H OH H OH H OH CH2OH CH2OH D-рибоза CH2OH HO H D-арабиноза CHO O H H HO OH H CHO HO H H OH H OH H OH HO H H OH H OH HO H CH2OH D-фруктоза (кетогексоза) CH2OH D-глюкоза (альдогексоза) CH2OH L-глюкоза 29 CHO CHO CH2 H NH2 H OH OH H H OH H OH H OH CH2OH CH2OH 2-дезокси-D-рибоза D-глюкозамин (2-амино-2-дезоксиD-глюкоза) Циклические формы сахаров OH ROH OR O OH O O O OH кольчато-цепная таутомерия -пиран O фуран 30 CHO H HO OH H H OH H OH H C OH HO H OH H HO C H OH HO H H H OH H OH H O H O CH2OH CH2OH CH2 OH D-глюкоза H H -D-глюкопираноза -D-глюкопираноза C C OH HO OH H H OH HO H HO H H O H O H OH H OH CH2OH -D-глюкофураноза CH2OH -D-глюкофураноза - и -формы являются эпимерами, отличающимися конфигурацией только одного асимметрического атома - аномерного центра (аномерами) 31 Структуры Хеуорса это не проекция Фишера! CHO H OH HO H H поворот на 90о OH H H OH H 1 6 HOH2C OH H 5 4 3 D-глюкоза 6 HOH2C HO 5 H 4 OH H 3 OH H 2 OH 1 CHO образование полуацеталя H 4 OH OH OH 6 H CHO 2 OH OH H CH2 OH вращение относительно связи С4-С5 5 H OH 3 H OH 6 O H 2 H 1 + OH OH -D-глюкопираноза H 4 OH 5 H OH 3 H O OH H 1 2 H OH -D-глюкопираноза Аномерный атом углерода находится в правом углу, атом кислорода в цикле – в правом верхнем углу. -аномер - аномерный атом кислорода "смотрит" вниз, -аномер - аномерный атом кислорода "смотрит" вверх Альдогексозы – пиранозы; тетрозы – фуранозы; пентозы – фуранозы + пиранозы CHO H H OH HO H O OH H H CH2OH OH H + H OH H H H OH OH H -L-треофураноза L-треоза O OH H -L-треофураноза CHO H OH H OH H OH CH2OH D-рибоза H H O H H H OH H H + H H OH OH O H OH H H H OH HO D-рибофураноза OH D-рибопираноза (20%) HOH2C + H (18%) OH OH HO O + H OH D-рибопираноза (56%) HOH2C H H O H H H OH HO OH D-рибофураноза (6%) 32 1 2 HO 3 H 4 H 5 6 33 CH2OH 1 6 O HOH2C H O H HO 5 OH H OH OH 2 3 4 6 CH2OH HOH2C 5 + H OH 3 4 OH H CH2OH D-фруктоза O H HO H OH 2 CH2OH 1 D-фруктофураноза D-фруктофураноза Изменение удельной величины оптического вращения растворов углеводов - мутаротация CHO H HO 6 OH H H OH H OH H 4 OH O H OH 3 OH 6 5 H H 2 H 1 OH OH -D-глюкопираноза CH2OH D-глюкоза ~ 0.02% OH a20 D H + 4 OH 5 H OH 3 H O OH H 1 2 H OH -D-глюкопираноза ~36% ~64% +112o +19o смесь +53o ( в воде) OH 6 H 4 6 5 H OH OH O H H 1 H 3 2 H 4 OH 5 H OH OH OH OH H 1 H OH H OH H O H O HO HO H H H O 2 3 H H OH HO HO 34 OH OH OH H H OH OH H -D-глюкопираноза -D-глюкопираноза -форма более устойчива, поскольку все объемные заместители находятся в экваториальном положении, но это справедливо не для всех пираноз отталкивание O O O H H H аномерный эффект O H более устойчивая конформация 35 Реакции углеводов Образование производных по гидроксильным группам O OR ROH OH H+ OR + H OR ROH OR -H+ -H2O CHO OH OH H H OH H OH O H H HO OH H OH H H H OH + H OH OH OH CH3OH H H+ H OH OH H O OH H CH2 OH D-глюкоза OH H H OH OH OH O H OH H H H OH H OH H OH H CH3OH H O OH H + -H H OH OH O H H + H OCH3 OH H H H метил--D-глюкопиранозид агликон OCH3 H OH OH > H OH O OH OH H H OH O H H H OH OH H NH2 OH H OH O H H OH HOH2C H3O+ OH H OH H OH нуклеозид, построенный из рибозы и аденина OH O H H H + OCH3 OH H N H H OH H N O H CH3OH / H+ N H OH OH N OH OH H OH O H H OH H OCH3 OH 36 рибоаденозин 37 OH H OCH3 O H OH H OH OCH3 (CH3O)2SO2 H OH- H OH метил--D-глюкозид H3CO H OCH3 H OH CH2OCH3 OCH3 H OCH3 H H3CO H3O+ H OCH3 t H3CO H OCH3 O CH2OCH3 H HNO3 t OH H OCH3 H H OCH3 CO2H OCH3 H O H метил-2,3,4,6-тетраметил--D-глюкозид H HNO3 H H3CO CO2H OCH3 H O H CHO H H OCH3 H3CO H OCH3 H + OCH3 CO2H CO2H H H3CO OCH3 H CO2H 38 Реакция ацилирования H OH H OAc H H O HO HO Ac2O AcO H H H OH AcO OH H H катализатор: ZnCl2 AcO- H OAc O OH H O + AcO H AcO OAc OAc H H OAc H соотношение продуктов термодинамический 9 :1 контроль 1:9 кинетический контроль Реакция является обратимой, гидролиз ацетатов может проходить и в кислой, и в щелочной среде; возможно протекание и реакции переэтерификации. 39 Восстановление CH2 OH CHO H HO H H H OH H HO NaBH4 H OH H OH CHO OH H OH OH CH2OH CH2 OH D-глюкоза D-глюцит (сорбит) H CH2OH H OH HO H H NaBH4 OH HO H D-ксилоза D-ксилит CO2H H HNO3 HO OH H H OH H OH H OH H OH CH2OH OH CH2 OH CHO OH H H CH2 OH Окисление H HO OH CO2H D-глюкаровая кислота CHO H CO2H OH H Восстанавливающие сахара - альдозы и кетозы HO H + Ag CHOH CH2OH OH O HO H HO- HO OH H OH -Ago H OH H OH CH2OH H H CH2OH D-глюкоза H OH H H OH H CH2OH H HO OH OH CO2 H CHO OH CH2OH D-фруктоза Реакция «серебряного зеркала» HO H HO H H OH H OH CH2OH D-манноза HO H Ag+ HO H -Ago H OH H OH CH2OH 40 41 Окисление бромом в щелочной среде H OH H O Br2 HO HO OH CaCO3/H2O H H OH H OH H CO2H H HO HO H O HO HO O H OH H Br H O OH H H H H OH D-глюколактон E2-элиминирование -OH OH H2O HO OH- H OH H OH H CH2OH D-глюконовая кислота -аномер реагирует значительно медленнее H OH H O HO HO H H H OH Br O O 42 O Синтез гликуроновых кислот H C H OH HO H HO H H OH O H OH H OH H3C CH2OH H H H OH CH2OH D-галактоза O H 2CH -CO-CH 3 3 H C 3 ZnCl2 OH CH2OH O H H O H O H O CH3 1,2-3,4-диацетонид D-галактопиранозы D-галактопираноза H O COOH H3C O KMnO4 H O H3C H OH H2O H O O H CH3 O H OH + H H C CO2H O CH3 H H OH H H CH3 OH H OH HO H HO H H OH CO2H D-галактуроновая кислота 43 Окислительное расщепление O O O I OH O OH -IO3- + O CHO H2O CO2H CO2H OH O IO4H2O IO4H2O -CO2 CHO H HO OH H H OH H OH CH2OH 5HIO4 + -NH3 O IO4- OH NH2 + OH IO4- O O- 5HCOOH + H2CO O O Реакция с фенилгидразином O H H NH2NHPh H OH H R H NNHPh OH R Ph H NH2NHPh -PhNH2 H H R NNHPh HO R NH R O H NNHPh NNHPh -NH3 R NNHPh озазон NNHPh OH H OH H NHNHPh NH2NHPh NH2NHPh CHO H H NHNHPh R H N HN 44 CH2OH NNHPh NH2NHPh HO H O NH2NHPh HO H H OH H OH H OH H OH H OH H OH CH2OH D-манноза или D-глюкоза CH2OH CH2OH D-фруктоза H NNHPh H O R O 45 + H3O R NNHPh озон Удлинение цепи Килиани-Фишер HO H H OH H OH HO2C C OH H NC C OH H CHO HO HCN CH2OH D-арабиноза H3O+ H HO H OH H OH H OH H OH O HO H HO H H H H CHO OH HO H O H O OH H OH CH2OH + -H2O CH2OH CH2OH O H CH2OH Na/Hg H HO (NaBH4) CHO OH H + HO H HO H H OH H OH H OH H OH CH2OH D-глюкоза CH2OH D-манноза 46 Укорачивание цепи Воль CHO H HO H H H CN C OH H NOH H NH2OH OH HO OH CH2OH H OH Ac2O H H OH H OH CN H HO CHO OH H H OH H OH CH2OH HO -HCN H CH3O- H OAc CH3OH H OAc AcO CH2OAc CH2OH D-глюкоза OAc H H OH H OH CH2OH D-арабиноза 47 Руфф CHO H CO2Ca/2 OH HO H H H HO Br2 OH CaCO /H O 3 2 OH H HO H2 O2/Fe3+ -CO2 OH H OH H OH D-арабиноза CO2 -e (реактив Фентона H2O2/Fe3+) H H CH2OH CH2OH глюконат кальция CO2OH OH H D-глюкоза H H H CH2OH CHO OH H H OH -CO2 OH -H O 48 Олигосахариды H HO H C C O O H O C O O O Дисахариды H HO OH H O OH H O H OH H H HO H HO H OH O HO H HO H OH O H H OH H H H HO OH OH H -мальтоза О--D-глюкопиранозил-(1,4) -D-глюкопираноза O OH H HO OH H H -мальтоза О--D-глюкопиранозил-(1,4)-D-глюкопираноза восстановливающий сахар H HO OH HO HO H H OH OH H H O H H CHO O HO H H OH OH OH H H O H HO O H H H O OH HO H HO H H OH H H OH OH O H HO O HO H HO H H OH H H OH H -целлобиоза О--D-глюкопиранозил-(1,4)-D-глюкопираноза восстанавливающие сахара H O H OH HO HO гентиобиоза - О--D-глюкопиранозил(1,6) --D-глюкопираноза H HO HO OH H 49 OH H OH OH H O OH HO H HO амигдалин H H OH H CN H3O+ OCHC6H5 -PhCHO -HCN H O H HO OH H H OH H OH OH H O H HO H 50 H OH H O O HO OH H H H OH H OH -лактоза - О- -D-галактопиранозил-(1,4)--D-глюкопираноза H H OH H O H HO H HO HO OH O H H O HO H OH H сахароза -О--D-глюкопирано-зил-(1,2)--Dфруктофуранозид - не восстанавливающий сахар, нет мутаротации OH 51 Гомополисахариды – крахмал, целлюлоза Состоит из звеньев глюкозы, 1,4-сочленение альфагликозидной связью Крахмал – 20% амилозы и 80% амилопектина Гидролиз амилозы – единственный дисахарид мальтоза H OH H O HO HO H H H H OH OH O H O HO H H H OH H OH O H O HO n H H амилоза n ~ 200, M ~ 40 000 H OH OH 52 Установление длины амилозной цепи H OCH3 H O H3CO H3CO H H H H OCH3 H O OCH3 O H3CO H H H OCH3 H H O OCH3 O H3CO H n H OCH3 H H OCH3 OCH3 H O H H H H OCH3 H O H3CO H3CO + OCH3 OH ~ ~ 1 : 200 HO H3CO H H H H3O+ OCH3 OH 53 Реакция с иодом (фиолетовое окрашивание) H OH H O O HO H OH O HO H H OH 1,6-гликозидная связь HO HO амилопектин H OH HO HO HO H O HO H H OH O H H OH n H H H OH O H H изомальтоза H O HO H HO H O H H OH O H O H H H H O H H OH OH OH H молекулярная масса ~ 200000 (1000 ед.) (-D-глюкопиранозил(1,6)--D-глюкопираноза) гидролиз амилопектин 54 декстрины (олигосахариды) гликоген – аналог амилопектина с более разветвленной цепью H OH H OH H O HO HO H H OH H H OH H O O HO H H H O O OH H öåëëþ ëî çà HO n H H OH OH H Гомополимер, состоящий из глюкозных субъединиц, соединенных бета-гликозидной связью 55 целлюлоза Ac2O H OAc H OAc H O AcO AcO H H O AcO OAc H OAc H O H H H OAc O AcO H n H ONO2 H O HNO3 O2NO H2SO4 O2NO H O H H ацетатный шелк H ONO2 H O H ONO2 H H O2NO H ONO2 H OAc H H ONO2 H O O H OAc O n O2NO H ONO2 H H тринитрат целлюлозы (пироксилин, целлулоид) ONO2 56 S S- HO CS2 / OH- HO целлюлоза HO H3 O+, - CS2 S S- HO HO H OH H O H HO H OH H вискоза S- HO HO O H S n HO HO OH H H OH H H OH 57 H OH HO HO HO H H O NH H H OH HO O HO H O O H NH H HO HO H n хитин H O HO- / H2O NH H OH t CHO H OH H OH H O HO HO H H HO O HO NH2 H H OH H H O NH2 HO H H хитозан n H3O+ HO H OH NH2 H H NH2 OH H H OH H OH CH2OH D-глюкозамин (2-амино-2-дезоксиD-глюкоза) 58 Гетероциклические соединения O O O î êñèðàí O äèî êñàí òåòðàãèäðî ô óðàí N ï èðèäèí Пятичленные гетероциклы с одним гетероатомом 4 3 2 5 N1 H пиррол S O фуран тиофен ароматичность на примере фурана; -избыточные гетероциклические соединения O + O + O + O + O 59 Методы синтеза Пааль-Кнорр H+ O R R O R R t O R -H2 O R R O R HO OH R O R O O OH NH2 R H+ 150 H (NH4)2CO3 OH полифосфорная кислота N H R R N H R P2S5 t S R O R H+ S ± H+ + OH -H2O R R S R R 60 Юрьев O H2O H2S NH3 Al2O3 H2O 400о H2S N H S NH3 Те же превращения возможны и для полностью гидрированных производных OH NH3 N H HO -CO2, -H2O HO CO2H CO2 t CO2H -H2O CO2H - CO2 O Cu, хинолин OH слизевая кислота O пирослизевая кислота 61 CHO CHO CHO CHOH CHOH C HCl, (разб.) O O CH CH2 CHOH CHOH CHOH O CH2OH пентоза (отруби) CH2OH CH2 OH H CHOH OH O CHO H+ CHO H+ -H2O CHO O фурфурол O костяное масло N H каменноугольная смола NH3 CuCl, t N H CH H2S CH t 2 62 H2S CuCl, 150o S Кнорр O R R O R CH3CO2H R NOH O R R O NH2 R R R N H CH2 R N OH R O CH3 Zn O R NH3 R R N O NH O Zn -ZnO N H N H N H N H 63 S S S -H2S -H2S -H2S R S S R CO2Na R P2S3 R CO2Na S Свойства Реакции с электрофильными реагентами H + N H H H+ H + N N H H + N H H H H N H H и т.д. S 64 разбавленная кислота O H3O+ R R R O O R + E E + X E+ X E+ X H H H H X + X E E + H E + X этот путь менее выгоден! Повышенная реакционная способность в реакциях с электрофильными реагентами Преимущественое направление электрофильной атаки - -положение Низкая устойчивость по отношению к кислотам: пиррол, фуран < тиофен 65 O + N SO3ONO2 NO2 X X X = S, NH O X = O, NH SO3H X ONO2 X=O AcO- H O2N O H H O2N O H OAc пиридин t O NO2 66 O . Br2 O H H H3CO O Br2, CH3OH OCH3 X =O X =O X Br2 Br2 X=S X = NH Br Br Br I2/HgO X=S Br N H Br Br S Br Hg(OAc)2 X O S NaCl X HgOAc X HgCl X = O, S I 67 (CH3CO)2O/BF3 CH3COCl/SnCl4 X =O O X X=S S O O POCl3 ДМФА (CH3CO)2O X = NH X = NH H2O, OHN H N H O H ClN+ N N H N H O CH3 CH3 CH3I CH3I t < 0o t > 0o CH3MgI X X = NH N MgI 1. RCOCl 2. H2O R N H O 68 BuLi X X = O, S X Li 1. CO2 2. H3O+ X CO2H X = O, S O CO2CH3 O O O CO2CH3 CO2CH3 CO2CH3 O O O O O O O O CO2H N H N H CO2H 69 CO2H Ph CO2H CO2H N N CH2Ph CH2Ph + N CO2H CO2H CO2H N H CH2O - OH N H N H H+ N H OH FeCl3 HCO2H N H N пиррометан N H дипиррилметан 70 N HCO2H N H CHO N HN NH N N Fe N N CO2H порфин CO2H гемин H2/Pt Ni-Re X=S X X = O, NH X Na/NH3 + S + S S Cl- 71 Индол Методы получения 4 HC 5 CH 3 2 6 NH2 7 N1 H индол Фишер H NH N NH N H N H NH фенилгидразон циклогексанона H NH NH2 N H NH2 H+ -NH3 N H Маделунг 72 CH3 1. NaNH2, 300o 2. EtOH NH R R N H O Свойства индола Индол - -избыточный гетероцикл H H E E + + N H + E N H N H E+ самая значимая резонансная структура + H H N H преимущественое направление реакции E + N H E малозначимые резонансные структуры 73 Повышенная реакционная способность в реакциях с электрофильными реагентами Преимущественое направление электрофильной атаки - положение 3 Низкая устойчивость по отношению к кислотам CHO N POCl3 ДМФА N H EtO2C Na+ N H CH2O (CH3)2.HCl N H грамин + N RO2C NH2 NHCOCH3 NHCOCH3 CO2R EtO2C N H CO2H H3O+ N H триптофан CO2Et RONO - CO2Et EtO2C EtO CO2Et HON CO2Et Na+ NHCOCH3 RX EtO2C Zn AcOH/Ac2O EtO2C EtO2C R NHCOCH3 H N 0o EtO- NHCOCH3 NH2 + H3O t EtO2C RX 74 EtO2C R CH2CO2 CO2H H CH2CO2 ClCH2CO2N R N N CO2H CO2 N H N H гетероауксин 75 NOH NO AmONO N H CH3ONa NH2 N H скатол N H N H N H триптамин HO NH2 N H серотонин 76 Et Et N O N OPO3H2 N N H N H ЛСД псилоцибин 77 Индиго ONa O Cl O O ONa NaNH2 200o NH2 N H N H CO2Na ONa Cl индоксил CO2Na NaOH O NH2 ONa N H NaOH t O O O H3O+, t CO2Na N H - CO2 N H 78 O O H N O2 N H индиго N H Na2S2O4/OHO2 O O ONa H N NaO3S H N N H N H SO3Na O индигокармин NaO белое индиго O S H N H N N H S тиоиндиго Br N H O пурпур Br O O 79 O NH3 NH t O O N CN N N Cu/Cu2+ N Cu CN 2+ N N N N Цианиновые красители Азолы – пятичленные -избыточные гетероциклы N N N N N H N H пиразол O имидазол изоксазол 3 4 O оксазол N N N 2 5 N1 H N N H N H N H N N H N N H атом N1 - донор электронов, атом N3 - акцептор 80 81 Методы получения 1,2-Азолы NH2 N N HO O NH NH2NH2 O O NH2OH O N N O - H2O - H2O N N H OH OH N O 82 O NHR RNHNH2 HN HN NR O OH NH2OH OH HN HN O HN HN O - H2O O OH - H2O Ph NOH H Ph Br Br2 NaOH -H+ NOH -Br- Ph Ph NO NO H Ph H N O окись бензонитрила Br2 -Br- Ph Br NO H NR 83 Реакция 1,3-диполярного циклоприсоединения R R CH2N2 N R Ph N H H3C N Ph O N R O R H3C O R H3 C H3C CH3I PhNHNH2 HN O N CO2Et N N Ph OH H3C N O N Ph антипирин Ph CH3 H3C H3C NO Zn/H H3C N N Ph O N CH3 CH3I + HNO2 H3C NH2 H3C N N Ph O H3C N N O Ph амидопирин 84 H3C H3C N N H3C SO3Na H3C N CH3I N H3C O H N H3C NH2 HOCH2SO3Na SO3Na H3C O N O N Ph анальгин Ph Ph N 1,3-Азолы Синтез, аналогичный синтезу Пааля-Кнорра N R N H CH3CO2NH4 R CH3CO2H NH R R O O N H2SO4 R O R 85 Свойства азолов высокая температура плавления высокая растворимость в воде основность, NH-кислотность H H N N H N N N H N N N N N N H NH N H N 4(5)-метилимидазол N H3C N N I - I- N H N -H+ N H N H E E N + N X E - H+ N N X X N E+ - H+ E+ = HNO3/H2SO4; H2SO4; Br2 X 86 Другие азолы 4 3 N 4 N N2 5 3 N2 5 N1 H N1 H 1,2,3-триазол 1,2,4-триазол Два атома азота, обладающие акцепторными свойствами: 1. Очень низкая реакционная способность в реакциях ароматического электрофильного замещения 2. Высокая NH-кислотность 3. Основность RCOCl HN N 2H 4 N NH R R NH2 R R O O N R1 R R N RN3 R R N 1 N N R R 87 NH2 N N N HNO2 N + NH2 RCN HN3 N N N N H тетразол PhN2+ -H NH2 - N3 < - 70o ±H N N N R N N N H R pK ~ 5 N N N N Ph - N2 > - 70o PhN3 Пиридин 88 Каменноугольная смола g 4 CH CH 5 3 b 6 2 a N N1 HCN R C N ~ 400o t N N R Промышленные методы синтеза 2 CH3CHO + CH2O NH3 NH3 CH3CH=CHCHO + CH2O N CH3CHO + CH2O NH3 + + N N метилпиридины - пиколины N 89 Синтез Ганча NH2 O O CO2Et CH2O NH3 CO2Et CO2Et - H2O - H2O CH2 CO2Et CH2 EtO2C NH2 CO2Et + N H2 CO2Et + H2N O EtO2C EtO2C O - H2O CO2Et - O O NH2 EtO2C CO2Et EtO2C HNO3 N H дигидропиридин (85%) 1. H2O, OH2. CaO, t, - CO2 EtO2C N 2,6-диметилпиридин (лутидин) 65% H2SO4 CO2Et N Свойства: Ароматичность (по Хюккелю) -дефицитный гетероцикл - пониженная реакционная способность в реакциях ароматического электрофильного замещения + N N N Основность + + N N E+ N N E хлорид пиридиния + N H Cl- + N N RCO3H пиридин N-оксид CH3I HCl E+ CH3 N + N O E йодид метилпиридиния I- 90 91 Br2 + N Br SO3 20o 20o N Br3- + N - SO3 пербромид пиридинийбромида пиридинсульфотриоксид R1OH RCOCl -пиридин N +N COR RCO2R1 92 Реакции электрофильного ароматического замещения происходят в положение 3 + + X X+ N H + X X N H X H H + N X X + N N N H H X H N X + N H X + H + N + N Помимо акцепторного влияния гетероциклического атома азота, реакционная способность снижается в результате протонирования этого атома в условиях реакции HO3S Br2, SO3 SO3, H2SO4 200o 220o N 70% Br N N KNO3/H2SO4 50% NO2 6% N Модификация реакционной способности N-оксидной группировкой - + N + N O- O - + N O - + N O + + + N N N O- O- O- N-оксид донор или акцептор? 93 94 Использование в синтезе реакций N-окиси пиридина с электрофильными реагентами NO2 NO2 SO3H PPh3 HNO3/H2SO4 SO3, H2SO4 + N + N O- O- 90o + N OFe HX X NH2 N + N N OH OH NO2 X- PCl3 + N N X = Cl, Br CH3CO2H NO2 X X N O- - NO2- H+ 95 Реакции с нуклеофильными реагентами OHt N OH + N N O- OMgX NaBH4 CN- R N CH3MgI + N N H2O RMgX + N I- CH3 CH3 NaOH, H2O K3Fe(CN)6 N CN N O N R 96 Чичибабин NaNH2 130o - H2 N N NH2 1. KNH2 2. H2O N N NH2 N NH2 N 1. KOH, 400o 2. H2O Na/EtOH PhLi N или H2/Pt N H NH NH2 + HO N H2 O -OH- пиперидин 110o, 8 ч. H2O N Ph O2 N Ph 97 Таутомерные равновесия гидрокси- и аминопиридинов ± H+ N OH ± H+ N N H O- O H+ O- OH O ± H+ ± H+ N N N H H+ OH N O- ± H+ N H+ O± H+ + N H N N2 NaNO2 + N N H NH2 NH2 o H3O , 0 NH N NH2 NH N N H NaNO2 + o H3O , 0 устойчивая соль диазония N2 N H2O N - изомеры Реакции по боковой цепи KMnO4 CO2H OHN пиколин N - пиколиновая кислота - никотиновая кислота - изоникотиновая кислота 98 OH Повышенная СН-кислотность протонов у -углеродного атома заместителя в - и -положениях пиридинового кольца _ _ CH2 N N RCHO _ N CH2 1. RCHO N CH2- 2. H2O AmONO NOH CHR N N CH2 BuLi или NaNH2 OH- _ N N OH N R CH2 99 100 AmONO NOH + N OH PhCHO H+ пиперидин + N - Cl + N Ph Cl- ClHO- 2-ПАМ + N N CH2- Cl- p-TsCl Ac2O N N N N OCOCH3 O O SO2 Cl 101 Биологически активные производные пиридина CONHNH2 N CONH2 N H N N N никотин анабазин N тубазид (изоанизид) никотинамид (витамин РР) Витамины группы В6 CH2OH CHO HO CH2OH N пиридоксаль HO CH2OH N пиридоксол CH2NH2 HO CH2OH N пиридоксамин 102 Хинолин и изохинолин 4 5 4 5 6 3 6 3 7 2 7 N2 N 8 8 1 хинолин 1 изохинолин Методы получения Синтез Скраупа OH PhNH2 + HO OH H+ t H2SO4 PhNO2 t N OH O H H + H + CHO NH2 N H N H 103 H OH PhNO2 H+ N H - H2O N H -PhNH2 N Модификация Дебнера-Миллера PhNH2 CH3CHO H+ N O O O O H+ PhNH2 + N H N Синтез Бишлера-Напиральского 104 H+ NH R -H2 N Pt NH R O OH R R H+ = P2O5 / H3PO4 или P2O5 / POCl3 Свойства: -дефицитные ароматические гетероциклические соединения CO2H KMnO4 N N CO2H хинолиновая кислота KMnO4 CO2H CO2H + N CO2H N N CO2H цинхомероновая кислота 105 Реакции по атому азота CH3I + N I RCO3H N - N HCl O Cl- N H Реакции электрофильного замещения Br Br2 N + H2SO4 N N 51% H2SO4 Br 49% NaOH t N N SO3H OH 8-оксихинолин 106 NO2 HNO3/H2SO4 + 0o, 30 ì èí N N N 9 NO2 Чичибабин 1 NH2 NaNH2 + t N N NH2 NaNH2 N t N NH2 N 107 + N N EtBr OH- Br- [O] OH- + + N Br N - + N N O Iэтиловый красный (цианиновый краситель) Азины 4 5 6 3 N 1 4 4 N2 пиридазин 5 6 N3 N 1 2 пиримидин 5 6 N 3 N 1 пиразин 2 108 Синтез пиридазин O N2H4 N O N + N [O] N N CO2R N N CO2R N CO2R CO2R H3O+ NH t NH пиразин R N O N [O] 1. KMnO4 2 N NH2 Br HN Br N NH NH3 пиперазин N 2. t, -2CO2 N Пиримидин R CO2Et R1 CO2Et O NH H2HCONH2 EtONa O 109 OH N H N O HO N OH барбитуровая кислота O R R1 барбитураты: NH O N H O R = R1 = Et - веронал (барбитал) R = Et, R1 = Ph (фенобарбитал, люминал) O NH O OEt EtO CO2Et H2N N NH2 ONa N NH2 H2N O NH2 NH N O H урацил 110 Свойства: Ароматичность (по Хюккелю) -дефицитный гетероцикл - пониженная реакционная способность в реакциях ароматического электрофильного замещения Пониженная основность и нуклеофильность – возможность протонирования, а также окисления и алкилирования только по одному атому азота из двух Модификации строятся на реакциях нуклеофильного замещения получаемых в результате циклизации гидроксипроизводных Cl OH PCl5 N HO N OH HI N Cl N Cl OH OH урацил N NH2 N N N N OH N тимин N OH N цитозин OH 111 HO O H HO N H H H N O H H OH HO -D-рибофуранозид H HO -дезокси--D-рибофуранозид O NH HO N O H H HO P NH O 5' N O O H O H 5' HO N O H H 3' OH O H OH NH O H H HO H OH HO уридин (нуклеозид) HO РНК O OH O P O H H OH O NH2 NH2 H2O N OH 112 N Cl N N N PCl5 N OH N NH3 Cl N цитозин + Cl Cl урацил OH N N OH H2O N NH2 N NH2 изоцитозин OH N N O2 S + N N H NH2 сульфадимезин NH2 S тиамин (витамин В1) N N Cl- O Пурины 6 9 5 1N N H N HN N 3 4 N 7 H пурин O N H N H N N O 8 2 113 OH OH HO мочевая кислота N N H 114 Фишер O O NOH HNO2 HN O Zn HN NH2 HN H3O+ O N H O O N H O O N H O барбитуровая кислота O H O H N H O O N H O NH2 N N N - H2O O H O N H N H мочевая кислота HNCO 115 Траубе O CO2Et H2N O O HN HN NH2 1. HNO2 CN CN O O NH2 N H NH 2. [H] O O H N HN H2N O NH2 HN O NH2 N N H O OH NH HO диаминоурацил N NH2 O NH2 N H N H мочевая кислота O RCO2Et N HN O R N H N H ксантин (R = H) 116 O Cl H N HN O O N H N H PCl5 N N Cl NH2 NH3 Cl N N H Cl Cl H2N N N H NH3 NH2 N N N N Cl Cl HI N N N H аденин N H EtOOH OH OH N N N N Cl H2N N H HI OH N N Cl N HOOH N N N гуанин N H OEt N N H HI HO N N N ксантин N H 117 Пуриновые алкалоиды – производные ксантина O N N O N N O N H O N H O N N N H теобромин (какао) N O (CH3O)2SO2 N H N H O O N N N H теофиллин (чай) HN (CH3 CO)2O O N N N N O O O N N кофеин (чай, кофе) Синтез кофеина O H N HN O O N N Cl2 CCl3 O N N N N - OH , t O N N кофеин





