Дудкина Елена Николаевна, учитель химии МБОУ Ливенская СОШ №1. Идентификатор автора:222-467-726.
advertisement
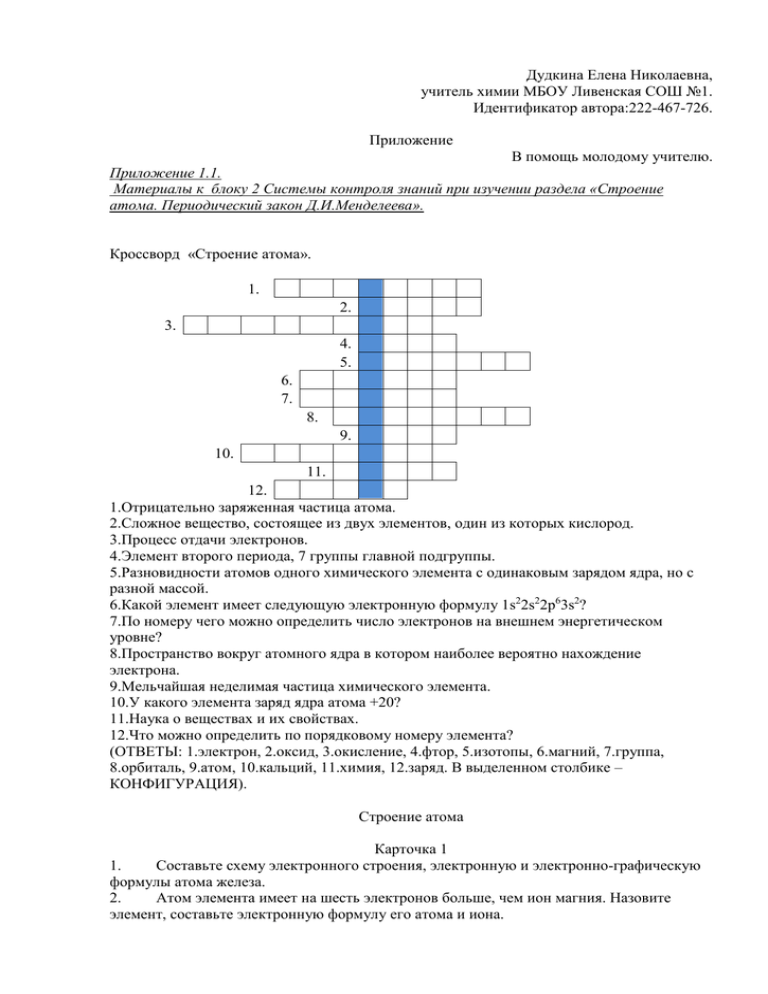
Дудкина Елена Николаевна, учитель химии МБОУ Ливенская СОШ №1. Идентификатор автора:222-467-726. Приложение В помощь молодому учителю. Приложение 1.1. Материалы к блоку 2 Системы контроля знаний при изучении раздела «Строение атома. Периодический закон Д.И.Менделеева». Кроссворд «Строение атома». 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 1.Отрицательно заряженная частица атома. 2.Сложное вещество, состоящее из двух элементов, один из которых кислород. 3.Процесс отдачи электронов. 4.Элемент второго периода, 7 группы главной подгруппы. 5.Разновидности атомов одного химического элемента с одинаковым зарядом ядра, но с разной массой. 6.Какой элемент имеет следующую электронную формулу 1s22s22p63s2? 7.По номеру чего можно определить число электронов на внешнем энергетическом уровне? 8.Пространство вокруг атомного ядра в котором наиболее вероятно нахождение электрона. 9.Мельчайшая неделимая частица химического элемента. 10.У какого элемента заряд ядра атома +20? 11.Наука о веществах и их свойствах. 12.Что можно определить по порядковому номеру элемента? (ОТВЕТЫ: 1.электрон, 2.оксид, 3.окисление, 4.фтор, 5.изотопы, 6.магний, 7.группа, 8.орбиталь, 9.атом, 10.кальций, 11.химия, 12.заряд. В выделенном столбике – КОНФИГУРАЦИЯ). Строение атома Карточка 1 1. Составьте схему электронного строения, электронную и электронно-графическую формулы атома железа. 2. Атом элемента имеет на шесть электронов больше, чем ион магния. Назовите элемент, составьте электронную формулу его атома и иона. 3. Электронная формула атома химического элемента – 1s22s22p63s23p63d34s2. Назовите этот элемент, напишите формулу его высшего оксида. Карточка 2 1. Составьте схему электронного строения, электронную и электронно-графическую формулы атома цинка. 2. Атом элемента имеет на семь электронов меньше, чем ион хлора. Назовите элемент, составьте электронную формулу его атома и иона. 3. Электронная формула атома элемента — 1s22s22p63s23p63d104s24p2. Назовите этот элемент, напишите формулу его высшего оксида. Химический диктант Закончить предложения: 1.Химический элемент-это……… 2.Период-….. 3.Группа-….. 4Изотопы-это……. 5.s-элементы- это…… 6.p-это……. 7.d-элементы- это…… 8.f-элементы-это……………. 9.В периодической системе элементы располагаются друг за другом в порядке…….. 10.В один и тот же период попадают элементы ,у которых одинаково……………….. 11.Первый период образуют только…………………….,потому что…………………… 12. Второй период образуют ……….…………………….,потому что…………………… 13.В третий период попадают всего……..элементов, несмотря на то, что……………. 14.Элементы, у которых заполняется d -орбитали, попадут в ………период, потому что…….. Индивидуальное задание по теме «Строение атома». Часть А 1.Определите химический элемент по составу его атома - 18 p+, 22 n0, 18 e-: а) F б) Ca в) Ar г) Sr 2. Общее число электронов у иона хрома 24Cr3+: а) 21 б) 24 в) 27 г) 52 3.Максимальное число электронов, занимающих 3s - орбиталь, равно: а) 14 б) 2 в) 10 г) 6 4.Число орбиталей на f - подуровне: а) 1 б) 3 в) 5 г) 7 5 .Наименьший радиус атома среди приведённых элементов имеет: а) Mg б) Ca в) Si г) Cl 6. Из приведённых элементов 3-го периода наиболее ярко выражены неметаллические свойства имеет: а) Al б) S в) Si г) Ar 7. Ряд элементов, образующих оксиды с общей формулой RO: а) Ba, Sr, Ca б) P, As, N в) C, Si, Ge г) B, Al, Ga 8. К р-элементам относится: а) кремний б) актиний в) гелий г) хром 9. Наиболее сходными химическими свойствами обладают простые вещества, образованные элементами: а) Ca и Si б) Pb и Ag в) Cl и Ar г) P и As 2 2 6 2 2 10. Электронная формула атома 1s 2s 2p 3s 3p . Формула его водородного соединения: а) PH3 б) H2S в) CH4 г) SiH4 Часть Б 1. Электронная формула внешнего электронного слоя атома химического элемента …3s23p5. Определите этот элемент, составьте формулы его высшего оксида, летучего водородного соединения . Какими свойствами (основными, кислотными или амфотерными) они обладают? Составьте его графическую формулу и определите валентные возможности атома этого химического элемента. 2. Составьте электронную и графическую формулы атома химического элемента № 22. 3. Расположите оксиды в порядке увеличения их кислотных свойств: P2O5, Al2O3, MgO, Na2O.Напишите их гидроксиды. (Ответы к индивидуальному заданию по теме «Строение атома». Часть А 1.в,2а,3б,4г,5г,6б,7а,8а,9г,10г Часть Б 1.хлор,Cl2O7;НCl-(свойства кислотные) 2. 2,8,10,2 3. Na2O, MgO, , Al2O3, P2O5,(NaOH, Mg(OH)2, Al(OH)3). Приложении 1.2. Материалы к блоку 3. Системы контроля знаний при изучении раздела «Строение атома. Периодический закон Д.И.Менделеева». Практико-ориентированные проблемно-творческие задачи. В «Стандарте основного общего образования по химии» отмечено, что учащиеся должны «использовать приобретенные знания и умения в практической деятельности и повседневной жизни», в том числе для критической оценки информации о веществах, используемых в быту. Поэтому содержание обучающей цели отличается от традиционных заданий своей практической направленностью. Задача 1. Почему для индийцев река Ганг священна? Научно-популярная информация-подсказка. Туристы, приехавшие в Индию, обязаны искупаться в водах “священного Ганга”. На берегах Ганга омываются ежедневно тысячи людей, при этом не обнаружено ни одного возбудителя инфекционного заболевания. Это связано с тем, что в устье реки Ганг располагаются залежи самородного серебра, в прибрежных зонах реки находятся самые крупные в Индии месторождения серебра. Поэтому в воде Ганга находятся ионы серебра, обладающие бактерицидным действием. Тема “Строение атома”. Задание. Составьте электронную формулу иона серебра Ag+, обладающего бактерицидным действием. (Ответ. 1s22s22p63s23p64s23d104p6 5s0 4d10.) Творческое задание. Составить мини-пособие “Соединения серебра в природе”. Пособие должно быть привлекательно оформлено фотографиями химических явлений, иллюстрациями веществ. Формируемые специальные химические умения и навыки. Закрепить умения составлять электронную формулу иона. Формируемые общеучебные умения и навыки. • Умение использовать приобретенные знания в практической деятельности и повседневной жизни для объяснения сущности явлений, происходящих в быту; • умение устанавливать причинно-следственные связи; • умение самостоятельно создать алгоритм деятельности при решении проблем творческого характера; • умение обрабатывать текстовую информацию с использованием возможностей Интернета. Образовательный продукт. Мини-пособие “Соединения серебра в природе”. Задача 2. Почему вьетнамцы едят землю? Научно-популярная информация-подсказка. Специально “копченые” куски земли в качестве “лакомства” продаются на многих базарах в провинции Виньфук и других районах Северного Вьетнама. В образцах земли химическим анализом обнаружено много железа и марганца. Тема “Строение атома”. Задание. Составьте электронную формулу атома железа. (Ответ. 1s22s22p63s23p64s23d6.) С помощью проблемно-творческих заданий реализуется компетентностный подход к творческому саморазвитию личности в процессе обучения. Цель использования данной группы проблемно-творческих заданий в процессе обучения – раскрыть химическую сущность явлений в укладе жизни народов мира. Практико-ориентированные задачи. Цель: развитие способностей к творческому мышлению, самостоятельности в принятии решений, инициативности в нестандартной ситуации. Развитие способностей ученика – основная задача учителя. Поэтому «вектор» развития учебно-познавательных способностей учащихся строю не от обучения к учению, а, наоборот, от ученика к определению педагогических средств, способствующих его развитию. В этих условиях меняется методика урока, т.е. ученики не просто слушают мое объяснение, а постоянно сотрудничают в диалоге, высказывают свои мысли, обсуждают то, что предлагают одноклассники, отбирают с моей помощью то содержание, которое подкреплено научным знаниям. На уроке постоянно обращаюсь к классу с вопросами: - Что вы знаете об этом веществе и его свойствах? - Как вы думаете? - Почему? Учащиеся охотно включаются в такую беседу, я поощряю различные подходы к решению одной и той же задачи. Я стараюсь не навязывать ученикам свое видение вопроса, делая учеников пассивными и некритическими потребителями информации, а побуждать их к высказыванию своего мнения, к столкновению и обсуждению различных мнений, только в случае крайней необходимости направляя эти суждения в нужное русло. Не принуждаю, а убеждаю учеников принять то содержание, которое я предлагаю с позиции научного знания. Повышение эффективности обучения химии вижу в развитии мыслительной деятельности ученика. Формирование такой деятельности осуществляю поэтапно: - первый этап репродуктивного воспроизведения; - второй этап организация частично - поисковой деятельности учащихся. - третий этап организация исследовательской деятельности. Последний этап - это выход школьника на самостоятельное составление логических схем, позволяющих анализировать и характеризовать химические явления, а также обобщать и систематизировать полученные знания. Объясняю приемы учебной работы и важнейшие мыслительные операции, предлагаю памятки – предписания с перечнем конкретных шагов действий. На этапе организации исследовательской деятельности использую серии однотипных заданий с возрастающей сложностью. Прокомментирую содержание некоторых заданий к обобщающему уроку по теме «Строение атома» Задание №1. Выпишете схемы, отражающие правильное расположение электронов в атомах элементов: 1) 2е, 8е, 18е; 2) 3е, 8е, 4е; 3) 2е ,9е, 1е; 4) 2е, 8е, 3е; 5) 2е, 8е, 18е, 2е; 6) 3е, 8е, 2е При выполнении данного задания учащиеся должны проанализировать предложенные схемы, используя для обоснования правильности выбора знания о способе расчета максимального числа электронов на внутренних слоях и максимальном числе электронов на внешнем слое. Характер деятельности преимущественно репродуктивный. Задание №2. Какие схемы распределения электронов в атомах соответствуют элементам, оксиды которых реагируют с гидроксидом химического элемента V группы 3-го периода: 1) 2е,8е, 2е; 2)2е, 8е, 7е;3)2е. 8е, 18е, 2е; 4) 2е, 4е. Задание направлено на развитие умения осуществлять аналитико-синтетическую деятельность. При выполнении познавательная деятельность учащихся приобретает частично-поисковый характер. Задание №3. Выпишите схемы распределения электронов в атомах элементов, которым соответствуют основные оксиды и гидроксиды: 1) 2е, 7е; 2) 2е, 8е, 2е; 3) 2е, 8е, 8е, 1е;4) 2е, 6е; 5) 2е, 8е, 18е, 18е, 2е; 6) 2е. 8е. 18е. Экспериментально подтвердите характер свойств этих оксидов и гидроксидов. Составьте уравнения реакций. Выполняя данное задание, учащиеся должны уметь не только анализировать сравнивать, но и находить причинно-следственные связи между строением атома химического элемента и свойствами его соединений параллельно с названными умениями используют и специальные: планировать и осуществлять эксперимент, составлять уравнения реакций. Характер деятельности преимущественно эвристический. Задание №4. Три элемента принадлежат к одной группе элементов периодической системы. Сумма атомных номеров двух крайних из них равна 76. Нитрат, образованный средним из этих элементов, используют для окрашивания огней фейерверка в красный цвет. Назовите эти элементы, определите их положение в периодической системе. Охарактеризуйте строение атомов этих элементов и предскажите изменение свойств с увеличением их атомной массы. Какие природные соединения этих элементов вам известны? Задание составлено так, что интеллектуальные умения, используемые при выполнении предыдущих заданий, и исходные знания учащихся переносятся в новую ситуацию, а работа включает элементы исследования. Для решения задач современного образования, формирование таких качеств личности, как способность к творческому мышлению, самостоятельности в принятии решений инициативности, использую практико-ориентированные задачи. Построенная таким образом работа по повышению эффективности обучения химии позволяет поддерживать и сохранять интерес к предмету, способствует росту мотивации к изучению предмета, формирует ключевые компетенции учащихся, развивает индивидуальные способности и общую культуру личности обучающихся, способной к саморазвитию. Приложении 1.3. Материалы к блоку 4. Системы контроля знаний при изучении раздела «Строение атома. Периодический закон Д.И.Менделеева». Тест I Тест состоит из частей А и В. На его выполнение отводится 10 минут. Часть А К каждому заданию части А дано несколько ответов, из которых один только верный. В листе ответов запишите номер задания и букву выбранного вами ответа. А1. Сколько периодов в периодической системе? а) 2 б) 3 в) 7 г) 8 А2. Сколько рядов в периодической системе? а) 7 б) 8 в) 9 А3. Сколько элементов в шестом периоде? а) 32 б) 18 в) 8 г) 10 г) 2 А4. Сколько элементов в главной подгруппе пятой группы? а) 3 б) 4 в) 5 г) 8 А5. Чему равен порядковый номер элемента, который находится в четвертом периоде, в главной подгруппе второй группы? а) 10 б) 20 в) 30 г) 40 А6. Чему равна высшая валентность элемента хрома (порядковый номер 24)? а) VI б) IV в) III г) II А7. На внешнем электронном уровне атома хлора: а) 5 электронов б) 1 электрон в) 7 электронов г) 3 электрона А8. Распределение электронов по уровням в атомах фосфора соответствует ряду чисел: а) 2,8,5 б) 2,5 в) 2,7 г) 2,8,3 А9. Среди химических элементов P,S,Cl,F наиболее ярко свойства неметаллов выражены у: а) фосфора б) сера в) хлор г) фтор А10. f-Элементом является: А). Калий. Б). Германий. В). Селен. Г). Уран. А11. s -Элементом является: А). Калий. Б). Германий. В). Селен. Г). Уран. А12. p -Элементом является: А). Калий. Б). Селен. В). Германий. Г). Уран. А13. В ядрах атомов углерода, кремния, хлора число протонов соответственно равно: а) 12,28,35 б) 6,14,17 в) 6,7,17 г) 12,14,17 А14. Атомы натрия и магния имеют: а) одинаковое число электронов б) одинаковое число электронных уровней в) одинаковую степень окисления в оксидах г) одинаковое число протонов в ядрах А15. Химические элементы расположены в порядке возрастания электроотрицательности в ряду: а) S, P, Si, O, Cl б) Si, P, Br, Cl, O в) F, O, N, S, P г) P, S, C, O, Br Часть В Ответом в задании части может служить только слово. В1. Химический элемент, в атоме которого 14 протонов, называется… В2. Формуле RO3 отвечает состав высших оксидов элементов … группы. В3. Количество энергетических уровней для элементов соответствует номеру … В4. Высшую валентность химического элемента можно определить по номеру… в периодической системе. В5. В периоде металлические свойства элементов … слева направо. Тест II Тест состоит из частей А и В. На его выполнение отводится 10 минут. Часть А К каждому заданию части А дано несколько ответов, из которых один только верный. В листе ответов запишите номер задания и букву выбранного вами ответа. А1. Сколько групп в периодической системе? а) 7 б) 8 в) 9 г) 10 А2. Какой из следующих элементов находится в четвертой группе? а) Fe б) C в) Cr г) K А3. Сколько химических элементов в пятом периоде? а) 8 б) 9 в) 18 г) 32 А4. Сколько химических элементов в главной подгруппе четвертой группы? а) 4 б) 5 в) 6 г) 7 А5. Чему равен порядковый номер элемента, который находится в пятом периоде, в побочной подгруппе VI группы? а) 42 б) 52 в) 73 г) 83 А6. Чему равна высшая валентность элемента висмута (порядковый номер 83)? а) VIII б) VII в) VI г) V А7. На внешнем электронном уровне два электрона имеют атомы: а) серы и кислорода б) фосфора и азота в) магния и кальция г) бария и натрия А8. Последовательность чисел в ряду 2,8,7 соответствует распределению электронов по уровням в атомах а) фосфор б) хлор в) алюминий г) марганец А9. Среди химических элементов Li, Na, K, Cs наиболее ярко свойства металла выражены у: а) лития б) натрия в) калия г) цезия А10. f- -Элементом является: А). Калий. Б). Германий. В). Селен. Г). Уран. А11. s -Элементом является: А). Калий. Б). Германий. В). Селен. Г). Уран. А12. p -Элементом является: А). Калий. Б). Селен. В). Германий. Г). Уран. А13. В ядрах атомов лития, бора, кислорода число протонов соответственно равно: а) 3, 5, 8 б) 7, 11, 16 в) 4, 6, 8 г) 8, 5, 3 А14. Атомы углерода и кремния имеют: а) одинаковое число электронных уровней б) одинаковые радиусы в) одинаковое число электронов на внешнем электронном уровне г) одинаковое число протонов в ядре А15. В порядке возрастания электроотрицательности атомов химические элементы расположены в следующем ряду: а) I, Br, Cl, F б) F, Cl, Br, I в) F, O, N, C г) Cl, S, P, Si Часть В Ответом в задании части может служить только слово. В1. Химический элемент, в атомном ядре которого 1 протон и нет нейтронов, называется… В2. В главных подгруппах неметаллические свойства элементов снизу вверх… В3. У элементов III периода число электронов на внешнем уровне … В4. В главных (А) подгруппах атомный радиус… В5. Формуле R2О7 отвечает состав высших оксидов элементов … группы. ОТВЕТЫ А1 А2 А3 А4 А5 А6 А7 А8 А9 А10 А11 А12 А13 А14 А15 Тест 1 В Г А В Б А В Б Г Г А Б Б Б Б Тест 2 Б Б В Б А Г В Б Г Б А Б А В А ОТВЕТЫ В1 В2 В3 В4 В5 Тест 1 КРЕМНИЙ ШЕСТОЙ ПЕРИОДА ГРУППЫ УМЕНЬША ЮТСЯ Тест 2 ВОДОРОД ВОЗРАСТА ЮТ ВОЗРАСТАЕ Т УВЕЛИЧИВ АЕТСЯ СЕДЬМОЙ Оценка выполнения заданий, каждое задание 1 балл. 18-20 БАЛЛОВ – ОЦЕНКА «5» 100% 17-12 БАЛЛОВ – ОЦЕНКА «4» 60% 11-9 БАЛЛОВ – ОЦЕНКА «3» 30% Тренировочная тестовая работа по теме: «Периодический закон и периодическая система химических элементов Д.И.Менделеева. Строение атома». 1. Среди химических элементов F,S,Cl,Si наиболее ярко свойства неметаллов выражены у: а) кремний б) сера в) хлор г) фтор 2. Среди химических элементов P,S,Cl, Br наиболее ярко электроотрицательные свойства неметаллов выражены у: а) фосфора б) сера в) хлор г) бром 3. Среди химических элементов Li, Na, K, Cs наиболее ярко свойства металла выражены у: а) лития б) натрия в) калия г) цезия 4. В ядрах атомов магния, кремния, хлора число протонов соответственно равно: а) 12,28,35 б) 6,14,17 в) 6,7,17 г) 12,14,17 5. Атомы азота и кислорода имеют: а) одинаковое число электронов б) одинаковое число электронных уровней в) одинаковую степень окисления в оксидах г) одинаковое число протонов в ядрах 6. Химические элементы расположены в порядке возрастания электроотрицательности в ряду: а) I, Br, Cl, F б) F, Cl, Br, I в) F, O, N, C г) Cl, S, P, Si Вставьте пропущенное слово. 1. Химический элемент, в атоме которого 14 протонов, называется… 2. Формуле RO3 отвечает состав высших оксидов элементов … группы. 3. Количество энергетических уровней для элементов соответствует номеру … 4. Высшую валентность химического элемента можно определить по номеру… в периодической системе. 5. В периоде металлические свойства элементов … слева направо. 6. Химический элемент, в атомном ядре которого 1 протон и нет нейтронов, называется… 7. В главных подгруппах неметаллические свойства элементов снизу вверх… 8. У элементов III периода число электронов на внешнем уровне … 9. В главных (А) подгруппах атомный радиус… 10. Формуле R2О7 отвечает состав высших оксидов элементов … группы (Ответы: Часть 1:1в,2в,3г,4г,5б,6а. Часть 2 кремний, шестая,период,группы,уменьшается,водородом,увеличивается,растет,седьмой.) Приложении 1.4. Материалы к блоку 5. Системы контроля знаний при изучении раздела «Строение атома. Периодический закон Д.И.Менделеева». «Периодический закон. Периодическая система химических элементов. Строение атома». Вариант 1 ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение 1.(2 балла). Электроны были открыты: А. Н.Бором. Б. Э. Резерфордом. В. Дж. Томсоном. Г. Д. Чедвигом. 2.(2 балла). Порядковый номер элемента в Периодической системе определяется: А. Зарядом ядра атома. Б. Числом электронов в наружном слое атома. В. Числом электронных слоев в атоме. Г. Числом нейтронов в атоме. 3.*(2 балла). Общий запас энергии электронов в атоме характеризует: А. Главное квантовое число. Б. Магнитное квантовое число. В. Орбитальное квантовое число. Г. Спиновое квантовое число. 4.(2 балла). Пара элементов, имеющих сходное строение внешнего энергетического уровня: А. В и Si. Б. S и Se. В. К и Са. Г. Сr и Fe. 5.(2 балла). s-Элементом является: А. Барий. Б. Америций. В. Галлий. Г. Ванадий. 6.(2 балла). Электронная конфигурация ...3d64s2 соответствует элементу: А. Аргону. Б. Железу. В. Криптону. Г. Рутению. 7.(2 балла). Амфотерным гидроксидом является вещество, формула которого: А. Ве(ОН)2. Б. Мg(ОН)2. В. Н2SiO3. Г. Ва(ОН)2. 8.(2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств: А. Sr — Rb — K. Б. Ве — Li — K. В. Na — K — Ca. Г. Al — Mg — Be. 9.(2 балла). Элемент Э с электронной формулой 1s22s22p63s23p3 образует высший оксид, соответствующий формуле: А. Э2О. Б. Э2О3. В. ЭО2. Г. Э2О5. 10. (2 балла). Изотоп железа, в ядре которого содержится 28 нейтронов, обозначают: А. . Б. . В. . Г. . 11. (9 баллов). Установите соответствие. Элемент: I. Бериллий. II. Натрий. III. Хлор. IV. Азот. Электронная формула: А. 1s22s2. Б. 1s22s22p3. В. 1s22s22p63s1. Г. 1s22s22p63s23p5. Формула высшего оксида: Э2О. 2. ЭО. 3. Э2О5. 4. Э2О7. Формула высшего гидроксида: а. ЭОН. б. Э(ОН)2. в. НЭО3. г. НЭО4. ЧАСТЬ Б. Задания со свободным ответом 12. (3 балла). На основании положения в Периодической системе расположите элементы: бериллий, бор, магний, натрий — в порядке возрастания восстановительных свойств. Объясните ответ. 13. (6 баллов). Как и почему в Периодической системе изменяются неметаллические свойства? А. В пределах периода. Б. В пределах главной подгруппы. 14. (5 баллов). Какие химические свойства характерны для оксида элемента 2-го периода, главной подгруппы I группы Периодической системы? Ответ подтвердите, написав уравнения реакций. 15. (7 баллов). Составьте электронную формулу элемента с порядковым номером 31 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер. (Ответы:Часть А1в,2а,3а,4б,5а,6б,7а,8б,9г,10 54 Fe,11-1а2,2в1,3г4,4б3. ЧастьВ 12бор,бериллий,магний,натрий,13А-усиливается,13Б-уменьшается 14 оксид лития проявляет основные свойства 15оксид галлия(III)и гидроксид галлия(III) амфотерны. 1s22s22p63s23p63d104s24p3). Вариант 2 26 ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение 1. (2 балла). Протоны были открыты: А. Г. Паули. Б. Э. Резерфордом. В. Дж. Томсоном. Г. Д. Чедвигом. 2.(2 балла). Общее число электронов в атоме элемента определяют, используя Периодическую систему, по номеру: А. Группы. Б. Периода. В. Ряда. Г. Порядковому. 3.*(2 балла). «Собственное вращение» электрона характеризует: А. Главное квантовое число. Б. Магнитное квантовое число. В. Орбитальное квантовое число. Г. Спиновое квантовое число. 4.(2 балла). Пара элементов, имеющих сходное строение внешнего энергетического уровня: А. С и Si. Б. As и Se. В. Zn и Ca. Г. Mo и Te. 5.(2 балла). f-Элементом является: А. Германий. Б. Калий. В. Селен. Г. Уран. 6.(2 балла). Электронная конфигурация ...4s24p6 соответствует элементу: А. Брому. Б. Железу. В. Неону. Г. Криптону. 7.(2 балла). Амфотерным гидроксидом является вещество, формула которого: А. Fe(OH)3. Б. Mg(OH)2 . В. LiOH. Г. Sc(ОH)2. 8.(2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств: А. K — Rb — Sr. Б. Al — Mg — Be. В. Be — Li — Cs. Г. Ge — Sn — Sb. 9.(2 балла). Элемент Э с электронной формулой 1s22s22p63s1 образует высший оксид, соответствующий формуле: А. Э2О. Б. Э2О3. В. ЭО2. Г. ЭО3. 10. (2 балла). Изотоп кальция, в ядре которого содержится 24 нейтрона, обозначают: А. . Б. . В. . Г. . 11. (9 баллов). Установите соответствие. Элемент: I. Азот. II. Кальций. III. Кремний. IV. Сера. Электронная формула: А. 1s22s22p3. Б. 1s22s22p63s23p4. В. 1s22s22p63s23p2. Г. 1s22s22p63s23p64s2. Формула высшего оксида: 1. ЭО. 2. ЭО2. 3. Э2О5. 4. ЭО3. Формула высшего гидроксида: а. Н2ЭО4. б. Э(ОН)2. в. Н2ЭО3. г. НЭО3. ЧАСТЬ Б. Задания со свободным ответом 12. (3 балла). На основании положения в Периодической системе расположите элементы: кислород, мышьяк, сера, фосфор — в порядке убывания окислительных свойств. Обоснуйте ответ. 13. (6 баллов). Как и почему в Периодической системе изменяются металлические свойства? А. В пределах периода. Б. В пределах главной подгруппы. 14. (7 баллов). Составьте электронную формулу элемента с порядковым номером 30 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер. 15. (5 баллов). Какие химические свойства характерны для высшего оксида элемента 3-го периода, главной подгруппы VI группы Периодической системы? Ответ подтвердите, написав уравнения реакций. (Ответы: 1б,2г,3г,4а,5г,6г,7а,8в,9а,10 4420Ca, 11.1а3г,2г1б,3в2в,12.кислород,сера,фосфор,мышьяк-убывают окислительные свойства(в подгруппе увеличиваются, в периоде уменьшаются),13А-усиливается,13Б-уменьшается 14. оксид лития проявляет основные свойства 15.оксид галлия(III)и гидроксид галлия(III) амфотерны. 1s22s22p63s23p63d104s24p3)

