SIRT HODISALARI. ADSORBSIYA
advertisement

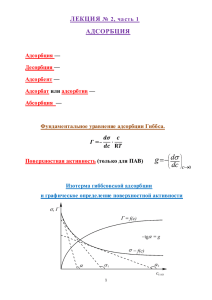
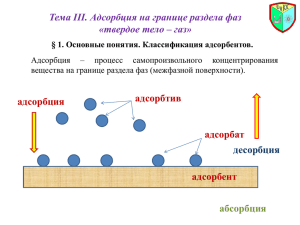
Кафедра биоорганической и биологической химии Бионеорганическая химия I КУРС ТЕМА: ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. АДСОРБЦИЯ ЛЕКЦИЯ №8 ЛЕКТОРА: ПРОФЕССОР ПРОФЕССОР ПРОФЕССОР ДОЦЕНТ А.Д.ДЖУРАЕВ У.А. БАЛТАБАЕВ С.С. КАСЫМОВА Ш.У.АБДУЛЛАЕВ Цель лекции Поверхностные явления происходят на поверхности раздела и подчиняются определённым закономерностям. При изучении этих закономерностей необходимо учитывать изменение энергии на поверхности, условия проведения адсорбции, её количественное изучение. Большинство биологически важных процессов проходят на поверхности тканей и клеток и сопровождаются процессом адсорбции. Усвоение питательных веществ, лекарств, действие ферментов и др. подчиняются законам адсорбции. Изучение этих законов и закономерностей и являются целью данной лекции. Рассматриваемые вопросы Поверхностные явления. Основные понятия и закономерности Поверхности, на которых проходят процессы сорбции Причины возникновения поверхностных явлений Биологическое значение поверхностных явлений Адсорбция, абсорбция и хемосорбция Зависимость адсорбции от поверхностного натяжения Количественное определение адсорбции Избирательная адсорбция и храмотография Поверхностные явления. Основные понятия и закономерности Раздел химии изучающий дисперсное состояние вещества и поверхностные явления называется коллоидной химией. Размеры частиц дисперсной системы и обратная им величина называется дисперсностью. Отношение площади поверхности вещества S к массе вещества m или к объёму V называется удельной поверхностью So: S S So= --------- cм2 /г ; So= --------- cм2/мл m V Поверхностные явления. Основные понятия и закономерности Поверхностные явления – это процессы, происходящие на границе раздела фаз и в результате взаимного действия этих фаз друг с другом. Отношение поверхностной энергии к единице поверхности называется поверхностным натяжением. G = --------; Дж /cм2 G – S поверхностная поверхности; G= S; Дж энергия; S – площадь - коэфф. поверхностного натяжения Процессы сорбции Изменение концентрации вещества на границе раздела фаз называется адсорбцией. Поглощающее вещество – адсорбент Поглощаемое вещество - адсорбтив Поглощение газов называется - абсорбцией Сорбция, сопровождаемая возникновением химической связи между адсорбентом и адсорбтивом называется хемосорбцией. Процесс, обратный сорбции называется десорбцией. Поверхности, на которых проходит адсорбция Газ - жидкость. Газ – твёрдое вещество Жидкость – жидкость. Жидкость – твёрдое вещество В организме человека: Поверхности клеток и клеточных ядер, протоплазмы, организм и окружающая среда и процессы, происходящие на данной границе: перемещение жиров и процессы пищеварения, деятельность ферментов, биосинтез белков и другие. Факторы, определяющие адсорбцию на неподвижной поверхности 1. Природа адсорбента и адсорбтива 2. Степень дисперсности адсорбента 3. Концентрация или давление адсорбтива 4. Температура 5. Природа растворителя Количественная оценка адсорбции Удельная адсорбция - количество молей адсорбированного вещества, соответствующее 1 см2 поверхности или 1 грамму адсорбента: X X Г = ------- моль/cм2; Г = ------- моль/г S m Количественная оценка адсорбции Уравнение Фрейндлиха для неподвижной поверхности: X Г = ------- = K·C1/n m X Г = ------- = K ·P1/n m Уравнение прямой Фрейндлиха: X lg ------- = lgK +1/n lgC m Количественная оценка адсорбции lg x/m ) tg = 1/n lg K lg C Изотерма адсорбции Фрейндлиха Количественная оценка адсорбции Уравнение Ленгмюра для неподвижной поверхности раздела: bC Г = Г ----------1+ bC Г – количество адсорбции Г - максимальная адсорбция C – концентрация вещества При малых концентрациях: Г = Г · bC При больших концентрациях: Г = Г Количественная оценка адсорбции Изотерма адсорбции Ленгмюра для монослойной адсорбции: Г II III I С Поверхностное натяжение и поверхностная активность Вещества понижающие поверхностное натяжение называются поверхностно-активными веществами: масла, жиры, спирты и др. органические вещества. Вещества повышающие поверхностное натяжение называются поверхностно-инактивными веществами: соли и другие электролиты. Величина, определяющая изменение поверхностного натяжения с изменением концентрации вещества называется поверхностной активностью: d / dC Количественная оценка адсорбции Уравнение Гибсса для подвижной поверхности: C d C – концентрация вещества Г = - ------- · ---------- R –универсальная газовая RT dC постоянная T – абсолютная температура d ---------- < 0 – адсорбция положительная dC d ---------- > 0 - адсорбция отрицательная dC Правило Дюкло-Траубе Вещества содержащие и полярную и неполярную группировки называются дифильными. Правило Дюкло-Траубе: при увеличении цепи дифильного органического соединения на каждую CH2 – группировку, увеличивает их способность участвовать в положительной адсорбции в 2-3 раза.