Загрязнитель Источник в ТЭК
advertisement

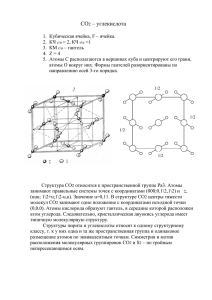
Загрязнение атмосферы предприятиями ТЭК Середина XIX в. Дж. Смит, предложил термин «кислотные дожди» по результатам изучения осадков в районе г. Манчестера (Англия) Начало-середина ХХ века – в промышленных центрах Англии широкое распространение получило явление, известное под названием, смог Осознание влияния деятельности предприятий ТЭК на изменение климата привело к формированию новой эколого-экономической парадигмы – «Зеленой» (низкоуглеродной) экономики. Загрязнение атмосферы предприятиями ТЭК Материальные загрязнители – газы, жидкости и твердые вещества Энергетические загрязнители — шумы, вибрация, излучения тепловой и электромагнитной энергии, различные виды радиации Загрязнитель Источник в ТЭК CO2 CO Сгорание дерева и природного топлива Неполное сгорание топлива SO2 Сгорание угля и нефти CH4 Сгорание; утечка природного газа NOx (NO+NO2) Высокотемпературное сгорание Уголь: С + О2 СО2 и Углеводороды: СnНm +(n + 0,25m) О2 nСО2 + (0,5m)Н2О, где Q = 102,2 (n + 0,25m) + 44,4 (0,5 m) кДж/моль Выбросы Уголь Топливо Мазут Природ ный газ Частицы 0,4 - 1,4 0,2 - 0,7 0 - 0,05 СО 0,3 - 1,0 0,1 - 0,5 - NOx 3,0 - 7,5 2,4 - 3,0 1,9-2,4 SO2 6,0 - 12,5 4,2 - 7,5 0 - 0,02 Техногенная эмиссия СО2 в атмосферу составляет 30 Гт/год. К этому количеству добавляется еще по меньшей мере 3,5 Гт СО2, выделяющегося в результате изъятия фитомассы и эрозии почвы. Образующиеся из техногенных оксидов серы и азота сильные кислоты, выпадающие на землю в виде кислотных дождей, вытесняют СО2 из карбонатов и органики почвы, что дает еще минимум 1,5 Гт углерода. Таким образом, в результате непосредственного и косвенного вмешательства в природный круговорот углерода общее количество СО2, ежегодно выбрасываемого в атмосферу, достигает 35 Гт и на 10% увеличивает планетарный обмен углерода. При нормальном природном составе воздуха обычная дождевая вода имеет слабокислую реакцию (рН = 5,5... 5,6), что связано с хорошей растворимостью в ней СО2 и образованием слабой угольной кислоты по реакции СО2 + Н2О => Н2СО3 —> HCO- + H+, а также с присутствием в атмосфере оксидов серы и азота либо хлористого водорода природного происхождения. В регионах, где почва и дно водоема содержат значительные количества щелочных веществ (например, известняка), кислотные осадки не наносят большого вреда, поскольку нейтрализуются, например в соответствии с уравнением реакции СаСО3 + 2Н+ => Са2+ + СО2 + Н2О