ИССЛЕДОВАНИЕ ПОТЕНЦИАЛЬНОЙ БИОЛОГИЧЕСКОЙ
advertisement
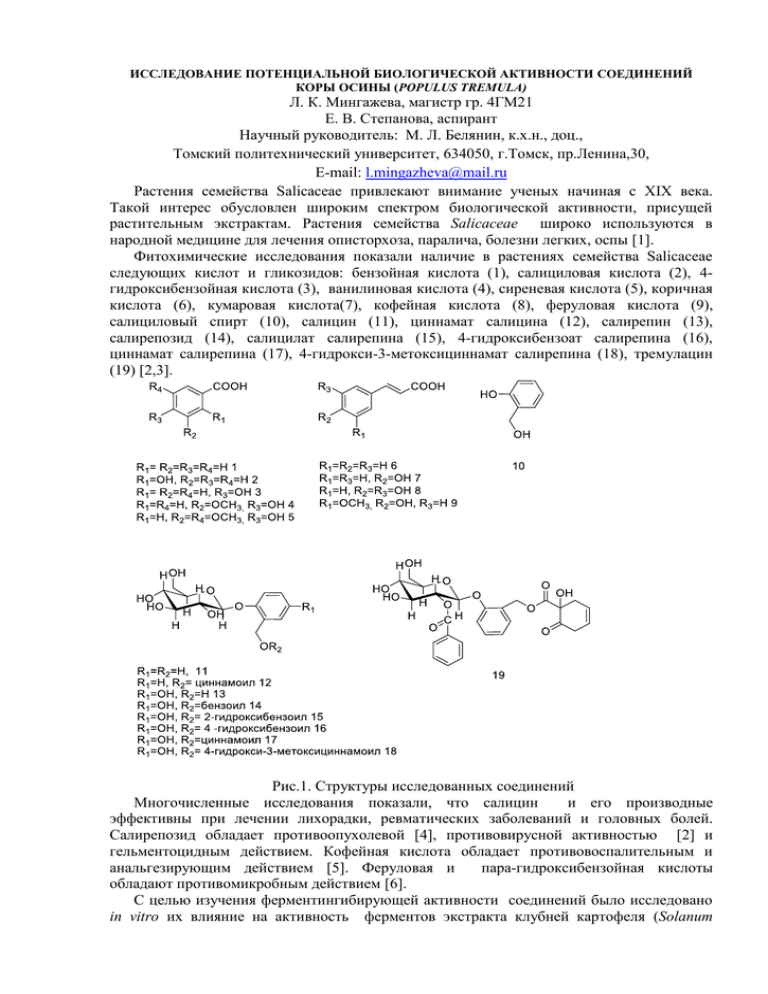
ИССЛЕДОВАНИЕ ПОТЕНЦИАЛЬНОЙ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ СОЕДИНЕНИЙ КОРЫ ОСИНЫ (POPULUS TREMULA) Л. К. Мингажева, магистр гр. 4ГМ21 Е. В. Степанова, аспирант Научный руководитель: М. Л. Белянин, к.х.н., доц., Томский политехнический университет, 634050, г.Томск, пр.Ленина,30, E-mail: l.mingazheva@mail.ru Растения семейства Salicaceae привлекают внимание ученых начиная с XIX века. Такой интерес обусловлен широким спектром биологической активности, присущей растительным экстрактам. Растения семейства Salicaceae широко используются в народной медицине для лечения описторхоза, паралича, болезни легких, оспы [1]. Фитохимические исследования показали наличие в растениях семейства Salicaceae следующих кислот и гликозидов: бензойная кислота (1), салициловая кислота (2), 4гидроксибензойная кислота (3), ванилиновая кислота (4), сиреневая кислота (5), коричная кислота (6), кумаровая кислота(7), кофейная кислота (8), феруловая кислота (9), салициловый спирт (10), салицин (11), циннамат салицина (12), салирепин (13), салирепозид (14), салицилат салирепина (15), 4-гидроксибензоат салирепина (16), циннамат салирепина (17), 4-гидрокси-3-метоксициннамат салирепина (18), тремулацин (19) [2,3]. Рис.1. Структуры исследованных соединений Многочисленные исследования показали, что салицин и его производные эффективны при лечении лихорадки, ревматических заболеваний и головных болей. Салирепозид обладает противоопухолевой [4], противовирусной активностью [2] и гельментоцидным действием. Кофейная кислота обладает противовоспалительным и анальгезирующим действием [5]. Феруловая и пара-гидроксибензойная кислоты обладают противомикробным действием [6]. С целью изучения ферментингибирующей активности соединений было исследовано in vitro их влияние на активность ферментов экстракта клубней картофеля (Solanum tuberosum): аланинаминопептидазы, глицинаминопептидазы и пролинаминопептидазы. Оценка ингибирующей способности соединений проводилась спектрофотометрическим методом. Изменение оптической плотности проводили при 415 нм а на микропланшетном ридере iMark BIO-RAD. Исследуемые соединения 11-18 были синтетически получены по [7,8]. Тремулацин был выделен из коры осины (Populus tremula) по [9]. Коммерчески доступные кислоты 1-9 предварительно перекристаллизовывались из подходящих растворителей. Измерение ферментативной активности экстракта картофеля проводилось по известной методике [10]. Для изучения ингибирующей активности соединений 1 - 19, для каждого соединения была приготовлена инкубационная смесь, содержащая исследуемое соединение в концентрации, приведенной в таблице 1. Таблица 1. Концентрации соединений 1-19 в инкубационной смеси. № Исследуемое соединение Исходная Концентрация в п\п концентрация, инкубируемом мМ объеме, мМ 1 Бензойная кислота 8,20 2,459 2 Салициловая кислота 7,25 2,174 3 4-гидроксибензойная кислота 7,25 2,174 4 Ванилиновая кислота 5,95 1,786 5 Сиреневая кислота 5,05 1,515 6 Коричная кислота 6,76 2,027 7 Кумаровая кислота 6,10 1,829 8 Кофейная кислота 5,56 1,667 9 Феруловая кислота 5,15 1,546 10 Салициловый спирт 8,06 2,419 11 Салицин 3,50 1,049 12 Циннамоат салицина 0,72 0,216 13 Салирепин 1,66 0,497 14 Салирепозид 2,46 0,739 15 2-гидроксибензоат салирепина 0,71 0,213 16 4-гидроксибензоат салирепина 0,47 0,142 17 Циннамоат салирепина 0,46 0,139 18 3-метокси-4-гидроксициннамоат 1,05 0,314 салирепина 19 Тремулацин 1,89 0,568 Пептидазная активность экстракта картофеля составила 11,07 мкмоль/мин*мл для аланинаминопептидазы, 3,267 мкмоль/мин*л для глицинаминопептидазы и 7,267мкмоль/мл*мин для пролинаминопептидазы. Для оценки ингибирующей активности для каждого соединения 1-19 была определена концентрация в инкубируемой смеси, при которой активность фермента уменьшилась на 50 % по сравнению с контролем (без добавления тестируемого соединения) (С50инг). Результаты представлены в таблице 2. Таблица 2. Значения С50инг соединений 1-19 для аланинаминопептидазы, глицинаминопептидазы и пролинаминопептидазы (n=3). № Исследуемое соединение С50инг, мМ п\п Аланинамино Глицинамино- Пролинаминопептидаза пептидаза пептидаза 1 Бензойная кислота Н.о. 4,118±0,303 2,802±0,006 2 Салициловая кислота Н.о. Н.о. 5,284±0,540 3 4-гидроксибензойная кислота Н.о. Н.о. 13,383±1,857 4 5 6 7 8 9 10 11 12 Ванилиновая кислота Сиреневая кислота Коричная кислота Кумаровая кислота Кофейная кислота Феруловая кислота Салициловый спирт Салицин Циннамоат салицина Салирепин Салирепозид 2-гидроксибензоат салирепина 16 4-гидроксибензоат салирепина 17 Циннамоат салирепина 18 3-метокси-4гидроксициннамоат салирепина 19 Тремулацин Н.о. – не обнаружена A 20 С50инг, мМ 13 14 15 15 2,875±0,173 Н.о. Н.о. 1,901±0,032 1,501±0,006 1,457±0,026 7,363±0,643 1,183±0,082 0,641±0,003 12,787±2,204 Н.о. Н.о. Н.о. 1,897±0,166 5,156±0,796 Н.о. Н.о. 6,365±0,306 Н.о. Н.о. 2,287±0,108 2,812±0,055 1,708±0,091 5,880±0,218 12,127±8,062 5,119±1,549 0,307±0,009 0,880±0,021 0,810±0,026 Н.о. 3,713±0,667 Н.о. 0,703±0,024 0,620±0,017 5,048±2,515 0,109±0,004 0,236±0,019 0,129±0,002 0,111±0,002 0,294±0,025 0,189±0,016 0,491±0,031 0,214±0,003 0,560±0,025 1,085±0,046 1,262±0,242 0,369±0,006 10 5 0 1. 2. 3. 4. 5. 7. 8. 9. 10. 14. 15. 16. 17. 18. 19. B 5.00 С50инг,мМ 4.00 3.00 2.00 1.00 0.00 11. 12. Аланинаминопептидаза 13. Глицинаминопептидаза Пролинаминопептидаза Рис. 2. Значения С50инг соединений 1 – 10 (A) и гликозидов 11 – 19 (B) для аланинаминопептидазы, глицинаминопептидазы и пролинаминопептидазы Кислоты 1- 9 и спирт 10 не являются эффективными ингибиторами исследованных пептидаз. Наибольшее ингибирующее действие проявили кумаровая, кофейная и феруловая кислоты (для всех протестированных ферментов С50инг<3мМ). По структуре эти кислоты являются производными коричной кислоты, содержащими одну или две гидроксильные группы. При этом сама коричная кислота не обладает ингибирующими свойствами. Таким образом, можно предположить, что наличие гидроксильных групп оказывает положительное влияние на способность к ингибированию. Для большинства гликозидов С50инг не превышает 1 мМ. Наиболее активными ингибиторами являются 4-гидроксибензоат салирепина и циннамоат салирепина (С50инг<0,250 мМ). Таким образом, гликозиды являются более эффективными ингибиторами, чем кислоты. Возможно, наличие большого количества гидроксильных групп увеличивает способность гликозида связываться с ферментом посредством образования водородных связей, вызывая изменение активности фермента. Это может послужить, в дальнейшем, для создания еще более активных обратимых ингибиторов ферментов. Список литературы: 1. Adams M. et al.// Journal of Ethnopharmacology. – 2009. - № 121. – P.343–359 2. Boeckler G. A. et al. // Phytochemistry. – 2011. - № 72. – P.1497–1509 3. H. Thieme, R. Benecke // Die Pharmazie. – 1970. – №25. – P.780 4. Van Hoof J. Torre J. Corthout L.A. // J. Nat. Prod, 1989. – Vol. 2. – № 4. Pp. 875-878 5. Podolak I // Farm.Pol. – 2006. – № 62. – P.62-69 6. Sh. Ou, K.Ch. Kwok // Journal of the Science of Food and Agriculture. – 2004. – Vol.11.– №84. – P.1261–1269 7. Belyanin M.L. et al. First total chemical synthesis of natural acyl derivatives of some phenolglycosides of the family Salicaceae// Carbohydrate Research . – 2012. – №363. – P.66–72 8. Belyanin M.L. et al. Synthesis of acyl derivatives of salicin, salirepin and arbutin // Carbohydrate Research - 2014 (in press) doi:10.1016/carres 9. Zapesochnaya G.G. Phenolic compounds of Salix acutifolia bark //Chemistry of Natural Compounds. – 2002. - Vol. 38. – №4. – P.314-318. 10. Биссвангер Х. Практическая энзимология - М.: Бином Лаборатория знания, 2010. – 328с.