Календарно-тематическое планирование по химии 8 класс на 2015-2016 учебный год
advertisement
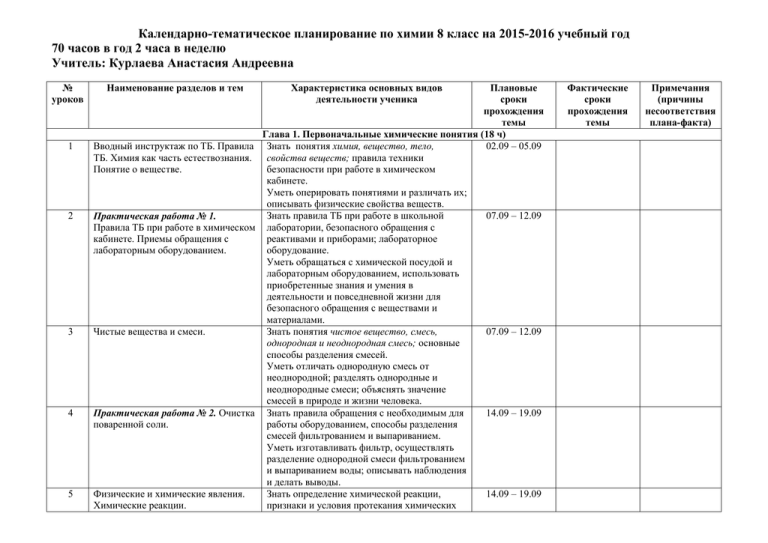
Календарно-тематическое планирование по химии 8 класс на 2015-2016 учебный год 70 часов в год 2 часа в неделю Учитель: Курлаева Анастасия Андреевна № уроков 1 2 3 4 5 Наименование разделов и тем Характеристика основных видов деятельности ученика Плановые сроки прохождения темы Глава 1. Первоначальные химические понятия (18 ч) Вводный инструктаж по ТБ. Правила Знать понятия химия, вещество, тело, 02.09 – 05.09 ТБ. Химия как часть естествознания. свойства веществ; правила техники Понятие о веществе. безопасности при работе в химическом кабинете. Уметь оперировать понятиями и различать их; описывать физические свойства веществ. Знать правила ТБ при работе в школьной 07.09 – 12.09 Практическая работа № 1. Правила ТБ при работе в химическом лаборатории, безопасного обращения с кабинете. Приемы обращения с реактивами и приборами; лабораторное лабораторным оборудованием. оборудование. Уметь обращаться с химической посудой и лабораторным оборудованием, использовать приобретенные знания и умения в деятельности и повседневной жизни для безопасного обращения с веществами и материалами. Чистые вещества и смеси. Знать понятия чистое вещество, смесь, 07.09 – 12.09 однородная и неоднородная смесь; основные способы разделения смесей. Уметь отличать однородную смесь от неоднородной; разделять однородные и неоднородные смеси; объяснять значение смесей в природе и жизни человека. Практическая работа № 2. Очистка Знать правила обращения с необходимым для 14.09 – 19.09 поваренной соли. работы оборудованием, способы разделения смесей фильтрованием и выпариванием. Уметь изготавливать фильтр, осуществлять разделение однородной смеси фильтрованием и выпариванием воды; описывать наблюдения и делать выводы. Физические и химические явления. Знать определение химической реакции, 14.09 – 19.09 Химические реакции. признаки и условия протекания химических Фактические сроки прохождения темы Примечания (причины несоответствия плана-факта) 6 Атомы и молекулы. Атомномолекулярное учение. 7 Простые и сложные Химический элемент. 8 Язык химии. Знаки химических элементов. Относительная атомная масса химических элементов. 9 Закон постоянства состава вещества. 10 Относительная молекулярная масса. Химические формулы. 11 Массовая доля химического элемента в соединении. 12 Валентность химических элементов. вещества. реакций. Уметь отличать физические процессы от химических реакций. Знать важнейшие химические понятия: атом, молекула; основные положения атомномолекулярного учения. Понимать его значение. Уметь оперировать данными понятиями. Знать определение атома и молекулы, простого и сложного вещества, химического элемента как определенного вида атомов. Уметь различать понятия «простое вещество» и «химический элемент». Знать важнейшие химические понятия: химический элемент, относительная атомная масса, коэффициент, атомная единица массы; химическую символику – знаки химических элементов и их названия. Понимать различия между абсолютной и относительной массами. Уметь называть химические элементы, записывать знаки химических элементов, находить значение относительной атомной массы. Знать формулировку и смысл закона постоянства состава веществ. Уметь производить расчеты на основе закона постоянства состава веществ. Знать понятия: химическая формула, индекс, молекулярная масса, количественный и качественный состав вещества. Уметь вычислять относительную молекулярную массу, характеризовать по данной формуле качественный и количественный состав вещества. Знать понятие: массовая доля элемента. Уметь рассчитывать массовую долю элемента в соединении по его формуле и устанавливать химическую формулу сложного вещества по известным массовым долям химических элементов. Знать определение валентности и 21.09 – 26.09 21.09 – 26.09 26.09 – 03.10 26.09 – 03.10 05.10 – 10.10 05.10 – 10.10 12.10 – 17.10 Определение валентности элементов по формулам соединений. Составление химических формул соединений по валентности. 13 Закон сохранения массы веществ. Химические уравнения. 14 Типы химических реакций. 15 Количество вещества. Моль. Молярная масса. 16 Количество вещества. Моль. Молярная масса. 17 Решение расчетных задач по химическим уравнениям реакций. 18 Контрольная работа № 1 по теме: «Первоначальные химические понятия». валентности некоторых химических элементов. Уметь определять валентность элементов по формулам соединений из двух элементов, составлять формулы бинарных соединений по валентности, называть бинарные соединения. Знать формулировку закона сохранения массы веществ, понимать смысл уравнений реакций, уметь расставлять коэффициенты в уравнениях реакций. Уметь составлять уравнения химических реакций; решать задачи на закон сохранения массы веществ. Знать определения реакций разложения, соединения и замещения, обмена; признаки классификации химических реакций. Уметь определять тип реакции по данному химическому уравнению. Знать единицу измерения количества вещества – моль; постоянную Авогадро; формулу вычисления количества вещества. Уметь количество вещества, используя число структурных частиц и число Авогадро. Знать понятие молярная масса; формулу вычисления количества вещества по молярной массе вещества и массе вещества. Уметь вычислять молярную массу по формуле соединения, массу вещества и число структурных частиц по известному количеству вещества (и обратные задачи), используя единицу измерения – моль. Знать единицы важнейших величин; алгоритм решения расчетных задач по химическим уравнениям. Уметь решать расчетные задачи по уравнениям реакций и находить количество вещества, массу и объем продуктов реакции по количеству вещества, объему и массе исходных веществ. Знать теоретический материал, изученный на предыдущих занятиях(см.уроки 1- 17). Уметь применять знания, умения и навыки, 12.10 – 17.10 19.10 – 24.10 19.10 – 24.10 26.10 – 31.10 26.10 – 31.10 09.11 – 14.11 полученные в ходе изучения данной темы. 19 Кислород, его общая характеристика и нахождение в природе. Получение кислорода и его физические свойства. Анализ контрольной работы №1. 20 Химические свойства кислорода. Оксиды. Применение. Круговорот кислорода в природе. 21 Практическая работа № 3. Получение и свойства кислорода. 22 Воздух и его состав. Горение и медленное окисление. Защита атмосферного воздуха от загрязнения. Глава 2. Кислород. Горение (5 ч) Знать план характеристики химического элемента; понятие катализатор; физические свойства кислорода; способы получения кислорода в лаборатории и промышленности. Уметь различать понятия «химический элемент» и «простое вещество» на примере кислорода; характеризовать кислород как химический элемент и простое вещество; составлять уравнения реакций, лежащих в основе получения кислорода в лаборатории; получать и собирать кислород в лаборатории. Знать химические свойства кислорода; понятия реакция окисления, окислитель, реакция горения, оксиды, фотосинтез; процессы, характеризующие круговорот кислорода в природе; области применения кислорода. Уметь различать физические и химические свойства; составлять уравнения реакций, характеризующих химические свойства кислорода – взаимодействие с простыми и сложными веществами; определять оксиды и составлять их формулы; объяснять круговорот кислорода в природе. Знать способы получения кислорода в лаборатории и способы его собирания; качественную реакцию на кислород; физические и химические свойства кислорода. Уметь собирать простейший прибор для получения газа; обращаться с нагревательными приборами; собирать газ вытеснением воды и воздуха; доказывать наличие кислорода; описывать наблюдения и делать соответствующие выводы. Знать состав воздуха как смеси, состоящей из простых и сложных веществ; условия возникновения и прекращения горения и меры по предупреждению пожаров. Понимать проблемы, связанные с охраной 09.11 – 14.11 16.11 – 21.11 16.11 – 21.11 23.11 – 28.11 23 Тепловой эффект химических реакций. Топливо и способы его сжигания. 24 Водород, его общая характеристика и нахождение в природе. Получение водорода и его физические свойства. 25 Химические свойства водорода. Применение водорода. 26 Повторение и обобщение по темам «Кислород» и «Водород». атмосферного воздуха. Уметь объяснять различие между горением и медленным окислением; составлять уравнения реакций горения простых и сложных веществ. Знать понятия: тепловой эффект химической реакции, экзотермическая реакция, эндотермическая реакция, термохимическое уравнение реакции; виды топлива и способы его сжигания. Уметь характеризовать уравнение по тепловому эффекту; записывать термохимическое уравнение реакции и вычислять количество теплоты по термохимическому уравнению реакции. Глава 3. Водород (3 ч) Знать план характеристики химического элемента; физические свойства водорода; состав молекул водорода; способы его получения в лаборатории и промышленности; способы собирания водорода и определения его чистоты. Уметь характеризовать водород как химический элемент и простое вещество; составлять уравнения реакций, лежащих в основе получения водорода; собирать водород методом вытеснения воздуха, доказывать его наличие, проверять водород на чистоту; соблюдать меры предосторожности при работе с химическими реактивами. Знать химические свойства водорода; понятия реакции восстановления, восстановитель, окислительно-восстановительная реакция, гидриды. Уметь составлять уравнения реакций, характеризующих химические свойства водорода – взаимодействие с простыми и сложными веществами; определять гидриды и составлять формулы водородных соединений. Знать теоретический материал, изученный на предыдущих занятиях (см.уроки 19-26). Уметь характеризовать физические и 23.11 – 28.11 30.11 – 05.11 30.11 – 05.11 07.12 – 12.12 27 Вода – растворитель. Растворы. 28 Массовая доля растворенного вещества. 29 Практическая работа № 4. Приготовление растворов солей с определенной массовой долей растворенного вещества. 30 Вода. Анализ и синтез воды. Вода в природе и способы ее очистки. 31 Физические и химические свойства воды. химические свойства кислорода и водорода; составлять уравнения реакций, подтверждающих химические свойства данных элементов; получать, собирать кислород и водород в лаборатории и доказывать их наличие, соблюдая правила ТБ; решать расчетные задачи по формулам и химическим уравнениям. Глава 4. Растворы. Вода (6 ч) Знать определения понятий раствор, растворимость, насыщенный и ненасыщенный растворы. Уметь оперировать понятиями. Иметь представление о сущности процесса получения кристаллов из растворов солей. Знать определение массовой доли растворенного вещества и формулу ее вычисления. Уметь решать расчетные задачи на вычисление массовой доли растворенного вещества. Знать формулу вычисления массовой доли растворенного вещества. Уметь приготавливать раствор с определенной массовой долей растворенного вещества; работать с лабораторным оборудованием в соответствии с ТБ. Знать качественный и количественный состав воды; способы очистки воды; сущность круговорота воды в природе; значение воды в природе и жизни человека. Уметь объяснять закон постоянства состава на примере воды; объяснять методы определения состава вещества (анализ) и получения сложных веществ (синтез). Знать физические и химические свойства воды, области применения воды и растворов, их значение. Уметь составлять уравнения реакций, подтверждающих химические свойства воды; сравнивать и анализировать физические и химические явления, происходящие с водой в 07.12 – 12.12 14.12 – 19.12 14.12 – 19.12 21.12 – 26.12 21.12 – 26.12 32 33 34 35 36 живой и неживой природе. Знать теоретический материал, изученный на 28.12 - 31.12 предыдущих занятиях(см.уроки 19- 32). Уметь применять знания, умения и навыки, полученные в ходе изучения данной темы Глава 5. Обобщение сведений о важнейших классах неорганических соединений (9 ч) Оксиды. Анализ контрольной Знать определение понятия оксиды, 11.01 – 16.01 работы № 2. классификацию оксидов, химические свойства оксидов. Уметь называть оксиды, распознавать их среди других веществ (по формуле), составлять уравнения реакций, характеризующих химические свойства оксидов. Основания: классификация, Знать определение понятия основания, 11.01 – 16.01 номенклатура, получение. классификацию оснований; правила техники безопасности при работе со щелочами. Уметь называть основания; распознавать их среди других веществ (по формуле); составлять формулы оснований, распознавать раствор щелочи с помощью индикатора; определять реакции обмена; составлять уравнения реакций, лежащих в основе получения оснований. Физические и химические свойства Знать химические и физические свойства 18.01 – 23.01 оснований. Реакция нейтрализации. оснований. Уметь составлять уравнения реакций, подтверждающих химические свойства оснований; реакции нейтрализации. Кислоты. Знать определение понятия кислота, 18.01 – 23.01 формулы некоторых кислот, классификацию кислот, физические и химические свойства кислот, правила техники безопасности при работе с кислотами. Уметь называть кислоты; распознавать их среди других веществ (по формуле); составлять уравнения химических реакций, характеризующих свойства кислот; определять валентность кислотного остатка и составлять формулы кислот; пользоваться рядом активности металлов; распознавать кислоты с помощью индикаторов. Контрольная работа № 2 по темам: «Кислород», «Водород», «Растворы. Вода». 37 38 39 40 41 42 Соли: классификация, номенклатура, способы получения. Знать определение понятия соли, их состав и 25.01 – 30.01 классификацию; номенклатуру солей и способы их получения. Уметь называть соли; распознавать их среди других веществ (по формуле); составлять формулы солей по валентностям металла и кислотного остатка; записывать уравнения соответствующих реакций. Физические и химические свойства Знать химические и физические свойства 25.01 – 30.01 солей. солей. Уметь составлять уравнения химических реакций, характеризующих свойства солей. Генетическая связь между Знать определения и классификацию 01.02 – 06.02 основными классами неорганических неорганических веществ; характерные соединений. химические свойства основных классов неорганических веществ. Уметь по составу и свойствам классифицировать неорганические вещества; составлять генетические ряды металла и неметалла; иллюстрировать уравнениями химических реакций генетическую связь между основными классами неорганических соединений. Практическая работа № 5. Решение Знать теоретический материал, изученный на 01.02 – 06.02 экспериментальных задач по теме предыдущих занятиях (см.уроки 33-40). «Важнейшие классы неорганических Уметь подбирать вещества и проводить соединений». химические реакции, необходимые для решения определенной задачи, соблюдая правила работы в кабинете химии; описывать наблюдения и делать соответствующие выводы. Контрольная работа №3 по теме: Знать теоретический материал, изученный на 08.02 – 13.02 «Основные классы неорганических предыдущих занятиях (см.уроки 33-40). соединений». Уметь применять знания, умения и навыки, полученные в ходе изучения данной темы. Глава 6. Периодический закон и Периодическая система химических элементов Д. И. Менделеева. Строение атома (8 ч) Классификация химических Знать общие признаки классификации 08.02 – 13.02 элементов. Амфотерные соединения. химических элементов на примере групп сходных элементов; физические свойства металлов и неметаллов; определение амфотерности и амфотерные соединения цинка и алюминия. 43 Периодический закон Д.И. Менделеева. 44 Периодическая таблица химических элементов. Группы и периоды. 45 Строение атома. Состав атомных ядер. Изотопы. Химический элемент. 46 Строение электронных оболочек Уметь объяснять закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп; характеризовать зависимость свойств щелочных металлов, галогенов и их соединений от относительной атомной массы; уметь экспериментально доказывать амфотерность предложенного оксида и гидроксида. Знать формулировку и объяснять сущность периодического закона Д.И. Менделеева. Уметь приводить примеры периодического изменения свойств химических элементов и их соединений. Знать структуру ПСХЭ Д.И. Менделеева – периоды, группы, подгруппы и их определения; закономерности изменения свойств простых веществ и соединений химических элементов в периодах, главных и побочных подгруппах периодической системы. Уметь определять период, группу, подгруппу, порядковый номер химического элемента в ПСХЭ, объяснять физический смысл атомного (порядкового) номера химического элементы; валентность на основании положения в ПСХЭ; составлять формулы высших оксидов и летучих соединений; характеризовать химический элемент по положению в периодической таблице. Знать особенности строения атома, состав ядра; определения понятий протоны, нейтроны, электроны, нуклоны, изотопы; химического элемента, как вида атомов с одинаковым зарядом ядра. Уметь объяснять физический смысл атомного (порядкового) номера химического элементы; номеров групп и периодов, к которым принадлежит элемент; находить число протонов, нейтронов, электронов указанного атома. Знать современную формулировку 15.02 – 20.02 15.02 – 20.02 22.02 – 27.02 22.02 – 27.02 атомов первых 20 элементов периодической системы Д.И. Менделеева. Современная формулировка периодического закона. 47 48 Состояние электронов в атомах. Периодическое изменение свойств химических элементов в периодах и главных подгруппах. Значение периодического закона. Жизнь и деятельность Д.И. Менделеева. 49 Повторение и обобщение по теме «Периодический закон и периодическая система химических элементов Д.И. Менделеева. Строение атома». 50 Электроотрицательность химических элементов. 51 Ковалентная связь. Полярная и периодического закона, физический смысл номеров периода и группы, причину периодического изменения химических свойств первых 20 элементов, план характеристики химического элемента. Уметь объяснять периодическое изменение свойств химических элементов в свете теории строения атомов; характеризовать химические элементы (от водорода до кальция) на основе их положения в ПСХЭ и особенности строения их атомов; составлять схемы строения атомов первых 20 элементов ПСХЭ. Иметь представление о двойственной природе электрона и состоянии электронов в атоме. Уметь составлять электронные формулы атомов. Знать формулировку периодического закона Д.И. Менделеева и современную; структуру ПСХЭ Д.И. Менделеева; значение периодического закона для обобщения и объяснения уже известных и предсказания новых факторов. Уметь применять периодический закон для объяснения взаимосвязи «строение атомов – строение вещества»; показать значение для развития науки. Знать теоретический материал, изученный на предыдущих занятиях (см.уроки 42-49). Уметь применять полученные знания и умения. 29.02 – 05.03 29.02 – 05.03 07.03 – 12.03 Глава 7. Строение вещества. Химическая связь (9 ч) Знать определение электроотрицательности; 07.03 – 12.03 характер изменения атомных радиусов и электроотрицательности, металлических и неметаллических свойств в периодах и главных подгруппах (А-группах). Уметь сравнивать электроотрицательность элементов, расположенных в одной подгруппе и в одном периоде периодической таблицы. Знать определение понятия ковалентная 14.03 – 19.03 неполярная ковалентная связь. 52 Ковалентная связь. Полярная и неполярная ковалентная связь. 53 Ионная связь. 54 Кристаллические решетки. 55 Валентность и степень окисления. Правила вычисления степени окисления элементов. 56 Валентность и степень окисления. Правила вычисления степени окисления элементов. связь, ее разновидности (полярная и неполярная) и механизмы образования. Уметь составлять электронные схемы образования ковалентных соединений; записывать электронные формулы молекул данного вещества; различать соединения с полярной и неполярной ковалентной связью. Знать определение понятия ковалентная связь, ее разновидности (полярная и неполярная) и механизмы образования. Уметь составлять электронные схемы образования ковалентных соединений; записывать электронные формулы молекул данного вещества; различать соединения с полярной и неполярной ковалентной связью. Знать определение понятий ион, ионная связь; механизм образования ионной связи. Уметь составлять схемы образования ионных соединений и их электронные формулы. Понимать отличия ионной связи от ковалентной. Знать особенности строения веществ в твердом, жидком и газообразном состоянии, кристаллических и аморфных веществ; типы кристаллических решеток (атомная, молекулярная, ионная, металлическая). Уметь характеризовать физические свойства вещества по типу кристаллической решетки. Знать определения понятий валентность, степень окисления. Понимать отличия степени окисления от валентности. Уметь определять степень окисления элемента по формуле вещества и составлять формулы по известной степени окисления элементов. Знать определения понятий валентность, степень окисления. Понимать отличия степени окисления от валентности. Уметь определять степень окисления элемента по формуле вещества и составлять 14.03 – 19.03 21.03 – 24.03 21.03 – 24.03 04.04 – 09.04 04.04 – 09.04 57 Окислительно-восстановительные реакции. 58 Контрольная работа № 4 по темам: «Периодический закон и периодическая таблица химических элементов Д.И. Менделеева. Строение атома» и «Строение вещества. Химическая связь». 59 Анализ контрольной работы № 4. Закон Авогадро. Молярный объем газов. 60 61 62 формулы по известной степени окисления элементов. Знать определения понятий окислитель, восстановитель, окислительновосстановительные реакции. Уметь определять окислительновосстановительные реакции, различать процессы окисления и восстановления с электронной точки зрения, составлять уравнения электронного баланса. Знать теоретический материал, изученный на предыдущих занятиях (см.уроки 42-58). Уметь применять знания, умения и навыки, полученные в ходе изучения данной темы 11.04 – 16.04 11.04 – 16.04 Глава 8. Закон Авогадро. Молярный объем газов (3 ч) Знать определение понятия молярный объем, 18.04 – 23.04 сущность закона Авогадро и следствие из него. Уметь определять объем определенного количества вещества газа, а также количество вещества газа, массу газа и число молекул, исходя из объема газа при нормальных условиях. Относительная плотность газов. Знать определение относительная 18.04 – 23.04 плотность газов. Уметь вычислять относительную плотность газов. Объемные отношения газов при Уметь проводить расчеты на основе 25.04 – 30.04 химических реакциях. уравнений реакций, находить объем газа по количеству вещества, массе или объему одного из реагентов или продуктов реакции. Глава 9. Галогены (7 ч) Положение галогенов в Знать строение атомов галогенов и их степени 25.04 – 30.04 периодической таблице и строение их окисления; вид химической связи между атомов. Хлор. атомами галогенов; физические, химические свойства хлора; способы получения хлора в лаборатории и промышленности; области применения хлора. Уметь давать характеристику элементовгалогенов по их положению в периодической 63 Хлороводород. 64 Соляная кислота и ее соли. 65 Сравнительная характеристика галогенов. 66 Практическая работа № 6. Получение соляной кислоты и изучение ее свойств. 67 Обобщение знаний за курсу химии 8 класса. 68 Контрольная работа № 5 по темам: «Закон Авогадро. Молярный объем таблице и строению атомов; составлять уравнения реакций, характеризующих химические свойства хлора. Знать свойства хлороводорода, значение качественных реакций; способ получения и собирания хлороводорода. Уметь выполнять химический эксперимент по распознаванию важнейших неорганических веществ, распознавать хлориды, составлять уравнения. Знать эмпирическую формулу соляной кислоты и хлоридов; общие и индивидуальные свойства соляной кислоты. Уметь отличать соляную кислоту и ее соли от других кислот и солей; составлять уравнения характерных для соляной кислоты реакций; соблюдать меры предосторожности при работе с химическими реактивами. Знать особенности физических и химических свойств галогенов; окислительновосстановительные свойства галогенов; способы их получения; качественные реакции на фторид-анион, бромид-анион, хлорид-анион, иодид-анион; области применения галогенов. Уметь характеризовать галогены по строению их атомов; степеням окисления, физическим и химическим свойствам; составлять уравнения реакций, подтверждающих химические свойства галогенов и способы их получения. Знать условия получения хлороводорода, его свойства и способы собирания. Уметь собирать простейший прибор для получения газов; растворять хлороводород в воде; распознавать соляную кислоту и ее соли; соблюдать правила техники безопасности при работе с кислотами. Понимать важность химических знаний. Уметь применять полученные знания для решения программных задач. Знать теоретический материал, изученный на предыдущих занятиях (см.уроки 59-66). 02.05 – 07.05 02.05 – 07.05 09.05 – 14.05 09.05 – 14.05 16.05 – 21.05 16.05 – 21.05 газов» и «Галогены». 69 70 Итоговое повторение (резерв). Итоговое повторение (резерв). Уметь применять знания, умения и навыки, полученные в ходе изучения данной темы 23.05 – 28.05 23.05 – 28.05


