19.Защита рефератов. - Нижегородская государственная
advertisement
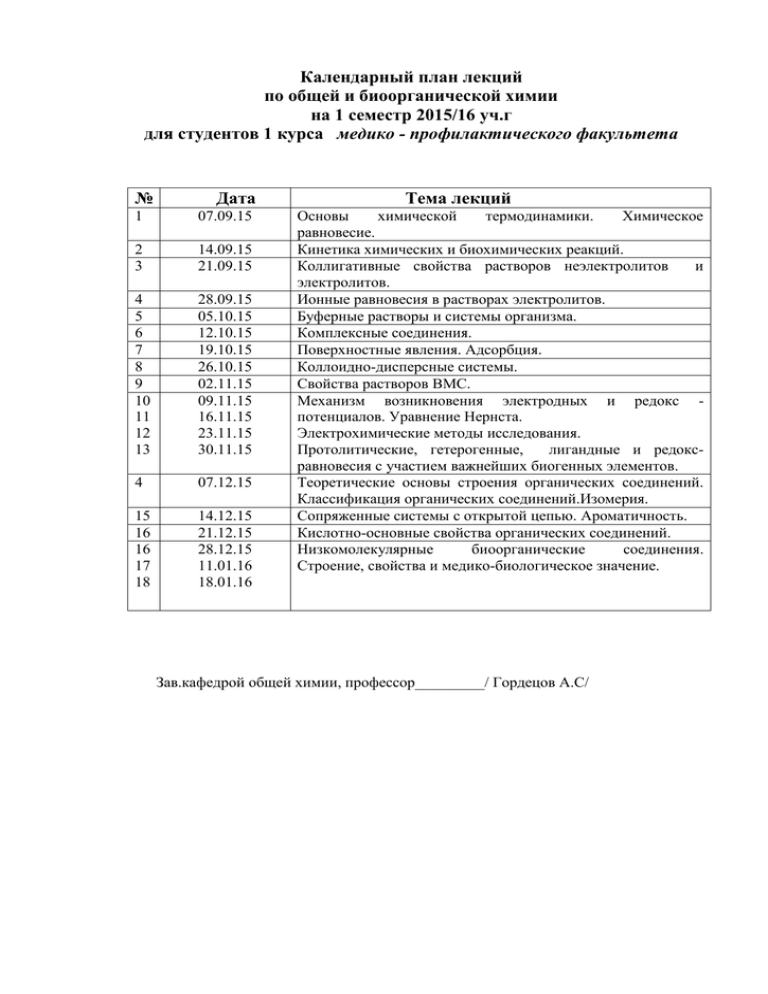
Календарный план лекций по общей и биоорганической химии на 1 семестр 2015/16 уч.г для студентов 1 курса медико - профилактического факультета № Дата 1 07.09.15 2 3 14.09.15 21.09.15 4 5 6 7 8 9 10 11 12 13 28.09.15 05.10.15 12.10.15 19.10.15 26.10.15 02.11.15 09.11.15 16.11.15 23.11.15 30.11.15 4 07.12.15 15 16 16 17 18 14.12.15 21.12.15 28.12.15 11.01.16 18.01.16 Тема лекций Основы химической термодинамики. Химическое равновесие. Кинетика химических и биохимических реакций. Коллигативные свойства растворов неэлектролитов и электролитов. Ионные равновесия в растворах электролитов. Буферные растворы и системы организма. Комплексные соединения. Поверхностные явления. Адсорбция. Коллоидно-дисперсные системы. Свойства растворов ВМС. Механизм возникновения электродных и редокс потенциалов. Уравнение Нернста. Электрохимические методы исследования. Протолитические, гетерогенные, лигандные и редоксравновесия с участием важнейших биогенных элементов. Теоретические основы строения органических соединений. Классификация органических соединений.Изомерия. Сопряженные системы с открытой цепью. Ароматичность. Кислотно-основные свойства органических соединений. Низкомолекулярные биоорганические соединения. Cтроениe, свойства и медико-биологическое значение. Зав.кафедрой общей химии, профессор_________/ Гордецов А.С/ УЧЕБНЫЙ ПЛАН ЛАБОРАТОРНО – ПРАКТИЧЕСКИХ ЗАНЯТИЙ ПО ОБЩЕЙ И БИООРГАНИЧЕСКОЙ ХИМИИ НА I СЕМЕСТР 2015/2016 УЧЕБНОГО ГОДА ДЛЯ СТУДЕНТОВ I КУРСА МЕДИКО – ПРОФИЛАКТИЧЕСКОГО ФАКУЛЬТЕТА. ЗАНЯТИЕ 1. ПРЕДМЕТ И ЗАДАЧИ КУРСА ХИМИИ. РАСТВОРЫ. 1. Ознакомление с правилами работы и техникой безопасности в химической лаборатории. Знакомство с химической посудой. 2. Определение исходного уровня знаний студентов. 3. ПРАКТИЧЕСКАЯ ЧАСТЬ. Растворы. Способы выражения концентрации растворов. Приготовление растворов заданной концентрации. 4. ЛАБОРАТОРНАЯ РАБОТА. 4.1. Приготовление раствора щавелевой кислоты из навески. 4.2. Приготовление 0,1 н. раствора минеральных кислот из концентрированных растворов. ЗАНЯТИЕ 2. ОСНОВЫ КОЛИЧЕСТВЕННОГО АНАЛИЗА. МЕТОД НЕЙТРАЛИЗАЦИИ. 1. ПРАКТИЧЕСКАЯ ЧАСТЬ. Теоретические основы метода нейтрализации. Кислотно – основное титрование. Закон эквивалентов и его применение для расчетов в объемном анализе. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Определение нормальности и титра щелочи по титрованному раствору щавелевой кислоты. 2.2. Определение нормальности и титра кислоты по установленному раствору щелочи. ЗАНЯТИЕ 3. ОКСИДИМЕТРИЯ. ПЕРМАНГАНАТОМЕТРИЯ. ЙОДОМЕТРИЯ. 1. ПРАКТИЧЕСКАЯ ЧАСТЬ. Окислительно – восстановительные процессы. Эквивалент окислителя и восстановителя. Основные положения оксидиметрии. Перманганатометрия. Йодометрия. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Определение нормальности и титра раствора KMnO4 по приготовленному титрованному раствору Na2C2O4. 2.2. Определение нормальности и титра раствора Н2О2 по приготовленному титрованному раствору KMnO4. 2.3. определение нормальности и титра раствора Na2S2O3 по титрованному раствору K2Cr2O7. 2.4. Определение титра и нормальности раствора йода по установленному титрованному раствору Na2S2O3. 3. КОНТРОЛЬНАЯ РАБОТА 1. Основы титриметрического анализа ЗАНЯТИЕ 4.ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ.ХИМИЧЕСКОЕ РАВНОВЕСИЕ 1. ПРАКТИЧЕСКАЯ ЧАСТЬ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Определение теплового эффекта реакции нейтрализации. 2.2. Определение теплоты гидратации сульфата меди. 2.3. Влияние концентрации и температуры на сдвиг химического равновесия. ЗАНЯТИЕ 5. КИНЕТИКА ХИМИЧЕСКИХ И БИОХИМИЧЕСКИХ РЕАКЦИЙ. 1. ПРАКТИЧЕСКАЯ ЧАСТЬ. 2. ЛАБОРАТОРНАЯ РАБОТА. Изменение скорости разложения тиосульфата натрия в зависимости от его концентрации. 2.2. Зависимость скорости реакции окисления йодид – ионов ионом Fe3+ в зависимости от концентрации FeCl3 и KI. 3. КОНТРОЛЬНАЯ РАБОТА 2. Химическая термодинамика и кинетика химических реакций. 2.1. ЗАНЯТИЕ 6. КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ ЭЛЕКТРОЛИТОВ. И 1. ПРАКТИЧЕСКАЯ ЧАСТЬ. 2. УИРС «Осмос, значение осмоса в жизнедеятельности организма». 3. ЛАБОРАТОРНАЯ РАБОТА. Определение молярной массы неэлектролита по методу Раста (на примерах органических соединений). ЗАНЯТИЕ 7. ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ. 1. ПРАКТИЧЕСКАЯ ЧАСТЬ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Влияние одноименного иона на степень диссоциации слабых электролитов. 2.2. Гидролиз солей. 2.3. Образование и растворение осадков труднорастворимых электролитов. ЗАНЯТИЕ 8. БУФЕРНЫЕ РАСТВОРЫ. 1. ПРАКТИЧЕСКАЯ ЧАСТЬ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Приготовление буферных растворов. 2.2. Изучение действия буферных растворов. 2.3. Определение рН растворов при помощи универсального индикатора и рН – метра. 2.4. Определение буферной емкости. ЗАНЯТИЕ 9. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ. 1. ПРАКТИЧЕСКАЯ ЧАСТЬ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Комплексонометрическое титрование. Определение жесткости воды. 2.2. Определение концентрации катионов Fe3+. 3. УИРС . Фотоколориметрическое определение концентрации катионов Fe3+. 4. КОНТРОЛЬНАЯ РАБОТА 3. Свойства растворов. Ионные равновесия. Буферные растворы. ЗАНЯТИЕ 10. ХИМИЯ ДИСПЕРСНЫХ СИСТЕМ. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. КОЛЛОИДНЫЕ РАСТВОРЫ. 1. ПРАКТИЧЕСКАЯ ЧАСТЬ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Определение поверхностного натяжения на поверхности на границе раздела жидкость – газ. 2.2. Определение ионов Pb2+ и Hg2+ в смеси методом колоночной хроматографии (демонстрация). 2.3. Приготовление коллоидных растворов. 2.4. Очистка коллоидных растворов методом диализа. 2.5. Определение заряда частиц окрашенных золей. ЗАНЯТИЕ 11. СВОЙСТВА РАСТВОРОВ ВМС. ВАЖНЕЙШИЕ БИОГЕННЫЕ ЭЛЕМЕНТЫ. S – ЭЛЕМЕНТЫ И ИХ СОЕДИНЕНИЯ. ГЕТЕРОГЕННЫЕ РАВНОВЕСИЯ В ОРГАНИЗМЕ. 1. ПРАКТИЧЕСКАЯ ЧАСТЬ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1.Определение молярной массы ВМС визкозиметрическим методом. 2.2.Определение изоэлектрической точки желатина. 2.3. Аналитические реакции на катионы: 2.3.1. Калия (К+): а) с гидротортратом натрия, б) с тройным нитритом натрия, свинца и меди (микрокристаллоскопия). 2.3.2. Магния (Mg2+): с гидрофосфатом натрия в присутствии аммонийной смеси. 2.3.3. Натрия (Na+) с дигидроантимонатом калия. 2.3.4. Кальция (Са2+) с оксалатом аммония. 2.3.5. Бария (Ba2+) с хроматом калия. 2.4. Анализ препарата, содержащего один из s – элементов IA и IIА групп ПСЭ. 3. СООБЩЕНИЕ ПО ТЕМАМ РЕФЕРАТОВ. ЗАНЯТИЕ 12. ЭЛЕКТРОХИМИЯ. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ В ЖИВЫХ ОРГАНИЗМАХ.ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ. 1. ПРАКТИЧЕСКАЯ ЧАСТЬ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Определение рН биологических жидкостей. 2.2. Потенциометрическое титрование. 2.3. Кондуктометрическое титрование (демонстрация). 3.КОНТРОЛЬ УСВОЕНИЯ ТЕМЫ: ТЕСТЫ. ЗАНЯТИЕ 13. ВАЖНЕЙШИЕ БИОГЕННЫЕ d-ЭЛЕМЕНТЫ И ИХ ЛИГАНДНЫЕ И РЕДОКС – РАВНОВЕСИЯ В ОРГАНИЗМЕ. СОЕДИНЕНИЯ. 1. ПРАКТИЧЕСКАЯ ЧАСТЬ 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Аналитические реакции на катионы: 2.1.1. Железа (Fe+2): с гексационоферрат (III) калия. 2.1.2. Железа (Fe+3): а) с гексационоферрат (II) калия, б) роданидом калия (капельный метод анализа). 2.1.3. Марганца (Mn2+) с пероксидом водорода в щелочной среде. 2.1.4. Хрома (Cr3+) с пероксидом водорода в щелочной среде. 2.1.5. Серебра (Ag+) с соляной кислотой с последующим растворением осадка гидроксидом аммония и разложением полученной соли азотной кислотой. 2.1.6. Меди (Сu2+) c гидроксидом аммония (с эквивалентным количеством и избытком). 2.1.7. Цинка (Zn2+) с гексацианоферратом (II) калия. 2.1.8. Ртути (Hg2+, Hg22+) демонстрация. 3. Сообщения по темам рефератов. ЗАНЯТИЕ 14. ВАЖНЕЙШИЕ БИОГЕННЫЕ р – ЭЛЕМЕНТЫ ИХ СОЕДИНЕНИЯ. ОРГАНО-ГЕНЫ. 1. ПРАКТИЧЕСКАЯ ЧАСТЬ. 2. ЛАБОРАТОРНАЯ РАБОТА. Аналитические реакции на анионы р – элементов: SO42–, PO43–, CO32–, SCN–, Cl–, Br–, I–, CH3COO–, NO3–. 2.2. Анализ препарата, содержащего один из р – элементов. 3. Сообщения по темам рефератов. 4. КОНТРОЛЬНАЯ РАБОТА 4. Биогенные элементы. 2.1. ЗАНЯТИЕ 15. КЛАССИФИКАЦИЯ, НОМЕНКЛАТУРА, ЭЛЕКТРОННОЕ И ПРОСТРАН-СТВЕННОЕ СТРОЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. ИЗОМЕРИЯ. 1. ПРАКТИЧЕСКАЯ ЧАСТЬ. 1.1. Электронное строение атома углерода и характеристика связей С–С, С=С, С≡С, С– Н. 1.2. Пространственное строение, конфигурации, конформации, изомерия органических молекул. Виды изомерии (упражнения в построении моделей молекул). 1.3. Химическая стойкость алканов. Механизм радикального замещения (SR). 1.4. Способность к окислению и электрофильному присоединению (АЕ) алкенов. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Получение алкана и изучение его свойств (демонстрация). 2.2. Изучение химических свойств непредельных углеводородов: алкены и терпены. ЗАНЯТИЯ 16. СОПРЯЖЕННЫЕ СИСТЕМЫ С ОТКРЫТОЙ И ЗАМКНУТОЙ ЦЕПЬЮ. АРОМАТИЧНОСТЬ. 1.ПРАКТИЧЕСКАЯ ЧАСТЬ 1.1. Термодинамическая устойчивость соединений с сопряженными связями. Электрофильное присоединение к диеновым.. 1.2.Ароматичность. Критерии ароматичности. Реакции электрофильного замещения (SE). 2.ЛАБОРАТОРНАЯ РАБОТА. 2.1. Сравнительные реакции окисления ароматических углеводородов. 2.2. Окисление нафталина. 3. КОНТРОЛЬ УСВОЕНИЯ ТЕМЫ: Теоретические основы строения, изомерии и реакционной способности углеводородов. ЗАНЯТИЕ 17. КИСЛОТНО – ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. СПИРТЫ, ФЕНОЛЫ, ТИОЛЫ, ЭФИРЫ. ОКСОСОЕДИНЕНИЯ. КАРБОНОВЫЕ КИСЛОТЫ, СЛОЖНЫЕ ЭФИРЫ. МЕХАНИЗМЫ РЕАКЦИЙ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ (SN) И НУКЛЕОФИЛЬНОГО ПРИСОЕДИНЕНИЯ. 1. ПРАКТИЧЕСКАЯ ЧАСТЬ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Изучение свойств одноатомных спиртов ациклического и циклического ряда. 2.2. Многоатомные спирты. Доказательство многоатомности спиртов. 2.3. Изучение свойств ароматического кольца фенола, фенольного гидроксила и их взаимного влияния. 2.4. Сравнительное изучение свойств альдегидов и кетонов. 2.5. Химические свойства предельных и непредельных одноосновных и многоосновных карбоновых кислот. 2.6. Реакция получения сложного уксусноамилового эфира (демонстрация). 3. УИРС: «МЕТАБОЛИЗМ ЭТИЛОВОГО СПИРТА В ОРГАНИЗМЕ». ЗАНЯТИЕ 18. ОМЫЛЯЕМЫЕ ЛИПИДЫ. ЕСТЕСТВЕННЫЕ ЖИРЫ КАК СМЕСИ ТРИАЦИЛГЛИЦЕРИНОВ. ФОСФАТИДНАЯ КИСЛОТА. ФОСФОЛИПИДЫ – СТРУКТУРНЫЕ КОМПОНЕНТЫ КЛЕТОЧНЫХ МЕМБРАН. ГЕТЕРОФУНКЦИОНАЛЬНЫЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ. ГИДРОКСИ - , ОКСО- И ФЕНОЛОКИСЛОТЫ. 1.ПРАКТИЧЕСКАЯ ЧАСТЬ. 2.ЛАБОРАТОРНАЯ РАБОТА. 2.1.Г идролиз жира под действием щелочи и анализ продуктов гидролиза. 2.2. Открытие молочной кислоты в растворе. 2.3. Получение кислой и средней соли винной кислоты. 2.4. Определение спиртовых групп в винной кислоте и ее солях. 2.5. Качественные реакции этилового эфира ацетоуксусной кислоты. 2.6. Сравнительные реакции FeCl3 с фенолом, салициловой кислотой и ее эфирами. 2.7. Разложение лимонной кислоты. 3.УИРС: «МЕДИКО-БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ЖИРОВ. ВАЖНЕЙШИЕ ХАРАКТЕРИСТИКИ ЖИРА: ЙОДНОЕ И КИСЛОТНОЕ ЧИСЛА, ЧИСЛО ОМЫЛЕНИЯ». 4. КОНТРОЛЬ УСВОЕНИЯ ТЕМЫ: МОНОФУНКЦИОНАЛЬНЫЕ ОРГАНИЧЕСКИЕ ПРОИЗВОДНЫЕ ЗАНЯТИЕ 19. 1.ПОДВЕДЕНИЕ ИТОГОВ: ТЕСТЫ . 2.СООБЩЕНИЕ ПО ТЕМАМ РЕФЕРАТОВ: БИООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ – ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ, НЕЙРОМЕДИАТОРЫ. ОСНОВНАЯ ЛИТЕРАТУРА: 1. Тюкавкина Н.А. Биоорганическая химия: учебник для вузов / Н.А.Тюкавкина, Ю.И. Бауков.- 4-е изд., стереотип. – М.:<Дрофа>,2005- 542 с. 2. Ю.А.Ершов, В.А.Попков и др. Общая химия. М.: Высшая школа,2008. – 560с. 3. В.А.Попков, С.А. Пузаков. Общая химия: учебник.-М.: ГЭОТАР-Медиа, 2009.- 976 с.: 4. Руководство к лабораторным занятиям по биоорганической химии/под редакцией Н.А.Тюкавкиной . 4 изд. стереотипное, для студентов лечебное дело, педиатрия, медикопрофилактическое дело, стоматология. – Изд.М.:<Дрофа>.-2008.-318с. ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА: 1. Общая химия: руководство к лабораторно-практическим занятиям/А.Н.Линева[ и др.].Н.Новгород: Издательство Нижегородской государственной медицинской академии, 2006.–288 с. 2. Методические разработки к лабораторно-практическим занятиям по биоорганической химии/сост. А.С.Гордецов [ и др.]. – Н.Новгород: Издательство НижГМА,2009. – 98с. 3. Растворы:Учеб.-метод.пособие.- Нижний Новгород: Изд-во Нижегородской государственной медицинской академии,2001. – 56с. 4. Общая и биоорганическая химия: тесты для самостоятельной подготовки студентов/ сост.А.С.Гордецов [ и др.]; 3 – е изд. – Н.Новгород: Изд-во Нижегородской госмедакадемии,2008.-40с. УЧЕБНЫЙ ПЛАН ЛАБОРАТОРНО – ПРАКТИЧЕСКИХ ЗАНЯТИЙ ПО ХИМИИ НА I СЕМЕСТР 2015/2016 УЧЕБНОГО ГОДА ДЛЯ СТУДЕНТОВ I КУРСА ЛЕЧЕБНОГО И ПЕДИАТРИЧЕСКОГО ФАКУЛЬТЕТОВ. ЗАНЯТИЕ 1. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ. ПРИГОТОВЛЕНИЕ РАСТВОРОВ ЗАДАННОЙ КОНЦЕНТРАЦИИ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Приготовление раствора щавелевой кислоты из навески. 2.2. Приготовление 0,1 н. раствора минеральных кислот из концентрированных растворов. ЗАНЯТИЕ 2 ОСНОВЫ КОЛИЧЕСТВЕННОГО АНАЛИЗА. 3. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ: Теоретические основы метода нейтрализации. Кислотно – основное титрование. Закон эквивалентности и его применение для расчетов в объемном анализе. 4. ЛАБОРАТОРНАЯ РАБОТА. 4.1. Определение нормальности и титра щелочи по титрованному раствору щавелевой кислоты. 4.2. Определение нормальности и титра кислоты по установленному раствору щелочи. ЗАНЯТИЕ 3. ОКСИДИМЕТРИЯ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 2. ЛАБОРАТОРНАЯ РАБОТА. Определение нормальности и титра раствора KMnO4 по приготовленному титрованному раствору Na2C2O4. 3. КОНТРОЛЬНАЯ РАБОТА 1. Титриметрические методы анализа. ЗАНЯТИЕ 4. ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ. 3. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ: Основные закономерности протекания химических реакций термодинамика). 4. ЛАБОРАТОРНАЯ РАБОТА: Определение теплового эффекта химической реакции. 2.1. Определение теплового эффекта реакции нейтрализации. 2.2. Определение теплоты гидратации сульфата меди. ЗАНЯТИЕ 5. КИНЕТИКА ХИМИЧЕСКИХ И БИОХИМИЧЕСКИХ РЕАКЦИЙ. 4. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ: Основные закономерности протекания химических реакций (кинетика). 5. ЛАБОРАТОРНАЯ РАБОТА 5.1. Изменение скорости разложения тиосульфата натрия в зависимости от его концентрации. 5.2. Зависимость скорости реакции окисления йодид – ионов ионом Fe3+ в зависимости от концентрации FeCl3 и KI. ЗАНЯТИЕ 6. ТЕРМОДИНАМИЧЕСКИЕ И КИНЕТИЧЕСКИЕ УСЛОВИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ. СМЕЩЕНИЕ РАВНОВЕСИЯ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 2. ЛАБОРАТОРНАЯ РАБОТА: Химическое равновесие. 3. КОНТРОЛЬНАЯ РАБОТА 2. Термодинамика, кинетика, химическое равновесие. ЗАНЯТИЕ 7. КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ И ЭЛЕКТРОЛИТОВ. 4. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ. 5. ЛАБОРАТОРНАЯ РАБОТА. Определение молярной массы неэлектролита по методу Раста (на примерах органических соединений). ЗАНЯТИЕ 8. ОСНОВНЫЕ ТИПЫ ХИМИЧЕСКИХ РАВНОВЕСИЙ И ПРОЦЕССОВ В ФУНКЦИОНИРОВАНИИ ЖИВЫХ СИСТЕМ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ: Теории кислот и оснований. Ионное произведение воды. Расчет pH и pOH протолитических систем. Конкуренция за протон. Гомогенные и гетерогенные равновесия. ЗАНЯТИЕ 9. ГИДРОЛИЗ СОЛЕЙ. БУФЕРНЫЕ РАСТВОРЫ. 3. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ. Протолитические равновесия. Гидролиз солей. Буферные растворы. 4. ЛАБОРАТОРНАЯ РАБОТА. 4.1. Гидролиз солей. 4.2. Приготовление буферных растворов. 4.3. Изучение действия буферных растворов. ЗАНЯТИЕ 10. ИТОГОВОЕ ЗАНЯТИЕ ПО ТЕМЕ: «РАСТВОРЫ ЭЛЕКТРОЛИТОВ И НЕЭЛЕКТРОЛИТОВ. ГОМОГЕННЫЕ И ГЕТЕРОГЕННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ» 1. КОНТРОЛЬНАЯ РАБОТА 3. 2. Защита рефератов по теме «Растворы» ЗАНЯТИЕ 11. БИОЛОГИЧЕСКИ АКТИВНЫЕ НИЗКОМОЛЕКУЛЯРНЫЕ НЕОРГАНИЧЕСКИЕ ВЕЩЕСТВА. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ: Понятие биогенности химических элементов. Химия биогенных элементов s-блока (Защита рефератов). 2. ЛАБОРАТОРНАЯ РАБОТА. 5.1. Аналитические реакции на катионы элементов s- блока: 5.1.1. Калия (К+): а) с гидротартратом натрия, б) с тройным нитритом натрия, свинца и меди (микрокристаллоскопия). 5.1.2. Магния (Mg2+): с гидрофосфатом натрия в присутствии аммонийной смеси. 5.1.3. Натрия (Na+) с дигидроантимонатом калия. 5.1.4. Кальция (Са2+) с оксалатом аммония. 5.1.5. Бария (Ba2+) с хроматом калия. ЗАНЯТИЕ 12. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ И ИХ СВОЙСТВА. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ: Химия биогенных элементов d- блока (Защита рефератов) 2. ЛАБОРАТОРНАЯ РАБОТА. 5.2. Аналитические реакции на катионы элементов d- блока: 5.2.1. Железа (Fe+2): с гексационоферрат (III) калия. 5.2.2. Железа (Fe+3): а) с гексационоферрат (II) калия, б) роданидом калия 5.2.3. Марганца (Mn2+) с пероксидом водорода в щелочной среде. 5.2.4. Меди (Сu2+) c гидроксидом аммония (с эквивалентным количеством и избытком). 5.2.5. Хрома (Cr+3) c пероксидом водорода в щелочной среде ЗАНЯТИЕ 13. БИОЛОГИЧЕСКИ АКТИВНЫЕ НИЗКОМОЛЕКУЛЯРНЫЕ НЕОРГАНИЧЕСКИЕ ВЕЩЕСТВА. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ: Химия биогенных элементов P- блока (Защита рефератов) 2. ЛАБОРАТОРНАЯ РАБОТА. 4.1. Аналитические реакции на анионы элементов р – блока: SO42–, PO43–, CO32–, SCN–, Cl–, CH3COO–, NO3–. 5. КОНТРОЛЬНАЯ РАБОТА 4. «Биогенные элементы» ЗАНЯТИЕ 14. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РАВНОВЕСИЯ И ПРОЦЕССЫ. 3. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ. Механизм возникновения электродного, редокс- и мембранных потенциалов. Электрическая проводимость растворов электролитов. Расчет константы и степени диссоциации слабых электролитов. 4. ЛАБОРАТОРНАЯ РАБОТА. 4.1. Определение рН биологических жидкостей. 4.2. Потенциометрическое титрование. ЗАНЯТИЕ 15. ФИЗИКО-ХИМИЯ ПОВЕРХНОСТНЫХ ЯВЛЕНИЙ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ. (Защита рефератов). 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Определение поверхностного натяжения на границе раздела жидкость – газ. 2.2. Определение ионов Pb2+ и Hg2+ в смеси методом колоночной хроматографии (демонстрация). 2.3. Изотерма поверхностного натяжения, изотерма адсорбции на границах раздела жидкость-газ, жидкость – твердое тело. ЗАНЯТИЕ 16. ФИЗИКО-ХИМИЯ ДИСПЕРСНЫХ СИСТЕМ. КОЛЛОИДНЫЕ РАСТВОРЫ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ (Защита рефератов). 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Приготовление коллоидных растворов. 2.2. Очистка коллоидных растворов методом диализа. 2.3. Определение заряда частиц окрашенных золей. ЗАНЯТИЕ 17. ИТОГОВОЕ ЗАНЯТИЕ. Итоговые тесты. ЛИТЕРАТУРА. Основная: 1. Общая химия. Биофизическая химия. Химия биогенных элементов. Учебник для медицинских вузов. Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др., / под ред. В.А. Попкова – М.: Высшая школа, 2007 . 560 с. 2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов. Учебн. Пособие для студентов медицинских вузов / под ред. В.А.Попкова – М.: Высшая школа, 2005. 237 с. 3. Тюкавкина Н.А. Биоорганическая химия: учебник для вузов / Н.А.Тюкавкина, Ю.И.Бауков - М.:Дрофа, 2009. 542с. 4. Руководство к лабораторным занятиям по биоорганической химии: пособие для Вузов/ под ред. Н.А.Тюкавкиной. – М.: Дрофа, 2009 – 318с. Дополнительная: 1. Общая химия. Руководство к лабораторно-практическим занятиям/ А.Н.Линева [и др.] – Нижний Новгород.: Изд-во НГМА, 2008.- 288с.; 2. Методические разработки к лабораторно-практическим занятиям по био- органической химии. Н.Новгород: Изд-во НГМА, 2009 - 80с. КАЛЕНДАРНЫЙ ПЛАН ЛЕКЦИЙ ПО ХИМИИ НА I СЕМЕСТР 2015/2016 УЧЕБНОГО ГОДА ДЛЯ ЛЕЧЕБНОГО ФАКУЛЬТЕТА № 1 ДАТА 02.09.15 08.09.15 ТЕМА ЛЕКЦИИ Основные понятия и законы термодинамики. Первое начало термодинамики. Закон Гесса и следствия из него. 2 09.09.15 15.09.15 16.09.15 22.09.15 Второе начало термодинамики. Энтропия. Энергия Гиббса. Применение законов термодинамики к биосистемам. 3 Кинетика химических и биохимических реакций. Зависимость скорости реакции от различных факторов. Катализ. 4 23.09.15 29.09.15 Термодинамика химического равновесия. 5 30.09.15 06.10.15 Коллигативные свойства растворов неэлектролитов и электролитов. 6 07.10.15 13.10.15 Основные типы химических равновесий в живых системах. Теории кислот и оснований. Кислотно – основные равновесия. Водородный показатель. Растворы сильных электролитов. 7 14.10.15 20.10.15 8 21.10.15 27.10.15 9 28.10.15 03.11.15 10 10.11.15 11.11.15 Гидролиз солей. Буферные системы, механизм их действия. Буферная емкость, буферные системы живых организмов. Окислительно-восстановительные равновесия и процессы. Теория возникновения электродных, окислительновосстановитель-ных и мембранных потенциалов. Электрохимические методы исследования. Совмещенные и конкурирующие процессы. Физико-химия поверхностных явлений функционировании живых систем. Поверхностная энергия Гиббса и поверхностное натяжение. Адсорбция. Адсорбционные равновесия. ПАВ, ПНВ. Физико-химия дисперсных систем в функционировании живых организмов. Природа коллоидного состояния. Диализ. Оптические свойства. Двойной электрический слой. Зав. кафедрой общей химии, профессор _______________ /Гордецов А.С./ КАЛЕНДАРНЫЙ ПЛАН ЛЕКЦИЙ ПО ХИМИИ НА I СЕМЕСТР 2015/2016 УЧЕБНОГО ГОДА ДЛЯ ПЕДИАТРИЧЕСКОГО ФАКУЛЬТЕТА № 1 ДАТА 03.09.15 ТЕМА ЛЕКЦИИ Основные понятия и законы термодинамики. Первое начало термодинамики. Закон Гесса и следствия из него. 2 17.09.15 Второе начало термодинамики. Энтропия. Энергия Гиббса. Применение законов термодинамики к биосистемам. 3 01.10.15 Кинетика химических и биохимических реакций. Зависимость скорости реакции от различных факторов. Катализ. 4 15.10.15 Термодинамика химического равновесия. 5 29.10.15 Коллигативные свойства растворов неэлектролитов и электролитов. 6 12.11.15 Основные типы химических равновесий в живых системах. Теории кислот и оснований. Кислотно – основные равновесия. Водородный показатель. Растворы сильных электролитов. 7 19.11.15 Гидролиз солей. Буферные системы, механизм их действия. Буферная емкость, буферные системы живых организмов. 8 26.11.15 9 03.12.15 10 10.12.16 Окислительно-восстановительные равновесия и процессы. Теория возникновения электродных, окислительновосстановитель-ных и мембранных потенциалов. Электрохимические методы исследования. Совмещенные и конкурирующие процессы. Физико-химия поверхностных явлений функционирования живых систем. Поверхностная энергия Гиббса и поверхностное натяжение. Адсорбция. Адсорбционные равновесия. ПАВ, ПНВ. Физико-химия дисперсных систем в функционировании живых организмов. Природа коллоидного состояния. Диализ. Оптические свойства. Двойной электрический слой. Зав. кафедрой общей химии, профессор________________ /Гордецов А.С./ КАЛЕНДАРНЫЙ ПЛАН ЛЕКЦИЙ ПО ОБЩЕЙ И БИООРГАНИЧЕСКОЙ ХИМИИ НА I СЕМЕСТР 2015/2016 УЧЕБНОГО ГОДА ДЛЯ СТОМАТОЛОГИЧЕСКОГО ФАКУЛЬТЕТА № ДАТА ТЕМА ЛЕКЦИИ 1 02.09.15 2 09.09.15 3 16.09.15 КИНЕТИКА ХИМИЧЕСКИХ И БИОХИМИЧЕСКИХ РЕАКЦИЙ. 4 23.09.15 ХИМИЧЕСКОЕ РАВНОВЕСИЕ 5 30.09.15 КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ, ЭЛЕКТРОЛИТОВ, 6 07.10.15 ТЕОРИИ КИСЛОТ И ОСНОВАНИЙ. КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ. 7 14.10.15 ГИДРОЛИЗ СОЛЕЙ. БУФЕРНЫЕ РАСТВОРЫ И СИСТЕМЫ ОРГАНИЗМА. 8 21.10.15 КООРДИНАЦИОННЫЕ (КОМПЛЕКСНЫЕ) СОЕДИНЕНИЯ, ИХ МЕДИКО-БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ. 9 28.10.15 ФИЗИКО-ХИМИЯ ДИСПЕРСНЫХ СИСТЕМ. 10 11.11.15 11 18.11.15 12 25.11.15 ЭЛЕКТРОННОЕ СТРОЕНИЕ И РЕАКЦИОННАЯ СПОСОБНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. МЕХАНИЗМЫ РЕАКЦИЙ. УГЛЕВОДОРОДЫ (АЛКАНЫ, АЛКЕНЫ, АЛКИНЫ, АЛКАДИЕНЫ, АРОМАТИЧЕСКИЕ). СТРОЕНИЕ И ХИМИЧЕСКИЕ СВОЙСТВА. 13 02.12.15 КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. МОНОФУНКЦИОНАЛЬНЫЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ. СПИРТЫ, ФЕНОЛЫ. 14 09.12.15 КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ. АЛЬДЕГИДЫ И КЕТОНЫ. 15 16.12.15 КАРБОНОВЫЕ КИСЛОТЫ, ИХ ПРОИЗВОДНЫЕ. ОМЫЛЯЕМЫЕ ЛИПИДЫ. 16 23.12.15 ГЕТЕРОФУНКЦИОНАЛЬНЫЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ. ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ. 17 30.12.15 ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ И БИОЭНЕРГЕТИКИ. УГЛЕВОДЫ. МОНОСАХАРИДЫ. Заведующий кафедрой общей химии, профессор /Гордецов А.С./ УЧЕБНЫЙ ПЛАН ЛАБОРАТОРНО – ПРАКТИЧЕСКИХ ЗАНЯТИЙ ПО ХИМИИ НА I СЕМЕСТР 2015/2016 УЧЕБНОГО ГОДА ДЛЯ СТУДЕНТОВ I КУРСА СТОМАТОЛОГИЧЕСКОГО ФАКУЛЬТЕТА. ЗАНЯТИЕ 1. ПРЕДМЕТ И ЗАДАЧИ ОБЩЕЙ ХИМИИ, ХИМИЧЕСКИЕ И ФИЗИКО – ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА ХИМИЧЕСКИХ СОЕДИНЕНИЙ. 1. Ознакомление с правилами работы и техникой безопасности в химической лаборатории. Знакомство с химической посудой. 2. Определение исходного уровня знаний студентов. 3. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ. РАСТВОРЫ. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ. ПРИГОТОВЛЕНИЕ РАСТВОРОВ ЗАДАННОЙ КОНЦЕНТРАЦИИ. 4. ЛАБОРАТОРНАЯ РАБОТА. 4.1. Приготовление раствора щавелевой кислоты из навески. 4.2. Приготовление 0,1 н. раствора минеральных кислот из концентрированных растворов. ЗАНЯТИЕ 2. ОСНОВЫ КОЛИЧЕСТВЕННОГО АНАЛИЗА. 1 ПРАКТИЧЕСКОЕ ЗАНЯТИЕ.Теоретические основы метода нейтрализации. Кислотно – основное титрование. Закон эквивалентности и его применение для расчетов в объемном анализе. 2 ЛАБОРАТОРНАЯ РАБОТА. 2.1. Определение нормальности и титра щелочи по титрованному раствору щавелевой кислоты. 2.2. Определение нормальности и титра кислоты по установленному раствору щелочи. ЗАНЯТИЕ 3. ОКСИДИМЕТРИЯ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ. Окислительно – восстановительные процессы. Эквивалент окислителя и восстановителя. Основные положения оксидиметрии. Перманганатометрия, йодометрия. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Определение нормальности и титра раствора KMnO4 по приготовленному титрованному раствору Na2C2O4. 2.2. Определение нормальности и титра раствора Na2S2O3 по титрованному раствору K2Cr2O7. 3. КОНТРОЛЬНАЯ РАБОТА №1: «Основы метода объемного анализа». ЗАНЯТИЕ 4. ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ И БИОЭНЕРГЕТИКИ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ.. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Определение теплового эффекта реакции нейтрализации. 2.2. Определение теплоты гидратации сульфата меди, гипса. ЗАНЯТИЕ 5. РЕАКЦИЙ. КИНЕТИКА ХИМИЧЕСКИХ И БИОХИМИЧЕСКИХ 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Изменение скорости разложения тиосульфата натрия в зависимости от его концентрации. 2.2. Зависимость скорости реакции окисления йодид – ионов ионом Fe3+ в зависимости от концентрации FeCl3 и KI. ЗАНЯТИЕ 6. ТЕРМОДИНАМИЧЕСКИЕ И КИНЕТИЧЕСКИЕ УСЛОВИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ. СМЕЩЕНИЕ РАВНОВЕСИЯ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ. 2. ЛАБОРАТОРНАЯ РАБОТА. 3. КОНТРОЛЬНАЯ РАБОТА №2. « Основы термодинамики, кинетики и химического равновесия» ЗАНЯТИЕ 7. РАСТВОРЫ. СВОЙСТВА РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ. УИРС «Осмос, значение осмоса в жизнедеятельности организма». 6. ЛАБОРАТОРНАЯ РАБОТА. Определение молярной массы неэлектролита по методу Раста (на примерах органических соединений). ЗАНЯТИЕ 8. РАСТВОРЫ ЭЛЕКТРОЛИТОВ. 3. СЕМИНАР. 4. ЛАБОРАТОРНАЯ РАБОТА. 4.1. Влияние одноименного иона на степень диссоциации слабых электролитов. 4.2. Гидролиз солей. 4.3. Индикаторный метод определения рН растворов. ЗАНЯТИЕ 9. БУФЕРНЫЕ РАСТВОРЫ И ИХ РАСТВОРЫ. БУФЕРНЫЕ СИСТЕМЫ ОРГАНИЗМА. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Установление буферного действия растворов. 2.2. Приготовление буферных растворов. 3. КОНТРОЛЬНАЯ РАБОТА № 3. ЗАНЯТИЕ 10. ХИМИЯ ДИСПЕРСНЫХ СИСТЕМ. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. КОЛЛОИДНЫЕ РАСТВОРЫ. 3. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ. 4. ЛАБОРАТОРНАЯ РАБОТА. 4.1. Получение коллоидных растворов. 4.2. Очистка коллоидных растворов методом диализа. 4.3. Определение заряда частиц окрашенных золей. 4.4. Определение органических веществ методом хроматографии. ЗАНЯТИЕ 11. БИОГЕННЫЕ ЭЛЕМЕНТЫ. МАТЕРИАЛЫ В СТОМАТОЛОГИИ. ИЗУЧЕНИЕ СВОЙСТВ СОЕДИНЕНИЙ ЭЛЕМЕНТОВ s-,p – БЛОКОВ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ. Строение атомов и молекул. Типы химических связей. Теории валентных связей (ВС, МО ЛКАО). Периодический закон и таблица Д.И.Менделеева. квантовые числа. S-, p-, d-, f- блоки элементов. Энергия ионизации, сродство к электрону, относительная электроотрицательность. закономерности в изменении химических свойств элементов и их соединений в зависимости от электронного строения атомов. Роль химии элементов в медицине и стоматологии. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Аналитические реакции на катионы: 2.1.1. Калия (К+): а) с гидротортратом натрия, б) с тройным нитритом натрия, свинца и меди (микрокристаллоскопия). 2.1.2. Магния (Mg2+): с гидрофосфатом натрия в присутствии аммонийной смеси. 2.1.3. Натрия (Na+) с дигидроантимонатом калия. 2.1.4. Кальция (Са2+) с оксалатом аммония. 2.1.5. Бария (Ba2+) с хроматом калия. 2.2. Аналитические реакции на анионы р – элементов: SO42–, PO43–, CO32–, SCN–, Cl–, Br–, I–, CH3COO–, NO3–. ЗАНЯТИЕ 12. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ В БИОЛОГИИ И МЕДИЦИНЕ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Аналитические реакции на катионы: 2.1.1. Железа (Fe+2): с гексационоферрат (III) калия. 2.1.2. Железа (Fe+3): с гексационоферрат (II) калия; с роданидом аммония 2.1.3. Марганца (Mn2+) с пероксидом водорода в щелочной среде. 2.1.4. Хрома (Cr3+) с пероксидом водорода в щелочной среде. 2.1.5. Серебра (Ag+) с соляной кислотой с последующим растворением осадка гидроксидом аммония и разложением полученной соли азотной кислотой. 2.1.6. Меди (Сu2+) c гидроксидом аммония (с эквивалентным количеством и избытком). 2.2. Анализ препарата, содержащего один из d – элементов. ЗАНЯТИЕ 13. ЭЛЕКТРОХИМИЯ. ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ. ПОТЕНЦИОМЕТРИЯ. ХИМИЧЕСКАЯ И ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Потенциометрическое титрование (демонстрация). 2.2. Коррозия металлов в агрессивных средах. 2.3. Потенциометрический метод определения рН биологических жидкостей и буферных растворов. 3. УИРС №4: «Физиотерапевтические методы в стоматологии и медицине, основанные на электрохимических процессах». ЗАНЯТИЕ 14. ГЕНЕТИЧЕСКАЯ СВЯЗЬ ОСНОВНЫХ КЛАССОВ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ. Классификация, номенклатура, изомерия органических соединений. Углеводороды – основа органических соединений. Алканы, алкены, алкины. Механизмы реакций Sn, АЕ, Аn. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Получение этана, исследование его свойств (демонстрация). 2.2. Изучение свойств непредельных соединений (на примере алкенов). ЗАНЯТИЕ 15. СОПРЯЖЕННЫЕ СИСТЕМЫ С ЛИНЕЙНОЙ И ЗАМКНУТОЙ ЦЕПЬЮ. АРОМАТИЧНОСЬ. ТЕРПЕНЫ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ. 1.1. Термодинамическая устойчивость ароматических соединений. Критерии ароматичности. 1.2. Реакции электрофильного замещения. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Сравнительные реакции окисления ароматических углеводородов. 2.2. Окисление нафталина. 2.3. Окисление и доказательство ненасыщенности терпенов. 3. КОНТРОЛЬНАЯ РАБОТА № 4 «СТРОЕНИЕ, ИЗОМЕРИЯ И РЕАКЦИОННАЯ СПОСОБНОСТЬ УГЛЕВОДОРОДОВ». ЗАНЯТИЕ 16. МОНОФУНКЦИОНАЛЬНЫЕ ОРГАНИЧЕСКИЕ СОЕДИННИЯ. ВАЖНЕЙШИЕ СВОЙСТВА СПИРТОВ, ФЕНОЛОВ, ТИОЛОВ, АМИНОВ И ИХ ПРОИЗВОДНЫХ. КИСЛОТНО - ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ. Спирты, фенолы, карбоновые кислоты, жиры. Электронное строение функциональных групп. Важнейшие реакции функциональных групп. Реакции замещения (Sn1, Sn2). 2. ЛАБОРАТОРНАЯ РАБОТА. Изучение свойств одноатомных спиртов ациклического и циклического ряда 2.2. Многоатомные спирты. Доказательство многоаттомности спиртов. 2.3. Реакции окисления фенолов сильным и слабым окислителями. 2.4. Изучение свойств ароматического кольца фенола, фенольного гидроксила и их взаимного влияния. 2.5. Цветные качественные реакции на фенолы. 3. УИРС. «Метаболизм этилового спирта в организме». 2.1. ЗАНЯТИЕ 17. МОНОФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ. КАРБОНИЛЬНЫЕ АЛЬДЕГИДЫ И КЕТОНЫ. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ – 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ. Альдегиды, кетоны. Электронное строение и основные характеристики карбонильной группы. Биологически важные реакции альдегидов и кетонов. Механизмы нуклеофильного присоединения AN, AN-E. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Сравнительное изучение свойств альдегидов и кетонов. 2.2. Дезинфицирующее действие формалина. 3. КОНТРОЛЬНАЯ РАБОТА №5. « СПИРТЫ, ФЕНОЛЫ, АЛЬДЕГИДЫ, КЕТОНЫ» ЗАНЯТИЕ 18. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ. ОМЫЛЯЕМЫЕ ЛИПИДЫ. ЕСТЕСТВЕННЫЕ ЖИРЫ КАК СМЕСИ ТРИАЦИЛГЛИЦЕРИДОВ. ФОСФОЛИПИДЫ – СТРУКТУРНЫЕ КОМПОНЕНТЫ КЛЕТОЧНЫХ МЕМБРАН. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Химические свойства предельных и непредельных одноосновных и многоосновных карбоновых кислот. 2.2. Реакция получения сложного уксусноамилового эфира (демонстрация). 2.3. Гидролиз жира под действием щелочи. 2.4. Анализ продуктов гидролиза. 2.5. Реакции доказательства ненасыщенности жиров растительного происхождения. 3. УИРС: «Медико – биологическое значение жиров. Важнейшие характеристики жира: йодное, кислотное числа, число омыления». 4. КОНТРОЛЬНАЯ РАБОТА №6. « КАРБОНОВЫЕ КИСЛОТЫ. ЖИРЫ.» ЗАНЯТИЕ 19. ГЕТЕРОФУНКЦИОНАЛЬНЫЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ. ЭНАНТИОМЕРЫ. ДИАСТЕРЕОМЕРЫ.. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Открытие молочной кислоты в растворе. 2.2. Получение кислой и средней соли винной кислоты. 2.3. Определение спиртовых групп в винной кислоте и ее солях. 2.4. Качественные реакции этилового спирта ацетоуксусной кислоты. 2.5. Сравнительные реакции FeCl3 с фенолом, салициловой кислотой и ее эфирами. ЗАНЯТИЕ 20. ЗАЧЕТ ЛИТЕРАТУРА. Основная: 5. Общая химия. Биофизическая химия. Химия биогенных элементов. Учебник для медицинских вузов. Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др., / под ред. В.А.Попкова – М.: Высшая школа, изд. 560 с., 2007. 6. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов. Учебн. Пособие для студентов медицинских вузов / под ред. В.А.Попкова – М.: Высшая школа, изд., 237 с., 2005. 7. Тюкавкина Н.А. Биорганическая химия: учебник для вузов / Н.А.Тюкавкина, Ю.И.Бауков - М.:Дрофа, 2005, - 542с. 2009 (131 экз) 8. Руководство к лабораторным занятиям по биорганической химии: пособие для Вузов/ под ред. Н.А.Тюкавкиной. – М.: Дрофа, 2009 – 318с. Дополнительная: 3. Общая химия. Руководство к лабораторно-практическим занятиям/ А.Н.Линева [и др.] – Нижний Новгород.: Изд-во НГМА, 2008.- 288с.; 4. Методические разработки к лабораторно-практическим занятиям по био- органической химии. Н.Новгород: Изд-во НГМА, 2009 - 80с. КАЛЕНДАРНЫЙ ПЛАН ЛЕКЦИЙ ПО ОБЩЕЙ И НЕОРГАНИЧЕСКОЙ ХИМИИ НА I СЕМЕСТР 2015/2016 УЧЕБНОГО ГОДА ФАРМАЦЕВТИЧЕСКОГО ФАКУЛЬТЕТА № Тема лекции 1 Введение. Основные понятия химической термодинамики. Энергетика химических реакций. 03.09.15 2 10.09.15 Основные понятия химической кинетики. Обратимые и необратимые химические реакции. Химическое равновесие. 3 Учение о растворах. Равновесные процессы в растворах электролитов. 17.09.15 4. 24.09.15 5.01.10.15 6.08.10.15 Строение атома и периодический закон. 7.15.10.15 Химическая связь. Строение химических соединений. 8.22.10.15 9.29.10.15 Комплексные соединения 10.05.11.15 Химия элементов. 11.12.11.15 S-элементы. 12.19.11.15 13.26.11.15 d-элементы. 14.03.12.15 15.10.12.15 16.17.12.15 17.24.12.15 р-элементы 18.31.12.15 Заведующий кафедрой общей химии, профессор /Гордецов А.С./ УЧЕБНЫЙ ПЛАН ЛАБОРАТОРНО-ПРАКТИЧЕСКИХ ЗАНЯТИЙ ПО ОБЩЕЙ И НЕОРГАНИЧЕСКОЙ ХИМИИ НА I СЕМЕСТР 2015/2016 УЧЕБНОГО ГОДА ДЛЯ СТУДЕНТОВ I КУРСА ФАРМАЦЕВТИЧЕСКОГО ФАКУЛЬТЕТА ЗАНЯТИЕ № 1. ПРЕДМЕТ И ЗАДАЧИ ОБЩЕЙ И НЕОРГАНИЧЕСКОЙ ХИМИИ. РАСТВОРЫ. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ. 1. Ознакомление с правилами работы и техникой безопасности в химической лаборатории. Знакомство с химической посудой. 2. Определение исходного уровня знаний студентов. 3. Номенклатура неорганических веществ. 4. Способы выражения концентрации растворов. ЗАНЯТИЕ 2. ПРИГОТОВЛЕНИЕ РАСТВОРОВ ЗАДАННОЙ КОНЦЕНТРАЦИИ. 1. РЕШЕНИЕ СИТУАЦИОННЫХ ЗАДАЧ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Приготовление раствора заданной концентрации из навески, фиксанала. 2.2. Приготовление 0,1 н раствора минеральных кислот из концентри рованных растворов. ЗАНЯТИЕ 3. ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ. СЕМИНАР. 1. РЕШЕНИЕ СИТУАЦИОННЫХ ЗАДАЧ. 2. ЛАБОРАТОРНАЯ РАБОТА. Определение энтальпии реакции нейтрализации. ЗАНЯТИЕ 4. ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ КИНЕТИКИ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ. 1. РЕШЕНИЕ СИТУАЦИОННЫХ ЗАДАЧ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Зависимость скорости реакции от температуры. 2.2. Влияние различных факторов на смещение химического равновесия. ЗАНЯТИЕ 5. ИТОГОВОЕ ЗАНЯТИЕ ПО ТЕМАМ: КОНЦЕНТРАЦИЯ РАСТВОРОВ. ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ. КОЛЛОКВИУМ. ЗАНЯТИЕ 6. СВОЙСТВА РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ И ЭЛЕКТРОЛИТОВ. 1. РЕШЕНИЕ СИТУАЦИОННЫХ ЗАДАЧ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Очистка соединений методом перекристаллизации. 2.2. Определение температуры плавления. ЗАНЯТИЕ 7. ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ СИЛЬНЫХ И СЛАБЫХ ЭЛЕКТРОЛИТОВ. 1. РЕШЕНИЕ СИТУАЦИОННЫХ ЗАДАЧ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Определение рН растворов с помощью индикатора. 2.2. Влияние одноименного иона на степень диссоциации слабых электролитов. 2.3. Гидролиз солей. 2.4. Условия выпадения и растворения осадков труднорастворимых соединений. 2.5. Получение и изучение свойств амфотерных электролитов. ЗАНЯТИЕ 8. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. 1. РЕШЕНИЕ СИТУАЦИОННЫХ ЗАДАЧ. 2. ЛАБОРАТОРНАЯ РАБОТА. Окислительно–восстановительные свойства простых веществ, важнейших окислителей (KMnO4, K2Cr2O7) и веществ с двойственной окислительно - восстановительной способностью. ЗАНЯТИЕ 9. ИТОГОВОЕ ЗАНЯТИЕ ПО ТЕМАМ: СВОЙСТВА РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ И ЭЛЕКТРОЛИТОВ. ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. КОНТРОЛЬНАЯ РАБОТА. ЗАНЯТИЕ 10. СТРОЕНИЕ ЭЛЕКТРОННЫХ ОБОЛОЧЕК АТОМОВ. ХИМИЧЕСКАЯ СВЯЗЬ. СТРОЕНИЕ МОЛЕКУЛ. ХИМИЧЕСКАЯ СВЯЗЬ. СТРОЕНИЕ ВЕЩЕСТВА. 1. РЕШЕНИЕ СИТУАЦИОННЫХ ЗАДАЧ. ЗАНЯТИЕ 11. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ. 1. РЕШЕНИЕ СИТУАЦИОННЫХ ЗАДАЧ. 2. ЛАБОРАТОРНАЯ РАБОТА. Получение и изучение свойств комплексных соединений меди, никеля, серебра, железа. 3. ТЕСТОВЫЙ КОНТРОЛЬ: строение атома, химическая связь. ЗАНЯТИЕ 12. s – ЭЛЕМЕНТЫ I И II ГРУПП. 1. РЕШЕНИЕ СИТУАЦИОННЫХ ЗАДАЧ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Свойства простых веществ. 2.2. Химические свойства пероксида водорода. 2.3. Свойства магния и его соединений. 2.4. Получение и изучение свойств гидроксидов и сульфатов щелочноземельных металлов. ЗАНЯТИЕ 13. d – ЭЛЕМЕНТЫ. ЭЛЕМЕНТЫ VI И VII ГРУПП. 1. РЕШЕНИЕ СИТУАЦИОННЫХ ЗАДАЧ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Изучение кислотно – основных и оксилительно– восстановительных свойств соединений хрома (III), (VI). 2.2. Окислительно – восстановительные свойства соединений марганца (II), (IV), (VI), (VII). ЗАНЯТИЕ 14. d – ЭЛЕМЕНТЫ I , II , VIII ГРУПП. 1. РЕШЕНИЕ СИТУАЦИОННЫХ ЗАДАЧ. 2. ЛАБОРАТОРНАЯ РАБОТА. Изучение свойств соединений железа, кобальта, никеля, серебра, меди, ртути, цинка. ЗАНЯТИЕ 15. ИТОГОВОЕ ЗАНЯТИЕ ПО ТЕМАМ: КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ. s - И d - ЭЛЕМЕНТЫ. КОНТРОЛЬНАЯ РАБОТА. ЗАНЯТИЕ 16. p – ЭЛЕМЕНТЫ. ЭЛЕМЕНТЫ III И IV ГРУПП. 1. РЕШЕНИЕ СИТУАЦИОННЫХ ЗАДАЧ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Получение и изучение свойств борной кислоты. 2.2. Свойства алюминия и его соединений. 2.3. Свойства углерода, его оксидов, важнейших карбонатов и силикатов. 2.4. Свойства соединений свинца и олова. ЗАНЯТИЕ 17. p – ЭЛЕМЕНТЫ V ГРУППЫ. 1. РЕШЕНИЕ СИТУАЦИОННЫХ ЗАДАЧ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Свойства аммиака, солей аммония. 2.2. Свойства азотной и азотистой кислот, их солей. 2.3. Свойства фосфорной кислоты и ее солей. 2.4. Свойства соединений мышьяка, сурьмы и висмута. ЗАНЯТИЕ 18. p – ЭЛЕМЕНТЫ VI И VII ГРУПП. 1. РЕШЕНИЕ СИТУАЦИОННЫХ ЗАДАЧ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Получение и изучение свойств кислорода. 2.2. Свойства серы и ее важнейших соединений. 2.3. Получение и изучение свойств галогенов, их соединений. 3. ИТОГОВОЕ ЗАНЯТИЕ ПО ТЕМЕ p – ЭЛЕМЕНТЫ. ЗАНЯТИЕ 19. КОЛЛОКВИУМ. ГРАФИК ДЕЖУРСТВА ПРЕПОДАВАТЕЛЕЙ НА ОТРАБОТКАХ – КОНСУЛЬТАЦИЯХ НА I СЕМЕСТР 2015/2016 УЧЕБНОГО ГОДА ЛАБОРАТОРИЯ № 15 Дни проведения – ВТОРНИК, СРЕДА 15.30 – 17.00 ДАТА ДЕЖУРНЫЙ ДАТА ПРЕПОДАВАТЕЛЬ ДЕЖУРНЫЙ ПРЕПОДАВАТЕЛЬ 13.10.15вт ЛИНЕВА А.Н. 14.10.15ср ПИСКУНОВА М.С. 20.10.15вт КРАСНИКОВА О.В. 02.12.15ср ПИСКУНОВА М.С. 21.10.15ср ЖДАНОВИЧ И.В. 16.12.15ср КОНДРАШИНА О.В. 27.10.15вт ЗИМИНА С.В. 28.10.15ср ВДОВИЧЕВА В.В. 03.11.15ср ЛИНЕВА А.Н. 10.11.15вт КРАСНИКОВА О.В. 24.11.15вт ЖДАНОВИЧ И.В. 11.11.15ср ЛИНЕВА А.Н. 22.12.15вт ЗИМИНА С.В. 17.11.15вт ЗИМИНА С.В. 18.11.15ср КОНДРАШИНА О.В. 24.11.15вт ЖДАНОВИЧ И.В. 02.12.15ср КОНДРАШИНА О.В. 25.11.15ср ВДОВИЧЕВА В.В. 23.12.15ср МОСЕЕВА Е.М. 01.12.15вт КРАСИЛЬНИКОВА Е.В. 02.12.15ср ПИСКУНОВА М.С. 08.12.15вт КРАСНИКОВА О.В. 09.12.15ср КОНДРАШИНА О.В. 15.12.15вт КРАСИЛЬНИКОВА Е.В. 16.12.15ср ЖДАНОВИЧ И.В. 22.12.15вт ЗИМИНА С.В. 23.12.15ср МОСЕЕВА Е.М. 29.12.15вт МЕДВЕДЕВА О.А.. 30.12.15ср МОСЕЕВА Е.М. аналитическая химия органическая химия Физическая химия КАЛЕНДАРНЫЙ ПЛАН ЛЕКЦИЙ ПО БИООРГАНИЧЕСКОЙ ХИМИИ НА ВЕСЕННИЙ СЕМЕСТР 2015/2016 УЧЕБНОГО ГОДА ДЛЯ СТУДЕНТОВ 1 КУРСА МЕДИКО-ПРОФИЛАКТИЧЕСКОГО ФАКУЛЬТЕТА. № Дата Тема Лекции 1 10.02.16 Углеводы. Моносахариды. 2 24.02.16 Дисахариды. Гомо- и гетерополисахариды 3 09.03.16 Амины. Аминокислоты. Пептидная связь. Пептиды. Белки. 4 23.03.16 Биологически активные пяти- и шестичленные гетероциклы. 5 06.04.16 Нуклеиновые основания. Нуклеиновые кислоты. УЧЕБНЫЙ ПЛАН ЛАБОРАТОРНО-ПРАКТИЧЕСКИХ ЗАНЯТИЙ ПО БИООРГАНИЧЕСКОЙ ХИМИИ НА II СЕМЕСТР 2015/2016 УЧЕБНОГО ГОДА ДЛЯ СТУДЕНТОВ I КУРСА МЕДИКО-ПРОФИЛАКТИЧЕСКОГО ФАКУЛЬТЕТА ЗАНЯТИЕ 1. ГЕТЕРОФУНКЦИОНАЛЬНЫЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ. СТЕРЕОИЗОМЕРИЯ. ХИРАЛЬНЫЕ МОЛЕКУЛЫ. 1. ПРАКТИЧЕСКАЯ ЧАСТЬ 1.1.Строение, стереоизомерия и реакционная способность окси-, кето-, альдегидо-, фенолокислот. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Открытие молочной кислоты в растворе. 2.2. Получение кислой и средней соли винной кислоты. 2.3. Определение спиртовых групп в винной кислоте и ее солях. 2.4. Качественные реакции этилового эфира ацетоуксусной кислоты. 2.5. Сравнительные реакции FeCl3 с фенолом, салициловой кислотой и ее эфирами. 2.6. Разложение лимонной кислоты. 3. УИРС. «МЕДИКО-БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ОРГАНИЧЕСКИХ КИСЛОТ И ИХ СОЛЕЙ». ЗАНЯТИЕ 2. УГЛЕВОДЫ. КЛАССИФИКАЦИЯ УГЛЕВОДОВ. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ. МОНОСАХАРИДЫ. ДИ- И ПОЛИСАХАРИДЫ 1. ПРАКТИЧЕСКАЯ ЧАСТЬ 1.1.Строение, изомерия и химические свойства моно-, ди-, полисахаридов. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Доказательство многоатомности и восстанавливающей способности моно,дисахаридов 2.2. Качественные реакции на кетогексозы и пентозы, крахмал, декстрины, гликоген. ЗАНЯТИЕ 3. УГЛЕВОДЫ. ГОМО- И ГЕТЕРОПОЛИСАХАРИДЫ. 1. ПРАКТИЧЕСКАЯ ЧАСТЬ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Изучение восстанавливающей способности ди- и полисахаридов. 2.2. Гидролиз сахарозы и крахмала, изучение продуктов гидролиза. 3. КОНТРОЛЬНАЯ РАБОТА «СТРОЕНИЕ, ИЗОМЕРИЯ, ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕВОДОВ». ЗАНЯТИЕ 4. БИОГЕННЫЕ АМИНЫ. АМИНОСПИРТЫ. АМИДЫ КИСЛОТ. АМИНОКИСЛОТЫ. КЛАССИФИКАЦИЯ, ИЗОМЕРИЯ, НОМЕНКЛАТУРА И ХИМИЧЕСКИЕ СВОЙСТВА. 1. ПРАКТИЧЕСКАЯ ЧАСТЬ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Химические свойства алифатических и ароматических аминов. 2.2. Обнаружение карбоксильной группы в аминокислоте. 2.3. Отличие аминокислот от амидов кислот по их способности к гидролизу. 2.4. Свойства мочевины. 3. УИРС «НЕЗАМЕНИМЫЕ АМИНОКИСЛОТЫ И ИХ РОЛЬ В ОРГАНИЗМЕ» ЗАНЯТИЕ 5. ПЕПТИДНАЯ СВЯЗЬ. ДИ-, ТРИ-, ПОЛИПЕПТИДЫ. СТРОЕНИЕ, ФОРМЫ ОРГАНИЗАЦИИ БЕЛКОВОЙ МОЛЕКУЛЫ. 1. ПРАКТИЧЕСКАЯ ЧАСТЬ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Качественная реакция на белок. 2.2. Действие растворов формалина и фенола на белки. 3. КОНТРОЛЬНАЯ РАБОТА: АМИНЫ, АМИДЫ, АМИНОКИСЛОТЫ. ПЕПТИДЫ И БЕЛКИ. ЗАНЯТИЕ 6. ФИЗИОЛОГИЧЕСКИ АКТИВНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ. СТРОЕНИЕ, АРОМАТИЧНОСТЬ И ХИМИЧЕСКИЕ СВОЙСТВА 5-ТИ И 6-ТИ ЧЛЕННЫХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ С ОДНИМ И ДВУМЯ ГЕТЕРОАТОМАМИ. 1. ПРАКТИЧЕСКАЯ ЧАСТЬ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Исследование свойств пиридина. 2.2. Реакции обнаружения производных фурана – фурацилина, фурадонина. 2.3. Реакция обнаружения производных пиразолона – анальгетиков (антипирина, амидопирина, анальгина, бутадиона). 2.4. Реакция открытия мочевой кислоты. 2.5. Извлечение, очистка, экстракция в аппарате Сокслета (демонстрация). ЗАНЯТИЕ 7. НУКЛЕИНОВЫЕ КИСЛОТЫ. ПЕРВИЧНАЯ СТРУКТУРА РНК И ДНК. НУКЛЕОЗИДЫ И НУКЛЕОТИДЫ. АТФ. ОТНОШЕНИЕ К ГИДРОЛИЗУ. 1. ПРАКТИЧЕСКАЯ ЧАСТЬ. 2. КОНТРОЛЬНАЯ РАБОТА «БИОЛОГИЧЕСКИ АКТИВНЫЕ ГЕТЕРОЦИКЛЫ. НУКЛЕИНОВЫЕ КИСЛОТЫ». ЛИТЕРАТУРА: 1. Биоорганическая химия: учебник / Н.А. Тюкавкина, Ю.И. Бауков, С.Э. Зурабян. –М.: ГЭОТАР-Медиа, 2009.– 416 с. 2. Руководство к лабораторным работам по биоорганической химии: пособие для вузов / Н.Н. Артемьева, В.Л. Белобородов, С.Э. Зурабян и др.; под ред. Н.А. Тюкавкиной –М.: ГЭОТАР-Медиа, 2009.– 318 с. 3. Методические разработки к лабораторно-практическим занятиям по биоорганической химии / сост. А. С. Гордецов (и др.). – Н. Новгород: Издательство НижгГМА, 2009 – 97 с. КАЛЕНДАРНЫЙ ПЛАН ЛЕКЦИЙ ПО ОБЩЕЙ И БИООРГАНИЧЕСКОЙ ХИМИИ НА II СЕМЕСТР 2015/2016 УЧЕБНОГО ГОДА ДЛЯ СТОМАТОЛОГИЧЕСКОГО ФАКУЛЬТЕТА № ДАТА ТЕМА ЛЕКЦИИ 1. 01.02.16 УГЛЕВОДЫ. МОНО-, ДИ-, 2. 15.02.16 ПОЛИ- И ГЕТЕРОСАХАРИДЫ. 2. 29.02.16 АМИНЫ. АМИНОКИСЛОТЫ. 3. 14.03.16 ПЕПТИДЫ. БЕЛКИ. 4. 28.03.16 БИОЛОГИЧЕСКИ АКТИВНЫЕ ГЕТЕРОЦИКЛЫ. 5. 11.05.16 6. 25.05.16 НУКЛЕИНОВЫЕ ОСНОВАНИЯ. НУКЛЕИНОВЫЕ КИСЛОТЫ. 7. 23.05.16 НЕОМЫЛЯЕМЫЕ ЛИПИДЫ Заведующий кафедрой общей химии, профессор /Гордецов А.С./ УЧЕБНЫЙ ПЛАН ЛАБОРАТОРНО – ПРАКТИЧЕСКИХ ЗАНЯТИЙ ПО ОБЩЕЙ И БИООРГАНИЧЕСКОЙ ХИМИИ НА II СЕМЕСТР ДЛЯ СТУДЕНТОВ I КУРСА СТОМАТОЛОГИЧЕСКОГО ФАКУЛЬТЕТА. ЗАНЯТИЕ 1. ГЕТЕРОФУНКЦИОНАЛЬНЫЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ. ОПТИЧЕСКАЯ ИЗОМЕРИЯ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 2. Лабораторная работа. Открытие молочной кислоты в растворе. Получение кислой и средней соли винной кислоты. Определение спиртовых групп в винной кислоте и ее солях. Качественные реакции этилового спирта ацетоуксусной кислоты. Сравнительные реакции FeCl3 с фенолом, салициловой кислотой и ее эфирами. ЗАНЯТИЕ 2. УГЛЕВОДЫ. МОНОСАХАРИДЫ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 2. Лабораторная работа. 2.1. Доказательство многоатомности моносахаридов. 2.2. Восстанавливающие свойства моносахаридов. 2.3. Качественные реакции на пентозу, фруктозу. ЗАНЯТИЕ 3. УГЛЕВОДЫ. ДИ- И ПОЛИСАХАРИДЫ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Изучение восстанавливающей способности ди- и полисахаридов. 2.2. Гидролиз сахарозы и крахмала. 2.3. Доказательство многоатомности дисахаридов. 2.4. Качественная реакция на полисахариды. 3. КОЛЛОКВИУМ. «Углеводы». ЗАНЯТИЕ 4. АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ. Амины. Аминокислоты. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 2. ЛАБОРАТОРНАЯ РАБОТА Химические свойства алифатических и ароматических аминов. Обнаружение карбоксильной группы в аминокислоте. Отличие аминокислот от амидов кислот по их способности к гидролизу. Свойства мочевины. ЗАНЯТИЕ 5. АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ. ПЕПТИДЫ. БЕЛКИ. 1. КОНТРОЛЬНАЯ РАБОТА: «Азотсодержащие органические соединения». ЗАНЯТИЕ 6. БИОЛОГИЧЕСКИ АКТИВНЫЕ ГЕТЕРОЦИКЛЫ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Исследование свойств пиридина. 2.2. Реакция обнаружения производных фурана – фурациллина, фурадонина. 2.3. Реакция обнаружения производных пиразолона – нанальгетиков (антипирина, амдопирина, анальгина, бутадиона). 2.4. Реакция открытия мочевой кислоты. ЗАНЯТИЕ 7. БИОЛОГИЧЕСКИ АКТИВНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ. НУКЛЕИНОВЫЕ ОСНОВАНИЯ. НУКЛЕОЗИДЫ И НУКЛЕОТИДЫ. НУКЛЕИНОВЫЕ КИСЛОТЫ. ПЕРВИЧНАЯ СТРУКТУРА РНК И ДНК. ОТНОШЕНИЕ К ГИДРОЛИЗУ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 2. КОНТРОЛЬНАЯ РАБОТА: «Гетероциклические соединения. Нуклеиновые кислоты и основания». ЛИТЕРАТУРА. Основная: 1. Тюкавкина Н.А. Биорганическая химия: учебник для вузов / Н.А.Тюкавкина, Ю.И.Бауков - М.:Дрофа, 2005, - 542с. 2009 (131 экз) 2. Руководство к лабораторным занятиям по биорганической химии: пособие для Вузов/ под ред. Н.А.Тюкавкиной. – М.: Дрофа, 2009 – 318с. Дополнительная: 1. Методические разработки к лабораторно-практическим занятиям по биоорганической химии. Н.Новгород: Изд-во НГМА, 2009 - 80с. КАЛЕНДАРНЫЙ ПЛАН ЛЕКЦИЙ ПО ХИМИИ НА ВЕСЕННИЙ СЕМЕСТР 2015/2016 УЧЕБНОГО ГОДА ДЛЯ ЛЕЧЕБНОГО ФАКУЛЬТЕТОВ № 1 ДАТА 24.02.16 ср 26.02.16 пт 2 09.03.16 ср 11.03.16 пт 3 23.03.16 ср 25.03.16 пт 4 5 6 7 06.04.16 ср 08.04.16 пт 20.04.16 ср 22.04.16 пт 11.05.16 ср 13.05.16 пт 25.05.16 ср 27.05.16 пт ТЕМА ЛЕКЦИИ Теория строения органических соединений А.М.Бутлерова. Сравнение реакционной способности алифатических и ароматических углеводородов. Монофункциональные органические соединения. (спирты, фенолы, альдегиды, кетоны) Карбоновые кислоты. Липиды. Углеводы. Моно-, ди-, полисахаридлы. Аминокислоты. Пептиды и белки. Биологически активные гетероциклические соединения. Нуклеиновые кислоты. Зав.кафедрой общей химии, профессор ______________________ /Гордецов А.С./ КАЛЕНДАРНЫЙ ПЛАН ЛЕКЦИЙ ПО ХИМИИ НА ВЕСЕННИЙ СЕМЕСТР 2015/2016 УЧЕБНОГО ГОДА ДЛЯ ПЕДИАТРИЧЕСКОГО ФАКУЛЬТЕТА № 1 2 ДАТА 03.02.16 ср 17.02.16 ср ТЕМА ЛЕКЦИИ Теория строения органических соединений А.М.Бутлерова. Сравнение реакционной способности алифатических и ароматических углеводородов. 02.03.16 ср Монофункциональные органические соединения. (спирты, фенолы, альдегиды, кетоны) Карбоновые кислоты. 16.03.16 ср Липиды. Углеводы. Моно-, ди-, полисахаридлы. 5 30.03.16 ср Аминокислоты. Пептиды и белки. 6 11.05.16 ср Биологически активные гетероциклические соединения. 3 4 7 25.05.16 ср Нуклеиновые кислоты. Зав.кафедрой общей химии, профессор ______________________ /Гордецов А.С./ УЧЕБНЫЙ ПЛАН ЛАБОРАТОРНО – ПРАКТИЧЕСКИХ ЗАНЯТИЙ ПО ХИМИИ НА II СЕМЕСТР 2015/2016 УЧЕБНОГО ГОДА ДЛЯ СТУДЕНТОВ I КУРСА ЛЕЧЕБНОГО И ПЕДИАТРИЧЕСКОГО ФАКУЛЬТЕТОВ. ЗАНЯТИЕ 1. ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕОРИИ СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. КЛАССИФИКАЦИЯ. НОМЕНКЛАТУРА. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ОРГАНИЧЕСКИХ МОЛЕКУЛ. ИЗОМЕРИЯ. 2.1. 1.1. 1.2. 2. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ Электронное строение атома углерода и характеристика связей С–С, С=С, С≡С, С–Н. Пространственное строение, конфигурации, конформации, изомерия органических молекул. Виды изомерии (упражнения в построении моделей молекул). ЛАБОРАТОРНАЯ РАБОТА. Получение алкана и изучение его свойств (демонстрация). Занятие 2. Взаимное влияние атомов в молекулах электронные эффекты заместителей. Сопряженные системы с открытой цепью. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 1.1. Химическая стойкость алканов. Механизм радикального замещения (SR). 1.2. Способность к окислению и электрофильному присоединению (АЕ) алкенов. 2. ЛАБОРАТОРНАЯ РАБОТА. По названию данного углеводорода изобразить структуру, возможные изомеры и изучить его химические свойства. ЗАНЯТИЯ 3. СОПРЯЖЕННЫЕ СИСТЕМЫ С ЗАМКНУТОЙ ЦЕПЬЮ. АРОМАТИЧНОСТЬ. ТЕРПЕНЫ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 1.1. Термодинамическая устойчивость ароматических соединений. Критерии ароматичности. 1.2. Реакции электрофильного замещения (SE). 1.3. Терпены. 2.ЛАБОРАТОРНАЯ РАБОТА. 2.1. 2.2. 2.3. Сравнительные реакции окисления ароматических углеводородов. Окисление нафталина. Окисление и доказательство ненасыщаемости терпенов. ЗАНЯТИЕ 4. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ СТРОЕНИЯ, ИЗОМЕРИИ И РЕАКЦИОННОЙ СПОСОБНОСТИ УГЛЕВОДОРОДОВ. 1. КОЛЛОКВИУМ. 2. ЛАБОРАТОРНАЯ РАБОТА. Получение, обнаружение и испытание хлороформа на чистоту. ЗАНЯТИЕ 5. КИСЛОТНО – ОСНОВНЫЕ СВОЙСТВА СПИРТОВ, ФЕНОЛОВ, ТИОЛОВ, АМИНОВ И ИХ ПРОИЗВОДНЫХ. МЕХАНИЗМ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ (SN). 1. ПРОГРАММИРОВАННЫЙ КОНТРОЛЬ. 2.ЛАБОРАТОРНАЯ РАБОТА. 2.1. 2.2. 2.3. 2.4. Получение н – пропилового спирта. Изучение свойств одноатомных спиртов ациклического и циклического ряда. Многоатомные спирты. Доказательство многоатомности спиртов. Изучение свойств ароматического кольца фенола, фенольного гидроксила и их взаимного влияния. ЗАНЯТИЕ 6. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ. ЭЛЕКТРОННОЕ СТРОЕНИЕ И ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ОКСОГРУПП. БИОЛОГИЧЕСКИ ВАЖНЫЕ РЕАКЦИИ АЛЬДЕГИДОВ И КЕТОНОВ. МЕХАНИЗМ НУКЛЕОФИЛЬНОГО ПРИСОЕДИНЕНИЯ (AN). 1. ПРОГРАММИРОВАННЫЙ КОНТРОЛЬ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1.Сравнительное изучение свойств альдегидов и кетонов. 2.2. Дезинфицирующее действие формалина. ЗАНЯТИЕ 7. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ. 1. ПРОГРАММИРОВАННЫЙ КОНТРОЛЬ. 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Химические свойства предельных и непредельных одноосновных и многоосновных карбоновых кислот. 2.2. Реакция получения сложного уксусноамилового эфира (демонстрация). ЗАНЯТИЕ 8. ОМЫЛЯЕМЫЕ ЛИПИДЫ. ЕСТЕСТВЕННЫЕ ЖИРЫ КАК СМЕСИ ТРИАЦИЛГЛИЦЕРИНОВ. ФОСФАТИДНАЯ КИСЛОТА. ФОСФОЛИПИДЫ – СТРУКТУРНЫЕ КОМПОНЕНТЫ КЛЕТОЧНЫХ МЕМБРАН. 1.ПРОГРАММИРОВАННЫЙ КОНТРОЛЬ. 2.ЛАБОРАТОРНАЯ РАБОТА. Гидролиз жира под действием щелочи и анализа продуктов гидролиза. ЗАНЯТИЕ 9. ГЕТЕРОФУНКЦИОНАЛЬНЫЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ. СТЕРЕОИЗОМЕРИЯ. ХИРАЛЬНЫЕ МОЛЕКУЛЫ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 1.1.Строение, стереоизомерия и реакционная способность окси-, кето-, альдегидо-, фенолокислот. 4. ЛАБОРАТОРНАЯ РАБОТА. 4.1. Открытие молочной кислоты в растворе. 4.2. Получение кислой и средней соли винной кислоты. 4.3. Определение спиртовых групп в винной кислоте и ее солях. 4.4. Качественные реакции этилового эфира ацетоуксусной кислоты. 4.5. Сравнительные реакции FeCl3 с фенолом, салициловой кислотой и ее эфирами. 4.6. Разложение лимонной кислоты. ЗАНЯТИЕ 10. УГЛЕВОДЫ. КЛАССИФИКАЦИЯ УГЛЕВОДОВ. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ. МОНОСАХАРИДЫ. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 1.1.Строение, изомерия и химические свойства моносахаридов. 5. ЛАБОРАТОРНАЯ РАБОТА. 5.1. Доказательство многоатомности моносахаридов. 5.2. Восстанавливающие свойства моносахаридов. 2.3. Качественные реакции на кетогексозы и пентозы. ЗАНЯТИЕ 11. УГЛЕВОДЫ. ДИСАХАРИДЫ. ГОМО- И ГЕТЕРОПОЛИ-САХАРИДЫ. 4. КОНТРОЛЬНАЯ РАБОТА «СТРОЕНИЕ, ИЗОМЕРИЯ, ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕВОДОВ». 5. ЛАБОРАТОРНАЯ РАБОТА. 5.1. Изучение восстанавливающей способности ди- и полисахаридов. 5.2. Гидролиз сахарозы и крахмала. 5.3. Качественная реакция на полисахариды. ЗАНЯТИЕ 12. БИОГЕННЫЕ АМИНЫ. АМИНОСПИРТЫ. АМИДЫ КИСЛОТ. АМИНОКИСЛОТЫ. КЛАССИФИКАЦИЯ, ИЗОМЕРИЯ, НОМЕНКЛАТУРА И ХИМИЧЕСКИЕ СВОЙСТВА. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 2. лабораторная работа. Химические свойства алифатических и ароматических аминов. Обнаружение карбоксильной группы в аминокислоте. Отличие аминокислот от амидов кислот по их способности к гидролизу. Свойства мочевины. ЗАНЯТИЕ 13. ПЕПТИДНАЯ СВЯЗЬ. ДИ-, ТРИ-, ПОЛИПЕПТИДЫ. СТРОЕНИЕ, ФОРМЫ ОРГАНИЗАЦИИ БЕЛКОВОЙ МОЛЕКУЛЫ. 3. КОЛЛОКВИУМ. 4. ЛАБОРАТОРНАЯ РАБОТА. 4.1. Качественная реакция на пептидную связь. 4.2. Действие растворов формалина и фенола на белки. ЗАНЯТИЕ 14.ФИЗИОЛОГИЧЕСКИ АКТИВНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ. СТРОЕНИЕ, АРОМАТИЧНОСТЬ И ХИМИЧЕСКИЕ СВОЙСТВА 5-ТИ И 6-ТИ ЧЛЕННЫХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ С ОДНИМ ГЕТЕРОАТОМОМ. 3. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 4. ЛАБОРАТОРНАЯ РАБОТА. 4.1. Исследование свойств пиридина. 4.2. Реакции обнаружения производных фурана – фурацилина, фурадонина. ЗАНЯТИЕ 15. БИОЛОГИЧЕСКИ АКТИВНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ С ДВУМЯ ГЕТЕРОАТОМАМИ. ВАЖНЕЙШИЕ ПРОИЗВОДНЫЕ ПИРИМИДИНА И ПУРИНА. 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 2. ЛАБОРАТОРНАЯ РАБОТА. 2.1. Реакция обнаружения производных пиразолона – анальгетиков (антипирина, амидопирина, анальгина, бутадиона). 2.2. Реакция открытия мочевой кислоты. ЗАНЯТИЕ 16. НУКЛЕИНОВЫЕ КИСЛОТЫ. ПЕРВИЧНАЯ СТРУКТУРА РНК И ДНК. НУКЛЕОЗИДЫ И НУКЛЕОТИДЫ. АТФ. ОТНОШЕНИЕ К ГИДРОЛИЗУ. КОНТРОЛЬНАЯ РАБОТА ЗАНЯТИЕ 17. ЗАЧЕТ. ЛИТЕРАТУРА: 1. Биоорганическая химия. Учебник. (Тюкавкина Н.А., Бауков Ю.И.). 7 изд., 543 с. Дрофа, 2008. 2. Руководство к лабораторным занятиям по биоорганической химии. Под ред. тюкавкиной Н.А., М.: Медицина, 1999. 320с. 3. Методические разработки к лабораторно-практическим занятиям по биоорганической химии. Н.Новгород: Изд-во НГМА, 2009.80 с. ДОПОЛНИТЕЛЬНАЯ: Органическая химия: Учеб. Для вузов: в 2 книгах. Под ред. Тюкавкиной Н.А. – М.: Дрофа, 2002. – Кн. 1: Основной курс. – 640с. Райлс А., Смит К., Уорд Р. Основы органической химии (для студентов биологических, медицинских и сельскохозяйственных специальностей.). М.: Мир, 1983. – 352с. ГРАФИК ДЕЖУРСТВА ПРЕПОДАВАТЕЛЕЙ НА ОТРАБОТКАХ – КОНСУЛЬТАЦИЯХ НА II СЕМЕСТР 2015/2016 УЧЕБНОГО ГОДА ЛАБОРАТОРИЯ № 15 Дни проведения – ВТОРНИК, ЧЕТВЕРГ 15.30 – 17.00 ДАТА ДЕЖУРНЫЙ ДАТА ДЕЖУРНЫЙ ПРЕПОДАВАТЕЛЬ ПРЕПОДАВАТЕЛЬ 03.03.16 чт. ЖДАНОВИЧ И.В. 10.03.16 чт ПИСКУНОВА М.С. 15.03.16 вт ЖДАНОВИЧ И.В. 31.05.16 ПИСКУНОВА 17.03.16 чт КРАСНИКОВА О.В. 19.05.16 КОНДРАШИНА 22.03.16 вт ЗИМИНА С.В. 24.03.16 чт МОСЕЕВА Е.М. 29.03.16 вт МЕДВЕДЕВА О.А. 31.03.16 чт ВДОВИЧЕВА В.В. 07.04.16 ЗИМИНА С.В. 05.04.16 вт ПИСКУНОВА М.С. 19.04.16 ЖДАНОВИЧ И.В. 07.04.16 чт ЗИМИНА С.В. 12.04.16 вт КРАСНИКОВА О.В. 14.04.16 чт НОВИКОВА А.Н. 10.05.16 КОНДРАШИНА О.В. 19.04.16 вт ЖДАНОВИЧ И.В. 26.05.16 КОНДРАШИНА О.В. 21.04.16 чт ВДОВИЧЕВА В.В. 24.03.16 МОСЕЕВА Е.М. 26.04.16 вт НОВИКОВА А.Н. 28.04.16 чт КРАСИЛЬНИКОВА Е.В. 05.05.16 чт КРАСИЛЬНИКОВА Е.В. 10.05.16 вт КРАСНИКОВА О.В. 12.05.16 чт ЛИНЕВА А.Н. 17.05.16 вт КРАСИЛЬНИКОВА Е.В. 19.05.16 чт КОНДРАШИНА О.В. 24.05.16 вт НОВИКОВА А.Н. 26.05.16 чт ВДОВИЧЕВА В.В. 31.05.16 вт ПИСКУНОВА М.С. 02.06.16 чт ЛИНЕВА А.Н. 07.06.16 вт КРАСНИКОВА О.В. 09.06.16.чт МЕДВЕДЕВА О.А. ЗАВ.КАФ.ОБЩЕЙ ХИМИИ, ПРОФ. Аналитическая химия Органическая химия Физическая химия ГОРДЕЦОВ План практических занятий по органической химии для студентов II курса фармацевтического факультета на весенний семестр IV семест р 1. Введение в органической синтез. Лабораторные методы выделения, очистки и идентификации органических соединений. 4.42 2.Карбоновые кислоты и их функциональные производные [продолжение и углубление занятия 15 (3 семестр)]. 4.42 3.Галогено-, гидрокси- и оксокислоты 4.42 4. Аминокислоты. 5.Контрольная работа №5 "Карбоновые (моно-, ди- и гетерофункциональные) кислоты". 4.42 4.42 6.Получение бензойной кислоты. 4.42 7. Получение ацетона. 4.42 8. Получение бромистого этила. 9. Моносахариды. 4.42 4.42 10.Олиго- и полисахариды. 4.42 11.Пятичленные гетероциклические соединения. 12.Шестичленные гетероциклы. 4.42 4.42 13.Конденсированные гетероциклы. Алкалоиды. 4.42 14.Контрольная работа №6. "Гетероциклические соединения". 4.42 15.Нуклеотиды. Нуклеозиды. 4.42 16. Терпеноиды. 4.42 17. Стероиды. 4.42 18.Контрольная работа №7. 4.42 "Нуклеозиды, нуклеотиды, омыляемые и неомыляемые липиды". 19.Защита рефератов. Решение типовых комплексных задач. 4.42