11 класс Тема «Кислоты» Литература: О.С. Габриелян. Химия 11
advertisement
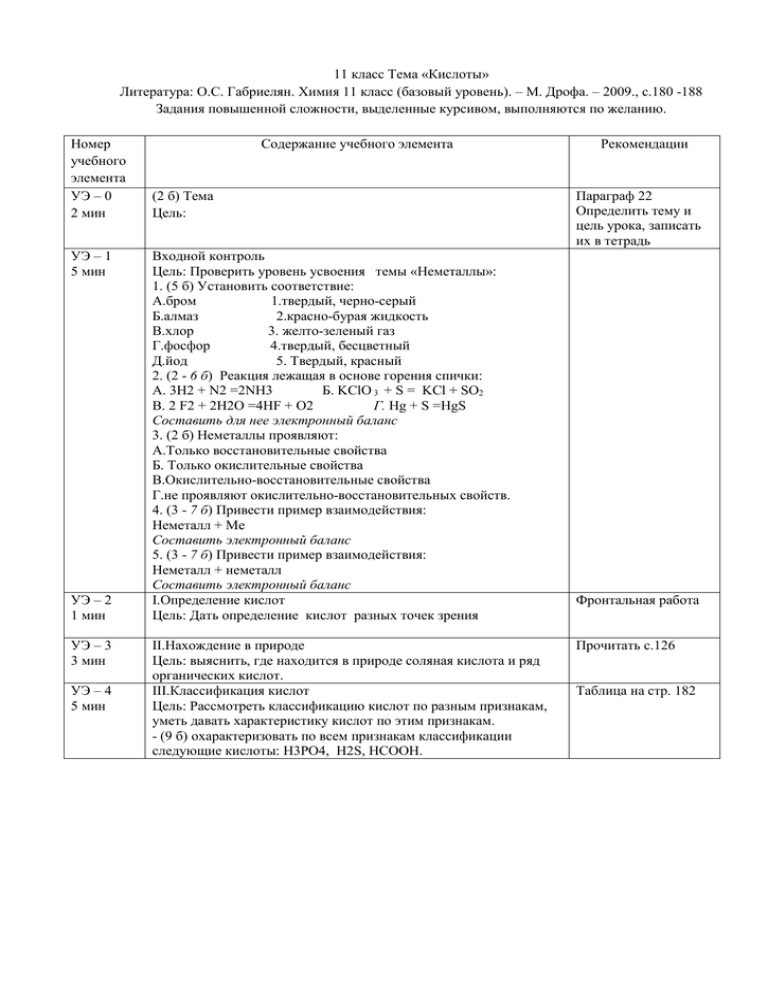
11 класс Тема «Кислоты» Литература: О.С. Габриелян. Химия 11 класс (базовый уровень). – М. Дрофа. – 2009., с.180 -188 Задания повышенной сложности, выделенные курсивом, выполняются по желанию. Номер учебного элемента УЭ – 0 2 мин УЭ – 1 5 мин УЭ – 2 1 мин УЭ – 3 3 мин УЭ – 4 5 мин Содержание учебного элемента (2 б) Тема Цель: Входной контроль Цель: Проверить уровень усвоения темы «Неметаллы»: 1. (5 б) Установить соответствие: А.бром 1.твердый, черно-серый Б.алмаз 2.красно-бурая жидкость В.хлор 3. желто-зеленый газ Г.фосфор 4.твердый, бесцветный Д.йод 5. Твердый, красный 2. (2 - 6 б) Реакция лежащая в основе горения спички: А. 3Н2 + N2 =2NH3 Б. KClO 3 + S = KCl + SO2 В. 2 F2 + 2H2O =4HF + O2 Г. Hg + S =HgS Составить для нее электронный баланс 3. (2 б) Неметаллы проявляют: А.Только восстановительные свойства Б. Только окислительные свойства В.Окислительно-восстановительные свойства Г.не проявляют окислительно-восстановительных свойств. 4. (3 - 7 б) Привести пример взаимодействия: Неметалл + Ме Составить электронный баланс 5. (3 - 7 б) Привести пример взаимодействия: Неметалл + неметалл Составить электронный баланс I.Определение кислот Цель: Дать определение кислот разных точек зрения II.Нахождение в природе Цель: выяснить, где находится в природе соляная кислота и ряд органических кислот. III.Классификация кислот Цель: Рассмотреть классификацию кислот по разным признакам, уметь давать характеристику кислот по этим признакам. - (9 б) охарактеризовать по всем признакам классификации следующие кислоты: Н3РО4, Н2S, HCOOH. Рекомендации Параграф 22 Определить тему и цель урока, записать их в тетрадь Фронтальная работа Прочитать с.126 Таблица на стр. 182 УЭ – 5 22 мин УЭ – 6 5 мин IV.Химические свойства Цель: Обобщить знания о химических свойствах неорганических и органических кислот, некоторые из них подтвердить путем проведения эксперимента. (Лабораторная работа) 1.Диссоциация. Действие на индикаторы -(4 б) записать уравнение диссоциации (распад на ионы) соляной и уксусной кислот - Л.Р. (соблюдать осторожность при работе с кислотами) (3 б) проверить действие трех индикаторов (фенолфталеин, метилоранж, лакмус) на кислоты на примере уксусной кислоты, записать результаты 2.Взаимодействие с металлами - (2 б) Записать, как реагируют азотная и концентрированная серная кислота с металлами. -(2 – 5 б) дописать реакцию, составить электронный баланс и уравнять: Zn + k.H2SO4 = SO2 +….. + ….. 3.Взаимодействие с оксидами металлов - Л.Р. (соблюдать осторожность при работе с кислотами и спиртовкой) (3 б) провести реакцию между оксидом меди и соляной кислотой, записать уравнение реакции в молекулярном виде. 4. Взаимодействие с гидроксидами металлов - Л.Р. (соблюдать осторожность при работе с кислотами и щелочами) А. (3 - 4 б) к содержимому пробирки, в которой находится уксусная кислота с лакмусом (или метилоранжем) прилить гидроксид натрия, записать уравнение реакции в молекулярном и ионном видах Б. (4 - 5 б) получить гидроксид меди (слить хлорид меди со щелочью) и добавить к нему соляную кислоту, записать уравнение реакции между гидроксидом меди и соляной кислотой в молекулярном и ионном видах. 5. Взаимодействие с солями - (2 б) Что должно образовываться в этих реакциях? - Л.Р. (соблюдать осторожность при работе с кислотами) -(2 б) провести качественную реакцию на хлорид-ион, записать уравнение реакции только в ионном виде - (3 - 4 б) провести качественную реакцию на карбонат-ион, записать уравнение реакции в молекулярном и ионном виде 6.Взаимодействие со спиртами -(2 б) записать реакцию этерификации между этиловым спиртом и азотной кислотой. Выходной контроль Цель: Проверка понимания и осмысления новых знаний. 1. (2 б) В желудке содержится: А.серная кислота б.соляная В.фосфорная г.уксусная 2. (2 б) Муравьиная кислота не содержится в: А. крапиве б.муравьях В.медузах г. щавеле 3. (2 б) В клюквенном соке можно хранить свежее мясо, т. к она содержит кислоту: А.серную б.соляную В.бензойную г.уксусную 4. (4 б) Установить соответствие А.HCl 1.двухосновная, нелетучая, растворимая, Парная работа Перед выполнением лабораторной работы рассказать учителю о ТБ При необходимости проконсультироваться у учителя, результаты опыта показать учителю С.167-168 С.183 С.184 рис. 130 с.184-185 С.185 Рис.132 Рис.133 (б) С.186-187 УЭ – 7 2 мин стабильная Б.H2SO4 2.одноосновная, летучая, сильная, бескислородная В. H2SiO3 3. двухосновная, нелетучая, нерастворимая, нестабильная Г.H2CO3 4. двухосновная, нелетучая, растворимая, нестабильная 5. (2 б) С группой каких веществ будет реагировать разбавленная серная кислота: А. Cu, CuO, Cu(OH)2, BaCl2 Б. Mg, CuO, Cu(OH)2, BaCl2 B. Mg, CuO, Cu(OH)2, AgNO3 Г. Mg, CO2, Cu(OH)2, BaCl2 Цель: осуществить самооценку работы на уроке Проверьте правильность выполнения вашей работы по контрольному листу. Сосчитайте общее количество баллов и поставьте оценку 27 – 52 баллов – «3» 53 - 70 баллов –«4» 71 -81 баллов – «5» Спасибо за работу! Контрольный лист Тема «Кислоты» УЭ – 1 5 мин УЭ – 4 5 мин УЭ – 5 22 мин Входной контроль 1. (5 б) Установить соответствие: А.2 Б.4 В.3 Г.5 Д.1 2. (2 - 6 б) Реакция лежащая в основе горения спички: Б. 2KCl+5 O 3 +3 S0 = 2KCl-1 +3 S+4 O2 Cl+5 + 6е = Cl-1, ок-ль 2 S0 – 4 е = S+4, в-ль 3 3. (2 б) Неметаллы проявляют: В.Окислительно-восстановительные свойства 4. (3 - 7 б) Привести пример взаимодействия: (один из вариантов) Hg0 + S0 =Hg 2+S2Hg0 – 2e = Hg 2+ (в-ль) S0 + 2е = S2- (о-ль) 5. (3 - 7 б) Привести пример взаимодействия: (один из вариантов) 2 P0 +3 Cl02 = 2P+3 Cl-3 P0 – 3e = P+3 Cl02 + 2e = 2 ClIII.Классификация кислот - (9 б) охарактеризовать по всем признакам классификации следующие кислоты: Н3РО4 – кислородсодержащая, трехосновная, растворимая, нелетучая, слабая, стабильная; Н2S – бескислородная , двухосновная, растворимая, летучая, слабая, стабильная; HCOOH - кислородсодержащая, одноосновная, растворимая, летучая, слабая, стабильная. IV.Химические свойства 1.Диссоциация. Действие на индикаторы -(4 б) HCl = H+ + ClCH3COOH = CH3COO- + H+ - (3 б) фенолфталеин – не меняет окраску; Метилоранж – становится красным (розовым); Лакмус - становится красным (розовым). 2.Взаимодействие с металлами УЭ – 6 5 мин - (2 б) Со всеми металлами, с образованием трех продуктов (соль, сода, продукт азота (серы) -(2 – 5 б) дописать реакцию, составить электронный баланс и уравнять: Zn0 +2 k.H2S+6 O4 = S +4O2 +2Н2О + Zn+2 SO4 Zn0 – 2e = Zn+2,в-ль S+6 + 2e = S +4, о-ль 3.Взаимодействие с оксидами металлов - (3 б).CuO + 2HCl = CuCl2 + H2O 4. Взаимодействие с гидроксидами металлов А. (3 - 4 б) CH3COOH + NaOH = CH3COONa + H2 CH3COOH + OH- = CH3COO- + H2 Б. (4 - 5 б) получить гидроксид меди (слить хлорид меди со щелочью) и добавить к нему соляную кислоту, записать уравнение реакции между гидроксидом меди и соляной кислотой в молекулярном и ионном видах. 2HCl + Cu(OH)2 = CuCl2 +2 H2O 2H+ + Cu(OH)2 = Cu2+ + 2 H2O 5. Взаимодействие с солями - (2 б) осадок или газ -(2 б) Ag+ + Cl- = AgCl - (3 - 4 б) провести качественную реакцию на карбонат-ион, записать уравнение реакции в молекулярном и ионном виде Na2CO3 + 2HCl =2 NaCl + H2O + CO2 6.Взаимодействие со спиртами -(2 б).C2H5OH +HO-NO2 = C2H5ONO2 + H2O Выходной контроль 1. (2 б) В желудке содержится: б.соляная 2. (2 б) Муравьиная кислота не содержится в: г. щавеле 3. (2 б) В клюквенном соке можно хранить свежее мясо, т. к она содержит кислоту: В.бензойную 4. (4 б) Установить соответствие А.2 Б.1 В.3 Г.4 5. (2 б) С группой каких веществ будет реагировать разбавленная серная кислота: Б. Mg, CuO, Cu(OH)2, BaCl2





