по общей и неорганической химии в 11
advertisement
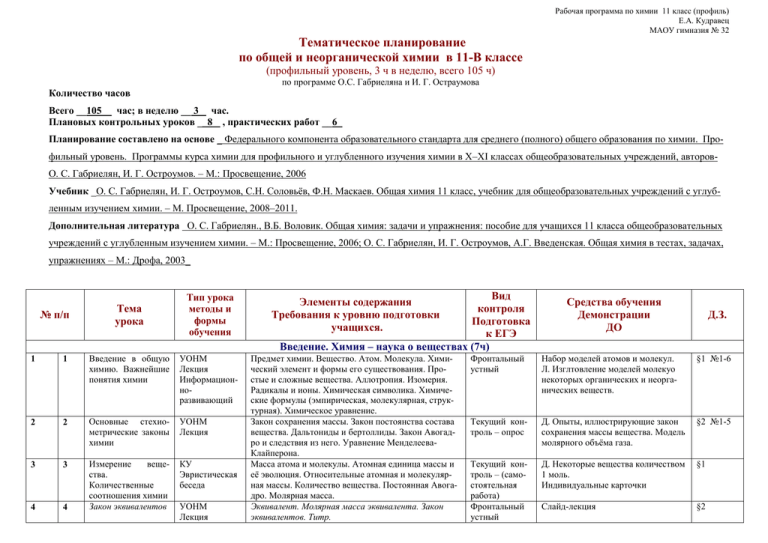
Рабочая программа по химии 11 класс (профиль) Е.А. Кудравец МАОУ гимназия № 32 Тематическое планирование по общей и неорганической химии в 11-В классе (профильный уровень, 3 ч в неделю, всего 105 ч) по программе О.С. Габриеляна и И. Г. Остраумова Количество часов Всего __105__ час; в неделю __ 3 час. Плановых контрольных уроков _ 8 , практических работ __6_ Планирование составлено на основе _ Федерального компонента образовательного стандарта для среднего (полного) общего образования по химии. Профильный уровень. Программы курса химии для профильного и углубленного изучения химии в X–XI классах общеобразовательных учреждений, авторовО. С. Габриелян, И. Г. Остроумов. – М.: Просвещение, 2006 Учебник _О. С. Габриелян, И. Г. Остроумов, С.Н. Соловьёв, Ф.Н. Маскаев. Общая химия 11 класс, учебник для общеобразовательных учреждений с углубленным изучением химии. – М. Просвещение, 2008–2011. Дополнительная литература О. С. Габриелян., В.Б. Воловик. Общая химия: задачи и упражнения: пособие для учащихся 11 класса общеобразовательных учреждений с углубленным изучением химии. – М.: Просвещение, 2006; О. С. Габриелян, И. Г. Остроумов, А.Г. Введенская. Общая химия в тестах, задачах, упражнениях – М.: Дрофа, 2003_ № п/п Тема урока Вид контроля Подготовка к ЕГЭ Введение. Химия – наука о веществах (7ч) Тип урока методы и формы обучения Элементы содержания Требования к уровню подготовки учащихся. Предмет химии. Вещество. Атом. Молекула. Химический элемент и формы его существования. Простые и сложные вещества. Аллотропия. Изомерия. Радикалы и ионы. Химическая символика. Химические формулы (эмпирическая, молекулярная, структурная). Химическое уравнение. Закон сохранения массы. Закон постоянства состава вещества. Дальтониды и бертоллиды. Закон Авогадро и следствия из него. Уравнение МенделееваКлайперона. Масса атома и молекулы. Атомная единица массы и её эволюция. Относительные атомная и молекулярная массы. Количество вещества. Постоянная Авогадро. Молярная масса. Эквивалент. Молярная масса эквивалента. Закон эквивалентов. Титр. 1 1 Введение в общую химию. Важнейшие понятия химии УОНМ Лекция Информационноразвивающий 2 2 Основные стехиометрические законы химии УОНМ Лекция 3 3 КУ Эвристическая беседа 4 4 Измерение вещества. Количественные соотношения химии Закон эквивалентов УОНМ Лекция Средства обучения Демонстрации ДО Д.З. Фронтальный устный Набор моделей атомов и молекул. Л. Изглтовление моделей молекуо некоторых органических и неорганических веществ. §1 №1-6 Текущий контроль – опрос Д. Опыты, иллюстрирующие закон сохранения массы вещества. Модель молярного объёма газа. §2 №1-5 Текущий контроль – (самостоятельная работа) Фронтальный устный Д. Некоторые вещества количеством 1 моль. Индивидуальные карточки §1 Слайд-лекция §2 Рабочая программа по химии 11 класс (профиль) Е.А. Кудравец МАОУ гимназия № 32 5 5 Смеси веществ. Массовая, объёмная и мольная доля компонентов смеси КУ Групповой Массовая доля. Объёмная доля газа в смеси. Мольная доля. Способы выражения состава растворов, особенности их применения и расчёты одного вида концентрации по другому. 6 7 6 7 Урок-практикум. Решение расчётных задач Контрольная работа №1 8 1 Строение атома. Изотопы УОНМ Лекция Частичнопоисковы. 9 2 Ядерные реакции 10 3 Состояние электрона в атоме. Квантовые числа. УОНМ Лекция Информационноразвивающий УОНМ Лекция Информационноразвивающий 11 4 Строение электронных оболочек атомов. Электроннографические формулы. УПЗУ Творческирепродуктивный Открытие Д.И.Менделеевым периодического закона. ПЗ и строение атома. УОНМ Лекция Информационноразвивающий Для закрепления темы: задачник – стр.5 №22-25 Д. Определение плотности растворов с помощью ареометров, определение объёма растворов с помощью мерной посуды. По тетради задачник – стр.5 №26-30 Тема 1. Строение атома. Периодический закон и ПСХЭ Д.И.Менделеева (9ч) 12 5 Атом – сложная частица. Ядро и электронная оболочка. Электроны, протоны и нейтроны. Макромир и микромир. Дуализм частиц микромира. Нуклоны и нуклиды. Изобары и изотопы. Знать современные представления о строении атомов. Знать важнейшие химические понятия: «химический элемент», «изотопы». Уметь определять состав и строение атома элемента по положению в ПС А-1 Ядерные реакции и их уравнения Для закрепления темы: задачник – стр.9 №1 Слайд-лекция http://imgfotki.yandex.ru/get/9/nanoworld.2/0_5 de3_f6a0c07e_L http://files.schoolcollection.edu.ru/dlrstore/bb14a024aae7-11db-abbd0800200c9a66/ch08_06_09.swf §3 №1-6 §4 №1-5 Для закрепления темы: задачник – стр.9 №2,3 Слайд-лекция http://www.physics.ru/courses/op25par t2/content/chapter6/section/paragraph8/ theory.html §4 №7,12 Электронное облако, электронная орбиталь. Энергетические уровни и подуровни. Максимальное число электронов на подуровнях и уровнях. Понятие о квантовых числах. Основные правила заполнения электронами энергетических уровней Знать сущность понятий «электронная орбиталь» и «электронное облако», формы орбиталей, взаимосвязь номера уровня и энергии электрона Правила заполнения энергетических уровней и орбиталей электронами. Принцип минимума энергии, запрет Паули, правило Хунда, правило Клечкоского. Электронные конфигурации атомов и ионов. Знать основные закономерности заполнения энергетических подуровней электронами. Уметь составлять электронные формулы атомов Предпосылки открытия ПЗ. Структура ПСХЭ. ПС и строение атома. Периодическое изменение свойств элементов. Знать физический смысл порядкового номера, номеров периода и группы. Уметь давать характеристику элемента на основании его расположения в ПС Фронтальный устный Для закрепления темы: задачник – стр.10 №7 Д. Модели орбиталей различной формы http://chemistry.ru/course/content/chap ter2/section/paragraph2/theory.html §5 №1-4 (5-8) Фронтальный устный Для закрепления темы: задачник – стр.11 №9-12. Слайд-лекция Упражнение на тренажёрах и алгоритмах Фронтальный устный Для закрепления темы: задачник – стр.11 №14-16 Слайд-лекция Д. Различные варианты таблиц ПСХЭ http://files.schoolcollection.edu.ru/dlrstore/3c96a890aae9-11db-abbd0800200c9a66/ch11_05_07.swf §6 №1-6 §7 №1-8 Рабочая программа по химии 11 класс (профиль) Е.А. Кудравец МАОУ гимназия № 32 13 6 Зависимость свойств элементов и соединений от их положения в периодической системе. Значение ПЗ. КУ Творческирепродуктивный Причины изменения металлических и неметаллических свойств элементов в группах и периодах. Знать смысл и значение Периодического закона, горизонтальные и вертикальные закономерности и их причины. А-2 Для закрепления темы: задачник – стр.12 №17-19 Индивидуальные карточки задачник – стр.12 №21 http://www .maratakm. ru/index2.f iles/a2.htm 14-15 16 7-8 9 Обобщение и систематизация знаний по теме (семинар) Контрольная работа №2 17 1 Химическая связь. Ионная связь УОНМ Лекция Эвристическая беседа Понятие химической связи. Виды химической связи. Аморфные и кристаллические вещества. Ионная химическая связь. Знать классификацию типов химической связи и характеристики каждого из них. А-5 Для закрепления темы: задачник – стр.14 №2 §8 №1-7 Лекция Эвристическая беседа Парная работа Метод валентных связей. Электроотрицательность. Механизмы образования и основные свойства ковалентной связи. Уметь определять геометрию молекулы по характеристикам хим. связей. А-5 Фронтальный устный Выполнение тестовых заданий. Металлическая связь КУ Творческирепродуктивный Особенности ковалентной связи. Уметь характеризовать свойства вещества, зная тип его кристаллической решетки А-5 А-7 Самостоятельная работа с раздаточным материалом Д. Модели ионных кристаллических и аморфных веществ и изделий из них http://schoolcollection.edu.ru/catalog/rubr/d05469af -69bd-11db-bd130800200c9c11/75922/?interface=pupil &class=54&subject=31 Д. Модели кристаллических веществ атомной и молекулярной структуры http://schoolcollection.edu.ru/catalog/rubr/d05469af -69bd-11db-bd130800200c9c11/75922/?interface=pupil &class=54&subject=31 Д. Модели кристаллических решёток металлов Индивидуальные карточки 18 2 Ковалентная связь 19 3 20 4 Водородная связь УОНМ Лекция Информационноразвивающий Текущий контроль – (самостоятельная работа) http://schoolcollection.edu.ru/catalog/rubr/d05469af -69bd-11db-bd130800200c9c11/75922/?interface=pupil &class=54&subject=31 §11 №1-5 http://www .maratakm. ru/index2.f iles/a5.htm 5 Комплексные соединения УОНМ Лекция Частичнопоисковы. Водородная связь и ее разновидности. Единая природа химических связей. Разные виды связи в одном веществе. Единая природа химических связей. Разные виды связи в одном веществе Уметь по формуле вещества предполагать тип связи, предсказывать тип крист. Решетки А-7 Понятие комплексного соединения. Координационная теория А.Вернера. Координационное число комплексообразователя. Классификация комплексных соединений и их номенклатура. Применение компл. соединений в химическом анализе, их роль в природе. 21 Фронтальный устный Для закрепления темы: стр.17, №2-6 Д. Получение комплексных соединений. Демонстрация сухих кристаллогидратов. §12 №1-7 Тема 2. Строение вещества (11ч) §9 №1-4 (5-9) §10 №1-5 §8 Рабочая программа по химии 11 класс (профиль) Е.А. Кудравец МАОУ гимназия № 32 22 6 23 7 24 8 25 26 27 9 10 11 28 1 29 30 2 3 Пространственное строение молекулярных частиц УПЗУ Творческирепродуктивный Парная работа Геометрия молекул органических и неорганических веществ. sp3 –гибридизация у алканов, воды, аммиака, алмаза; sp2–гибридизация у алкенов, соединений бора, аренов, диенов и графита; sp–гибридизация у алкинов, карбина. Знать геометрию молекул важнейших соединений: воды, аммиака, алканов, алкенов, алкинов и др. и объяснять причины особенностей строения Теория химического УПЗУ Предпосылки теории химического строения органистроения соединеТворческических соединений. Основные положения ТХС Бутний Бутлерова репродуктивлерова. Изомерия. Значение теории химического ный строения органических соединений Бутлерова в современной органической и общей химии. Основные направления развития ТХС Знать основные положения ТХС Бутлерова. Знать важнейшие понятия «изомерия», «гомологический ряд»; уметь составлять структурные формулы изомеров и гомологов. Полимеры органиУПЗУ Основные понятия химии ВМС: мономер, полимер, ческие и неорганиТворческиструктурное звено, степень полимеризации, средняя ческие. репродуктивмолекулярная масса. Способы получения полимеров. Обзор важнейших ный Свойства особых групп полимеров: пластмасс, элаполимеров стомеров и волокон. Классификация полимеров. Наиболее широко распространенные полимеры. Различие между полимером как веществом и полимерным материалом на его основе Практическая работа №1 «Получение и исследование комплексного соединения» Обобщение и систематизация знаний по теме (семинар) Контрольная работа №3 Самостоятельная работа с раздаточным материалом Текущий контроль – (самостоятельная работа) Д. Демонстрация моделей молекул органических и неорганических веществ с разным типом гибридизации http://schoolcollection.edu.ru/catalog/rubr/d05469af -69bd-11db-bd130800200c9c11/75923/?interface=pupil &class=54&subject=31 Слайд-лекция Д. Модели изомеров и гомологов Л. Изготовление моделей молекул воды, аммиака, метана и др. http://schoolcollection.edu.ru/catalog/rubr/d05469af -69bd-11db-bd130800200c9c11/75925/?interface=pupil &class=54&subject=31 Фронтальный устный Выполнение тестовых заданий. §13 №1-5 Слайд-лекция http://schoolcollection.edu.ru/catalog/rubr/d05469af -69bd-11db-bd130800200c9c11/75926/?interface=pupil &class=54&subject=31 Конспект Конспект Тема 3. Растворы и дисперсные системы (4ч) Ч истые вещества и смеси. Растворы Лекция Информационноразвивающий Чистые вещества и смеси. Состав смесей. Растворы. Классификация растворов. Растворимость веществ. В-9 Самостоятельная работа с раздаточным материалом Д. Примеры гомогенных и гетерогенных систем. Л. Получение пересыщенного раствора тиосульфата натрия и его мгновенная кристаллизация Решение расчётных задач применением понятий: растворимость, концентрация растворов, растворение кристаллогидратов. Понятие дисперсУОНМ Определение и классификация дисперсных систем. Текущий конД. Прохождение луча света через ных систем, их Информацион- Истинные и коллоидные растворы. Взвеси, золи, гетроль – (самоколлоидные и истинные растворы классификация и ноли. Специфические свойства коллоидных систем, стоятельная Л. Получение коллоидного раствора значение развивающий эффект Тиндаля. Значение коллоидных систем в работа) хлорида железа (III) жизни человека http://schoolЗнать определение и классификацию дисперсных collection.edu.ru/catalog/rubr/d05469af систем, понятия: истинные и коллоидные растворы, -69bd-11db-bd13дисперсионная среда, дисперсная фаза, коагуляция, 0800200c9c11/75924/?interface=pupil синерезис. &class=54&subject=31 Конспект задачник – стр.19 № 2-10 §14 №1-3 Рабочая программа по химии 11 класс (профиль) Е.А. Кудравец МАОУ гимназия № 32 31 4 Практическая работа №2 «Приготовление раствора заданной концентрации» 32 1 Классификация химических реакций в органической и неорганической химии УОНМ Лекция Информационноразвивающий 33 2 Энергетика химических реакций. Внутренняя энергия. Энтальпия УОНМ Лекция Информационноразвивающий 34-35 3-4 Стандартные энтальпии реакций и образования веществ. Закон Гесса 36 5 Урок-практикум Решение расчётных задач 37 6 Скорость химических реакций. Факторы, влияющие на скорость химической реакции. УОНМ Лекция Информационноразвивающий УПЗУ Творческирепродуктивный УОНМ Лекция Информационноразвивающий 38 7 Катализ и катализаторы Тема 4. Химические реакции (10ч) УОНМ Лекция Информационноразвивающий Классификация химических реакций: по числу и составу реагирующих веществ; по изменению степеней окисления элементов, образующих вещества; по тепловому эффекту; по фазовому составу реагирующих веществ; по участию катализатора; по направлению; по механизму протекания; по виду энергии, инициирующей реакцию. Уметь устанавливать принадлежность конкретных реакций к различным типам по различным признакам классификации Возможность протекания химической реакции на основании законов химической термодинамики. Теплота образования вещества. Тепловой эффект реакции. Знать понятия: «теплота образования вещества», «тепловой эффект реакции». Закон Гесса. Термохимические уравнения. Энтальпия. Энтропия. Энергия Гиббса Уметь составлять термохимические уравнения и производить расчеты по ним Фронтальный устный Для закрепления темы: задачник – стр.27 № 5-9 http://www.mar atakm.ru/index2 .files/a2.htm Д. Аллотропные превращения серы и фосфора. Л. Типы химических реакций на примере свойств органических и неорганических соединений §15 № 1-5 Текущий контроль-опрос Д. Примеры экзо- и эндотермических реакций §16 № 1,2 Текущий контроль-опрос Слайд-лекция Опорные конспекты §16 №3 Термохимические расчёты Самостоятельная работа с раздаточным материалом А-29 задачник – стр.31 № 3-9 Опорные конспекты Индивидуальные карточки. задачник – стр.31 № 10-14 Скорость гомогенных и гетерогенных реакций. Энергия активации. Влияние различных факторов на скорость химической реакции: природы и концентрации реагирующих веществ, площади соприкосновения реагирующих веществ, температуры, катализаторов Знать понятие «скорость химической реакции». Знать факторы, влияющие на скорость реакций. Понятие о катализаторе и механизме его действия. Ферменты - биокатализаторы. Ингибиторы и каталитические яды Знать понятия «катализ», «катализатор». Гомогенный и гетерогенный катализ. Сравнение ферментов с неорганическими катализаторами. А-22 Фронтальный устный задачник – стр.34 №1-3 http://www.mar atakm.ru/index2 .files/a2.htm Слайд-лекция Д. Зависимость скорости р-и от концентрации и температуры http://experiment.edu.ru/catalog.asp?ca t_ob_no=12669 §17 № 1-5 Текущий задачник – стр.35 №10-16 Д. Разложение пероксида водорода в присутствии катализатора (оксида марганца (IV) и фермента каталазы) §18 №1-4 Рабочая программа по химии 11 класс (профиль) Е.А. Кудравец МАОУ гимназия № 32 Химическое равновесие, условия его смещения УОНМ Лекция Информационноразвивающий 1 Электролитическая диссоциация (ЭД). КУ Творческирепродуктивный Групповой 43 2 Реакции ионного обмена КУ Творческирепродуктивный Групповой 44 3 Водородный показатель УОНМ Творческирепродуктивный 45-46 4-5 Гидролиз УОНМ Творческирепродуктивный 39 8 40 41 9 10 42 Обратимые и необратимые химические реакции. Химическое равновесие. Условия смещения химического равновесия. Принцип Ле Шателье. Закон действующих масс для равновесных систем. Константа равновесия Знать классификацию хим. реакций (обратимые и необратимые), понятие «химическое равновесие» и условия его смещения. А-23 Обобщение и систематизация знаний по теме семинар (Повтор. §15-23) Контрольная работа №4 Текущий опрос. Выполнение тестовых заданий. http://www.mar atakm.ru/index2 .files/a2.htm Портрет Ле Шателье, таблицы http://schoolcollection.edu.ru/catalog/rubr/eb17b17 a-6bcc-01ab-0e3aa1cd26d56d67/23574/?interface=themc ol §19 № 1-8 Тема 5. Электролитическая диссоциация (7ч) Электролиты и неэлектролиты. Электролитическая диссоциация. Механизм диссоциации веществ с различным типом связи. Основные положения ТЭД. Сильные и слабые электролиты. Константа диссоциации. Знать понятия «электролиты» и «неэлектролиты», примеры сильных и слабых электролитов. Знать сущность механизма диссоциации. Знать основные положения ТЭД. А-24 Ионные реакции и условия их протекания. Кислоты, соли, основания в свете представлений об ЭД А-25 Самостоятельная работа с раздаточным материалом http://www.mar atakm.ru/index2 .files/a2.htm Д. Сравнение электропроводности растворов электролитов. http://experiment.edu.ru/catalog.asp?ca t_ob_no=12600 §20 №1-4 Опрос задачник – стр.44 № 14-16 http://www.mar atakm.ru/index2 .files/a2.htm §20 №7 Методы определения кислотности среды. Диссоциация воды. Константа её диссоциации. Ионное произведение воды. Водородный показатель –рН. Среды водных растворов электролитов. Влияние рН на химические и биологические процессы Уметь определять характер среды раствора неорганических соединений Понятие «гидролиз». Гидролиз органических веществ. Биологическая роль гидролиза в организме человека. Реакции гидролиза в промышленности. Гидролиз солей. Различные пути протекания гидролиза солей в зависимости от их состава. Необратимый гидролиз Знать типы гидролиза солей и органических соединений. Уметь составлять уравнения гидролиза солей (1 ступень), определять характер среды. А-26 В-4 Текущий контроль – (самостоятельная работа Л. Проведение реакций ионного обмена для характеристики свойств электролитов http://schoolcollection.edu.ru/catalog/rubr/eb17b17 a-6bcc-01ab-0e3aa1cd26d56d67/23536/?interface=themc ol Слайд-лекция Индивидуальные карточки Л. Определение характера среды с помощью универсального индикатора Упражнение на тренажёрах §21 №1-4 (5-8) задачник – стр.48 № 14 Текущий Работа по карточкам Для закрепления темы: задачник – стр.48 № 7-13 http://www.mar atakm.ru/index2 .files/a2.htm http://schoolcollection.edu.ru/catalog/rubr/eb17b17 a-6bcc-01ab-0e3aa1cd26d56d67/23537/?interface=themc ol §20 задачник – стр.46№ 4-7 Рабочая программа по химии 11 класс (профиль) Е.А. Кудравец МАОУ гимназия № 32 47 48 6 7 Практическая работа № 3 Решение экспериментальных задач по теме «Реакции ионного обмена. Гидролиз» Обобщение и систематизация знаний по теме (семинар) 49 1 Окислительновосстановительные реакции УОНМ Лекция Частичнопоисковый. 50-51 2-3 Метод электронноионного баланса УПЗУ Творческирепродуктивный. 52-53 4-5 Электролиз, его практическое применение 54 55 6 7 56 1 Классификация неорганических и органических веществ КУ Информационноразвивающий 57 2 Металлы, их свойства УОНМ Лекция Информационноразвивающий Тема 6. Окислительно-восстановительные реакции. Электрохимические процессы (7ч) Окисление и восстановление. Окислители и восстановители. Знать понятия «окислитель», «восстановитель», «окисление», «восстановление». Знать отличия ОВР от реакций ионного обмена. А-27 Составление уравнений ОВР методом электронного баланса. Метод полуреакций. Влияние среды на протекание ОВР в органической химии Уметь составлять уравнения ОВР методом электронного баланса и полуреакций Упражнение на тренажёрах С-1 Электролиз как ОВ процесс. Электролиз расплавов и растворов электролитов. Электрохимическое получение и очистка веществ. В-3 УОНМ Лекция Информационноразвивающий Обобщение и систематизация знаний по теме семинар (Повторить §20-23) Контрольная работа №5 Фронтальный устный http://www.mar atakm.ru/index2 .files/a2.htm Работа по ДМ Выборочная проверка тетрадей. Слайд-лекция §22 №1 Таблица «Направление ОВР в различных средах» Индивидуальные карточки. §22 №2-4 Выполнение тестовых заданий. Д. Электролиз растворов хлорида натрия и сульфата меди (II) Индивидуальные карточки. §23 №14(5-8) Тема 7. Классификация веществ. Основные классы неорганических и органических веществ (13ч) Простые и сложные вещества. Оксиды, их классификация; гидроксиды Кислоты, соли их классификация. Углеводороды, их классификация. Изомерия. Гомология. Производные углеводородов: галогеналканы, спирты, фенолы, альдегиды и кетоны, карбоновые кислоты, простые и сложные эфиры, Нитросоединения, амины, аминокислоты Знать важнейшие классы неорганических и неорганических соединений. А-8 Положение металлов в ПС Д.И. Менделеева. Металлическая связь. Общие физические свойства металлов. Химические свойства металлов. Взаимодействие с простыми и сложными веществами. Ряд стандартных электродных потенциалов. Значение Ме в природе и в жизни организмов Знать основные металлы, их общие свойства. Уметь характеризовать свойства металлов, опираясь на их положение в ПС и строение атомов Текущий. Для закрепления темы: задачник – стр.63, №1-5 http://www.mar atakm.ru/index2 .files/a2.htm Д. Образцы представителей различных классов неорганических соединений §25 №1-4 Самостоятельная работа с раздаточным материалом http://www.mar atakm.ru/index2 .files/a2.htm Д. Взаимодействие металлов с неметаллами, с растворами кислот и щёлочей. Горение металлов в кислороде. http://experiment.edu.ru/catalog.asp?ca t_ob_no=12793 §26 №1,2 Рабочая программа по химии 11 класс (профиль) Е.А. Кудравец МАОУ гимназия № 32 58 3 Металлургия. Общие способы получения металлов КУ Эвристическая беседа Групповой Основные способы получения металлов: пиро-, гидро- и электрометаллургия. Электролиз. Катодные и анодные процессы, протекающие при электролизе различных веществ. Составление уравнений ОВР электролиза Понимать суть металлургических процессов. Уметь составлять уравнения электролиза, производить по ним вычисления Текущий. Опрос + индивидуальная работа по карточкам. 59 4 Получение и свойства неметаллов УОНМ Лекция Информационноразвивающий Текущий опрос. Выполнение тестовых заданий. 60 6 Оксиды КУ Эвристическая беседа 61 7 Кислоты неорганические и органические КУ Эвристическая беседа Групповой Положение неметаллов в ПС Д.И. Менделеева. Конфигурация внешнего электронного слоя неметаллов. Простые вещества неметаллы: строение, физические свойства. Аллотропия. Химические свойства. Важнейшие оксиды, соответствующие им гидроксиды и водородные соединения неметаллов. Зависимость свойств кислот от с.о. неметалла Знать основные неметаллы, их окислительные и восстановительные свойства. Уметь характеризовать свойства неметаллов, опираясь на их положение в ПС Менделеева. Изменение кислотных свойств высших оксидов и гидроксидов неметаллов в периодах и группах Строение, номенклатура, классификация и свойства оксидов Знать классификацию и номенклатуру оксидов, особенности органических ангидридов. Уметь характеризовать их свойства. А-10 Кислоты в свете протолитической теории. Строение, номенклатура классификация и свойства органических и неорганических кислот. Важнейшие представители этого класса. Знать классификацию, номенклатуру кислот, уметь характеризовать их свойства. Знать особенности свойств серной и азотной кислот, муравьиной и уксусной кислот А-11 62 8 Основания неорганические и органические КУ Эвристическая беседа Групповой Строение, номенклатура, классификация и свойства органических и неорганических оснований. Растворимые и нерастворимые основания. Важнейшие представители класса. Взаимное влияние атомов в молекуле анилина Знать классификацию и номенклатуру оснований, особенности органических оснований; уметь характеризовать их свойства А-11 Д. Коллекция руд. Восстановление меди из оксида меди (II) водородом. Л. Взаимодействие сульфата меди (II) с железом. http://schoolcollection.edu.ru/catalog/rubr/d05469af -69bd-11db-bd130800200c9c11/75934/?interface=pupil &class=54&subject=31 Слайд-лекция Д. Горение серы и фосфора. Возгонка иода, растворение иода в спирте Задачники, ДМ §26 №3-5 Д. Коллекции кислотных. Основных и амфотерных оксидов, демонстрация их свойств §28 №1-5 Д. Взаимодействие концентрированных серной и азотной кислот с медью. Л. Распознавание хлоридов и сульфатов http://schoolcollection.edu.ru/catalog/rubr/d05469af -69bd-11db-bd130800200c9c11/75936/?interface=pupil &class=54&subject=31 Текущий опрос Л. Получение и свойства нераствозадачник – римых оснований стр.86 №13,14 http://schoolhttp://www.marat collection.edu.ru/catalog/rubr/d05469af akm.ru/index2.fil -69bd-11db-bd13es/a2.htm 0800200c9c11/75937/?interface=pupil &class=54&subject=31 §29 №1-6 Фронтальный устный+ индив. работа по карточкам Текущий опрос задачник – стр.80 №6-10 http://www.mar atakm.ru/index2 .files/a2.htm §27 №1-4 §30 №1-7 Рабочая программа по химии 11 класс (профиль) Е.А. Кудравец МАОУ гимназия № 32 63 9 Амфотерные неорганические и органические соединения КУ Эвристическая беседа Групповой Амфотерность оксидов и гидроксидов переходных металлов и алюминия: взаимодействие с кислотами и щелочами. Амфотерность аминокислот, образование пептидов Знать понятие «амфотерность», уметь характеризовать свойства амфотерных соединений, составлять формулы пептидов Понятие о генетической связи и генетических рядах в неорганической и органической химии. Генетические ряды металла и неметалла. Единство мира веществ. Знать важнейшие свойства изученных классов органических и неорганических соединений А12 А-13 Фронтальный устный задачник – стр.91 №10-13 64 10 Генетическая связь между классами неорганических и органических соединений. КУ Информационноразвивающий 65 66 67 11 12 13 Практическая работа №4 «Генетическая связь между классами неорганических и органических веществ» Обобщение и систематизация знаний по теме семинар (Повтор. §25-32) Контрольная работа №6 68 1 Водород УОНМ Лекция Информационноразвивающий Особенности положения водорода в ПСХЭ. Изотопы водорода. Получение, физические и химические свойства водорода. Применение водорода. Уметь характеризовать окислительновосстановительные свойства водорода. Выполнение заданий. 69 2 Вода КУ Эвристическая беседа Строение молекулы. Вода в природе. Вода - амфолит. Свойства воды. Реакции гидролиза. Гидратация органических и неорганических веществ. Жёсткость воды, способы её устранения. Уметь составлять уравнения гидролиза солей.. Фронтальный устный 70 3 Галогены КУ Творческирепродуктивный Общая характеристика галогенов. Свойства простых веществ – галогенов. Окислительновосстановительные свойства галогенов. Галогеноводороды, их свойства. С-2 Текущий опрос + индивидуальная работа по карточкам Для закрепления темы: задачник – стр.93 №1-4 Л. Взаимодействие цинка и железа с растворами кислот и щелочей http://schoolcollection.edu.ru/catalog/rubr/d05469af -69bd-11db-bd130800200c9c11/75938/?interface=pupil &class=54&subject=31 Д. Осуществление превращения: фосфор→оксид фосфора→гидроксид →соль http://schoolcollection.edu.ru/catalog/rubr/d05469af -69bd-11db-bd130800200c9c11/75939/?interface=pupil &class=54&subject=31 §31 №1-5 Д. Получение и свойства водорода http://schoolcollection.edu.ru/catalog/rubr/eb17b17 a-6bcc-01ab-0e3aa1cd26d56d67/23511/?interface=themc ol Д. Реакции воды с металлами и солеобразующими оксидами. Гидратация сульфата меди (II). http://schoolcollection.edu.ru/catalog/rubr/eb17b17 a-6bcc-01ab-0e3aa1cd26d56d67/23530/?interface=themc ol Д. Окислительные свойства хлорной воды. http://schoolcollection.edu.ru/catalog/rubr/eb17b17 a-6bcc-01ab-0e3aa1cd26d56d67/23533/?interface=themc ol §33 №1-5 §32 №1-3 задачник – стр.93 №5-8 Тема 8. Химия элементов (38ч) §33 №6-8 §34 №1-3 №4-7 Рабочая программа по химии 11 класс (профиль) Е.А. Кудравец МАОУ гимназия № 32 71-72 4-5 Хлор и его соединения УОНМ Лекция Информационноразвивающий Хлор и его соединения. Соляная кислота и хлориды. Кислородные соединения хлора. С-2 Текущий опрос. Выполнение тестовых заданий. http://www.mar atakm.ru/index2 .files/a2.htm 73 6 Подгруппа кислорода. Кислород КУ Творческирепродуктивный Тематический контроль 74 7 Сера и её соединения КУ Творческирепродуктивный Нахождение в природе, получение в промышленности и в лаборатории. Аллотропия кислорода. Окислительно-восстановительные свойства кислорода. Окислительные свойства озона. Применение кислорода и озона. Нахождение серы в природе. Аллотропия и физические свойства модификаций серы. Применение серы. Сероводород, его свойства. С-2 75 8 Кислородные соединения серы. 76 77 9 10 78 11 Аммиак КУ Творческирепродуктивный Аммиак: получение, строение молекулы, свойства (основные, реакции комплексообразования, окислительно-восстановительные, реакции с органическими веществами). Физиологическое действие аммиака. Соли аммония и их применение. Текущий опрос + самостоятельная работа http://www.mar atakm.ru/index2 .files/a2.htm 79 12 Кислородные соединения азота УОНМ Лекция Информационноразвивающий Оксиды азота, их строение и свойства. Азотистая кислота и нитриты. Азотная кислота: получение, строение, свойства. Нитраты, их свойства и применение. С-2 Текущий опрос. Выполнение тестовых заданий. КУ Оксиды серы (IV) и (VI), их свойства. Сернистая Творческикислота и её соли. Серная кислота, получение , репродуктивсвойства. Применение серной кислоты. Соли серной ный кислоты. Урок-практикум. Решение расчётных задач (задачник – стр.112 №3,4; стр.115 №1,3,31) Подгруппа азота. КУ Нахождение в природе, биологическая роль, получеАзот Творческиние. Строение молекулы. Окислительнорепродуктиввосстановительные свойства азота. Применение азоный та. С-2 Д. Свойства соляной кислоты. Качественные реакции на галогенидионы. http://schoolcollection.edu.ru/catalog/rubr/eb17b17 a-6bcc-01ab-0e3aa1cd26d56d67/23533/?interface=themc ol Д. Получение кислорода. Горение металлов и неметаллов в кислороде. http://experiment.edu.ru/catalog.asp?ca t_ob_no=12849 §34№4-7 Текущий опрос. Самостоятельная работа http://www.mar atakm.ru/index2 .files/a2.htm Текущий опрос. Выполнение тестовых заданий. Д. Горение серы. Качественные реакции на сульфид-ион. http://schoolcollection.edu.ru/catalog/rubr/eb17b17 a-6bcc-01ab-0e3aa1cd26d56d67/23539/?interface=themc ol Д. Свойства серной кислоты. Качественная реакция на сульфат-ион §36 №1-3 Фронтальный устный Текущий опрос + индивидуальная работа по карточкам http://schoolcollection.edu.ru/catalog/rubr/eb17b17 a-6bcc-01ab-0e3aa1cd26d56d67/23552/?interface=themc ol Д. Получение и разложение хлорида аммония. Качественная реакция на катион аммония http://schoolcollection.edu.ru/catalog/rubr/eb17b17 a-6bcc-01ab-0e3aa1cd26d56d67/23552/?interface=themc ol Д. Получение оксида азота (IV) реакцией взаимодействия меди с концентрированной азотной кислотой §37 №1-3 §35 №1-5 §36 №4-6 §37 №6 §37№4,5,7 Рабочая программа по химии 11 класс (профиль) Е.А. Кудравец МАОУ гимназия № 32 УОНМ Нахождение в природе, биологическая роль, получеЛекция ние. Аллотропия и физические свойства модификаИнформацион- ций. Окислительно-восстановительные свойства нофосфора. Фосфин, его свойства, соли фосфония. развивающий Фосфорноватистая и фосфористая кислоты. Урок-практикум. Решение расчётных задач (задачник – стр.128 №14,19,30) Углерод УОНМ Нахождение в природе. Аллотропия и физические Лекция свойства модификаций. Химические свойства углеИнформацион- рода. Применение аллотропных модификаций. норазвивающий Фронтальный устный http://www.mar atakm.ru/index2 .files/a2.htm Д. Горение фосфора, растворение оксида фосфора (V) в воде. Качественная реакция на фосфат-анион. http://experiment.edu.ru/catalog.asp?ca t_ob_no=12846 §38 №1-4 Текущий опрос + самостоятельная работа http://www.mar atakm.ru/index2 .files/a2.htm §39 №4 16 Соединения углерода КУ Творческирепродуктивный Текущий опрос. Выполнение тестовых заданий. 84 17 Кремний и его соединения КУ Информационноразвивающий Д. Коллекция природных соединений углерода. Кристаллические решётки алмаза и графита. http://schoolcollection.edu.ru/catalog/rubr/eb17b17 a-6bcc-01ab-0e3aa1cd26d56d67/23565/?interface=themc ol Л. Получение углекислого газа и исследование его свойств. http://schoolcollection.edu.ru/catalog/rubr/eb17b17 a-6bcc-01ab-0e3aa1cd26d56d67/23565/?interface=themc ol Д. Ознакомление с коллекцией природных силикатов. Получение кремниевой кислоты. http://experiment.edu.ru/catalog.asp?ca t_ob_no=12907 85 86 87 88 18 19 20 21 §41 №1-3 89 22 Д. Образцы щелочных металлов. Взаимодействие щ. металлов с водой. http://schoolcollection.edu.ru/catalog/rubr/eb17b17 a-6bcc-01ab-0e3aa1cd26d56d67/23569/?interface=themc ol Д. Взаимодействие кальция с водой. Горение магния в воде. Качественные реакции. 80 13 81 82 14 15 83 Фосфор и его соединения Получение, свойства и применение оксидов углерода. Угольная кислота и её свойства. Соли угольной кислоты. Качественная реакция на карбонат-анион. Нахождение в природе, получение. Аллотропия кремния. Окислительно-восстановительные свойства кремния. Применение кремния. Оксид кремния, кремниевая кислота и её соли. Силикатная промышленность. Урок-практикум. Решение расчётных задач (задачник – стр.143 №2,5,13) Практическая работа №5 «Качественные реакции на анионы» Контрольная работа №7 Металлы I А группы КУ Щелочные металлы, общая характеристика на основе Информацион- положения в ПСХЭ Д.И. Менделеева и строения ноатомов. Реакция окрашивания пламени солями щ. развивающий металлов. Соединения щелочных металлов, их свойства. Текущий опрос + индивидуальная работа по карточкам Металлы I I А группы Выполнение тестовых заданий. http://www.mar atakm.ru/index2 .files/a2.htm КУ Информационноразвивающий Бериллий, магний, щелочно-земельные металлы, их общая характеристика на основе положения в ПСХЭ Д.И. Менделеева и строения атомов. Получение, физические и химические свойства, применение. Соединения щелочно-земельных металлов. Текущий опрос + самостоятельная работа §39 №5,6 §40 №1-4 §41 №4-6 Рабочая программа по химии 11 класс (профиль) Е.А. Кудравец МАОУ гимназия № 32 90 23 Алюминий и его соединения УОНМ Лекция Информационноразвивающий Алюминий, его характеристика на основе положения в ПСХЭ Д.И. Менделеева и строения атомов. Получение, физические и химические свойства, применение. Соединения алюминия. С-2 Текущий + индивидуальная работа по карточкам http://www.mar atakm.ru/index2 .files/a2.htm 91-92 2425 Железо и его соединения УОНМ Лекция Информационноразвивающий Железо и его характеристика на основе положения в ПСХЭ Д.И. Менделеева и строения атомов. Получение, физические и химические свойства, применение. Соединения железа. С-2 Текущий опрос + самостоятельная работа http://www.mar atakm.ru/index2 .files/a2.htm 93-94 2627 Медь и его соединения 2829 Хром и его соединения Общая характеристика d-элементов. Строение атома, физические и химические свойства, получение и применение меди. Важнейшие соединения меди, их свойства. С-2 Строение атома, физические и химические свойства, получение и применение хрома. Важнейшие соединения хрома, их свойства. С-2 Текущий опрос + индивидуальная работа по карточкам 95-96 УОНМ Лекция Информационноразвивающий УОНМ Лекция Информационноразвивающий 97-98 3031 Марганец и его соединения Тематический контроль http://www.mar atakm.ru/index2 .files/a2.htm 99 100 101 102105 32 33 34 3538 УОНМ Строение атома, физические и химические свойства, Лекция получение и применение марганца. Важнейшие соИнформацион- единения марганца, их свойства. норазвивающий Урок-практикум. Решение расчётных задач (задачник – стр.174 № 6-11) Практическая работа №6 «Качественные реакции на катионы» Итоговая контрольная работа №8 Итоговые тестирования Тематический контроль http://www.mar atakm.ru/index2 .files/a2.htm Л. Взаимодействие алюминия с растворами кислот и щелочей. Получение и свойства гидроксида алюминия. http://schoolcollection.edu.ru/catalog/rubr/eb17b17 a-6bcc-01ab-0e3aa1cd26d56d67/23570/?interface=themc ol Л. Коллекция железосодержащих руд, чугунов и сталей. Получение нерастворимых гидроксидов железа и изучение их свойств. http://schoolcollection.edu.ru/catalog/rubr/eb17b17 a-6bcc-01ab-0e3aa1cd26d56d67/23572/?interface=themc ol Д. Качественные реакции на катионы меди. §42 №1-7 Д. Получение и исследование свойств гидроксида хрома (III), окислительные свойства дихромата калия. http://schoolcollection.edu.ru/catalog/rubr/eb17b17 a-6bcc-01ab-0e3aa1cd26d56d67/23571/?interface=themc ol Д. Окислительные свойства перманганата калия в различных средах §43 №4,5 §43 №1-3 §43№3,6,7


