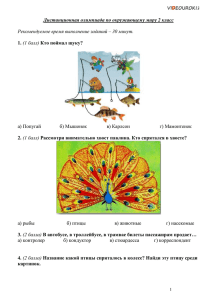
Оценка "5" ставится, если ученик
advertisement
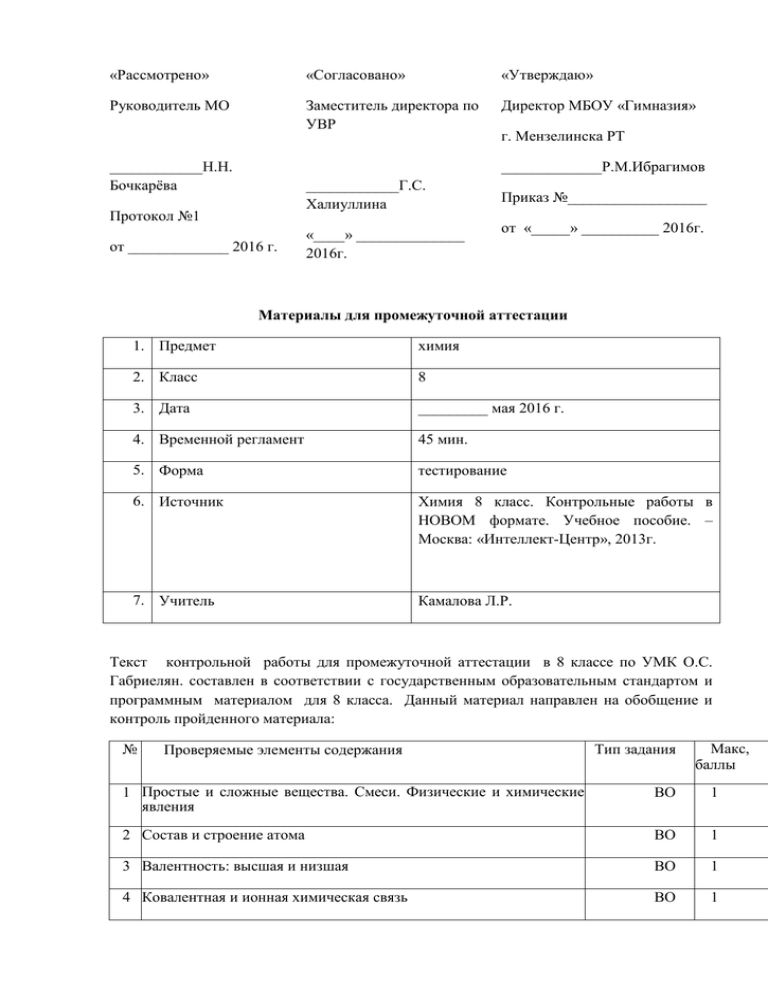
«Рассмотрено» «Согласовано» «Утверждаю» Руководитель МО Заместитель директора по УВР Директор МБОУ «Гимназия» ____________Н.Н. Бочкарёва г. Мензелинска РТ _____________Р.М.Ибрагимов ____________Г.С. Халиуллина Протокол №1 от _____________ 2016 г. «____» ______________ 2016г. Приказ №__________________ от «_____» __________ 2016г. Материалы для промежуточной аттестации 1. Предмет химия 2. Класс 8 3. Дата _________ мая 2016 г. 4. Временной регламент 45 мин. 5. Форма тестирование 6. Источник Химия 8 класс. Контрольные работы в НОВОМ формате. Учебное пособие. – Москва: «Интеллект-Центр», 2013г. 7. Учитель Камалова Л.Р. Текст контрольной работы для промежуточной аттестации в 8 классе по УМК О.С. Габриелян. составлен в соответствии с государственным образовательным стандартом и программным материалом для 8 класса. Данный материал направлен на обобщение и контроль пройденного материала: № Проверяемые элементы содержания Тип задания Макс, баллы 1 Простые и сложные вещества. Смеси. Физические и химические явления ВО 1 2 Состав и строение атома ВО 1 3 Валентность: высшая и низшая ВО 1 4 Ковалентная и ионная химическая связь ВО 1 5 Химические свойства неорганических веществ ВО 1 6 Правила техники безопасности при работе в лаборатории. Методы получения веществ и разделения смесей. ВО 1 7 Классификация и номенклатура неорганических веществ. КО 1 8 Типы химических реакций КО 2 радиуса атомов, электроотрицательности, 9 Изменение металлических и неметаллических свойств но группам и периодам периодической системы химических элементов Д.М.Менделеева. КО 2 10 Химические свойства неорганических веществ КО 2 11 Генетическая связь между основными классами неорганических соединений РО 12 Задача: вычисление массы (объема) вещества по известной массе (объему) реагента или продукта реакции РО ИТОГО 2 3 18 Соответствие баллов, полученных за выполнение заданий, отметке/оценке по пятибалльной шкале оценивания Отметка 2 3 4 5 Число 05 6-10 11-14 15-18 баллов за работу Материал: Химия 8 класс. Контрольные работы в НОВОМ формате. Учебное пособие. – Москва: «Интеллект-Центр», 2013 «Рассмотрено» «Согласовано» «Утверждаю» Руководитель МО Заместитель директора по УВР Директор МБОУ «Гимназия» ____________Н.Н. Бочкарёва _________Г.С. Халиуллина Протокол №1 «___» _____________2016г. г. Мензелинска РТ _____________Р.М.Ибрагимов Приказ №__________________ от «____» ___________ 2016г. от ____________ 2016 г. Материалы для промежуточной аттестации 1. Предмет химия 2. Класс 9 3. Дата _________ мая 2016 г. 4. Временной регламент 45 мин. 5. Форма тестирование 6. Источник Поурочные разработки по химии. Сост. Н.П. Троегубова. 9 класс.-М.: ВАКО, 2008. 7. Учитель Камалова Л.Р. Текст контрольной работы для промежуточной аттестации в 9 классе по УМКО.С. Габриелян. составлен в соответствии с государственным образовательным стандартом и программным материалом для 9 класса. Данный материал направлен на обобщение и контроль пройденного материала: «Гидролиз. Металлы. Неметаллы. Органические соединения». Вариант I 1.Осуществить цепочку превращений. Дать названия полученным веществам. Са -> СаО > Са(ОН)2 -> Ca(N03)2 -» CaS04 Для первой реакции составить электронный баланс. Для последней реакции составить молекулярное, полное и сокращенное ионные уравнения. 2.Осуществить цепочку превращений. Дать названия полученным веществам. N2 ->NH3 >N02 ->HNO3-> KNO3-> 02 i No2 Любую OB реакцию уравнять методом электронного баланса. Для любой реакции ионного обмена составить молекулярное, полное и сокращенное ионные уравнения. 3.Опишите химические свойства карбоновых кислот. Вариант II 1.Осуществить цепочку превращений. Дать названия полученным веществам. Fe -> FeCl2 —> Fe(OH)2 —> FeO —> FeS04 Для 1-й реакции составить электронный баланс. Для 4-й реакции составить молекулярное, полное и сокращенное ионные уравнения. 2.Осуществить цепочку превращений. Дать названия полученным веществам. Sil4 Si02 ->Si-> K2Si03-> KNO3 -> 02 -> Si02 I SiC Любую ОВ реакцию уравнять методом электронного баланса. Для любой реакции ионного обмена составить молекулярное, полное и сокращенное ионные уравнения. 3. Опишите химические свойства этилена. Вариант III 1.Осуществить цепочку превращений. Дать названия полученным веществам. АL 2(SO 4) 3 -AL2(S04)3 АL->АL203->АLС1з А1(0Н) 3 NaAL02 Для первой реакции составить электронный баланс. Для реакции получения гидроксида алюминия составить молекулярное, полное и сокращенное ионные уравнения. 2.Осуществить цепочку превращений. Дать названия полученным веществам. NaCl -> НС1 Н2 -> H2S ->S02-> S03 ->H2S04 ->H2S I Cl2 —> I2 Любую OB реакцию уравнять методом электронного баланса. Для любой реакции ионного обмена составить молекулярное, полное и сокращенное ионные уравнения. 3.Опишите химические свойства метана. Критерии оценивания ответов. Оценка "5" ставится, если ученик: 1) 2) выполнил работу без ошибок и недочетов; допустил не более одного недочета. Оценка "4" ставится, если ученик: 1) выполнил работу полностью, но допустил в ней не более одной не грубой ошибки и о .mom недочета: 2) или не более двух недочетов. Оценка "3 " ставится, если ученик: 1) правильно выполнил не менее половины работы или допустил не более двух грубых ошибок: или не более одной грубой и одной негрубой ошибки и одного недочета; или не более двух-трех негрубых ошибок: или одной негрубой ошибки и трех недочетов; 2) или при отсутствии ошибок, но при наличии четырех-пяти недочетов. Оценка "2" ставится, если ученик: 1) допустил число ошибок и недочетов превосходящее норму, при которой может бы п. выставлена оценка "3": 2) правильно выполнил менее половины работы. Оценка "2 " ставится, если ученик: 1) не приступал к выполнению работы; 2 j или правильно выполнил не более 10 % всех заданий. Примечание. 1) Учитель имеет право поставить ученику оценку выше той, которая предусмотрена нормами, если учеником оригинально выполнена работа. 2) Оценки с анализом доводятся до сведения учащихся, как правило, на последующем уроке предусматривается работа над ошибками, устранение пробелов. Материал: http://videotutor-rusyaz.ru/uchitelyam/metodichka/15 «Рассмотрено» Руководитель МО «Согласовано» Заместитель директора по УВР ____________Н.Н. Бочкарёва Протокол №1 от _____________ 2016 г. ____________Г.С. Халиуллина «____» ______________ 2016г. «Утверждаю» Директор МБОУ «Гимназия» г. Мензелинска РТ _____________Р.М.Ибрагимов Приказ №__________________ от «_____» __________ 2016г. Материалы для промежуточной аттестации 8. Предмет химия 9. Класс 10 10. Дата _________ мая 2014 г. 11. Временной регламент 45 мин. 12. Форма контрольная работа 13. Источник Поурочные разработки по химии. Сост. О.С. Габриелян 10 класс. -М.: ВАКО, 2008. 14. Учитель Камалова Л.Р. Текст контрольной работы для промежуточной аттестации в 10 классе по УМК О.С. Габриелян. составлен в соответствии с государственным образовательным стандартом и программным материалом для 10 класса. Данный материал направлен на обобщение и контроль пройденного материала: «Теория химического строения органических соединений. Предельные УВ. Непредельные УВ. Ароматические УВ. Спирты и фенолы. Альдегиды и карбоновые кислоты. Сложные эфиры и жиры. Углеводы». Вариант 1 Дайте общую характеристику аминам и опишите их химические свойства. Составить уравнения реакций, с помощью которых можно осуществить следующие превращения: молочная кислота 1) 2) крахмал —> глюкоза этиловый спирт —> —> этилформиат —> муравьиная кислота —> серебро Дать названия реакциям. 3) Какую массу целлюлоза и азотной кислоты надо взять для получения 1 т тринитроцеллюлозы? Массовая доля её выхода составляет 70%. Вариант 2 1) Дайте общую характеристику глюкозы и опишите её химические свойства. 2) Составить уравнения реакций, с помощью которых можно осуществить следующие превращения: СН4 -> 4 CH3N02 -> CH3NH2 -> N2 CH3COOH -> СН2С1СООН ->NH2-CH2COOH-> (NH2- СН2СОО)2Са Дать названия реакциям и соединениям. 3) Определите массу соли, образующейся при взаимодействии раствора аминоуксусной кислоты массой 300 г с массовой долей кислоты 15% и раствора гидроксида натрия, содержащего 10 г NaOH? Вариант 3 1.Дайте общую характеристику аминокислотам и опишите их химические свойства. 2.Составить уравнения реакций, с помощью которых можно осуществить следующие превращения: этанол —> уксусная кислота триацетилцеллюлоза целлюлоза —> глюкоза —> глюконовая I кислота сорбит Дать названия реакциям и соединениям. 3.Сколько кг молочной кислоты можно получить из 300 кг кормовой патоки, если массовая доля сухих веществ в ней составляет 70 %, из которых на долю сахарозы приходится 50 %? Массовая доля выхода молочной кислоты составляет 80 % от теоретически возможного. 4*При выполнении задания выберите правильные ответы и выпишите их номера. Запишите выбранные цифры в порядке возрастания. Анилин, в отличие от метиламина: 1)Плохо растворим в воде; 2)Проявляет основные свойства; 3)вступает в реакции электрофильного замещения; 4)Более слабое основание; 5)реагирует с кислотами; 6)содержит аминогруппы. Критерии оценивания ответов. Оценка "5" ставится, если ученик: 3) выполнил работу без ошибок и недочетов; 4) допустил не более одного недочета. Оценка "4" ставится, если ученик: 1) выполнил работу полностью, но допустил в ней не более одной не грубой ошибки и о .mom недочета: 2) или не более двух недочетов. Оценка "3 " ставится, если ученик: 1) правильно выполнил не менее половины работы или допустил не более двух грубых ошибок: или не более одной грубой и одной негрубой ошибки и одного недочета; или не более двух-трех негрубых ошибок: или одной негрубой ошибки и трех недочетов; 2) или при отсутствии ошибок, но при наличии четырех-пяти недочетов. Оценка "2" ставится, если ученик: 1) допустил число ошибок и недочетов превосходящее норму, при которой может бы п. выставлена оценка "3": 2) правильно выполнил менее половины работы. Оценка "2 " ставится, если ученик: 1) не приступал к выполнению работы; 2 j или правильно выполнил не более 10 % всех заданий. Приме чан ие. 1) Учитель имеет право поставить ученику оценку выше той, которая предусмотрена нормами, если учеником оригинально выполнена работа. 2) Оценки с анализом доводятся до сведения учащихся, как правило, на последующем уроке предусматривается работа над ошибками, устранение пробелов. Материал: http://videotutor-rusyaz.ru/uchitelyam/metodichka/15 Материалы для промежуточной аттестации 15. Предмет химия 16. Класс 11 17. Дата _________ мая 2016 г. 18. Временной регламент 45 мин. 19. Форма тестирование Химия. 11 класс : контрольные и проверочные работы к учебнику О.С. Габриеляна «Химия». 11 класс. Базовый уровень» / О.С. Габриелян, П.Н. Березкин, А.А. Ушакова и др. – 2-е изд., - М.: Дрофа. 20. Источник 21. Учитель Камалова Л.Р. Текст контрольной работы для промежуточной аттестации в 11 классе по УМК О.С. Габриелян составлен в соответствии с государственным образовательным стандартом и программным материалом для 11 класса. Данный материал направлен на обобщение и контроль пройденного материала: «Строение атома. Строение вещества. Химические реакции. Гидролиз. Металлы. Неметаллы». Вариант 1 ЧАСТЬ А. Тестовые задания с выбором ответа 1 (3 балла). Знаки химических элементов, имеющих сходное строение внешнего энергетического уровня: А. В и Si. В. К и Са. Б. Se и S. Г. Мп и Вг. 1. (3 балла). Номер периода в Периодической системе показывает: 2. Число электронных слоев в атоме. Б. Заряд ядра атома. 3. Число электронов на внешнем энергетическом уровне. Г. Число электронов в атоме. 3. (3 балла). Формула вещества с ионной связью и ионной кристаллической решеткой: А. С02. Б. N2. В. КС1. Г. С (алмаз). 4. (3 балла). К окислительно-восстановительным не относятся все реакции: А. Соединения. В. Замещения. Б. Разложения. Г. Обмена. 5. (3 балла). Формула соли, водный раствор которой имеет щелочную среду: А. К2С03. В. CuS04. Б. A1(N03)3. Г. NaCl. 6.(3 балла). Аморфным веществом является: А. Алмаз. Б. Стекло. 1. В. Кремнезем. Г. Сода. (3 балла). Условие, необходимое для смещения химического равновесия в реакции, уравнение которой N2(r) + 02(r) 2NO(r)-Q, в сторону продуктов: А. Увеличить давление. Б. Повысить температуру. В.Применить катализатор. Г. Понизить температуру. 8. (3 балла). Окислителем в химической реакции, уравнение которой СиО + Н2 = Си + Н20, является: 0 - 2 А. Н2. 9. + Б. О. 2 0 В. Си. Г. Си. (3 балла). Формула вещества X в цепочке превращений Na ---- ► X ---> Na20: A. Na202. Б. NaOH. В. NaH. Г. NaCl. 10. (3 балла). Превращение, которое нельзя осуществить в одну стадию: А. 02 ---- > 03. В. NH3---- HN03. Б. 02 ----- > Н20. Г. 02 ----- > СиО. ЧАСТЬ Б. Задания со свободным ответом 11. (8 баллов). Напишите уравнения реакций, при помощи которых можно осуществить превращения 1 2 3 4 Li —> Li20 ---- > LiOH —> Li2C03---- > C02. 12. (8 баллов). Дайте характеристику реакции 1 из задания 11 с точки зрения различных признаков классификации химических реакций. Выберите ОВР, укажите окислитель и восстановитель. Реакцию 4 рассмотрите в свете ТЭД. 13. (4 балла). Рассчитайте объем (н. у.) оксида серы (IV), который образуется при растворении в соляной кислоте 504 г сульфита натрия, содержащего 25% примесей. Вариант 2 ЧАСТЬ А. Тестовые задания с выбором ответа 1 (3 балла). Знаки химических элементов, имеющих сходное строение внешнего энергетического уровня: A. S и С1. В. Кг и Хе. Б. Be и В. Г. F и О. (3 балла). Общее число электронов в атоме элемента определяется в Периодической системе по номеру: А. Группы. В. Ряда. Б. Периода. Г. Порядковому. (3 балла). Вещество с металлической связью: А. Вода. В. Иод. Б. Хлорид натрия. Г. Кобальт. (3 балла). Вещество, способное переходить из твердого состояния в газообразное, минуя жидкое: А. Бензол. В. Вода. Б. Сера. Г. Иод. (3 балла). Тип реакции, с помощью которой можно осуществить превращение АЮ13 CH3 СН2 СН2 CH3 > CH3 СН CH3 сн3 А. Изомеризации. В. Разложения. Б. Замещения. Г. Обмена. (3 балла). Вещества, при гидролизе которых образуются карбоновые кислоты: А. Белки. В. Нуклеиновые кислоты. Б. Жиры. Г. Углеводы. 7* (3 балла). Фактор, влияющий на смещение химического равновесия: Вид химической связи. Б. Катализатор. Природа реагирующих веществ. Г. Температура. (3 балла). Ряд формул веществ, в которых степень окисления серы возрастает: А.H2S04, H2S03, S, MgS. Б. S03, Na2S, FeS, S02. В. CaS, S, H2S03, K2S04. Г. S, H2S, SOg, H2S04. 9. (3 балла). Кальций взаимодействует с каждым веществом ряда: А.Гидроксид натрия, водород, кислород. Б. Вода, уксусная кислота, хлор. В.Оксид цинка, этанол, фенол (расплав). Г. Серная кислота, вода, гидроксид калия. 10.(3 балла). Вещества, взаимодействию которых соответствует ионное уравнение СО + 2Н+ = Н20 + С02|: А. Карбонат натрия и соляная кислота. Б. Карбонат кальция и уксусная кислота. В.Гидрокарбонат калия и азотная кислота. Г. Карбонат бария и вода. ЧАСТЬ Б. Задания со свободным ответом 11. (10 баллов). Напишите уравнения реакций, с помощью которых можно осуществить превращения 1 2 3 NaH < Na > Na202 ► > Na20 NaOH > Na2S04. 12.(6 баллов). Дайте характеристику превращения 1 из задания 11 с точки зрения различных признаков классификации. Выберите ОВР, укажите окислитель и восстановитель. Превращение 5 рассмотрите в свете ТЭД. 13. (4 балла). Определите объем (н. у.) углекислого газа, который образуется при растворении в азотной кислоте 250 г известняка, содержащего 20% примесей. Вариант 3 ЧАСТЬ А. Тестовые задания с выбором ответа 1.(3 балла). Знаки химических элементов, имеющих сходное строение внешнего энергетического уровня: А. Мп и Вг. В. Si и Р. Б. N и Р. Г. Сг и Si. 2.(3 балла). Номер группы (для элементов главных подгрупп) в Периодической системе химических элементов определяет: А.Число протонов в ядре атома. Б. Число электронов в наружном электронном слое. В.Число электронов в атоме. Г. Заряд ядра атома. 3.(3 балла). Формула вещества с ковалентной полярной связью и молекулярной кристаллической решеткой: А. Вг2. В. NaCl. Б. С (графит). Г. С02. 4.(3 балла). Газ тяжелее воздуха: А. Азот. В. Водород. Б. Хлор. Г. Аммиак. 5.(3 балла). Тип реакции, с помощью которой можно осуществить превращение KN03 ---- > KN02: А. Замещения. В. Разложения. Б. Обмена. Г. Соединения. 6.(3 балла). Формула соли, раствор которой имеет кислотную среду: A. Na2C03. В. А1С13. Б. Ba(N03)2. Г. K2S04. 7.(3 балла). Условие, необходимое для смещения химического равновесия вправо в реакции, уравнение которой 2S02(r) + 02(r) 2S03(r) + Q: a. Увеличить давление. Б. Повысить температуру. b. Уменьшить концентрацию кислорода. Г. Применить катализатор. 8.(3 балла). Окислитель в реакции, уравнение которой 2А1 + Fe203 = А1203 + 2Fe + Q : о о + з + з А. А1. Б. Fe. В. А1. Г. Fe. 9.(3 балла). Ряд веществ, каждое из которых взаимодействует с натрием: А.Бензол, вода, уксусная кислота. Б. Водород, метан, фенол (расплав). В.Вода, кислород, этанол. Г. Вода, оксид углерода (IV), стеариновая кислота. 10.(3 балла). Превращение, которое можно осуществить в одну стадию: A. N2 ---- > HN03. В. Си --- > Си(ОН)2. Б. H2Si03 ---- > Si02. Г. S --------- > S03. ЧАСТЬ Б. Задания со свободным ответом 11.(S баллов). Напишите уравнения реакций, с помощью которых можно осуществить превращения 1 2 3 4 S ---- » S02 --- > S03 ---- > H2S04 --- > BaS04. 12.(8 баллов). Дайте характеристику превращения 1 из задания 1 1 с точки зрения различных признаков классификации. Выберите ОВР, укажите окислитель и восстановитель. Превращение 4 рассмотрите в свете ТЭД. 13. (4 балла). Рассчитайте массу осадка, образующегося при сливании 300 г 14,2%-го раствора сульфата натрия с раствором нитрата бария, взятым в избытке. Вариант 4 ЧАСТЬ А. Тестовые задания с выбором ответа 1.(3 балла). Знаки химических элементов, имеющих сходное строение внешнего электронного слоя: A. S и Сг. В. Р и As. Б. А1 и Si. Г. А1 и Sc. 2.(3 балла). Порядковый номер элемента в Периодической системе соответствует: А.Заряду ядра атома. Б. Числу электронов на внешнем энергетическом уровне. В.Числу электронных слоев. Г. Числу нейтронов в ядре атома. 3.(3 балла). Формула вещества с ковалентной неполярной связью и атомной кристаллической решеткой: А. С (алмаз). В. КС1. Б. Си. Г. S02. 4 . ( 3 балла). Качественной является реакция углекислого газа: А. С хлоридом бария. В. С соляной кислотой. Б. С нитратом серебра. Г. С известковой водой. 5 . ( 3 балла). Тип реакции, с помощью которой можно осуществить превращение С 2Н6 * С2Н4 + Н2: А. Гидрирования. Б. Дегидратации. В. Дегидрирования. Г. Изомеризации. 6.(3 балла). Условие, необходимое для смещения химического равновесия в реакции, уравнение которой ЗН2 + N2 <=± 2NH3 + Q , в сторону продуктов реакции: А.Увеличение температуры. Б. Увеличение давления. В.Применение катализатора. Г. Уменьшение концентрации азота. 7.(3 балла). Восстановитель в реакции, уравнение которой 2СО + 02 ---- > 2С02 + Q : +2 +4 А. С. 0 Б. С. -2 В. О. Г. О. 8.(3 балла). Формула вещества X в уравнении реакции Си + 2H2S04(конц.) = CuS04 + X + 2Н20: А. Н2. Б. S02. В. H2S. Г. S03. 9.(3 балла). Формула вещества, при гидролизе которого образуется ацетилен: А. СаС2. Б. А14С3. В. A12S3. Г. Zn3P2. 10.(3 балла). Вещества, взаимодействию которых соответствует ионное уравнение Н+ + ОН' = Н20: А.Хлорид натрия и нитрат серебра. Б. Гидроксид калия и азотная кислота. В.Гидроксид калия и хлорид меди (II). Г. Гидроксид кальция и оксид углерода (IV). ЧАСТЬ Б. Задания со свободным ответом 11.(8 баллов). Напишите уравнения реакций, с помощью которых можно осуществить превращения 1 2 3 4 С ---- > СО -- ► С02 -- ► Н2С03 -- > CaCO3. 12.(8 баллов). Дайте характеристику превращения 1 из задания 1 1 с точки зрения различных признаков классификации. Выберите ОВР, укажите окислитель и восстановитель. Превращение 4 рассмотрите в свете ТЭД. 13.(4 балла). Рассчитайте количество вещества соли, образующейся при пропускании 67,2 л (н. у.) хло- роводорода через раствор гидроксида калия. Вариант 5 ЧАСТЬ А. Тестовые задания с выбором ответа 1.(3 балла). Знаки химических элементов, имеющих наибольшую разницу значений атомных радиусов: A. Na и С1. В. С1 и Аг. Б. As и Se. Г. Be и Mg. 2.(3 балла). В главной подгруппе пятой группы Периодической системы с увеличением порядкового номера элемента: А.Уменьшается радиус атома и уменьшается электроотрицательность. Б. Увеличивается радиус атома и уменьшается электроотрицательность. В.Уменьшается радиус атома и увеличивается электроотрицательность. Г. Увеличивается радиус атома и постоянная электроотрицательность. 3.(3 балла). Кристаллическая решетка химического соединения, элементами с электронными конфигурациями ...5s2 и ...4s24p5: А. Атомная. образованного В. Ионная. Б. Молекулярная. Г. Металлическая. 4.(3 балла). Утверждение, справедливое для жидкостей: А.Небольшие расстояния между молекулами. Б. Малосжимаемы. В.Текучи. Г. Все ответы верны. 5.(3 балла). Тип реакции, с помощью которой можно осуществить превращение СН3СООН -- ► СН3СООСН3: А. Гидратации. В. Дегидрирования. Б. Этерификации. Г. Изомеризации. 6.(3 балла). Пара формул солей, в водных растворах которых фенолфталеин имеет одинаковую окраску: A. Ba(N03)2 и K2S. В. CH3COONa и К3Р04 Б. CH3ONa и MgCl2. Г. Zn(N03)2 и А1С13. 7.(3 балла). При повышении температуры на 20 °С (температурный коэффициент реакции равен 3) скорость химической реакции увеличится: А. В 3 раза. В. В 27 раз. Б. В 9 раз. Г. В 81 раз. +5 +7 +6 +6 8.(3 балла). Среди частиц N, M n , S , Сг только окислительные свойства могут проявлять: А. Одна. В. Три. Б. Две. Г. Четыре. 9.(3 балла). Ряд формул веществ, с каждым из которых взаимодействует оксид бария: А. НС1, Н2, HN03. В. S03, КОН, Fe(OH)2. Б. Р205, H2S04, Mg. Г. Si02, Н20, СН3СООН. 10.(3 балла). Формула вещества, название которого дано неверно: А.Ca3N2 — нитрид кальция. Б. NF3 — нитрид фтора. В.Na3N — нитрид натрия. Г. NI3 — иодид азота. ЧАСТЬ Б. Задания со свободным ответом 11.(8 баллов). Определите вещества Х1; Х2, Х3 в схеме превращений 1 2 3 уксусная кислота -----> Х1 ---> Х2 ----> Х3. Как называется вещество Х3 в медицине? 12.(6 баллов). Среди веществ, формулы которых ZnS, KN03, FeS04, KMn04, Na3[Cr(OH)6], выберите вещества, вступающие в реакции ионного обмена с соляной кислотой. Одно из уравнений запишите в молекулярном и ионном виде. 13.(6 баллов). Натрий, полученный электролизом расплава 46,8 г хлорида натрия, обработали избытком воды. Рассчитайте массу 10%-го раствора серной кислоты, необходимой для нейтрализации полученного раствора. Критерии оценивания ответов. Все предлагаемые работы состоят из двух частей и являются комбинированными. Часть А содержит тестовые задания с выбором одного правильного ответа и задания на установление соответствия. Часть Б содержит задания со свободной формой ответа и предусматривает написание уравнений реакций, условий их проведения, установление последовательности и решение задач Контрольная работа оценивается в 50 баллов. Выполнение каждого задания теста оценивается тремя баллами. Заданий со свободной формой ответа, как правило, три, но они оцениваются гораздо более высоким баллом. В таких заданиях оцениваются не только полнота и правильность выполнения (максимальный балл), но и отдельные этапы и элементы. Примерная шкала перевода в пятибалльную систему оценки 0—25 баллов — «2» (0—50%) 26—35 баллов — «3» (52—70%) 36—43 балла — «4» (72—86%) 44—50 баллов — «5» (88—100%) Завершается пособие разноуровневой итоговой контрольной работой. Материал: Химия. 11 класс : контрольные и проверочные работы к учебнику О.С. Габриеляна «Химия». 11 класс. Базовый уровень» / О.С. Габриелян, П.Н. Березкин, А.А. Ушакова и др. – 2-е изд., - М.: Дрофа, 2010. – 220 с.