Календарно-тематическое планирование (базовый уровень 1
advertisement

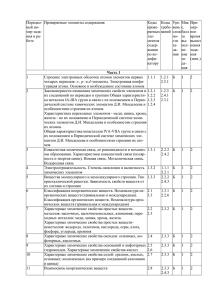
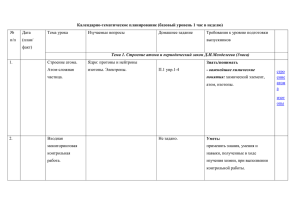
Календарно-тематическое планирование (базовый уровень 1 час в неделю) № п/п Дата Тема урока Изучаемые вопросы Эксперимент. Требования к уровню подготовки (план/ Д. – демонстрационный выпускников факт) Л. – лабораторный Тема 1. Строение атома и периодический закон Д.И.Менделеева (3часа) 1. Строение атома. Ядро: протоны и нейтроны Знать/понимать Атом-сложная изотопы. Электроны. Электронная - важнейшие химические понятия: частица. оболочка. Энергетический уровень. химический элемент, атом, изотопы. Атомные орбитали. s-, pэлементы. Особенности строения электронных оболочек атомов переходных элементов. 2. Входная мониторинговая контрольная работа. 3. Электронные Электронная оболочка. Знать/понимать конфигурации Энергетический уровень. Атомные -особенности строения электронных атомов химических орбитали. s-, p, d, f - элементы. оболочек атомов переходных элементов элементов. Особенности строения электронных оболочек атомов 1 переходных элементов. 4. Периодичес- Периодическая система химических Д. Различные формы Знать/понимать кий закон элементов Д.И.Менделеева – периодической - основные законы химии: Д.И.Менделеева в графическое отображение системы химической - периодический закон Д.И.Менделеева. свете учения о периодического закона. Физический системы Уметь строении атома смысл порядкового номера - характеризовать: Д.И.Менделеева. элемента, номера периода и номера элементы малых периодов по их группы. Валентные электроны. положению в периодической системе Причины изменения свойств Д.И.Менделеева. элементов в периодах и группах (главных подгруппах). Значение периодического закона. Тема 2. Строение вещества (11часов) 1 (5) Ионная Ионная связь. Катионы и анионы. Д. Модели ионных Знать/понимать химическая Ионные кристаллические решетки. кристаллических - важнейшие химические понятия: связь Свойства веществ с этим типом решеток (хлорид натрия) вещества немолекулярного строения кристаллических решеток. (ионные кристаллические решетки); ион, ионная химическая связь (вещества ионного строения); 2 Уметь - определять: заряд иона, ионную связь в соединениях; - объяснять: природу ионной связи. 2 (6) Ковалентная Электроотрицательность. Полярная и Д. Модели атомных и Знать/понимать химическая неполярная ковалентные связи. молекулярных - химические связь Механизмы ее образования связи кристаллических понятия:электроотрицательность, (обменный и донорно-акцепторный). решеток валентность, степень окисления, Молекулярные и атомные вещества молекулярного и атомного кристаллические решетки. Свойства строения. веществ с этими типами Уметь кристаллических решеток. - определять: Степень окисления и валентность валентность и степень окисления химических элементов. химических элементов, ковалентную (полярную и неполярную) связь в соединениях. - объяснять: природу ковалентной связи. 3(7) Металлическая Особенности строения атомов Д. Модели Знать/понимать химическая металлов. Металлическая химическая металлических - химическое понятие: связь связь и металлическая кристаллических металлическая связь, вещества кристаллическая решетка. Свойства решеток. металлического строения. 3 веществ с металлической связью. Уметь - объяснять: природу металлической связи - определять: металлическую связь. 4 (8) Водородная Межмолекулярная и Д. Модель молекулы химическая связь внутримолекулярная водородная связь. ДНК. Значение водородной связи для организации структур биополимеров. Единая природа химической связи. 5 (9) Газообразное Три агрегатных состояния воды. Д. Модель молярного Знать/понимать состояние Особенности строения газов. объема газов - важнейшие химические понятия: вещества Молярный объем газообразных Д. Три агрегатных моль, молярная масса, молярный объем. веществ. Представители газообразных состояния воды. веществ: водород, кислород, аммиак, углекислый газ, этилен. Их получение, собирание, распознавание. 6 (10) Практическая Химический эксперимент по Уметь работа №1 получению, собиранию и -выполнять химический эксперимент: «Получение, распознаванию водорода, кислорода, по распознаванию водорода, кислорода, собирание и углекислого газа, аммиака и этилена. углекислого газа, аммиака, этилена распознавание 4 газов» 7 (11) Жидкое и Вода, ее биологическая роль. Л. Ознакомление с твердое Применение воды. Жесткость воды и минеральными водами состояние способы ее устранения. Кислые соли. вещества Минеральные воды. Жидкие кристаллы и их использование. Кристаллическое и аморфное состояние вещества. Применение аморфных веществ 8 (12) Дисперсные Понятие о дисперсных системах. Д. Образцы различных системы Дисперсная фаза и дисперсионная дисперсных систем среда. Классификация дисперсных систем. Грубодисперсные системы. Понятие о коллоидах и их значение (золи, гели) 9 (13) Состав Закон постоянства состава веществ. Знать/понимать вещества. Смеси Вещества молекулярного и - важнейшие химические понятия: немолекулярного строения. вещества молекулярного и Молекулярная формула. Формульная немолекулярного строения 5 единица вещества. Массовая и - основные законы химии: объемная доля компонента в смеси. закон постоянства состава веществ Решение задач 10 Обобщение и Выполнение упражнений и решение Л. Определение типа Знать/понимать (14) систематизация задач кристаллической - теорию химической связи решетки вещества и Уметь описание его свойств - объяснять: природу химической связи, знаний по теме 2 зависимость свойств веществ от их состава и строения - определять: тип химической связи в соединениях 11 Контрольная (15) работа №1 по теме 2 «Строение вещества» Тема 3. Химические реакции (9часов) 6 1-2 Классификация Реакции, протекающие без изменения Д. Превращение Знать/понимать (16- химических состава веществ: аллотропия,. красного фосфора в - химические понятия: 17) реакций в аллотропные модификации углерода, белый. аллотропия, изомерия, гомология, неорганической серы, фосфора, олова и кислорода; Д. Модели молекул углеродный скелет, и органической изомеры,. изомерия, реакции н-бутана и изобутана, тепловой эффект реакции химии изомеризации. Причины многообразия гомологов бутана. - основные теории химии: веществ: аллотропия и изомерия, Л. Реакции обмена строения органических соединений гомология. идущие с образованием Реакции, идущие с изменением осадка, газа и воды. состава веществ: реакции соединения, разложения, замещения, обмена. Реакции соединения, протекающие при производстве серной кислоты. Экзо - и эндотермические реакции. Тепловой эффект химических реакций. Термохимические уравнения. 7 3 (18) Скорость Скорость химической реакции. Д. Зависимость скорости Знать/понимать химической Факторы, влияющие на скорость химических реакций от - химические понятия: скорость реакции химической реакции. Катализаторы и природы веществ, химической реакции, катализ. катализ. Представление о ферментах концентрации и Уметь как биологических катализаторах температуры. - объяснять: зависимость скорости белковой природы Л. Получение кислорода химической реакции от различных разложением пероксида факторов. водорода с помощью катализатора (MnO2)и каталазы сырого картофеля. Д. Модель «кипящего слоя» 4 (19) Обратимость Необратимые и обратимые Знать/понимать химических химические реакции. Химическое - важнейшеехимическое понятие: реакций равновесие и способы его смещения. химическое равновесие Общие представления о Уметь промышленных способах получения - объяснять: зависимость положения веществ на примере производства химического равновесия от различных серной кислоты факторов 8 5 (20) Роль воды в Истинные растворы. Растворение как Д. Растворение Знать/понимать химических физико-химический процесс. Явления, окрашенных веществ в - важнейшие химические понятия: реакциях происходящие при растворении воде: сульфата меди растворы, электролит и неэлектролит, веществ, - разрушение (II),перманганата калия, электролитическая диссоциация, кристаллической решетки,диффузия, хлорида железа (III) - основные теории химии: диссоциация, гидратация, диссоциация теория электролитической диссоциации электролитов в водных растворах. Уметь Степень электролитической - определять:заряд иона диссоциации, Сильные и слабые электролиты. Кислоты, основания, соли в свете ТЭД 6 (21) Гидролиз Гидролиз неорганических и Л. Различные случаи Уметь органических соединений. Среда гидролиза солей - определять: водных растворов: кислая, характер среды в водных растворах нейтральная, щелочная. Водородный неорганических соединений показатель (рН) раствора. 7 (22) Окислительно- Степень окисления. Определение Д. Простейшие Знать/понимать восстановительн степени окисления элементов по окислительно - - важнейшие химические понятия: ые реакции формуле соединения. Понятие об восстановительные степень окисления, окислитель и окислительно-восстановительных реакции: взаимодействие восстановитель, окисление и реакциях. Окисление и цинка с соляной восстановление. восстановление, окислитель и кислотой и железа с Уметь 9 восстановитель. Электролиз сульфатом меди (II) растворов и расплавов (на примере степень окисления химических хлорида натрия). Практическое элементов, окислитель и восстановитель применение электролиза 8 (23) Обобщение и Выполнение упражнений и решение систематизация задач знаний по теме 3 9 (24) - определять: Контрольная работа №2 по теме 3 «Химические реакции» Тема 4. Вещества и их свойства (10 часов) 10 Положение металлов в ПСХЭ Д.И. Д. Образцы металлов. Знать (25- Менделеева. Общие физические Д. Взаимодействие - важнейшие вещества и материалы: 26) свойства металлов. Взаимодействие щелочных и основные металлы и сплавы. металлов с неметаллами (хлором, щелочноземельных Уметь серой, кислородом). Взаимодействие металлов с водой. - характеризовать:элементы металлы щелочных и щелочноземельных Д. Взаимодействие малых периодов по их положению в металлов с водой. Электрохимический железа с серой, меди с периодической системе химических ряд напряжений металлов, кислородом. элементов; 1-2 Металлы взаимодействие металлов с растворами Д. Горение железа и общие химические свойства металлов; кислот и солей. Общие способы - объяснять: зависимость свойств магния в кислороде. получения металлов. Понятие о металлов от их состава и строения коррозии металлов, способы защиты от коррозии. Сплавы. 3 (27) Неметаллы Положение неметаллов в ПСХЭ Д.И. . Л. Знакомство с Уметь Менделеева. Сравнительная образцами неметаллов и - характеризовать: элементы неметаллы характеристика галогенов как их природными малых периодов по их положению в наиболее типичных представителей соединениями. Д. периодической системе химических неметаллов. Окислительные свойства Возгонка йода. элементов; общие химические свойства неметаллов (взаимодействие с Д. Изготовление йодной неметаллов; металлами и водородом) спиртовой настойки. - объяснять: зависимость свойств Восстановительные свойства Д. Взаимодействие неметаллов от их состава и строения неметаллов (взаимодействие с более хлорной воды с 11 электроотрицательными неметаллами). раствором бромида 4 (28) Кислоты Благородные газы (йодида) калия Кислоты неорганические и Л. Испытание растворов Знать/понимать органические. Классификация кислот. кислот индикаторами -важнейшие вещества и материалы: Химические свойства кислот: Л. Взаимодействие серная, соляная ,азотная, уксусная взаимодействие с металлами, соляной кислоты и кислоты основными оксидами, основаниями, раствора уксусной Уметь солями, спиртами. кислоты с металлами, - характеризовать: основаниями, солями. общие химические свойства кислот -называть: кислоты по «тривиальной» или международной номенклатуре: - определять: характер среды водных растворов кислот 12 5 (29) Основания Основания неорганические и Л. Испытание растворов Уметь органические. Классификация оснований - характеризовать: общие химические оснований. Химические свойства индикаторами. свойства оснований; неорганических оснований: Л. Получение и свойства - называть основания по «тривиальной» взаимодействие с кислотами, нерастворимых и международной номенклатуре; кислотными оксидами и солями. оснований. - определять: характер среды водных Разложение нерастворимых растворов щелочей оснований. 6 (30) Соли Классификация солей: средние, Д. Образцы природных Уметь кислые, основные. Химические минералов, содержащих - характеризовать: общие химические свойства солей: взаимодействие с хлорид натрия, карбонат свойства солей; кислотами, щелочами, металлами, кальция, фосфат - называть: соли по «тривиальной» и солями. Представители солей и их кальция, международной номенклатуре; значение. Хлорид натрия, фосфат гидроксокарбонат меди - определять: характер среды водных кальция, карбонат кальция (средние (II) растворов солей соли); гидрокарбонаты натрия и Л. Испытание растворов аммония (кислые соли); солей индикаторами гидроксокарбонат меди (II) – малахит Д. Качественные (основная соль). Качественные реакции на катионы и реакции на хлорид-.сульфат-, анионы карбонат- ионы, катион аммония, катионы железа (II) и (III) 13 7 (31) Практическая Распознавание неорганических и Уметь работа №2. органических соединений - выполнять химический эксперимент по Решение распознаванию важнейших эксперименталь неорганических и органических ных задач на соединений идентификацию неорганических и органических соединений 8 (32) 9 (33) Обобщение и Понятие о генетической связи и Уметь систематизация генетических рядах. Генетический ряд - характеризовать: общие химические знаний по теме 4 металла. Генетический ряд неметалла. свойства металлов, неметаллов и Особенности генетического ряда в основных классов неорганических и органической химии. органических соединений Контрольная работа №3 по теме 4 «Вещества и их свойства» 10 Анализ (34) контрольной работы. Резерв. 14 15