Материал для учащихся Оксиды. Классификация оксидов –
advertisement
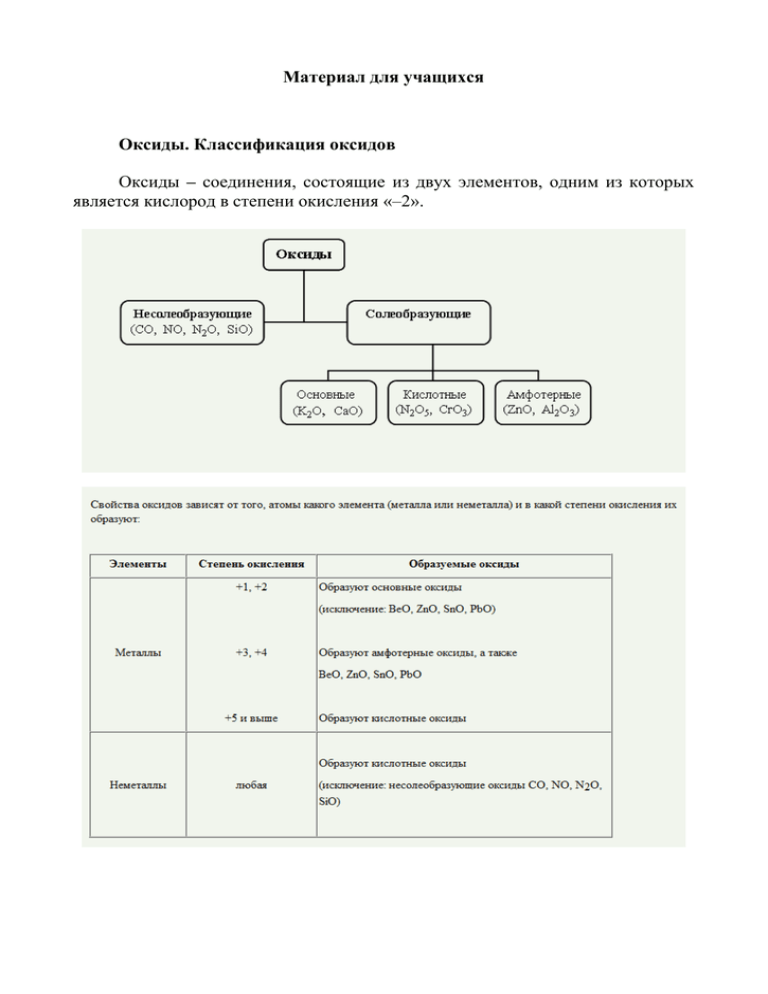
Материал для учащихся Оксиды. Классификация оксидов Оксиды – соединения, состоящие из двух элементов, одним из которых является кислород в степени окисления «–2». Химический состав воздуха Вещества Объёмный % Азот 78,08 Кислород 20,95 Аргон 0,93 Углекислый газ 0,03 Неон 1,25 10-3 Гелий 5,2·10-4 Основные источники и вещества, загрязняющие воздух Вещества, загрязняющие атмосферу Оксиды углерода (CO2, CO) Оксиды серы ( SO2,SO3) Оксиды азота (NO,NO2) Взвешенные вещества (пыль, сажа и др.) Основные источники загрязнения Транспорт, сжигание угля, нефтепродуктов, торфа, сланцев, древесины Производство железа, меди, серной кислоты Транспорт, производство азотной кислоты Промышленные предприятия, теплостанции, электростанции, цементные заводы Угарный газ (СО) − несолеобразующий оксид, попадает в воздух при сжигании топлива в печах и двигателях автомобилей. Ядовит, т.к. соединяется с гемоглобином крови, в результате чего кровь не способна переносить кислород из лёгких к тканям. Углекислый газ (СО2) − кислотный оксид, входит в состав воздуха. Не ядовит. Малозаметная «вуаль», состоящая из СО2, воды, озона и метана, является в атмосфере своеобразным фильтром, пропуская 70% солнечного излучения, она задерживает отражаемые Землёй тепловые лучи. Вследствие этого у поверхности нашей планеты, словно под стеклянной крышей оранжереи, температура поддерживается более-менее на одном уровне: от − 40 до + 40°С. Однако всё возрастающее количество сжигаемого топлива приводит к тому, что содержание углекислого газа в атмосфере неуклонно увеличивается, это неизбежно ведёт к повышению средней температуры поверхности Земли на 2−4°С. Диоксид серы − кислотный оксид SO2, ядовит, вызывает заболевания дыхательных путей. SO2 применяется в качестве отбеливателя. Им окуривают склады, подвалы для уничтожения плесени. Растворяясь в воде, образует сернистую кислоту, которая, в свою очередь, окисляется кислородом воздуха до серной, в результате чего возникают «кислотные дожди». Мировой рекорд по выпадению «кислотного дождя» принадлежит шотландскому городу Питлохри, где 10 апреля 1973 года выпал дождь с pH=2,4. Кислотные дожди разрушают почву, изменяют состав почвенных организмов, вызывают гибель ценных видов промысловых рыб, исчезает уникальная растительность, разрушаются здания, памятники. У человека SO2 раздражает кожу и слизистые оболочки. Оксиды азота. NO − бесцветный газ, NO2 − бурый газ со специфическим запахом, ядовит. Поступают в атмосферу при сгорании топлива (90%) и из выбросов химической промышленности (5%). При контакте NO2 с влажной поверхностью лёгких происходит образование азотистой и азотной кислот, которые поражают альвеолярную ткань, что приводит к отёку легких. Фотохимический смог − вторичное загрязнение воздуха, возникающее в процессе разложения первичных загрязняющих веществ солнечными лучами. Главный ядовитый компонент − озон. Под воздействием яркого солнечного света начинается распад молекул NO2 на NO и атомарный кислород. Последний реагирует с молекулами кислорода, образуя озон, который накапливается в тропосфере. Такие реакции называются фотохимическими. Казалось бы, озон, являясь сильным окислителем, должен превратить оксид азота NO в диоксид NO2, а сам стать кислородом. Но этого не происходит. Оксид азота вступает в реакции с веществами выхлопных газов, и опять образуется избыток озона. Возникает циклическая реакция, в результате которой в атмосфере постепенно накапливается озон. Образованию фотохимического смога способствует безветренная солнечная погода, которая сопровождается инверсией: более холодный воздух опускается в нижние слои атмосферы, тем самым не даёт возможности подниматься вверх вредным выбросам, и их концентрация около поверхности Земли значительно возрастает. Все компоненты смога обладают высокой химической активностью, легко окисляются или сами являются сильнейшими окислителями. Оксиды азота вызывают раздражение слизистых оболочек, поражение верхних дыхательных путей, повышают риск онкологических заболеваний.










