Южное окружное управление образования г. Москвы КОНКУРСНАЯ РАБОТА
advertisement

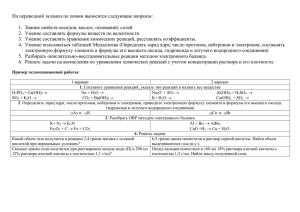
Южное окружное управление образования г. Москвы КОНКУРСНАЯ РАБОТА Тема: « Разработка элективного курса для старших классов (10-11 класс) «Цифровой лабораторный эксперимент». Сусанова Тамара Дмитриевна ГОУ СОШ № 866 Разрешаю публикацию разработки Введение Цели курса: углубление знаний учащихся по теме « Химические реакции»; предоставление возможности учащимся удовлетворить интересы в области химии при проведении цифрового лабораторного эксперимента. Что содержит: данный элективный курс посвящён рассмотрению вопросов, связанных с особенностями протекания химических реакций. Обращается внимание на вопросы углубления знаний о возможных критериях протекания химических реакций в заданном направлении при использовании таких понятий как энтальпия, энтропия, энергия Гиббса, потенциал. Это даёт возможность применения данных критериев в стандартных и нестандартных условиях. При проведении цифровых лабораторных экспериментов учащиеся приобретают умения и навыки: по определению температуры, давления, теплового эффекта химической реакции; наблюдают за зависимостью давления газа от его температуры; влиянием изменяющегося объёма газа на давление в системе; знакомятся с условиями плавления и кристаллизации веществ; наблюдают за процессами растворения веществ в воде и делают выводы о возможностях протекания этих реакций, а также о их тепловом эффекте, т.е. учатся предсказывать и определять количественные результаты . Школьники приобретают навыки титрования, закрепляют знания о видах концентрации и её расчётах, учатся готовить растворы разных видов ( молярные, с определённой процентной концентрацией ), определять реакцию среды, используя такие понятия как рН и рОН , предсказывать их. Рассматриваются и вопросы, связанные с процессами окисления и восстановления, влияние катализатора на скорость протекания химических реакций. При выполнении данных работ учащиеся учатся работать с графиками. Какие результаты ожидаются Данный элективный курс должен помочь формированию систематического подхода к рассмотрению химических процессов. Учащиеся должны уметь предсказывать возможность протекания одной или другой химической реакции, понимать условия их протекания и видеть от чего зависит скорость реакции. Важно их понимание практической направленности производимых опытов. Школьники должны развить умения и навыки использования химических веществ и приборов при проведении эксперимента, по соблюдению правил обращения с химическими соединениями. Они должны научиться решать расчётные задачи на разные виды концентрации; производить расчёты по термохимическим уравнениям; сравнивать тепловые эффекты различных реакций; производить вычисления по газовым законам; определять реакцию среды, используя рН и рОН. Необходимо, чтобы учащиеся понимали сущность процесса катализа и необходимость использования катализатора в химических процессах, как веществ ускоряющих реакции. Понимание процессов окисления и восстановления, что такое окислитель и восстановитель, составление окислительно- восстановительных реакций по схеме электронного баланса – вот что также должно быть понято учащимися. Все эти знания и умения школьников помогут им при изучении данной темы в школьном курсе, дадут возможность более глубоко рассмотреть эту тему и подготовиться к олимпиаде, сдаче ЕГЭ, поступлению в ВУЗ, сориентируют при выборе профессии, заложат практические умения и навыки экспериментальной работы, научат правилам безопасного обращения с химическими веществами и оборудованием. 1.Тематический план элективного курса «Химические реакции». Курс расcчитан на 17 часов ( 1час в неделю ) для профильного класса в 10 — 11 классе. № п/п Тема занятия Изучаемые понятия Программа Часы 1 Растворение нитрата аммония в воде Закон сохранения энергии, внутренняя энергия, эндотермические реакции, тепловой эффект реакции, термохимические уравнения, стандартная энтальпия, критерий Бертло-Томсена для определения возможности протекания химического процесса Решение задач по термохимическим уравнениям, определение теплоты образования, вычисление поглощённой энергии. 2 2 Тепловой эффект горения топлива Закон сохранения энергии, внутренняя энергия, экзотермические реакции, термохимические уравнения, теплота образования, закон Гесса Вычисление теплового эффекта реакции, определение типа реакции, сравнение тепловых эффектов горения разных видов топлива, вычисление по термохимическим уравнениям 2 3 Зависимость давления воздуха от его температуры Изохорный процесс, зависимость объёма от температуры, изменение давления при изменении температуры, закон Шарля, энтропия, энергия Гиббса Вычисление по закону Шарля, доказательство Р/Т=const, определение давления при изменении температуры 2 4 Плавление и кристаллизация Температура плавления, температура кристаллизации, температура замерзания, изменения агрегатных состояний, кинетическая энергия, потенциальная энергия, энтропия Расчеты по термохимическим уравнениям, расчет теплового эффекта химической реакции, вычисление теплоты образования соединений 2 5 Влияние изменения объёма на давление воздуха Закон Бойля-Мариотта, изотермический процесс, энергия Гиббса, энтропия Вычисление давления воздуха при изменении объёма, использование формулы РV=const, использование таблиц стандартной молярной энтропии, предсказание направления химической реакции по энтропии 2 6 Разложение пероксида водорода в присутствии оксида марганца IV Каталитические реакции, катализатор, гомогенный катализ, гетерогенный катализ, каталитические яды, регенерация катализатора, ферменты, ингибиторы Механизм действия катализаторов, сравнение ферментов с неорганическими катализаторами, ферментативный катализ и его механизм, определение зависимости скорости реакций от поверхности соприкосновения реагирующих веществ 2 7 Реакция гидроксида Титрование, виды концентраций, натрия с соляной степень диссоциации, константа кислотой диссоциации, произведение растворимости, водородный Приготовление растворов с определённой молярной и процентной концентрацией, решение задач на разные виды 2 8 Реакция хлорида меди с алюминием 9 Защита проекта показатель, значение водородного показателя для химических и биологических процессов концентрации, определение рН и рОН растворов, нахождение константы равновесия реакций по равновесным концентрациям и определение исходных концентраций веществ, определение степени диссоциации Окислитель, восстановитель, окисление, восстановление, схема электронного баланса, степень окисления Составление окислительновосстановительных реакций, решение задач по ОВР 2 1 Самостоятельная работа 1. Проработка материалов по учебнику. 2. Подготовка к лабораторной работе. 3. Оформление отчёта по лабораторной работе. 4. Решение дополнительных расчётных задач. Тема 1.1 Классификация реакций по тепловому эффекту — эндотермические. Работа 9.4. Растворение нитрата аммония в воде. Требования к знаниям: - сущность эндотермического процесса как реакции с поглощением тепла; - измерительная посуда и её назначение; - сравнение температуры в колбе с температурой окружающей среды. Требования к умениям: - рассчитывать удельную теплоту реакции, контролировать измерения температуры раствора; - определять измерения температуры в процессе реакции и время необходимое для достижения конечного значения температуры; - определять тип реакции; - изучать влияния добавления воды или увеличения окружающей температуры на процесс растворения; - производить расчёты по формуле удельной теплоты реакции. Сущность эндотермических реакций. Умение следить за изменением температуры в процессе растворения кристаллов соли в воде. Вычисление теплового эффекта реакции и удельной теплоты реакции. Выдвижение предположений относительно изменения температуры раствора при растворении в воде разных количеств соли. Кривые графика температур. Тема 1.2. Классификация реакций по тепловому эффекту — экзотермические. Работа 9.15. Тепловой эффект горения топлива. Требования к знаниям: - сущность метода сравнения между собой тепловых эффектов горения различных видов топлива; - умения определять выделяющееся тепло; - подсчёт энергии, потраченной на нагрев известного количества воды при сжигании различных видов топлива; - умения пользоваться формулой количества теплоты; - рассчитывать эффективность нагревателя в каждом эксперименте, удельную теплоту сгорания 1 г топлива. Требования к умениям: - пользоваться необходимыми формулами; - производить наблюдения и сравнивать кривые графиков; - определять тепловой эффект горения разных видов топлива. Сущность определения теплового эффекта реакции. Способы вычисления тепла выделяющегося при горении. Измерительная посуда и приборы, их назначение при определении теплового эффекта реакции. Кривые графиков теплоты сгорания топлива. Тема 1.3. Закон Г.И. Гесса и следствия из него. Работа 9.8. Газовые законы. Зависимость давления воздуха от его температуры. Требования к знаниям: сущность закона Г.И. Гесса и следствий из него; понятия об энтропии, энергии Гиббса; условия протекания реакций в зависимости от изменения энергии и энтропии; расчёты по закону Гесса; знания закона Шарля о давлении газа при постоянном объёме; измерительной посуды и её назначению. Требования к умениям: производить расчеты энтропии, энергии Гиббса, давления массы газа при постоянном объёме; сравнивать характер изменения давления и температуры газа; наблюдать зависимость давления от температуры; объяснять зависимость температуры и давления от времени, а также от объёма воды в колбе. Сущность закона Гесса и следствий из него. Вычисления энтропии, энергии Гиббса. Определение давления при постоянном и переменном объёме воды в колбе. Зависимость давления данной массы газа от температуры. Измерительная посуда, её назначение при изучении данной зависимости. Сравнение исходного графика с полученным в эксперименте. Тема 1.4. Вероятность протекания химических реакций. Работа 9.12. Плавление и кристаллизация. Требования к знаниям: сущность процессов кристаллизации и плавления как перехода веществ из жидкого состояния в твёрдое и из твёрдого в жидкое; температура плавления или кристаллизации; измерительная посуда и её назначение; сравнение температуры замерзания и плавления воды и сравнение их друг с другом. Требования к умениям: работа с приборами при проведении опытов; следить за изменением температуры воды в процессе отвердевания-плавления; определять температуру замерзания и плавления воды; наблюдать изменения кинетической и потенциальной энергии воды в ходе эксперимента; сравнивать графики кристаллизации и плавления воды. Сущность кристаллизации и плавления воды. Температура плавления или кристаллизации. Температура замерзания и плавления воды, и их сравнение. Определение температуры замерзания и плавления воды. Зависимость кинетической и потенциальной энергий друг от друга. Измерительная посуда и её назначение при определении температур кристаллизации и плавления. Кривые кристаллизации и плавления. Тема 1.5. Газовые законы. Работа 9.9. Влияние изменения объёма на давление воздуха. Требования к знаниям: сущность закона Бойля-Мариотта о зависимости объёма газа определённой массы при постоянной температуре от давления; измерительная посуда и её назначение; отличие газов от жидкостей и твёрдых тел по способности сжиматься; произведение расчётов между объёмом и давлением газа в плотно закрытой колбе; составление графика по разным количествам замеров; зависимость объёма и давления газа от температуры. Требования к умениям: производить расчёты по формулам; выяснение влияния изменений объёма на давление у газов; сравнивать кривые графиков, находить сходства и различия; проводить эксперименты при другой температуре воздуха. Сущность закона Бойля-Мариотта. Вычисления по формулам. Зависимость объёма газа от давления. Изменения объёма газов при изменении температур. Измерительная посуда и её назначение. Кривые зависимости объёмов газа от давления и температур. Тема 1.6. Классификации реакций по использованию катализатора. Работа 9.7. Химический катализ. Разложение пероксида водорода в присутствии оксида марганца (IV). Требования к знаниям: сущность процесса катализа; понятие о катализаторе как веществе ускоряющем реакцию; сохранение массы катализатора при химической реакции (на 1 этапе вступление в реакцию, а на 2 — регенерация); разноообразие катализаторов; каталитические реакции. Требования к умениям: отличать каталитические реакции от некаталитических; объяснять зависимость скоростей реакции от наличия катализатора; влияние на скорость реакции количества катализатора; сравнение эффективности различных катализаторов; сравнивать влияние на скорость реакции разные концентрации катализаторов; определение зависимости скорости каталитической реакции от температуры. Сущность катализатора. Многообразие катализаторов. Увеличение скорости реакций под действием катализаторов. Измерительная посуда и её назначение в каталитических реакциях. Кривые зависимости скорости каталитических реакций от разности давлений и изменения температуры. Тема 1.7. Классификация реакций по числу и составу реагирующих и образующихся веществ. Работа 9.1. Реакции нейтрализации. Реакция гидроксида натрия с соляной кислотой. Требования к знаниям: сущность титриметрического метода; метод кислотно-основного титрования; измерительная посуда и её назначение; способы выражения концентрации в титриметрическом анализе и приготовление стандартных растворов; изменение рН и рОН образующихся растворов с помощью индикаторов; Требования к умениям: выражать концентрацию раствора различными способами; готовить стандартные растворы; производить замеры изменения температуры и рН образующихся растворов. Сущность титриметрического анализа. Способы выражения концентрации в титриметрическом анализе. Вычисления в титриметрическом анализе. Титрование, титрованные растворы. Измерительная посуда, её назначение в титриметрическом анализе. Метод кислотно-основного титрования, его сущность. Индикаторы и принцип их выбора, интервал перехода окраски индикатора, показатель титрования. Кривые титрования. Тема 1.8. Классификация реакций по изменению степеней окисления элементов. Работа 9.2. Окислительно-восстановительные реакции. Реакция хлорида меди с алюминием. Требования к знаниям: сущность окислительно-восстановительных реакций; понятия об окислителе и восстановителе, процессах окисления и восстановления; степень окисления; изменения температуры в процессе окислительно-восстановительных реакций; составление окислительно-восстановительных реакций. Требования к умениям: определять степени окисления; находить окислитель и восстановитель; определять процессы окисления и восстановления; составлять окислительно-восстановительные реакции методом электронного баланса; рассчитывать удельную теплоту реакции по формуле. Сущность окислительно-восстановительных реакций. Определение окислителя и восстановителя(процессов окисления и восстановления). Вычисления теплоты реакции. Составление окислительно-восстановительных реакций методом электронного баланса. Кривые графика зависимости времени реакции от изменения температуры. Название практической работы Тепловой эффект растворения нитрата аммония Выполняемые задания Повторение материала о тепловом эффекте при растворении серной кислоты и гидроксида натрия в воде. Расчёт теплового эффекта химической реакции. Расчёты по термохимическим уравнениям. Рассчитайте тепловой эффект реакции окисления 70 кг азота в оксид азота (II ). При окислении 56 г азота в оксид азота (II ) требуется 280 кДж энергии. Составьте термохимическое уравнение этой реакции. Тепловой эффект горения топлива Тепловой эффект химической реакции. Первое начало термодинамики. Стандартная энтальпия. Энтальпия образования вещества. Расчёты по термохимическим уравнениям. Расчёт теплового эффекта химической реакции. Термохимическое уравнение реакции полного сгорания ацетилена: 2C2H2+ 5O2 = 4CO2 + 2H2O +2610кДж Сколько теплоты выделяется при использовании 1,12 л ацетилена? При сгорании 7г этилена выделяется 350 кДж теплоты. Определите тепловой эффект реакции. Зависимость давления воздуха от Закон Авогадро. Закон Шарля. Закон Гей-Люссака. Закон его температуры Бойля-Мариотта. Зависимость давления и температуры у газов. Химическое равновесие и его смещение. Связь между концентрацией и парциальным давлением газообразного вещества. Зависимость между давлением и температурой газообразных веществ. Расчёт степени протекания реакции стандартных/нестандартных условиях. Как надо изменить давление в гомогенной системе P Сl5 ↔ P Сl3 + Cl2 – 129 кДж чтобы сместить равновесие в сторону разложения P Cl5? Как изменится скорость реакции 2Fe+3CI2=2FeCI3, если давление в системе увеличить в 5 раз? Плавление и кристаллизация Энтальпийный фактор. Энтропийный фактор. Возможность протекания химической реакции в зависимости от температуры. Смещение равновесия под действием нагревания или охлаждения. Расчёт температуры равновероятности прямой и обратной реакции. В какую сторону сместится химическое равновесие системы: АВ↔А+В, если повысить температуру на 30°С? Температурные коэффициенты прямой и обратной реакции соответственно равны 2 и 3. В лаборатории проводят очистку загрязнённого дихромата калия методом перекристаллизации. Для этого растворяют 50 г загрязнённой соли в воде при 80°С, отфильтровывают раствор от механических примесей, охлаждают его до 20°С и затем отделяют выделившиеся кристаллы от маточного раствора вакуумным фильтрованием. Рассчитайте массу очищенного дихромата калия (теоретический выход), считая, что потери этого вещества в ходе эксперимента отсутствуют. Как следует изменить условия перекристаллизации, чтобы повысить теоретический выход очищенного вещества? Влияние изменения объёма на давление воздуха Закон Авогадро. Закон Бойля-Мариотта. Изотермический процесс. Зависимость давления от объёма газа. Во сколько раз изменится скорость реакции: 2А+В→А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза?(вещества газообразные). Как повлияет повышение давления на химическое равновесие в следующих системах: 1) 2NO↔N2O4; 2) CO+CI2↔COCI2; 3) H2+Br2↔2HBr; 4) CO+3H2↔CH4+H2O(г) . Разложение пероксида водорода в Гомогенный, гетерогенный катализ. Ферменты. присутствии оксида марганца IV Ингибиторы. Как объяснить, что для гидролиза сахарозы в лабораторных условиях её раствор подкисляют и затем кипятят, а в пищеварительном тракте гидролиз идёт при температуре всего 36,6°С, да ещё значительно быстрее? Титрование Повторение расчёта концентрации. Определение водородного показателя. Ионное произведение воды. Определение рН и степени протолиза в растворах протолитов. Факторы, способствующие рН среды. К 200 мл 0,2 М азотной кислоты добавили 15 мл 10%-го раствора гидроксида натрия (плотность 1,11 г/мл). Найдите водородный показатель полученного раствора? Рассчитайте водородный показатель раствора, приготовленного смешиванием 200 мл 0,1 М раствора серной кислоты и 100 мл 0,2 М раствора гидроксида калия с последующим разбавлением водой до объёма 10 л? Установите, какова среда (кислотная, щелочная, нейтральная) в растворах: а)гидроортофосфата натрия; б)дигидроортофосфата натрия. Какая из этих 2 солей в большей степени подвергается протолизу при одинаковых молярных концентрациях и температуре раствора? Реакция хлорида меди с алюминием Составление уравнений окислительновосстановительных реакций методом электронного баланса. Стандартный потенциал. Электрохимический ряд напряжения металлов. Сравнение силы окислителей и восстановителей. Использование стандартного электродного потенциала. Расчёт потенциалов. Стехиометрические расчёты по уравнениям ОВР. Составьте ОВР, расставьте коэффициенты методом электронного баланса, определите окислитель и восстановитель, процесс окисления и восстановления в схеме: CH3-COH+Ag2O→CH3-COOH+Ag↓ KMnO4+HCI=KCI+MnCI2+CI2↑+H2O. Определите объём образовавшегося газа, выделившегося при взаимодействии 180 г 5%-го раствора соляной кислоты с алюминием. Составьте схему электронного баланса, расставьте коэффициенты, укажите окислитель и восстановитель. 3. Формы и содержание текущего, промежуточного и итогового контроля. Текущий контроль знаний учащихся осуществляется путём устного собеседования при допуске к выполнению лабораторных работ, защиты отчётов по ним, путем опроса в начале практических занятий и решения задач у доски. Промежуточный контроль знаний учащихся осуществляется путем проведения тестов, включающих вопросы и задания по отработанным разделам. Итоговый контроль знаний, умений и навыков учащихся осуществляется на зачете, который проводится в конце учебного года. Примеры вопросов к зачёту: 1.Рассмотрите реакцию, отвечающую уравнениям: 2NO2(г)=2NO(г)+O2(г) Используя справочные данные, рассчитайте значение энтропии данной реакции. Будет ли данная реакция протекать самопроизвольно в стандартных условиях? 2.Рассмотрите равновесие: C(т)+СО2(г)↔2СО(г); ∆Н°›0. Как сместится химическое равновесие, если в системе: а) температура повышается (р = const); б) давление падает (Т=const)? Увеличится ли выход продукта при одновременном изменении температуры и давления? Ответ обоснуйте. 3.Рассчитаейте рН раствора фтороводородной кислоты (0,001 моль/л). Как изменится рН и степень протолиза фтороводородной кислоты, если данный раствор: а) нагреть; б) разбавить водой в 2 раза; в) добавить к нему фторид натрия (0,1 моль/л)? Дайте обоснованные ответы. 4.Рассчитайте водородный показатель раствора, приготовленного смешиванием 200 мл моль 0,1 М раствора хлороводорода и 100 мл 0,2 М раствора гидроксида бария с последующим разбавлением водой до объёма 10 л. Примерная тематика творческих работ 1.Диссоциация или протолиз? Сравнительная характеристика 2 теорий. 2.От термохимии растворения к технологии перекристаллизации. Вещества, применяемые в повседневной жизни. 3.Электронная теория кислот и оснований. 4.Зависимость энергии Гиббса от температуры. 5.Энтальпия и энтропия вещества: зависимость от температуры. 4.Перечень литературы и средств обучения 1.1. Литература Основная 1. Петрухин О.М. Аналитическая химия. Химические методы анализа.-М: Химия, 1993. 2. Мягковский С.А. Аналитическая химия.-Минск: Гос. ун-т. 1991. 3. Барсукова З.А. Аналитическая химия. М., Высш. Шк.,1990. 4.Леенсон И.А. Химические реакции: тепловой эффект, равновесие, скорость.- М.:Астрель,2002. 5.Лидин Р.А., Молочко В.А., Андреева Л.Л. Химия для школьников старших классов и поступающих в вузы. Теоретические основы. Вопросы. Задачи. Тесты – М.: Дрофа, 2004. 6. Лидин Р.А., Якимова Е.Е., Вотинова Н.А. Химия. 10-11 кл. Учебное пособие. – М.: Дрофа, 2000 Дополнительная литература 1. Клещев Н.Ф., Алферов Е.А., Базалей Н.В. и др. Задачник по аналитической химии.М: Химия,1993. 2. Ярославцев А.А. Сборник задач и управлний по аналитической химии. М:-Химия, 1993. 3. Логинов Н.Я., Воскресенский А.Г., Солодкин И.С. Аналитическая химия. М: Просвещение, 1979. 4.2 Средства обучения 1. Золотова В.И., Смотракова М.В. Растворы. Способы выражения концентрации растворов. Методические указания к изучению раздела аналитическая химия. Воронеж 1999г 2. Золотова В.И. Гравиметрический анализ. Методические указания к лабораторным работам по аналитической химии. Воронеж 1997г. 4. Смотракова М.В. Кислотно-основное титрование. Методические указания к лабораторным работам по аналитической химии. Воронеж 2002г. 5. Смотракова М.В. Окислительно-восстановительное титрование. Методические указания к лабораторным работам по аналитической химии. Воронеж 2002г.