Оптическая когерентная томография сетчатки глаза
advertisement

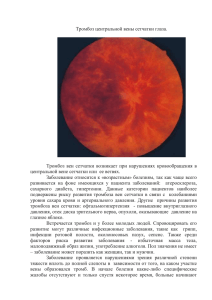
Spectral optic coherent tomography: principles and possibilities (Literary review) A.V. Svirin, Yu.I. Kiiko*, B.V. Obruch, A.V. Bogomolov Russian State Medical University of Roszdrav, *FGU VCGPH of Roszdrav, Moscow Authors discuss principles, diagnostic possibilities and types of new examination method – spectral optic coherent tomography which information value exceeds the OCT’s. Оптическая когерентная томография (ОКТ) широко используется в современной медицине. Это неинвазивный и высокоточный метод исследования, с помощью которого сталовозможным получать изображение поперечного среза исследуемых тканей in vivo. ОКТ была разработана в Массачусетском технологическом университете в конце 80–х годов ХХ века. ОКТ нашла применение во многих отраслях медицины – в гастроэнтерологии, кардиологии, урологии, дерматологии, стоматологии. Однако наибольшую популярность новая методика завоевала в диагностике заболеваний глаза. Самый известный прибор, реализующий технологию ОКТ в офтальмологии – Stratus OCT (Carl Zeiss Meditec) на данный момент был продан в количестве, превышающем 6 тыс. экземпляров. В мире насчитывается более тысячи статей и научных трудов, посвященных применению ОКТ в диагностике заболеваний глаза. Принципы метода Суть ОКТ заключается в измерении времени задержки светового луча, отраженного от исследуемой ткани. Поскольку современное оборудование не позволяет непосредственно измерять этот параметр на столь малых пространственных отрезках, работа ОКТ построена на принципах световой интерферометрии. До недавнего времени основой всех когерентных томографов был интерферометр Михельсона (time–domain OCT). Источником света в нем является суперлюминесцентный диод, позволяющий получать луч низкой когерентности. С помощью делителя световой пучок расщепляется на две равные части, одна из которых направляется на исследуемую структуру, вторая – на подвижное зеркало (опорное плечо). Исследователь путем смещения рабочей части прибора добивается того, чтобы расстояние до обоих объектов было одинаковым. После этого отраженные лучи суммируются, что вызывает эффект интерференции, регистрируемый фотодетектором. Полученная амплитуда интерферировавшей световой волны характеризует отражающую способность конкретной точки исследуемого объекта. Затем опорное плечо смещается и выполняется исследование следующей точки. В итоге формируется одномерный А–скан (axial scan). Получаемое путем суммирования нескольких А–сканов двухмерное изображение, по аналогии с ультразвуковым исследованием, называется В–сканом. Расстояние между точками А–скана определяет продольное (аксиальное) разрешение, между соседними А–сканами – поперечное. Основным фактором, ограничивающим возможности Time–domain OCT, является наличие механического элемента системы – подвижного зеркала опорного плеча. От точности и скорости его смещения напрямую зависят аксиальное разрешение и время сканирования. Максимальная продольная разрешающая способность ОКТ, полученная в лабораторных условиях, составляет 2–3 мкм. Этот результат достигнут на неподвижных объектах с использованием в качестве источника света фемтосекундного лазера. Однако коммерческий вариант данной системы не был реализован ввиду ее высокой стоимости. Максимальная разрешающая способность Time–domain ОКТ в клинике представлена в последней модификации Stratus OCT и составляет 8–10 мкм при скорости сканирования 400 А–сканов в секунду. Стандартное исследование, состоящее из 512 А–сканов, занимает, таким образом, более 1 секунды. Спектральная ОКТ Коренной перелом в технологии оптической когерентной томографии произошел с внедрением в практику спектральных интерферометров, использующих преобразование Фурье (spectral/Fourier domain). Их отличием от интерферометра Михельсона является наличие спектрометра и высокоскоростной CCD – камеры (CCD – charge–coupled device, русскоязычный аналог термина – ПЗС (прибор зарядовой связи). Источником света является широкополосный суперлюминесцентный диод, позволяющий получить низкокогерентный луч, содержащий несколько длин волн. Как и в time–domain OCT, световой импульс делится на две равные части, одна из которых отражается от фиксированного опорного плеча (зеркала), вторая – от исследуемого объекта. Затем сигналы суммируются, а проинтерферировавший луч света раскладывается на составные части спектра, которые одномоментно фиксируются CCD–камерой. Полученный спектр интерференции состоит из совокупности световых волн, отраженных от различных по глубине участков исследуемого объекта. Затем из полученного массива данных путем математического преобразования Фурье выделяются частотные составляющие, из которых формируется А–скан. Таким образом, получение линейного скана происходит не путем последовательного измерения отражающих свойств каждой отдельной точки пространства, а одномоментно. Глубина сканирования при этом равна зоне когерентности. Подобный принцип исследования позволяет преодолеть ограничивающие факторы, связанные со скоростью и точностью движения механических частей интерферометра, поскольку опорное плечо остается во время исследования неподвижным. Скорость сканирования спектральных ОКТ зависит от быстроты работы CCD–камеры и математического преобразователя, а аксиальная разрешающая способность – от чувствительности спектрометра. Поперечное разрешение всех типов ОКТ ограничивается аберрациями оптической системы глаза. Благодаря принципу своей работы, спектральные ОКТ позволяют выполнять более 25 тыс. линейных сканов в секунду, превосходя по этому параметру оптические томографыпредыдущего поколения более чем в 60 раз (некоторые модели – в 120 раз). Аксиальная разрешающая способность находится в пределах 3–8 мкм, поперечная – 10–15 мкм. К моменту написания статьи на мировом рынке было представлено 5 моделей спектральных оптических когерентных томографов c возможностью исследования заднего отрезка глаза: 1) RTVue–100 фирмы Optovue (США) – позволил совместить в одном приборе возможности исследования как переднего, так и заднего отрезка глазного яблока; 2) 3D OCT–1000 (Topcon) – обладает функциями фундус–камеры и сопоставления фотоснимка глазного дна с ОКТ изображением; 3) CIRRUS HD OCT (Carl Zeiss); 4) Soct Copernicus и Soct Copernicus HR совместного производства Reichert (США) – Optopol (Польша). Soct Copernicus HR обладает на сегодняшний день максимальной заявленной скоростью сканирования (55000 А– сканов в секунду) и аксиальным разрешением (3 мкм). Также под маркой Soct разработан спектральный ОКТ для исследования переднего отрезка глаза; 5) Spectralis HRA+OCT (Heidelberg Engineering) – ОКТ–приставка к лазерному сканирующему ангиографу HRA. Первым коммерческим прибором, в котором были реализованы возможности спектральной ОКТ глаза, стал RTVu–100 фирмы Optovue (США). Компания объявила о начале его производства в конце 2006 г. Именно этот прибор мы используем в работе нашей клиники, поэтому в дальнейшем основные технические характеристики и протоколы обследования приводятся исходя из возможностей RTVu–100. Улучшенные диагностические возможности Значительный прирост скорости и точности метода качественно изменил роль оптической когерентной томографии в диагностике заболеваний глаза. Чтобы понять всю значимость этих изменений, рассмотрим спектральную ОКТ с точки зрения ее клинического применения. Одной из самых главных проблем, возникающих при использовании томографов предыдущего поколения, является чувствительность метода к микродвижениям глазного яблока. Наибольшие погрешности вызывают так называемые микросаккады – непроизвольные быстрые движения с амплитудой 2–10 угловых мин и интервалом от 100 мс. Одно стандартное исследование на Stratus OCT (512 А–сканов) длится 1,28 сек. – за это время глазное яблоко 10–14 раз меняет свое положение. Подобный эффект негативно сказывается на конечной томограмме. Для нейтрализации появляющихся артефактов применяются методы графического сглаживания. Они эффективно выравнивают изображение, но могут скрывать локальные изменения, что вносит дополнительные затруднения в интерпретацию результатов. Спектральные когерентные томографы в отличие от time–domain OCT позволяют получить стандартный линейный профиль (1024 А–сканов) в среднем за 0,04 сек. За этот промежуток времени глазное яблоко не успевает совершить значимых движений, а значит, конечный В–скан максимально соответствует истинной структуре изучаемого объекта. Высокое разрешение позволяет четко идентифицировать все слои сетчатки и внутренние слои сосудистой оболочки. Диагностический поиск производится на уровне отдельных структур и групп клеток (рис. 1). Четкая визуализация комплекса «пигментный эпителий – слой фоторецепторов – наружная пограничная мембрана» способствует раннему выявлению ретино–хориоидальной патологии. В качестве примера на рисунке 2 представлена ОКТ периферической зоны сетчатки пациента, страдающего дистрофией Штаргардта. Высокая разрешающая способность метода позволяет выявить патологические изменения в слое наружных сегментов фоторецепторов. Трехмерная визуализация Однако главным отличием спектральных ОКТ стала возможность трехмерной визуализации объекта (участок сетчатки, головка зрительного нерва, роговица и проч.). Высокая скорость сканирования позволяет выполнить большое количество А–сканов (более 50 000) участка ткани фиксированной площади за 1–2 с. На основе этих данных программное обеспечение восстанавливает трехмерную структуру объекта. Полученное 3D–изображение позволяет оценить профиль поверхности изучаемой структуры, ее внутреннюю топографию. Возможна четкая визуализация границ патологических образований, наблюдение за их динамикой. Также эта функция незаменима в поиске небольших по размерам изменений, вероятность попадания которых в одиночный линейный скан мала. На рисунке 3 продемонстрирована трехмерная структура центральной зоны сетчатки пациентки с хориоидальной неоваскуляризацией. 3D–томограмма позволяет оценить вовлеченность фовеолы в патологический процесс и проследить динамику изменений. Трехмерная модель головки зрительного нерва (ГЗН) открывает новые возможности в оценке профиля экскавации при глаукоме (рис. 4). RTVu–100 позволяет выполнять морфометрию ГЗН, сходную по структуре получаемых данных с HRT. При этом определение границ диска зрительного нерва производится на основе 3D–изображения, что позволяет наносить его контур, основываясь на структурных особенностях ГЗН. Функции картирования Возможность исследования толщины сетчатки и ее слоев на определенном участке впервые была реализована в Stratus OCT. Итогом выполнения стандартного протокола является карта, представляющая полученные результаты графически и в абсолютных значениях. Методы картирования нашли широкое применение как в практической, так и в научно–исследовательской работе. Спектральная оптическая томография предоставляет новые возможности построения карт глазных структур. Прежде всего высокая скорость сканирования повышает их точность, поскольку на единицу площади приходится большее количество А–сканов. Кроме того, выполнение стандартного протокола исследования занимает не более 1 с, следовательно, движения глазного яблока оказывают минимальное воздействие на конечный результат. Высокая разрешающая способность позволяет четко идентифицировать границы между слоями сетчатки в автоматическом режиме. В результате становится возможным получать не только карту толщины сетчатки, но и ее отдельных слоев (слой ганглиозных клеток и нервных волокон, фоторецепторных клеток, пигментного эпителия). На рисунке 5–1 представлена карта элевации пигментного эпителия сетчатки пациентки с впервые диагностированной ВМД. Линейные сканы центральной зоны сетчатки не выявили патологических изменений. Однако методом картирования парацентрально были обнаружены участки локальной элевации пигментнго эпителия. Линейный скан, выполненный прицельно, позволил выявить расположенные на периферии друзы (рис. 5–2). Карта толщины слоя нервных волокон и ганглиозных клеток сетчатки расширяет возможности прибора в диагностике атрофий зрительного нерва, в том числе глаукомного генеза. Можно провести параллель в структуре получаемых результатов с поляриметрическими методами (хотя в последних определяется только толщина слоя нервных волокон без учета слоя ганглиозных клеток). Заключение К сожалению, в рамках одной статьи невозможно описать все новые возможности, которые предоставляет исследователю спектральная оптическая когерентная томография. Еще предстоит выработать комплекс диагностических критериев для основных групп заболеваний заднего отрезка глаза, оценить точность получаемых результатов относительно приборов, использующих другие физические принципы (сканирующие лазерные офтальмоскопы, лазерные поляриметры и т.п.). Однако уже сейчас можно утверждать, что спектральная оптическая когерентная томография является качественно новым методом диагностики заболеваний глаз. Ее информативность значительно превосходит ОКТ предыдущего поколения за счет возросшей разрешающей способности и высокой скорости исследования. Метод позволяет получить исчерпывающее представление об ультраструктуре произвольного участка сетчатки и головки зрительного нерва. Разнонаправленность получаемых результатов, широкие возможности диагностики и динамического наблюдения различных глазных заболеваний делают спектральную оптическую когерентную томографию одним из наиболее точных и универсальных методов морфологического исследования в офтальмологии. Ключевые слова статьи: возможности, метода, Спектральная, томография, оптическая Оптическая когерентная томография сетчатки глаза Метод оптической когерентной томографии, в аббревиатуре ОКТ – современная неинвазивная процедура исследования тонких слоев кожи, слизистых оболочек а также зубных и глазных тканей. Во многом этот метод схож с технологией ультразвукового исследования, однако для изучения состояния тканей вместо ультразвуковых волн применяют инфракрасное излучение около 1 мкм длиной. Информацию о структуре тканей получают путем измерения задержки луча излучения, отражаемого от исследуемой части ткани. Современные аппараты оптической томографии позволяют офтальмологам выявлять патологии, которые не определяются другими методами. Наибольшую эффективность оптическая томография демонстрирует в ислледовании патологий сетчатки и зрительного нерва. Когерентная томография является наименее опасным неинвазивным видом оптической биопсии, которая позволяет избегать удаления части ткани и ее отдельного исследования. Впервые применение метода ОКТ в офтальмологии было предложено ученым из США Карменом Пулиафито в 1995 г, совсем недавно. Уже через 2 года в американских офтальмологических центрах появились первые приборы для ОКТ сетчатки, а позже практика их использования распространилась по всему миру. Показания к исследованию Офтальмологи применяют оптическую когерентную томографию сетчатки для диагностики следующих недугов: макулярные разрывы; диабетическая ретинопатия; глаукома; тромбоз центральной вены сетчатки; отслойка сетчатки; дегенеративные изменения сетчатки (как генетических, так и приобретенных, включая ВМД - возрастную макулодистрофию); кистоидный макулярный отек; эпиретинальная мембрана; отек, атрофия и другие аномалии диска зрительного нерва; пролиферативная витреоретинопатия. Метод ОКТ сетчатки глаза также используют для оценки эффективности назначенного лечения в районе заднего отдела зрительного органа, с его помощью можно оценить угол передней камеры, а также качество работы дренажного устройства, которое назначают при глаукоме. Кроме того, томография глаза оценивает состояние роговицы при установке интраокулярных линз и интрастромальных колец и кератопластике. Как проводится процедура ОКТ? Во время процедуры ОКТ глаза пациента просят сфокусироваться на специальной отметке тем глазом, который подлежит обследованию. Оператор при этом выполняет ряд сканирований. При невозможности сфокусировать исследуемый глаз на метке пациент использует другой, лучше видящий глаз. Такие дефекты как кровоизлияние, отек роговицы или помутнения в оптических средах глаза могут препятствовать информативности процедуры. Результаты ОКТ представляют в виде таблиц, карт и протоколов, которые предоставляют подробную картину состояния исследуемых участков как количественно, так и визуально. Для сравнения может быть использована база данных, которая находится в памяти томографа. Там указан процент людей с аналогичными показателями, что дает возможность определить вероятность патологической природы выявленных изменений. Преимущества метода Использование оптической когерентной томографии глаза позволяет осуществлять точную диагностику глаукомы, оценить степенно прогрессирования недуга и эффективность лечения. Метод демонстрирует наибольшую эффективность в диагностике такого недуга как возрастная макулодистрофия, при котором в центре поля зрения пациент видит черное пятно. Когерентная томография сетчатки может давать в сочетании с другими методами исследования, в частности с флюоресцентной ангиографией сетчатки, особо ценные результаты для хорошего диагноста. Где можно сделать процедуру? Томография сетчатки проводится с использованием специальной аппаратуры – ОКТ-томографа, поэтому пройти такого рода обследование возможно в клиниках с такими аппаратами. Чаще всего это офтальмологические клиники и медицинские центры коррекции зрения. Стоимость Томография сетчатки глаза не требует направления врача, однако даже при его наличии ОКТ исследование будет платным. Стоимость ОКТ глаза зависит главным образом от того, какую область глаза будут исследовать. Так, томография макулы оценивается в 600 – 700 рублей, томография переднего отдела глаза – в 700 – 800 рублей, тогда как цена оптической когерентной томографии глаза в комплексе оценивается в 1800-2000 рублей. Под комплексной томографией подразумевается 3-D исследование макулы, переднего отрезка глаза, зрительного нерва и слоя нервных волокон сетчатки. Стоимость процедуры также зависит от того, будет ли обследоваться один глаз или оба. В последнем случае все цены, соответственно, удваиваются. Оптическая когерентная томография глаза Оптическая когерентная томография (ОКТ) — оптический метод исследования, позволяющий отображать структуру биологических тканей организма в поперечном срезе с высоким уровнем разрешения, обеспечивая получение прижизненной морфологической информации на микроскопическом уровне. Действие ОКТ основано на принципе низкокогерентной интерферометрии. Метод позволяет оценить величину и глубину светового сигнала, отражённого от различных по оптическим свойствам тканей. Осевое разрешение порядка 10 мкм обеспечивает наиболее хорошее из всех существующих методов исследования и отображения тканевых микроструктур. Методом ОКТ определяют эхозадержку отражённой световой волны с измерением интенсивности и глубины сигнала. При фокусировании на ткани-мишени светового луча происходят его рассеивание и частичное отражение от внутренних микроструктур на различных глубинах исследуемых тканей (рис. 17-1). Механизм аналогичен таковому при ультразвуковом А-сканировании, суть которого заключена в измерении времени, за которое импульс акустической волны проходит от источника ультразвука до цели и обратно к принимающему устройству. В ОКТ вместо звуковой волны применяют пучок когерентного света инфракрасного диапазона с длиной волны 820 нм. Схему применяемого в офтальмологии оптического когерентного томографа можно представить следующим образом. В качестве источника излучения в устройстве используется суперлюминесцентный диод с длиной когерентности излучения 5-20 мкм. Интерферометр Майкельсона встроен в аппаратную часть прибора, в объектном плече расположен конфокальный микроскоп (фундус-камера или щелевая лампа), в опорном плече - блок временной модуляции. Видимую картину и траекторию сканирования исследуемой области посредством видеокамеры выводят на монитор. Компьютер обрабатывает полученную информацию и сохраняет её в виде графических файлов в базе данных. Оптические когерентные томограммы представлены в виде логарифмической чёрно-белой шкалы. Для лучшего восприятия изображение трансформируют в псевдоцветное, где участкам с высокой степенью светоотражения соответствуют красный и белый цвет, оптически прозрачным - чёрный. Цель Современная ОКТ — бесконтактная неинвазивная технология, которую используют для исследования морфологии переднего и заднего отрезка глазного яблока in vivo. Она позволяет выявить, записать и количественно оценить состояние сетчатки и прилежащего СТ, зрительного нерва, а также измерить толщину и определить прозрачность роговицы, исследовать состояние радужки и УПК. Возможность многократного повторения исследований и сохранения полученных результатов в памяти компьютера даёт возможность проследить динамику патологического процесса. Показания ОКТ позволяет получить ценную информацию как о состоянии нормальных структур глаза, так и о проявлении патологических состояний, таких, как различные помутнения роговицы, в том числе после рефракционных операций, иридоцилиарные дистрофии, тракционный витреомакулярный синдром, макулярные разрывы и предразрывы, макулодистрофии, макулярные отёки, пигментный ретинит, глаукома и прочее. Противопоказания Методом ОКТ невозможно получить качественное изображение при сниженной прозрачности сред. Исследование затруднено у пациентов, которые не могут обеспечить неподвижную фиксацию взора на протяжении времени сканирования (2,0-2,5 с). Подготовка Процедура не требует дополнительной подготовки. Однако расширение зрачка позволит получить более качественное изображение структур заднего отрезка глаза. Методика и последующий уход Технически оптическую когерентную томографию осуществляют следующим образом. После ввода данных пациента (номер карты, фамилия, имя, дата рождения) приступают к исследованию. Пациент фиксирует взгляд на мигающем объекте в линзе фундус-камеры. Камеру приближают к глазу пациента до тех пор, пока изображение сетчатки не отобразится на мониторе. После этого следует зафиксировать камеру нажатием кнопки фиксатора и отрегулировать чёткость изображения. Если острота зрения низкая и пациент не видит мигающий объект, то следует использовать внешнюю подсветку, а пациент должен не мигая смотрен, прямо перед собой. Оптимальное расстояние между исследуемым глазом и линзой камеры 9 мм. Исследование проводят в режиме perform scans (выполнение сканирования) и контролируют с помощью панели управления, представленной в виде регуляторных кнопок и манипуляторов, разделённых на шесть функциональных групп. Далее осуществляют выравнивание и очищение выполненных сканов от помех. После обработки данных производят измерение исследуемых тканей и анализ их оптической плотности. Полученные количественные измерения можно сравнивать со стандартными нормальными значениями или значениями, полученными во время предыдущих обследований и сохранёнными в памяти компьютера. Интерпретация Установление клинического диагноза должно быть основано прежде всего на качественном анализе полученных сканов. Следует обращать внимание на морфологию тканей (изменение внешнего контура, взаимоотношения различных слоев и отделов, взаимоотношения с соседними тканями), изменение светоотражения (повышение или понижение прозрачности, наличие патологических включений). Количественный анализ позволяет выявить утолщение или истончение как слоя клеток, так и всей структуры, её объём, получить карту исследуемой поверхности. Далее приведены примеры интерпретации томограмм, полученных в норме и при некоторых заболеваниях. Томография роговицы. Важно точно локализовать имеющиеся структурные изменения и рассчитать их параметры: это даёт возможность более корректно выбрать тактику лечения и объективно оценить его эффективность. В некоторых случаях ОКТ роговицы считают единственным методом, позволяющим рассчитать её толщину (рис. 17-2). Большое преимущество для повреждённой роговицы — бесконтактность методики. Томография радужки даёт возможность выделить передний пограничный слой, строму и пигментный эпителий. Отражающая способность этих слоев различается в зависимости от количества содержащегося в слоях пигмента: на светлых, слабопигментированных радужках самые большие отражённые сигналы идут от заднего пигментного эпителия, передний пограничный слой чётко не визуализирован. Ранние патологические изменения радужки, выявляемые с помощью ОКТ считают значимыми для постановки диагноза в доклинической стадии при синдроме пигментной дисперсии, псевдоэксфолиагивном синдроме, эссенциальной мезодермальной дистрофии, синдроме Франк-Каменецкого. Томография сетчатки. В норме на ОКТ выявляют правильный профиль макулы с углублением в центре (рис. 17-3). Слои сетчатки дифференцируют согласно их светоотражающей способности, равномерные по толщине, без очаговых изменений. Высокой светоотражающей способностью обладает слой нервных волокон и пигментного эпителия, средняя степень светоотражения характерна для плексиформного и ядерного слоя сетчатки, практически прозрачен слой фоторецепторов. Наружный край сетчатки на ОКТ ограничен высокофоторефлектирующим ярко-красным слоем толщиной около 70 мкм, составляющим комплекс пигментного эпителия сетчатки (ПЭС) и хориокапилляров. Более тёмная полоса (на томограмме расположена непосредственно перед комплексом "ПЭС/хорио-капилляры") представлена фоторецепторами. Ярко-красная линия на внутренней поверхности сетчатки соответствует слою нервных волокон. СТ в норме оптически прозрачно и на томограмме имеет чёрный цвет. Резкий контраст между окрашиванием тканей позволил производить измерение толщины сетчатки. В области центральной ямки жёлтого пятна она составила в среднем около 162 мкм, у края фовеа - 235 мкм. Идиопатические макулярные разрывы дефекты сетчатки в области жёлтого пятна, возникающие без какой-то видимой причины у пациентов пожилого возраста. Использование ОКТ даёт возможность точно диагностировать заболевание на всех его этапах, определять тактику лечения и контролировать его эффективность. Так, для начального проявления идиопатического макулярного разрыва, называемого предразрывом, характерно наличие фовеолярной отслойки нейроэпителия вследствие витреофовеолярной тракции. При ламеллярном разрыве отмечают дефект внутренней поверхности сетчатки, при этом слой фоторецепторов сохранён. Сквозной разрыв (рис. 17-4) дефект сетчатки на всю глубину. Вторым по влиянию на зрительные функции признаком, который можно выявить с помощью ОКТ, считают дегенеративные изменения сетчатки вокруг разрыва. И наконец, наличие или отсутствие витреомакулярных тракций считают важным прогностическим признаком. При анализе томограммы следует оценивать толщину сетчатки в макуле, минимальный и максимальный диаметр разрыва (на уровне ПЭС), толщину отёка по краю разрыва, диаметр интраретинальных кист. Важно обращать внимание на сохранность слоя ПЭС, степень дегенерации сетчатки вокруг разрыва (определяют по уплотнению тканей и появлению их красного окрашивания на томограмме). Возрастная макулодистрофия (ВМД) группа хронических дегенеративных нарушений с неизвестным этиопатогенезом, которыми страдают пожилые пациенты. ОКТ может быть использована для диагностики изменений структур заднего полюса глаза на различных этапах развития ВМД. Измеряя толщину сетчатки, можно объективно проследить эффективность проводимой терапии. Далее мы приводим клинические случаи, которые позволяют более полно представить изменения сетчатки, происходящие на различных этапах развития ВМД (рис. 17-5, 17-6). Диабетический макулярный отёк - одна из наиболее тяжёлых, прогностически неблагоприятных и трудно поддающихся лечению форм ДР. ОКТ позволяет оценить толщину сетчатки, наличие интраретинальных изменений, степень дегенерации тканей, а также состояние прилежащего витреомакулярного пространства (рис. 17-7). Зрительный нерв. Высокая разрешающая способность ОКТ позволяет хорошо различить слой нервных волокон и измерить его толщину. Толщина слоя нервных волокон хорошо коррелирует с функциональными показателями, и прежде всего с полями зрения. Слой нервных волокон имеет высокое обратное рассеивание и, таким образом, контрастирует с промежуточными слоями сетчатки, так как аксоны нервных волокон ориентированы перпендикулярно пучку ОКТ наконечника. Томографию ДЗН можно проводить радиальными и кольцевыми сканами. Радиальные сканы через ДЗН позволяют получить изображение диска в поперечном сечении и оценить экскавацию, толщину слоя нервных волокон в перипапиллярной зоне, а также угол наклона нервных волокон относительно поверхности ДЗН и сетчатки (рис. 17-8). Трёхмерная информация параметров диска может быть получена на основе серии томограмм, выполненных в различных меридианах, и позволяет измерить толщину слоя нервных волокон в различных участках вокруг ДЗН и оценить их структуру. "Развёрнутая" томограмма представлена в виде плоского линейного снимка. Толщина слоя нервных волокон и сетчатки может быть автоматически обработана компьютером и представлена на экране как усреднённая величина всего скана, квадранта (верхнего, нижнего, височного, носового), часа или индивидуально для каждого скана, содержащего снимок. Эти количественные намерения можно сравнивать со стандартными нормальными значениями или значениями, полученными во время предыдущих обследований. Это позволяет выявлять как локальные дефекты, так и диффузную атрофию, что может быть использовано для объективной диагностики и мониторинга патологических процессов при ней родегенеративных заболеваниях. Застойный диск - офтальмологический симптом повышения внутричерепного давления. ОКТ считают объективным методом, позволяющим определить, измерить и проследить в динамике степень выстояния ДЗН. Оценивая уровень светоотражения тканей, можно оценить как гидратацию тканей, так и степень их дегенерации (рис. 17-9). Ямка зрительного нерва - врождённая аномалия развития. Наиболее частым осложнением ямки зрительного нерва считают расслоение (шизис) сетчатки в макуле. ОКТ чётко иллюстрирует дефекты ДЗН и расслоение сетчатки, изменения, происходящие в фовеа (рис. 17-10). Пигментный ретинит, или тапеторетинальная абиотрофия, — наследственное прогрессирующее заболевание органа зрения с первичным генетически детерминированным поражением фоторецепторного слоя и ПЭС. Оценить состояние хориоретинального комплекса и тяжесть развития заболевания можно с помощью ОКТ. На томограммах оценивают толщину слоя фоторецепторов, нервных волокон и нейроглии сетчатки, прозрачность слоев сетчатки относительно стандартной цветовой шкалы прибора, состояние ПЭС и слоя хориокапилляров. Уже в латентной стадии пигментного ретинита при отсутствии клинических проявлений и офтальмоскопических признаков заболевания обнаруживают характерные изменения в виде уменьшения толщины слоя фоторецепторов, снижения его прозрачности, сегментов и повышенным метаболизмом пигментного эпителия. ОКТ позволяет осуществлять мониторинг патологического процесса и может быть использована в диагностике пигментного ретинита, включая беспигментную форму, в том числе и у детей, когда из-за маленького возраста ребёнка и его неадекватного поведения невозможно проведение функциональных методов исследования. Операционные характеристики Источник светового сигнала — суперлюминесцентный диод с длиной волны 820 нм для сетчатки и 1310 нм для переднего отрезка. Тип сигнала — оптическое рассеивание от ткани. Поле изображения: 30 мм по горизонтали и 22 мм по вертикали для заднего отрезка, 10-16 мм - для переднего. Разрешение: продольное - 10 мкм, поперечное — 20 мкм. Скорость сканирования — 500 аксиальных срезов в секунду. Факторы, влияющие на результат Если пациенту накануне проводили офтальмоскопию с использованием панфундусскопа, линзы Гольдмана либо гониоскопию, проведение ОКТ возможно только после вымывания контактной среды из конъюнктивальной полости. Осложнения Используемое излучение инфракрасного диапазона незначительной мощности не оказывает повреждающего воздействия на исследуемые ткани, не имеет ограничений по соматическому состоянию пациента и исключает нанесение травмы. ОКТ (ОПТИЧЕСКАЯ КОГЕРЕНТНАЯ ТОМОГРАФИЯ) ГЛАЗА Оптическая когерентная томография (или ОКТ) - неинвазивный (бесконтактный) современный метод исследования, позволяющий визуализировать любые структуры глаза с высочайшим разрешением (1 - 15 микрон), что намного точнее ультразвукового исследования. ОКТ - своего рода оптическая биопсия, благодаря которой для микроскопического исследования уже не требуется удалять участок ткани. Впервые использовать метод оптической когерентной томографии для офтальмологии предложил в 1995 году Кармен Пулиафито - американский ученый-офтальмолог. В 1996 - 1997 гг. компания Carl Zeiss Meditec стала поставлять первые приборы для внедрения в клиническую практику. Сегодня с помощью этих устройств на микроскопическом уровне проводят диагностику патологий глазного дна, а также переднего отрезка глаза. Исследование базируется на том, что все ткани организма по-разному отражают световые волны, что зависит от их структуры. В ходе его проведения измеряют время задержки отраженного света, а также его интенсивность после того как он прошел через ткани глаза. По причине очень высокой скорости световой волны, измерение этих показателей напрямую невозможно. В томографах для этой цели используют интерферометр Майкельсона. В основе метода - применение низкокогерентного луча света инфракрасного спектра, длина волны которого составляет 830 нм (для осмотра сетчатки) и 1310 нм (для осмотра переднего отрезка глаза). В процессе диагностики луч делится на два пучка, первый направляется к тестируемым тканям, а второй (контрольный) – к определенному зеркалу. Отражаясь, оба световых пучка принимаются фотодетектором и образуют интерференционную картину, которая в свою очередь, поступает для анализа программным обеспечением. Результат оформляется в виде псевдоизображения, которое соотносится со специальной шкалой, где участки с высоким уровнем отражения света окрашены в «теплые» (красные) цвета, а с низким – в «холодные», стремящиеся к черному. Самая высокая светоотражающая способность присуща слою нервных волокон, а также пигментного эпителия, средняя – плексиформному и ядерному слою сетчатки. Стекловидное тело является оптически прозрачным и на томограмме в норме имеет черный цвет. Трехмерное изображение получается путем сканирования, проводимого в поперечном и продольном направлениях. Проведение ОКТ бывает затруднено отеком роговицы, кровоизлияниями и помутнением оптических сред. Возможности ОКТ ОКТ позволяет определять и оценивать: • морфологические изменения слоя нервных волокон и сетчатки, толщину этих структур; • параметры и показатели диска зрительного нерва; • структуры и составляющие переднего отрезка глаза, их пространственные взаимоотношения. При проведении процедуры пациент фиксирует взгляд обследуемого глаза на определенной метке, а при невозможности это сделать – другим, лучше видящим. Оператором выполняется несколько сканирований, а далее отбирает изображения, лучшие по информативности и качеству. Результаты обследования представляются как различные протоколы, карты и таблицы, позволяющие визуально или количественно определять имеющиеся изменения. В качестве сравнения используют нормативную база данных, вложенную в память томографа. В таблице в процентном отношении указано количество здоровых людей, имеющих аналогичные показатели. То есть чем реже такие изменения отмечены в популяции, тем выше вероятность, что они являются признаком патологии. ОКТ обычно применяют для диагностики или оценки эффективности лечения в области заднего отрезка глаза: • макулярных разрывов; • наследственных и приобретенных дегенеративных изменений сетчатки (включая ВМД); • диабетической ретинопатии; • глаукомы; • атрофии, отека и аномалии ДЗН; • тромбоза ЦВС; • кистоидного макулярного отека; • пролиферативной витреоретинопатии; • эпиретинальной мембраны; • отслойки сетчатки. ОКТ в диагностике переднего отрезка глаза используют: • при глубоких кератитах или язвах роговицы; • с ее помощью оценивают угол передней камеры и функционирование дренажных устройств при заболевании глаукомой; • проводят оценку роговицы при проведения LASIK, кератопластики, установке интрастромальных колец иИОЛ.