Литературный обзор работ профессора В.В
advertisement
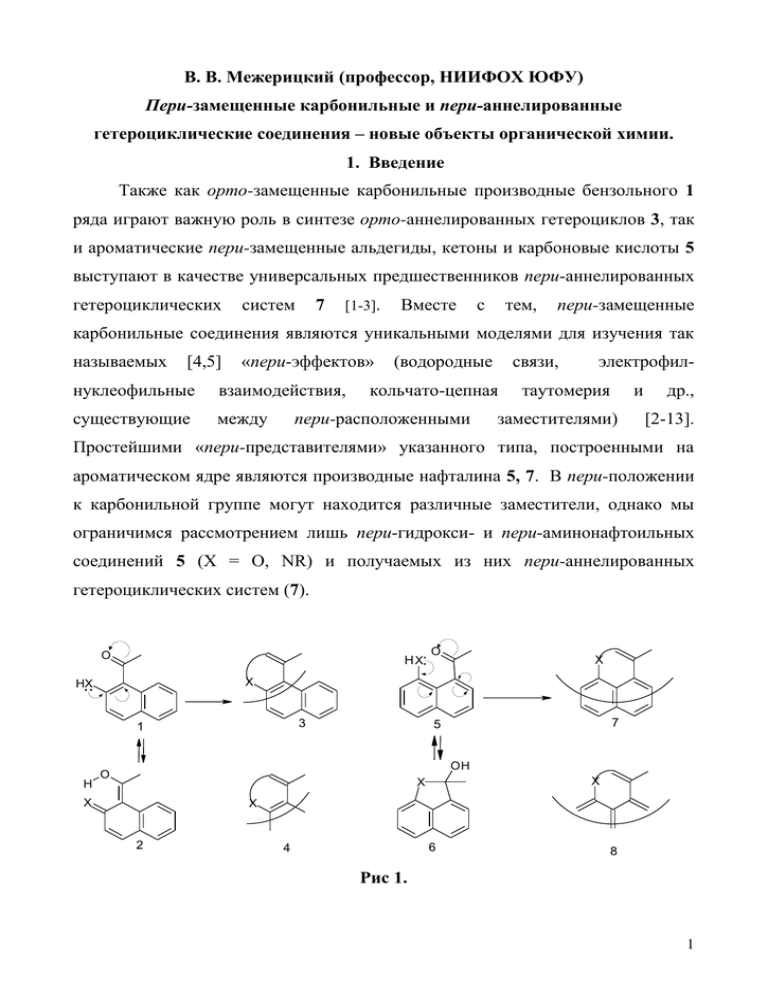
В. В. Межерицкий (профессор, НИИФОХ ЮФУ) Пери-замещенные карбонильные и пери-аннелированные гетероциклические соединения – новые объекты органической химии. 1. Введение Также как орто-замещенные карбонильные производные бензольного 1 ряда играют важную роль в синтезе орто-аннелированных гетероциклов 3, так и ароматические пери-замещенные альдегиды, кетоны и карбоновые кислоты 5 выступают в качестве универсальных предшественников пери-аннелированных гетероциклических систем 7 [1-3]. Вместе с тем, пери-замещенные карбонильные соединения являются уникальными моделями для изучения так называемых [4,5] «пери-эффектов» нуклеофильные взаимодействия, существующие между (водородные связи, кольчато-цепная пери-расположенными электрофил- таутомерия и заместителями) др., [2-13]. Простейшими «пери-представителями» указанного типа, построенными на ароматическом ядре являются производные нафталина 5, 7. В пери-положении к карбонильной группе могут находится различные заместители, однако мы ограничимся рассмотрением лишь пери-гидрокси- и пери-аминонафтоильных соединений 5 (X = O, NR) и получаемых из них пери-аннелированных гетероциклических систем (7). O H X: X X HX .. 3 1 H O 7 5 OH O X X X X 2 6 4 8 Рис 1. 1 Чем орто-замещение отличается от пери-замещения? Дело в том, что гидрокси- или аминогруппа, соседствующие с карбонильной группой в периположениях, отличаются от таких же функциональных заместителей, расположенных в орто-положениях ароматического ядра, разнонаправленным действием друг на друга через ароматическую π-систему. Иными словами заместители в орто-положениях имеют совпадающую ориентацию 1, а в периположениях прямо противоположную 5. По направлению взаимных электронных влияний друг на друга пери-замещенные схожи с метазамещенными карбонильными соединениями. Эта особенность строения перизамещенных соединений лишает их возможности участия в таких фундаменальных для ароматических систем превращениях, как бензоиднохиноидная таутомерия (1→2), электроциклические реакциии циклоприсоединения, процессы хелатирования металлов и др. Вместо бензоидной-хиноидной таутомерии у пери-замещенных возможна кольчатоцепная таутомерия (5→6). Чем орто-аннелирование Особенность отличается от пери-аннелирования? состоит том, что родоначальный элемента включен орто-аннелирования моногетероцикл 4 в качестве в структурного в конденсированную систему 3 с сохранением своей электронной структуры и, формально, может быть вычленен из нее без изменения пространственного и электронного строения. Более того, орто-аннелированные гетероциклические соединения в значительной мере сохраняют такие фундаментальные характеристики моногетероциклических предшественников, как π-избыточность и π-дефицитность, определяемые характером гибридизации гетероатома. Специфика структурного пери-аннелирования элемента, который заключается можно было в отсутствии бы такого определить как родоначальный моногетероцикл. Поэтому минимальной структурной единицей является трициклическое ядро с общим для трех колец углеродным атомом 7. Под моногетероциклами подразумеваются гетероциклические соединения с 2 замкнутой эндо-π-системой. В этой связи формально выделенный структурный фрагмент 8 не может считаться таковым. 2. Синтез пери-замещенных карбонильных соединений. Поскольку пери-гидроксизамещенные ключевыми исходными гетероциклов, нами веществами были в альдегиды и кетоны являются синтезе разработаны пери-аннелированных способы построения пери- гидроксикарбонильной группировки, основанные на формилировании или ацилировании производных 1,5-нафталиндиола 9a,b с последующим расщеплением пери-R-оксигруппы у образующихся продуктов реакции (10→11) [1420]. MeO COR" HO COR" CHO OH AlCl3 AlCl3 R"=H R"CO R"CO OMe 15 OH OH 17 16 AlCl3 R"COX / AlCl3 OR OR COR" R"COX R= Me 9 11 10 OMe R=Me OMe R"= H, Alk, Ar OMe R=Me EtOCHCl2 / AlCl3 OH OMe CHO CHO or CHO OMe 13 CHO OMe 12 OH CHO AlCl3 R = Me(a), R'CO(b) OH COR'' CHO OH 14 Рис.2 Этим путем, исходя из 1,5-диметоксинафталина 9a или 1-ацилокси-5метоксинафталина 9b получены соответствующие пери-метокси- или периацилоксизамещенные нафтальдегиды алкил- и арилкетоны 10a,b. Деметилирование соединений 10a осуществляют хлоридом алюминия, а дезацилирование соединений 10b – метилатом натрия. В обоих случаях с хорошими выходами получаются целевые 4-метокси-8-гидроксизамещенные 3 нафтальдегид, нафтилалкил- и арилкетоны Исходя 11. из 1,5- диметоксинафталина 9a получены и продукты бис-формилирования 12 или бис-ацилирования 15, после деметилирования которых образуются ранее неизвестные типы бис-пери-гидроксинафтоильных соединений 14 и 16. Частичное дезалкилирование диметоксидиальдегида 12 приводит к моно-перигидроксидиальдегиду а 13, деметилирование 4-метокси-8- гидроксинафтальдегида 11 (R″=H) дает 4,8-дигидросинафтальдегид 17. Этот же подход был применен нами для синтеза ранее не известных производных пери-ациламинонафтоильных соединений [21- 25]. Ac2O/HClO4 AcNH Ac NH NH2 COR' 1) R'COX 2) H2O Ac2O/H2O 19 OR 18 OR 20 OR R = Me, Et; R' = Alk (a); Ar (b); CH=CHAr (c) Рис. 3. Так при взаимодействии 5-алкокси-1-ацетиламинонафталина 19 с ангидридами алифатических кислот в присутствии хлорной кислоты или с хлорангидридами ароматических кислот при катализе хлоридом алюминия, после гидролиза, с выходами близкими к количественному образуются Nациламинокетоны 20. Пери-аминонафтилкетоны со свободной аминогруппой не существуют из-за легкости их Сохранению пери-аминокетонной гетероциклизации группировки в в бенз[cd]индолы. открытой форме 20 способствует уменьшение нуклеофильности атома азота аминогруппы, под действием N-ацильного заместителя. Однако, для пери- ацетиламинонафтальдегида 22, образующегося при формилировании 1ацетиламино-5-метоксинафталина 21 по Рихе, термодинамически более выгодной оказывается циклическая 1,2-дигидро-бенз[cd]индолиевая форма 23, в виде которой он и существует в конденсированной фазе [26]. Реакция Рихе оказалась очень удобной для получения 5-метокси-8-(N-метил-N- ацетил)аминонафтальдегида 24. 4 AcNH AcNR AcNMe CHO OH H R=H R=Me 22 OMe OMe 21 24 OMe введения Ac N Cl2CHOEt AlCl3 Cl2 CHOEt / AlCl3 Принцип CHO Рис.4. карбонильной группы в 23 OMe пери-положение к имеющемуся ацилоксиокси-заместителю применен нами для построения перигидроксиформильной 27a пери-гидроксикетонной 27b,c группировки на ядре аценафтена [27]. AcO AcO HO COR COR MeONa RCOX 27a-c 26 25 R=H(a), Me(b), Ph(c) Рис. 5. Пери-аминокетоны аценафтенового ряда в отличие от аналогичных производных нафталина существуют как таковые, благодаря «стягивающиму» эффекту биметиленового звена, в результате которого заместители, находящиеся в противоположных пери-положениях удаляются друг от друга, препятствуя замыканию пятизвенного гетерокольца. Синтез аценафтеновых пери-аминокетонов 30 осуществлен путем нитрования 5-ацилаценафтена 28 и последующего каталитического (никель Реннея) восстановления образующихся пери-нитрокетонов 29 гидразин-гидратом. Исходя из периаминокетонов 29, альтернативным (по ср. с предыдущим) путем, с помощью реакции диазотирования, получены пери-гидроксизамещенные метил- и арилкетоны 27a-c [28]. HNO3 28 NH2 NO2 COR COR COR HNO2/H2O (NH2)2/Ni-Ren. 30 29 OH COR 27a-c Рис. 6. 5 Дегидрированием пери-ацетиламино- и пери-бензоилоксиаценафтенилметилкетонов 31 с помощью «хлоранила» получены первые представители ранее неизвестного класса аценафтиленовых кетонов, содержащих в периположении N- и O-атомы 32-34, свободная электронная пара которых, в отличие от аналогичных производных нафталина и аценафтена, сопряжена с карбонильной группой через ароматическую π-систему [29, 30]. соединения являются синтонами для исключительно получения интересными качественно новых и Эти перспективными пери-аннелированных гетероароматических систем. Ac NH COMe COMe X p-C6Cl4O2 32 OH COMe PhCO O COMe MeONa 31a,b X=OCOPh(a), AcNH(b) 34 33 Рис. 7. 3. Строение пери-замещенных карбонильных соединений. Производные нафталина, несущие в соседних пери-положениях нуклеофильную (X=O, NR, рис.2) и карбонильную группы играют важную роль не только в качестве потенциальных предшественников пери- аннелированных гетероциклических систем, но и являются уникальными S .... H X H .... ... .O X H O S .... H O X R R R=H A C Me X H .... O B OH X D F Me R O X R E Рис 8. 6 моделями для изучения так называемых «пери-эффектов» (водородные связи, электрофил-нуклеофильные взаимодействия, кольчато-цепная таутомерия и др., существующие между пери-расположенными заместителями). Знание особенностей конформационного строения пери-замещенной карбонильной групппировки и сущности «пери-эффектов» важны при изучении реакционной способности и прогнозировании свойств и химических превращений этих соединений. В результате проведенных нами [31-33] спектральных (ИК, УФ, ЯМР), рентгеноструктурных исследований и квантово-химического моделирования, с учетом литературных данных РСА, предложена единая концепция возможных типов внутримолекулярных пери-взаимодействий этого класса соединений, графическая модель которой представлена на рисунке 8. Первый тип (A) – это классическая внутримолекулярная водородная связь (ВВС), соединяющая два электроотрицательных атома с образованием плоского семизвенного Н-цикла, компланарного с ароматическим ядром. При разрыве этой ВВС под действием полярных растворителей (S) создается возможность для реализации другого эффекта (B), который можно рассматривать как внутримолекулярное аттрактивное электрофил-нуклеофильное взаимодействие пери-расположенных заместителей, при котором свободная электронная пара кислородного или азотного атома гидрокси- или аминогруппы электростатически «притягивается» к электронодефицитному атому углерода карбонильной группы. Этот эффект, в качестве единственно возможного, реализуется также в пери-метокси- или пери-диметиамино закрепленной модели (E) и может рассматриваться как начальная фаза присоединения О- или N-нуклеофила к карбонильной группе. Оба типа взаимодействий, как (A) так и (B) могут быть движущей силой реакции, приводящей к замыканию пятизвенного гетероцикла (D), моделируя собой кислотный или основный катализ при взаимодействии карбонильной группы с нуклеофилами. Если в качестве карбонильной функции выступает альдегидная группа, возможен еще один из «пери-эффектов», когда водородный атом СН-кислотной формильной 7 группы электростатически взаимодействует со свободной электронной парой пери-расположенного кислородного(азотного) атома гидрокси (амино) - (C) или метокси (диметиламино) группы (F). Этот тип взаимодействия можно рассматривать как разновидность слабой ВВС [34]. 4. Пери-аннелированные гетероциклические системы из пери-гидрокси- и пери-аминозамещенных карбонильных соединений. На рисунке 9 представлены соединения, которые объединяют в одну группу именуемую флавоноидами [35, 36]. Известно, что флавоноиды содержатся практически во всех видах культурных и диких растений и будучи не токсичными разноплановой веществами-антиоксидантами, фармакологической обладают активностью, самым высокой и благоприятным образом воздействующими на организм человека. O O Ar R R O Flavones R O Isoflavones Ar Y _ + X O R Pyrylium salts O R (H, CH3, CH2R) OH Ortho-hydroxy(aldexyds; ketones) O R O R O Ar R O OH O Coumarines Ar OH Ortho-hydroxychalkones Рис.9. В свое время, исходя из орто-гидроксизамещенных альдегидов и кетонов, мы разработали препаративные методы синтеза всех типов флавоноидов, изображенных на рисунке 9 [37-50]. Наиболее интересные результаты были получены в синтезе и изучении биологической активности изофлавонов [51-55]. Эти исследования проводились совместно с Пятигорским фармацевтическим институтом. В 8 опытах на животных было показано, что изофлавоноиды, содержащиеся в клевере красном и синтезированные в НИИ ФОХ РГУ, при полной не токсичности обладают высочайшим антиатеросклеротическим эффектом. По материалам этих исследований получен ряд «Авторских свидетельств СССР», опубликовано несколько статей в центральной печати, защищены кандидатские и докторские диссертации. Я думаю, что не без использования ставших доступными результатов наших исследований, фирмой «Эквалар» выпущена т.н. «Биологическая добавка» - «Атероклефит», как сказано в инструкции по применению – средство для генеральной чистки сосудов. Действующим началом другой биологической добавки: «Черника – форте», используемой для профилактики и лечения патологий зрения являются антоцианидины – полифенольные антиоксиданты, производные солей бензопирилия. Изучение химии солей пирилия и бензопирилия, начатое профессором Г.Н.Дорофеенко и продолженное его учениками, к которым принадлежу и я, и до настоящего времени является одним из важнейших достижений ученых НИИФОХ. По материалам этих исследований опубликовано огромное количество статей, несколько монографий и получен ряд «Авторских свидетельств» на изобретения. Все, что я рассказывал выше о методах синтеза и строении перигидрокси- и пери-аминозамещенных карбонильных соединений, все это результаты проведенных нами впоследствии исследований и зрелых размышлений. O O Ar Ar O O Y _ + X O Ar O R (H, CH3, CH2R) OH O O Ar O O OH Ar OH Рис. 10. 9 В начале же, возникла простая идея: опыт, накопленный в результате изучения реакций гетероциклизации орто-гидроксизамещенных альдегидов и кетонов, перенести на пери-замещенные и на их основе выйти к классу, так сказать, пери-анелированных аналогов флавоноидов, изображенных на рисунке 10. Но у нас не было ни одного пери-гидроксизамещенного альдегида или кетона, на котором можно было бы попробовать осуществить эту идею. Было потрачено много времени пока, наконец, был синтезирован первый образец, которым стал 4-метокси-8-гидроксиацетонафтон. обнаруженные нами ранее реакции Из него, применив этилортоформиата с орто- гидроксикетонами 35 и реакцию с ортоэфиром, ароматическими альдегидами и орто-гидроксикетонами, приводящие к солям 4-этоксибензопирилия 36, 37 [3750], мы ожидали выйти к катионам нафто[1,8-bc]оксепиния (A, B) – принципиально новой пери-аннелированной гетероциклической системе. O OEt + _ ClO4 O Ar OEt CH3 ArCHO / HC(OEt)3 HClO4 HC(OEt)3 / HClO4 OH O 36 35 37 _ ClO4 + Ar O + O OEt OEt + A B Ar HO O + 40 _ ClO4 CH3 O HC(OEt)3 / HClO4 ArCHO / HC(OEt)3 HClO4 OMe 38 O O + _ ClO4 39 OMe OMe MeO Рис. 11. И, действительно, при замене орто-гидроксикетона 35 пери- гидроксикетоном 38, в тех же условиях были получены глубоко-окрашенные перхлораты, но, как оказалось, к нашему сожалению и недоумению, вместо замыкания семизвенного гетероцикла и образования катионов (A, B) реакция 10 протекает по иному, чем в орто-ряду маршруту, с замыканием пятизвенного кольца и образованием катионов нафто[1,8-bc]фурилия 39, 40 [15, 56, 57]. Теперь, в свете пространственном выясненных и и осознанных электронном нами строении различий орто- и в пери- гидроксикарбонильных соединений, о которых я сказал выше, понятно, что так оно и должно гетероцикла, быть. Кислотно-катализируемое замыкание пятизвенного начинающееся с атаки протоном кислородного атома карбонильной группы, является наиболее быстрым процессом, с которым не может конкурировать замыкание семизвенного цикла. Еще более наглядно этот тезис подтверждается направлением гетероциклизации синтезированных нами пери-гидроксидикетонов 42, для которых, на первый взгляд, чисто формально, замыкание пяти- и семизвенного цикла равновероятно. R O + A O R O COCH3 OH COCH2COR O O H2O 44 R 43 R 42 R O OEt COCH2COR CH3 KOH / DMSO O 45 O R + O O R OEt R HC(OEt)3 HClO4 LiH / DMSO 41 R OEt R OH HC(OEt)3 HClO4 + O 47 46 H2O O R R 48 Рис. 12. Тем ни менее, гетероциклизация идет исключительно с замыканием пятичленного кольца (42→43) [58, 59]. Если бы циклизация шла по тому же маршруту, что и в орто-ряду (45→46→47) [60, 61], то должны были получаться нафтоксепиниевые катионы A. Следует заметить, что обнаруженная нами перегруппировка пери-ацилоксикетонов 41 в пери-гидроксидикетоны 42, не смотря на ее кажущуюся аналогию с перегруппировкой Бейкера11 Венкатарамана (45→46), не была очевидной априорно, так как в отличие от последней для ее протекания требуется реализация иного (семизвенного) переходного состояния и такого же интермедиата. Ar O + A Ar OH _ O ClO4 H2O EtO OMe + 53 Ar OMe Ar Ar EtO OH _ ClO4 OH CHO _ ArCOCH3 O OEt H+ + HC(OEt)3 / HClO4 CHO MeO 51 OMe 50 OMe 49 OMe ArCOCH3 HC(OEt)3 / HClO4 OH O + O MeO 52 OMe _ ClO4 Ar 55 54 Рис. 13. Еще более неожиданным оказался результат кислотно-катализируемой конденсации синтезированного нами 4-метокси-8-гидроксинафтальдегида 49 с арилметилкетонами в среде этилортоформиата, где вместо ожидаемой нафтоксепиниевой соли (A) образуется устойчивый открытоцепной перхлорат 50, при депротонировании которого получена смесь эквимольных количеств производных нафтофурана 51 и нафтоксепина 52, а при гидролизе – халкон 53 [57]. В тех же условиях орто-гидроксиальдегид 54 дает бензопирилиевые соли 55. Единственный случай прямого замыкания семизвенного гетероцикла мы наблюдали при диметиацетамидом взаимодействии в условиях пери-гидроксиальдегида реакции Вильсмайера 49 приводящем с к нафтоксепиниевому иону 56, который существует скорее в иммониевой 56′ чем в оксепиниевой 56 форме [62, 63]. Как оказалось в реакцию с диметилацетамидом способны вступать не только пери-гидроксиальдегиды, но и пери-гидроксикетоны 57 [64]. И хотя и в этом случае были получены 2-диметиламинонафтоксепиниевые соли 58, 12 маршрут реакции, в качестве первой стадии, по-видимому, включает образование нафтофурилиевого иона A, а не прямое замыкание семизвенного цикла. Гидролиз солей 56 и 58 приводит к оксепин-2-онам 59 [62-64] – одному из представителей семейства пери-аннелированных аналогов флавоноидов, о которых я говорил выше. Функциональные производные нафтоксепинонов 59 (R=H, X=CN, образуются CO2Et) гидроксиальдегида 49 также при с метиленактивными взаимодействии соединениями пери- в условиях основного катализа [65]. XCH2Y / Et3N + OH CHO O 1) CH3 CONMe2 / POCl3 2) H2O / HClO4 H 2O H 2O _ ClO4 59 OMe 56' OMe 56 OMe 49 OMe Ar OH O + CH3 CONMe2 / POCl3 + Cl Me2 N Me2 N Ar O COAr R (H, Ar) O O + X O Me2 N Me2 N + Ar OH CH2 C(Cl)=NMe2 O + Ar H2O / HClO4 + CH2=C(Cl)NMe2 ClO4 A 57 OMe OMe C OMe B _ 58 OMe OMe Рис.14 Если рассматривать проводимые исследования как целенаправленный поиск подходов к пери-аннелированным флавоноидоподобным структурам с семизвенным гетероциклом, как это и планировалось вначале, и было главным стимулом этих работ, то надо было найти способ подавления гетероциклизации пери-гидроксикарбонильных соединений с замыканием пятизвенного гетероцикла (A, рис. 15) и таким образом реализовать второй маршрут гетероциклизации с замыканием семичленного гетероцикла. OEt O R + A R RCO O COCH3 OH O + 61 OEt 62 _ 63 O O O O Py / H2O HC(OEt)3 HClO4 LiH DMSO 60 COCH2COR R R H2 64 Рис. 15 13 Как оказалось, объектами удовлетворяющими этим требованиям являются пери-замещенные карбонильные производные аценафтена, вследствие того, что наличие пятизвенного цикла в пери-положениях нафталинового ядра существенно затрудняет замыкание второго пятизвенного цикла в противоположных пери-положениях. Действительно, введение биметиленового мостика позволило направить гетероциклизацию аценафтеновых пери-гидроксидикетонов 61 (получены перегруппировкой соединений 60) по желаемому маршруту и синтезировать соли нафтоксепиния 62 и аценафтоксепиноны 63 [28, 66], при дегидрировании которых получены первые представители новой гетероароматической системы 64 с 14π-электронным контуром [67]. Когда выяснилось, что гетероциклизация пери-гидроксикарбонильных соединений протекает по другим маршрутам чем орто-гидроксикарбонильных производных и подчиняется иным закономерностям, стала очевидной необходимость целенаправленного систематического подхода к исследованиям в рамках этого принципиально нового научного направления. Далее я кратко прокомментирую лишь некоторые успехи, достигнутые в этом направлении. Ar Ar _ O .. O. Ar O O 67 66 R ... O. Br O _ _ Br _ HBr H+ 65 _ O O Br Ar H 68 R R R Ar O O A R Рис.16 Показано [68], что атака пери-фенолят-аниона 65 направлена на αуглеродный непредельного кетона, то есть против действия электронных эффектов, которые должны направлять атаку нуклеофилом по β-положению. В результате вместо оксепинона A образуется арилиденпиранон 67, который был 14 получен встречно из дибромхалкона 68. То есть гетероциклизация управляется не электронными эффектами, а геометрией переходного состояния, благоприятной для замыкания шестизвенного цикла. Пери-ацилокси-α-бромкетоны 69 под действием щелочей претерпевают перегруппировку с образованием ацилоксипиранов 70 [69], тогда как при взаимодействии с пиперидином образуется пиранон 71 [70], легко реагирующий с альдегидами или нитрозосоединениями с образованием 2арилиденпиранонов или 72 2-арилиминопиранонов 74 [71]. Гидролиз последних приводит к пирандиону 75. Ацилоксипираны 70 являются люминесцирующими лигандами и дают люминесцирующие комплексы 73 с катионами меди, цинка, кадмия, никеля и др. металлами [69]. O RCO O R O R Br _ O Br O O _ R Br O O O H O O _ + H A R 69 R 70 R R Ar _ RCO + O O B M ++ R O O O ArCHO O R 72 R 71 R R O 73 M O O O R ArNO Ar O N O O O O H2O / H+ 75 R 74 R Рис. 17 При действии ароматических на аминов пери-ацилокси-α-бромкетоны или слабоосновного ацетата 69 малоосновных натрия вместо перегруппировки происходит замена атома брома на ариламино- или ацетоксигруппу, соответственно, с образованием соединений 76 и 77 [70]. Пиридин под действием бромкетона 69 претерпевает кватернизацию с последующей перегруппировкой (A→B) и фрагментацией интермедиата (C) на 15 пиридиниевый илид и нафтолактон 78 [70]. При взаимодействии бромкетона 69 с ароматическими альдегидами в присутствие метилата натрия, генерируемый первоначально бромметильный карбанион (A, рис. 17), образует эпоксидный интермедиат (D, рис. 18), трансформирующийся в описанный выше арилиденпиранон 72 [71]. COCH2NHAr RCOO 76 R 77 R AcONa ArNH2 COCH2Br RCOO COCH2OAc RCOO O + COCH2NC5H5 RCOO R _ + NC5H5 O O + C5H5N CHCOR _ O O Py R A 69 R B C R ArCHO / MeONa _ C H N=CHCOR 5 5 Ar H O Ar _ Ar CHOH H O O O O _ R E HO O O O _ D R O _ 78 R 72 R R Рис. 18 При взаимодействии пиранона 71 с диметилацеталем диметилформамида получен имин 79, а из него – енаминокетоны, которые образуются в в виде смеси изомеров 80A и 80B, находящиеся исключительно хиноидной форме. Эти соединения также могут быть использованы в качестве новых лигандов для синтеза ВКС и как показано являются интересными хемосенсорными реагентами на ионы различных, в том числе и токсичных тяжелых металлов [72]. R H CHNMe2 O O O O Me2NCH(OMe)2 71 N H H N H O O O O RNH2 79 R + 80A 80B Рис. 19 16 При взаимодействии пери-гидроксикетонов и альдегидов 81 с гидразинами или гидроксиламином образуются 1,2-диазафеналены 82 или 1,2оксазафеналены 85 [73]. Диазафеналены 82 являются крайне интересными пери-аннелированными гетероциклическими системами. Во первых они обладают исключительно высокой электронодонорной способностью, легко отдают электрон и образуют весьма устойчивые катион-радикалы 83, которые в виде солей с анионами минеральных кислот существуют на воздухе без специальных защитных мер [74]. Другим удивительным свойством этих соединений является протонирование в нафталиновое ядро при наличие высокоосновного атома азота «придинового типа» с образованием устойчивых солей 84, также существующих в открытой атмосферной среде, тогда как алкилированию подвергается именно указанный атом азота [73, 75]. Ну и наконец, они являются мощнейшими антиоксидантами при практически полном отсутствие токсичности. По крайней мере Ld50 в опытах на животных определить не удалось [76]. R O N R OH R COR N N R" . + H+ 85 R' 81 R' N R" + . 83 R' _e NH2NHR HONH2 N R + N N R 82 R' H H R' 84 Рис.20 Получены производные диазафеналена на ядре аценафтена [77] и изучены реакции окислительного дегидрирования [78]. Показано, что при замещенном азоте дегидрированию хинонами подвергается биметиленовое звено, а при не замещенном происходит «сшивание» с образованием димеров. Реакции протекают по свободно-радикальному механизму [77, 78]. 17 Me N N Me R N R N N 82 N NH N R R N R 83 81 N N R NH 84 Рис.21 Изучены и другие превращения этой интересной гетероциклической системы [73-81] и опубликованы литературные обзоры [82, 83]. Значительный гетероциклов интерес в представляют плане синтеза бис-пери-аннелированных синтезированные нами бис-пери- гидроксизамещенные альдегиды и кетоны 87 [20, 84, 85]. Некоторые недавно реализованные превращения показаны на рис. 22. Кетоны 87 существуют в равновесии с полуацетальной формой 88, что детектируется спектрами ПМР (сигнал одного протона резонирует при ~4м.д., а другого при 12.5 м.д.) [85]. Фенильный полуацеталь не удается сохранить, так как он легко отщепляет воду и превращается в метиленхинон 90 [84], а метильный существует как таковой и может быть трансформирован в закрепленную форму 89. При взаимодействии метильного полуацеталя 88 (R=Me) с гидразином получен тетраазапирен 91 [85]. Me O Ph O 85 OMe PhCO O 90 OEt OH Me O COR HO COR O R AlCl3 RCO OMe 86 O Me R=Me RCO OH RCO 87 OH Me CO OH 89 N Me 88 NH2NH2 HN N Me N [O] air Me N NH A Me N 91 N Рис. 22 18 Оригинальной модификацией предложенного нами подхода к построению пери-гидроксинафтоильной группировки является использование в качестве сложноэфирной компоненты α-пиронов 93, образующихся при кипячении 5-метоксинафтола 92 с коричными кислотами в трифторуксусной кислоте [86, 87]. O O COMe O O OH Ac2O ArCH=CHCO2H Ar HNRR' Ar HClO4 CF3CO2H 94 OMe 93 OMe 92 OMe H2N Me Ar O Ar COMe OH OH Ar NRR' R=H, R'=NH2 N Me + R'RN R'RN O O HN O N O NH2 OMe 96 OMe 95 Me N + N Me N 99 OMe 99' OMe N Me Ar Ar Ar OMe O O N 97 98 OMe Рис. 23 При ацетилировании этих соединений получены циклические периацилоксикетоны 94. Особенность этого подхода состоит в том, что при расщеплении сложноэфирного фрагмента аминами образующиеся амиды не элиминируют, а остаются в составе пери-гидроксикетонов 95 в виде специфического заместителя, существенно расширяя возможности их функционализации. При использовании в качестве аминной компоненты гидразина получены производные диазапиренона 98, 99 с мостиковым атомом азота [87]. Предложен новый способ достройки фуранового цикла к нафталиновому ядру. Так, при взаимодействии ди-трет.-бутилнафталиндиола 100 с аминалями ароматических альдегидов образуются 2Н-нафтофураны 101, которые легко могут быть окислены в соответствующие нафтофураноны 102 [88, 89]. 19 H O OH t-Bu Ar O Ar t-Bu t-Bu ArCH(NR2)2 [O] Bu-t Bu-t Bu-t 102 O 101 OH 100 OH Рис. 24 Полученные таким образом 2Н-нафтофураны 101 в условиях реакции Пехмана претерпевают весьма необычное каскадное ред-окс-превращение завершающееся образованием нафто[1,8-bc]фуран-5-она 103 и новой ортопери-аннелированной гетероциклической системы 104 [90]. H Ar O H Ar O OH + t-Bu t-Bu H+ MeCOCH 2CO2Et HCl / EtOH H Ar t-Bu +101 Bu-t Bu-t Bu-t EtO2C OH 101 EtO2C O Me O Me B A O Ar Ar OH O t-Bu t-Bu Bu-t Bu-t O Me MeCOCH 2CO2Et + EtO2C HCl / EtOH Bu-t EtO2C O Me 103 Ar O O Me 104 C Рис. 25 Пери-аминокетоны 106, образующиеся при ацилировании 1-алкокси-5ациламинонафталинов 105 в кислых средах замыкают пятизвенное кольцо и превращаются в соли бенз[cd]индолия 107 [21-26]. Депротонироване последних (при R′=H) приводит к бенз[cd]индолам-основаниям 108. Ac NR' Ac NR' COR" N N + RCOX 105 OR R" R" R' X 106 OR 107 OR _ R'=H _ HX 108 OR Рис. 26 20 Аналогично ведут себя и пери-аминокетоны аценафтенового ряда [91]. Так, нагревание аминокетонов 109 с хлорной кислотой или N-протонированных перхлоратов 110 в уксусной кислоте сопровождается их гетероциклизацией с образованием солей аценафто[5,6-bc]пирролия 111. Один из вероятных маршрутов гетероциклизации представлен на рис. 27 (109→110→A→B→111). При депротонировании 2-арилзамещенных солей 111 (R=Ar) получены соответствующие основания 112 (R=Ar), тогда как 2-метилзамещенное производное 112 (R=Me) выделить не удалось из-за быстро протекающего осмоления. N-Ацетиламинокетон 113 при обработке хлорной кислотой даeт Опротонированный перхлорат 114, который, в отличие от протонированных пери-аминокетонов 110, не претерпевает гетероциклизации (114→D) при нагревании. HO + NH3 COR OH H + H2N H + N _ ClO4 _ ClO4 _ ClO4 112 111 B A 110 N + R _ ClO4 R R HN R R NH2 COR COMe MeCO NH MeCONH IX 32 113 109 N COMe C OH Me Me + NH MeCO N COMe + _ ClO4 _ ClO4 D 114 Рис. 27 Попытки дегидрирования оснований 112 хлоранилом или кислотно- катализируемой гетероциклизацией аценафтиленового ацетиламинокетона 32 с целью получения производных новой 14π-электронной гетероциклической 21 системы (C) не привели к желаемому результату. Во всех случаях были выделены не измененные исходные соединения. В процессе поиска путей синтеза пери-аннелированных гетероароматических систем аценафтиленового ряда, нами обнаружено, что взаимодействие ароматических альдегидов с пери-аминоацетилаценафтеном 115 в условиях основного катализа приводит к образованию азепинонов 116 [92]. Протекание данной реакции возможно по четырем альтернативным маршрутам: через альдоли A, халконы B, алкилоламины C или азометины 117. При взаимодействии аминокетона 115 (R=H) с альдегидами, помимо азепинонов 116 были выделены незначительные количества соответствующих азометинов 117, которые, следовательно, могут быть интермедиатами в данном превращении. Это предположение подтверждается синтезом азепинонов 116 в описываемых условиях из целенаправленно полученных азометинов 117. Однако, при взаимодействии с анисовым альдегидом N-ацетиламинокетона 115 (R=Ac), строение которого исключает возможность образования азометинов 117, получен азепинон 116 (R=Ac). Установленный факт позволяет предположить возможность участия в этой реакции трех других интермедиатов (A,B,C). Ar HO H ArCH CH2 R NH NaOH Ar -H2O COCH3 B O RN ArCHO CO -H2O A R NH CH R NH CO HC(OEt)3/HClO4 R=Ac 115 Ar CHOH COCH3 RN NaOH -H2O 116 H 3C Ar CH N CO R=H -H2O C 117 Рис. 28 22 N-Ацетильные производные данной гетероциклической системы 116 (R=Ac) также могут быть получены при взаимодействии пери-N-ацетиламинокетона 115 (R=Ac) с ароматическими альдегидами в среде этилортоформиата в присутствии хлорной кислоты. Интересно, что аценафтиленовый пери-ацетиламинокетон 32 с анисовым альдегидом в условиях щелочного катализа вместо возможного гетероциклического соединения (A) образует транс-халкон 118, который не подвергается гетероциклизации даже при длительном нагревании. Ar O AcN Ac NH COCH3 ArCHO / HO _ A Ar O Ac NH 32 Ar = p-MeOC6H4 118 Рис. 29 Дегидрирование N-H – производных гетероциклической системы 118a,b «хлоранилом» (2,3,5,6-тетрахлор-1,4-безохиноном) в эфире или тетрагидрофуране приводит к многокомпонентной смеси продуктов реакции, из которой с помощью колоночной хроматографии удалось выделить несколько индивидуальных соединений [93]. Как оказалось, легкость и степень дегидрирования зависят от природы арильного заместителя в положении 2 гетерокольца. Так в случае «анизильного» заместителя (соединение 118a) был выделен только продукт дегидрирования биметиленового звена 119a, тогда как из «вератрилзамещенного» 118b образуются продукты частичного 119b и исчерпывающего «анизилзамещенного» 120b 118a дегидрирования. с хлоранилом, При помимо взаимодействии указанного выше соединения 119a, выделено еще одно вещество, которому на основании 23 спектров ИК, ЯМР1Н и масс-спектра мы посчитали возможным приписать структуру 121a. Ключевой стадией в процессе образования новой гетероциклической системы по-видимому, 121a, является электроциклическое [4+2] циклоприсоединение частично дегидрированных молекул 119a (диенофил) с азометином 117 (диен), продуктом прототропного раскрытия азепинонового гетерокольца, после чего происходит ароматизация аддукта (B). H N O Me 123a,b Ar 124a,b Ar O H N 119a,b O N + 122a,b O H N Me O N chloranil 118a,b Ar Me O N MeI / K2CO3 chloranil Ar Ar Ar Ar OH N 120b 120b' + Ar N O O Me H O Ar N Ar N Ar Me N Ar H H 117a O O Me N H 121a B Ar = 4-MeOC6H4 (a); 3,4-(MeO)2C6H3 (b) Рис. 30 При взаимодействии N-метилированных азепинонов 122a,b (получены реакцией NH-формы 118a,b с метилиодидом) с хлоранилом выделены продукты частичного 123a,b и исчерпывающего дегидрирования 124a,b, из чего можно сделать заключение, что первичным актом является дегидрирование биметиленового звена. То же самое можно сказать и об очередности дегидрирования NH-формы В последнее время нами уделяется значительное внимание синтезу и изучению свойств пери-замещенных карбонильных и пери-аннелированных гетероциклических производных аценафтилена. Эти исследования является 24 качественно новым этапом в развитии представленного здесь научного направления. Отличие пери-замещенных карбонильных производных аценафтилена от аналогичных соединений нафталинового ряда заключается в том, что находящиеся в пери-положениях заместители получают возможность сопряжения через систему кратных связей аценафтиленовогоя ядра. Эта особенность их строения открывает качественно новые перспективы и возможности в теоретических исследованиях и практике органического синтеза. O O N A O B Рис. 31 В семействе пери-аннелированных гетероциклов с замкнутой -системой также следует отличать производные нафталина I-III и аценафтена IV-VI от производных аценафтилена VII-IX. .. Y X X X II I III .. Y X X IV X VII X V .. Y X VI X VIII X = O, NR; Y = CH, N IX X = O+, S+, RN+, N Рис. 32 25 Системы I-VI, хотя и содержат ароматический нафталиновый фрагмент, в целом, не могут быть отнесены к полностью гетероароматическим молекулярным структурам из-за нечетного числа π-электронов (а именно:13) в периферическом контуре. Производные аценафтилена VII-IX, имеющие четное число π-электронов в периферическом контуре, также могут быть разделены на две группы: молекулярные структуры с 4n (системы типа VII) и 4n+2 (системы типа VIII, IX) периферических π-электронов. Системы VII, по-видимому, нужно отнести к антиароматическим, несмотря на то, что в целом молекула содержит 14, то есть 4n+2 π-электронов, тогда как системы типа VIII, IX, будучи 16-ти, то есть 4n π-электронными, тем не менее, являются ароматическими. Считается, что именно периферические электроны играют доминирующую роль в определении ароматического или антиароматического характера молекулы. В настоящее время известно лишь несколько полученных нами и описанных в литературе отдельных представителей этого семейства, свойства которых еще только предстоит изучить. 5. Выводы. В приведенном обзоре затронуты лишь некоторые аспекты химии перизамещенных и пери-аннелированных производных нафталина, основанные на работах небольшой исследовательской группы под руководством автора обзора. В действительности же существует значительно большее число работ, в которых используются иные подходы к построению самых разнообразных пери-объектов и не только на нафталиновом ядре. Кроме того в обзоре мы не затрагивали такого важного раздела как свойства и превращения перианнелированных гетероциклов. Свойства этих соединений весьма не обычны и зачастую дают ключи к новому пониманию и дополнению фундаментальных понятий и представлений органической и гетероциклической химии. Тем ни менее, в многочисленных монографиях по органической химии или химии посвященного гетероциклических пери-замещенным соединений карбонильным не и существует раздела, пери-аннелированным 26 гетероциклическим соединениям, что дает полное основания считать их, как это и отмечено в названии, новыми объектами, заслуживающими систематического изучения и предметного освещения в химической учебной и научной литературе. Надеюсь, что появление этого обзора будет стимулировать интерес специалистов к новому научному направлению и отражению его в химической литературе. Список литературы. 1. V. V. Mezheritskii, V. V. Tkachenko. Synthesis of peri-annelated heterocyclic Systems. In: Advances in Heterocyclic Chemistry, A. R. Katritzky (Ed), vol. 51, p. 434. Academic Press, New York-London (1990). 2. R. J. Packer, D. C. C. Smith. J. Chem. Soc., C., 2194 (1967). 3. D. Berry, D. C. C. Smith. J. Chem. Soc., Perkin Trans. I., 699 (1972). 4. V. Balasubramanian. Chem. Rev., 66, 567 (1966). 5. А. Ф. Пожарский. Успехи химии, 72, 498 (2003). 6. W. B. Schweizer, G. Procter, M. Kaftory, J. D. Dunitz. Helv. Chim. Acta, 61, 2783 (1978). 7. J. O’Leary., P. C. Bell., P. C. Wallis., W. B. Schweizer. J. Chem. Soc., Perkin Trans. II., 133 (2001). 8. J. C. Gallucci, D. J. Hart, G. J. Young. Acta Cryst., Sect. B., 54, 73 (1998). 9. J. Clayden, C. McCarthy, M. Helliwell. Chem. Commun., 2059 (1999). 10. R. E. Gerkin. Acta Cryst., Sect., C., 53, 1987 (1997). 11. A. C. Blackburn, R. E. Gerkin. Acta Cryst., Sect. C., 53, 1077 (1997). 12. J. E. Anderson, C. J. Cooksey. J. Chem. Soc., Chem. Commun., 942 (1975). 13. H. B. Burgi, J. D. Dunitz, E. Shefter. J. Am. Chem. Soc., 95, 5065 (1973). 14. О. Н. Жуковская, В. В. Межерицкий, В. В. Ткаченко, Г. Н. Дорофеенко. Журн. орг. химии, 14, 868 (1978). 15. В. В. Межерицкий, О. Н. Жуковская, В. В. Ткаченко, Г. Н. Дорофеенко. Журн. орг. химии, 15, 196 (1979). 16. В. В. Ткаченко, О. Н. Жуковская, В. В. Межерицкий, Г. Н. Дорофеенко. Журн. орг. химии, 13, 2009 (1977). 27 17. В. В. Межерицкий, В. В. Ткаченко, О. Н. Жуковская, Д. М. Елисеевич, Г. Н. Дорофеенко. Журн. орг. химии, 17, 627 (1981). 18. В. В. Межерицкий, О. Н. Жуковская, В. В. Ткаченко, Г. Н. Дорофеенко. Журн. орг. химии, 17, 2002 (1981). 19. В. В. Межерицкий, В. В. Ткаченко, О. Н. Жуковская. Журн. орг. химии, 19, 411 (1983). 20. Н. Г. Трегуб, А. П. Князев, В. В. Межерицкий. Журн. орг. химии, 26, 168 (1990). 21. В. В. Межерицкий, А. Л. Пикус, Л. Г. Миняева, Г. Н. Дорофеенко. Журн. орг. химии, 16, 1958 (1980). 22. В. В. Межерицкий, А. Л. Пикус, Л. Г. Миняева, Г. Н. Дорофеенко. Журн. орг. химии, 17, 1998 (1981). 23. В. В. Межерицкий, Л. Г. Миняева, Л. В. Межерицкая, А. Л. Пикус, Г. Н. Дорофеенко. Журн. орг. химии, 17, 2225 (1981). 24. В. В. Межерицкий, А. Л. Пикус, Л. Г. Миняева. Журн. орг. химии, 20, 225 (1984). 25. Л. Г. Миняева, В. В. Межерицкий. Журн. орг. химии, 21, 1941 (1985). 26. В. В. Межерицкий, Л. Г. Миняева. Журн. орг. химии, 22, 2394 (1986). 27. А. Н. Безуглов, Л. Г. Миняева, В. В. Межерицкий. Журн. орг. химии, 44, 361 (2008). 28. В. В. Межерицкий, А. Л. Пикус, Н. Г. Трегуб. Журн. орг. химии, 27, 2198 (1991). 29. А. Н. Антонов, Р. В. Тюрин, Л. Г. Миняева, В. В. Межерицкий. Журн. орг. химии, 42, 1585 (2006). 30. А. Н. Безуглов, Л. Г. Миняева, Р. В. Тюрин, В. В. Межерицкий. Журн. орг. химии, 44, 1258 (2008). 31. А. Н. Безуглов, Л. Г. Миняева, К. А. Лысенко, В. В. Межерицкий. Журн. орг. химии, 45, рег.№ 366/08 (2009). 32. В. В. Межерицкий, А. Н. Антонов, А. А. Милов, К. А. Лысенко. Журн. орг. химии, 45, рег.№ 40/09 (2009). 33. В. В. Межерицкий, А. Н. Безуглов, Л. Г. Миняева, К. А. Лысенко, Ю. В. Ревинский, А. А. Милов. Журн. орг. химии, 45, рег.№ 284/08 (2009). 34. L. Sobczyk, S. J. Grabowski, T. M. Krygowski. Chem.Rev., 105, 3513 (2005). 35. The Flavonoids, J. B. Harborne, T. J. Mabry, H. Mabry (Ed), p. 743. Acad. 28 Press, London (1975). 36. А. Л. Казаков, В. П. Хиля, В. В. Межерицкий, Ю. Литкеи. Природные и модифицированные изофлавоноиды, М. Ю. Корнилов (Ред.), с. 184. Изд-во РГУ, Ростов-на-Дону (1985). 37. В. В. Межерицкий, Е. П. Олехнович, С. М. Лукьянов, Г. Н. Дорофеенко. Ортоэфиры в органическом синтезе, А. Д. Гарновский (Ред.), с. 176. Изд-во РГУ, Ростов-на-Дону (1976). 38. В. В. Межерицкий, Е. П. Олехнович, Г. Н. Дорофеенко. Успехи химии, 42, 896 (1973). 39. V. V. Mezheritskii, A. L. Wasserman, G. N. Dorofeenko. Heterocycles, 12, 51 (1979) 40. A. T. Balaban, A. Dinculescu, G. N. Dorofeenko, G. W. Fischer, A. V. Koblik, V. V. Mezheritskii, W. Schroth. Pyrylium salts. Synthesis, Reactions and Physical Properties, in: Advances in Heterocyclic Chemistry, A. R. Katritzky (Ed), Suppl. 2, p. 434. Academic Press, New York-London (1982). 41. В. В. Межерицкий Г. Н. Дорофеенко. Журн. орг. химии, 3, 1533 (1967). 42. Г. Н. Дорофеенко, В. В. Межерицкий. Журн. орг. химии, 4, 1305 (1968). 43. В. В. Межерицкий Г. Н. Дорофеенко. Журн. общей химии, 40, 2459 (1970). 44. Г. Н. Дорофеенко, В. В. Межерицкий, Н. А. Лопатина. Хим. гетероцикл. соедин., 238 (1968). 45. Г. Н. Дорофеенко, В. В. Межерицкий, Н. А. Лопатина. Хим. гетероцикл. соедин., 1112 (1971). 46. В. В. Межерицкий, А. Л. Вассерман Г. Н. Дорофеенко. Хим. гетероцикл. соедин., 1163 (1972). 47. Г. Н. Дорофеенко, В. В. Ткаченко, В. В. Межерицкий, Н. А. Лопатина. Хим. гетероцикл. соедин., 1020 (1973). 48. Г. Н. Дорофеенко, В. В. Межерицкий, Ю. И. Рябухин, Е. П. Олехнович. Хим. гетероцикл. соедин., 1314 (1973). 49. Г. Н. Дорофеенко, В. В. Ткаченко, В. В. Межерицкий. Журн. орг. химии, 12, 432 (1976). 50. Г. Н. Дорофеенко, В. В. Ткаченко, В. И. Яковенко, В. В. Межерицкий, Э. Т. Оганесян. Хим. гетероцикл. соедин., 187 (1977). 51. Г. Н. Дорофеенко, А. Л. Шинкаренко, Л. И. Лисевицкая, А. Л. Казаков, А. И. Пыщев, В. В. Межерицкий. Хим. гетероцикл. соедин., 857 (1974). 29 52. Г. Н. Дорофеенко, А. Л. Шинкаренко, А. Л. Казаков, А. И. Пыщев, В. В. Межерицкий. Хим. природн. соедин., 160 (1974). 53. Г. Н. Дорофеенко, А. Л. Шинкаренко, Л. И. Лисевицкая, В. В. Межерицкий, А. Л. Казаков, Ю. А. Жданов. Научн. докл. высшей школы. Биологич. науки, 35 (1975). 54. Г. Н. Дорофеенко, В. В. Ткаченко, В. В. Межерицкий. Хим. гетероцикл. соедин., 465 (1975). 55. А. Л. Казаков, Л. Г. Курдюбова, В. Д. Пономарев, В. В. Межерицкий. Журн. прикл. химии, 48, 1872 (1975). 56. В. В. Межерицкий, О. Н. Жуковская, В. В. Ткаченко, Г. Н. Дорофеенко. Хим. гетероцикл. соедин., 1693 (1977). 57. В. В. Межерицкий, В. В. Ткаченко, О. Н. Жуковская, Г. Н. Дорофеенко. Журн.орг. химии, 14, 1986 (1978). 58. В. В. Межерицкий, В. В. Ткаченко, О. Н. Жуковская, Г. Н. Дорофеенко. Журн.орг. химии, 15, 662 (1979). 59. В. В. Межерицкий, О. Н. Жуковская, В. В. Ткаченко, Г. Н. Дорофеенко. Журн.орг. химии, 17, 1747 (1981). 60. Г. Н. Дорофеенко, В. В. Ткаченко. Журн.орг. химии, 8, 2188 (1972). 61. Г. Н. Дорофеенко, В. В. Ткаченко. Журн.орг. химии, 8, 2202 (1972). 62. В. В. Ткаченко, В. В. Межерицкий. Журн.орг. химии, 21, 455 (1985). 63. В. В. Межерицкий, В. В. Ткаченко, А. Л.Пикус. Журн.орг. химии, 22, 1487 (1986). 64. В. В. Межерицкий, В. В. Ткаченко. Журн.орг. химии, 31, 72 (1995). 6 5. В. В. Ткаченко, Н. Г. Трегуб, А. П. Князев, В. В. Межерицкий. Журн.орг. химии, 26, 638 (1990). 66. В. В. Межерицкий, А. Л. Пикус, Н. Г. Трегуб. Журн.орг. химии, 28, 764 (1992). 67. Р. В. Тюрин, А. А. Милов, А. Н. Безуглов, А. Н. Антонов, Л. Г. Миняева, В. В. Межерицкий . Журн. орг. химии, 43, 1474 (2007). 68. В. В. Межерицкий, О. Н. Жуковская, В. В. Ткаченко, Г. Н. Дорофеенко. Журн.орг. химии, 17, 2002 (1981). 69. В. В. Межерицкий, Л. Г. Миняева, О.М. Голянская. Журн.орг. химии, 28, 1187 (1992). 70. Л. Г. Миняева, В. В. Межерицкий, О. М. Голянская. Журн.орг. химии, 30, 30 258 (1994). 71. О. М. Голянская Л. Г. Миняева, В. В. Межерицкий. Журн.орг. химии, 30, 1030 (1994). 72. О. М. Голянская Н. А. Волошин, А. В. Чернышев, А. Д. Дубоносов, А. В. Метелица, В. В. Межерицкий В. А. Брень. Журн.орг. химии, 44, 608 (2008). 73. В. В. Межерицкий, В. В. Ткаченко, О. Н. Жуковская, Д. М. Елисеевич Г. Н. Дорофеенко. Журн.орг. химии, 17, 627 (1981). 74. А. С. Морковник, В. Б. Панов, Д. М. Елисеевич, В. В. Межерицкий. Журн.орг. химии, 19, 1984 (1983). 75. Д. М. Елисеевич, В. В. Межерицкий, Г. Н. Дорофеенко. Журн.орг. химии, 17, 1751 (1981). 76. В. В. Межерицкий, А. Л. Пикус, А. А. Спасов, О. И. Островский, Г. П. Дудченко, В. А. Косолапов. Хим.-фарм. журн., 15 (1998). 77. В. В. Межерицкий, Л. Г. Миняева, Р. В. Тюрин. Изв. Акад. наук. Сер. хим., 777 (2005). 78. В. В. Межерицкий, Л. Г. Миняева, О. М. Голянская, Р. В. Тюрин, О. Я. Борбулевич, Г. С. Бородкин, А. Н. Антонов. Журн.орг. химии, 42, 293 (2006). 79. В. В. Межерицкий, Д. М. Елисеевич, Г. Н. Дорофеенко. Журн. орг. химии, 17, 2444 (1981). 80. Д. М. Елисеевич, В. В. Межерицкий, Г. Н. Дорофеенко. Журн. орг. химии, 18, 415 (1982). 81. Д. М. Елисеевич, В. В. Межерицкий, В. Б. Панов, А. Л. Казаков. Журн. орг. химии, 20, 1474 (1984). 82. В. В. Межерицкий. В: Азотистые гетероциклы и алкалоиды, В. Г. Карцев, Г.А. Толстиков (Ред.), т. 1, с. 603, Иридиум-пресс, Москва (2001). 83. В. В. Межерицкий. В: Научная мысль Кавказа, Ю. А. Жданов (Ред.), с. 110, Изд-во Сев.-Кав. научн. центра ВШ, Ростов-на-Дону (2001). 84. В. В. Межерицкий, Р. В. Тюрин, Л. Г. Миняева. Журн. орг. химии, 37, 548 (2001). 85. Р. В. Тюрин, О. Н. Косыгина, В. В. Межерицкий. Журн. орг. химии, 45, рег.№ 250/08 (2009). 86. В. В. Межерицкий, Р. В. Тюрин, Л. Г. Миняева, А. Н. Антонов, 31 А.П. Задорожная. Журн. орг. химии, 42, 1473 (2006). 87. Р. В. Тюрин, А. П. Задорожная, А. Н. Антонов, В. В. Межерицкий. Журн. орг. химии, 44, 1680 (2008). 88. Р. В. Тюрин, Л. Г. Миняева, В. В. Межерицкий. Журн. орг. химии, 40, 1349 (2004). 89. Р. В. Тюрин, А. Н. Антонов, Л. Г. Миняева, В. В. Межерицкий. Журн. орг. химии, 41, 237 (2005). 90. Р. В. Тюрин, А. Н. Антонов, Л. Г. Миняева, В. В. Межерицкий. Журн. орг. химии, 40, 1874 (2004). 91. В. В. Межерицкий, А. Н. Антонов, А. А. Милов, К. А. Лысенко. Журн. орг. химии, 45, рег.№ 40/09 (2009). 92. А. Н. Антонов, Р. В. Тюрин, Л. Г. Миняева, В. В. Межерицкий. Журн. орг. химии, 43, 1005 (2007). 93. А. Н. Антонов, Р. В. Тюрин, К. А. Лысенко, А. Ф. Смольяков, В. В. Межерицкий. Журн. орг. химии, 44, 1074 (2008). 32