Химия - Центр ЕГЭ Магаданской области
advertisement
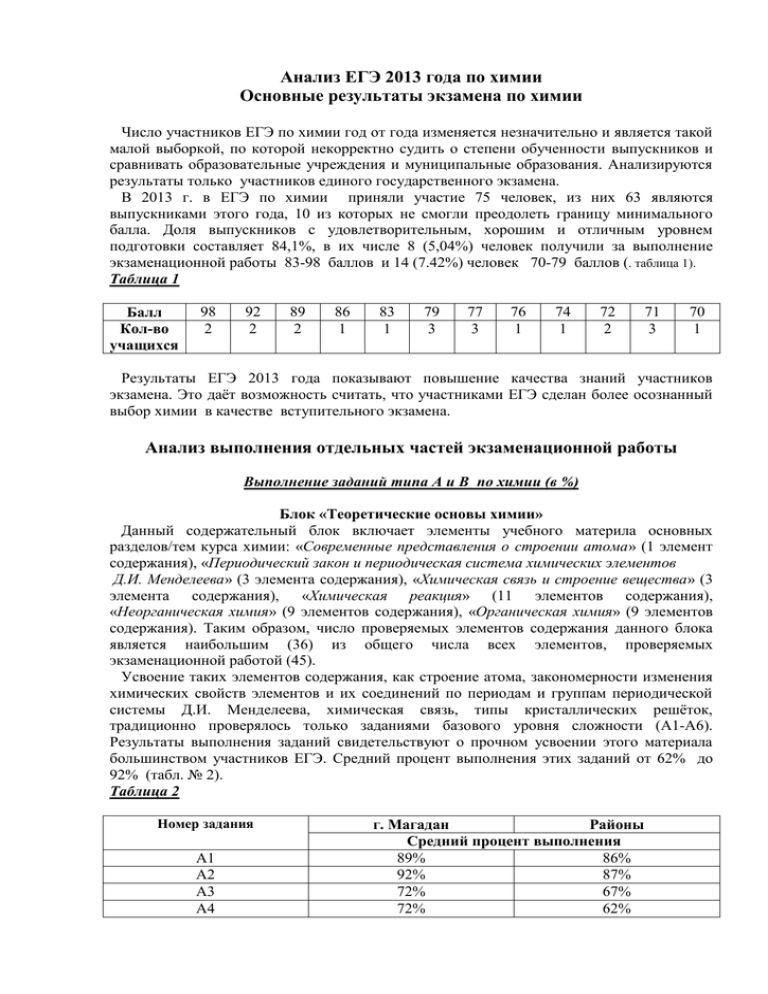
Анализ ЕГЭ 2013 года по химии Основные результаты экзамена по химии Число участников ЕГЭ по химии год от года изменяется незначительно и является такой малой выборкой, по которой некорректно судить о степени обученности выпускников и сравнивать образовательные учреждения и муниципальные образования. Анализируются результаты только участников единого государственного экзамена. В 2013 г. в ЕГЭ по химии приняли участие 75 человек, из них 63 являются выпускниками этого года, 10 из которых не смогли преодолеть границу минимального балла. Доля выпускников с удовлетворительным, хорошим и отличным уровнем подготовки составляет 84,1%, в их числе 8 (5,04%) человек получили за выполнение экзаменационной работы 83-98 баллов и 14 (7.42%) человек 70-79 баллов (. таблица 1). Таблица 1 Балл Кол-во учащихся 98 2 92 2 89 2 86 1 83 1 79 3 77 3 76 1 74 1 72 2 71 3 70 1 Результаты ЕГЭ 2013 года показывают повышение качества знаний участников экзамена. Это даёт возможность считать, что участниками ЕГЭ сделан более осознанный выбор химии в качестве вступительного экзамена. Анализ выполнения отдельных частей экзаменационной работы Выполнение заданий типа А и В по химии (в %) Блок «Теоретические основы химии» Данный содержательный блок включает элементы учебного материла основных разделов/тем курса химии: «Современные представления о строении атома» (1 элемент содержания), «Периодический закон и периодическая система химических элементов Д.И. Менделеева» (3 элемента содержания), «Химическая связь и строение вещества» (3 элемента содержания), «Химическая реакция» (11 элементов содержания), «Неорганическая химия» (9 элементов содержания), «Органическая химия» (9 элементов содержания). Таким образом, число проверяемых элементов содержания данного блока является наибольшим (36) из общего числа всех элементов, проверяемых экзаменационной работой (45). Усвоение таких элементов содержания, как строение атома, закономерности изменения химических свойств элементов и их соединений по периодам и группам периодической системы Д.И. Менделеева, химическая связь, типы кристаллических решёток, традиционно проверялось только заданиями базового уровня сложности (А1-А6). Результаты выполнения заданий свидетельствуют о прочном усвоении этого материала большинством участников ЕГЭ. Средний процент выполнения этих заданий от 62% до 92% (табл. № 2). Таблица 2 Номер задания А1 А2 А3 А4 г. Магадан Районы Средний процент выполнения 89% 86% 92% 87% 72% 67% 72% 62% А5 А6 92% 81% 86% 75% Сформированность такого важного понятия, как «степень окисления химического элемента» и умение его применять, проверялась заданиями не только базового уровня (А5), но и повышенного уровня сложности (В2) – см. примеры 1 и 2. Пример 1 (табл.1) Одну и ту же степень окисления атом хлора проявляет в соединениях: 1) СI2О и СаСI2 3) РСI3 и SСI4 2) IСI3 и СIF3 4) КСIО4 и КСI Пример 2 Установите соответствие между формулой частицы и степенью окисления хлора в ней. Формула соединения Степень окисления хлора А) СIО2 1) -1 Б) СIF3 2) 0 В) СI3) +1 Г) С2Н5СI 4) +3 5) +5 6) +7 Таблица 3 Номер задания В2 г. Магадан Районы Средний процент выполнения 76% 67% В основе выполнения этих заданий лежит одно и тоже умение – определять степень окисления химического элемента по формуле. Статистические данные показывают, что экзаменуемые успешно применяют это умение при выполнении заданий базового уровня сложности, когда требуется определить степень окисления элемента по формуле (пример 1). Но в изменённой ситуации, когда заданы формулы ионов, а не молекул, экзаменуемые справляются хуже, но средний процент выполнения заданий повышенного уровня сложности достаточно высокий (табл. 3). Наибольшее количество элементов содержания блока относятся к разделам: «Неорганическая химия», «Органическая химия». «Химическая реакция». Усвоение этого материала проверялось заданиями трёх уровней сложности – базового, повышенного и высокого. Результаты выполнения заданий, проверяющих усвоение элементов содержания раздела «Неорганическая химия» представлены в таблице 4: Таблица 4 Результаты выполнения заданий по разделу «Неорганическая химия» № п.п. 1. Средний процент выполнения заданий различного уровня сложности Проверяемый элемент содержания Классификация и неорганических веществ. Классификация и органических веществ. базового г. Мага дан 94% повышенного Райо ны г. Мага дан Райо ны 87% 68% 56% номенклатура номенклатура высокого г. Мага дан Райо ны - - 2. 3. 4. 5. 6. Характерные химические свойства простых веществ – металлов: щелочных, 81% щелочноземельных, алюминия, переходных металлов – меди, цинка, хрома, железа. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния. Характерные химические свойства оксидов: основных, амфотерных, 69% кислотных. Характерные химические свойства оснований и амфотерных гидроксидов. 75% Характерные химические свойства кислот. Характерные химические свойства солей: средних, кислых, основных; комплексных 67% (на примере соединений алюминия и цинка). Взаимосвязь различных классов неорганических веществ. 67% 71% 72% 67% - - 68% - - - - - - 68% 47% 35% 59% 69% 59% - - 63% - - 36% 28% Как видно из таблицы, экзаменуемые успешно справились с заданиями базового уровня сложности по всем проверяемым элементам (А7 – А12) содержания. Также можно отметить успешность выполнения заданий повышенного уровня сложности, проверяющих освоение знаний классификации неорганических и органических веществ (68% - 56%). При этом задания повышенного уровня сложности, проверяющие усвоение знаний о химических свойствах простых веществ, оксидов, оснований и кислот, оказались затруднительными для экзаменуемых со слабым уровнем подготовки. Причины допущенных ими ошибок имеют различный характер (см. примеры 3,4) Характерные ошибки, допускаемые экзаменуемыми: Пример 3 Только при нагревании вода реагирует с 1) серебром 2) медью 3) золотом 4) железом При выполнении этого задания необходимо было обратиться к ряду активности металлов. Только 47% и 35% экзаменуемых верно выполнил задание, выбрав «железо». Наибольшие затруднения вызвали задания повышенного уровня сложности, проверяющие свойства амфотерных гидроксидов (пример 4). Пример 4 Установите соответствие между исходными веществами и основным продуктом их взаимодействия. Формулы веществ Продукты взаимодействия А) АI(ОН)3 + RbОН(водн. р-р) 1) RbАIО2 АI2(SО4)3 + Н2О Б) АI(ОН)3 + Rb2О сплав. 2) Rb3[АI(ОН)6] В) АI(ОН)3 + СsОН сплав. 3) АI2О3 + Н2О Г) АI(ОН)3 + Сs2СО3 сплав. 4) Сs3[АI(ОН)6] Д) АI(ОН)3 t0 5) СsАIО2 Е) АI(ОН)3 + Н2SО4 → 6) RbАIО2 Большинство экзаменуемых (69% - 59%) продемонстрировали усвоение знаний о взаимодействии амфотерного гидроксида с кислотами и его способности к термическому разложению. Однако выбор продуктов реакций амфотерного гидроксида с раствором щелочи и при его сплавлении со щелочью оказался для слабо подготовленных выпускников затруднительным. Знания важнейших понятий и теорий органической химии, свойств изученных органических веществ, механизмов реакций в органической химии, а также умения выявлять классификационные признаки веществ и реакций, объяснять сущность того или иного процесса, взаимосвязь состава, строения и свойств веществ проверялись с помощью заданий базового, повышенного и высокого уровней сложности. Результаты выполнения заданий, проверяющих усвоение элементов содержания раздела «Органическая химия» представлены в таблице 5. Таблица 5 Результаты выполнения заданий по разделу «Органическая химия» № п.п. 1. 2. 3. 4. 5. 6. Средний процент выполнения заданий различного уровня сложности Проверяемый элемент содержания базового г. Мага дан Теория строения органических соединений: гомология и изомерия. Типы связей в молекулах органических 72% веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа. Характерные химические свойства углеводородов: алканов, циклоалканов, 69% алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола). Характерные химические свойства предельных одноатомных и многоатомных 78% спиртов; фенола. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. 72% Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды). Основные способы получения углеводородов (в лаборатории). Основные способы получения 61% кислородсодержащих соединений (в лаборатории). Взаимосвязь углеводородов и кислородсодержащих органических 81% соединений повышенного Райо ны г. Мага дан 65% высокого Райо ны г. Мага дан Райо ны - - - - 67% 71% 63% - - 65% 69% 62% - - 56% 63% 53% - - 54% - - - - 67% - - - - Как видно из таблицы, большинство заданий базового уровня сложности выполнено успешно (61% - 54%) и выше). Наибольшие затруднения у выпускников вызвали задания, проверяющие знания об основных способах получения углеводородов и кислородсодержащих соединений (см. примеры 5). Пример 5 5.1юЭлектролизом водного раствора ацетата калия может быть получен 1) метан 3) ацетон 2) этан 4) ацетилен Пример 6 5.2.Этиленгликоль образуется при взаимодействии этилена с 1) водным раствором КМnО4 2) водным раствором К2SО4 3) водой в присутствии катализатора 4) водородом Показательным является результат выполнения таких заданий хорошо подготовленными выпускниками. Усвоение элементов содержания по разделу «Химическая реакция» проверялось также с помощью заданий всех уровней сложности. Выполнение этих заданий в целом предусматривало проверку сформированности следующих важных умений: характеризовать реакцию на основе известных классификационных признаков; определять характер среды в водных растворах веществ; объяснять влияние различных факторов на скорость химической реакции и состояние химического равновесия; объяснять сущность изученных видов химических реакций и составлять уравнения химических реакций различных типов (электролитической диссоциации, полные и сокращённые ионные реакции реакций обмена, ОВР). Результаты выполнения таких заданий представлены в таблице 6. Таблица 6 Результаты выполнения заданий по разделу «Химическая реакция» № п.п. 1. 2. 3. 4. 5. 6. 7. 8. 9. Средний процент выполнения заданий различного уровня сложности Проверяемый элемент содержания базового повышенного высокого г. Мага дан Райо ны г. Мага дан Классификация химических реакций в неорганической и органической химии. 72% 60% - 83% 78% - - - - 75% 65% - - - - 78% 65% - - - - 81% 76% - - - - 75% 69% 59% - - 68% 76% 67% 56% 44% - 72% 62% - - Скорость реакции, её зависимость от различных факторов. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная. 78% Реакции окислительновосстановительные. 72% Электролиз расплавов и растворов (солей, щелочей, кислот). Ионный (правило В.В. Марковникова) и Райо ны - г. Мага дан - Райо ны - радикальный механизмы органической химии. реакций в - - 71% 63% - - Как видно из таблицы, большинство заданий базового и повышенного уровня сложности успешно выполнены экзаменуемыми ОУ города (69% - 83%). Наиболее проблемными для выпускников ОУ районов оказались задания повышенного уровня сложности, проверяющие сформированность знаний о гидролизе солей. Прочное овладение базовым умением определять среду раствора соли на качественном уровне отмечено у 75% экзаменуемых. При выполнении заданий повышенного уровня необходимо было раскрыть сущность процесса гидролиза (см. пример 7). Это умение сформировано лишь у выпускников с хорошим уровнем подготовки (59%). Пример 7 Установите соответствие между названием соли и способностью её к гидролизу Название соли Способность к гидролизу А) стеарат натрия 1) гидролизу не подвергается Б) сульфат этиламмония 2) гидролизуется по катиону В) карбонат калия 3) гидролизуется по аниону Г) сульфат аммония 4) гидролизуется по катиону и аниону Выполнение этого задания предполагало последовательное осуществление следующих действий: установить, сильной или слабой кислотой и основанием образована соль, и на основании этого определить характер её гидролиза. Наибольшие затруднения экзаменуемые испытали при определении отношения к гидролизу солей С17Н35СООNа, (СН3–СН2–NН3)2SО4. В учебной практике, по всей вероятности, крайне редко рассматриваются примеры сущности гидролиза подобных солей при изучении химических свойств карбоновых кислот (слабые электролиты) и аминов (слабые основания). Блок «Методы познания в химии. Химия и жизнь» Данный содержательный блок состоит из трёх разделов: «Экспериментальные основы химии» (4 элемента содержания), «Общие представления о промышленных способах получения важнейших веществ» (4 элемента содержания), «Расчёты по химическим формулам и уравнениям реакций» (9 элементов содержания). Всего 17 элементов содержания учебного материала курса химии проверяется заданиями этого блока. Причём некоторые элементы содержания, такие как: определение характера среды водных растворов веществ, индикаторы; расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного, массовой доли (массы) химического соединения в смеси – проверяются в комплексе с другими элементами содержания. Результаты выполнения заданий этого блока представлены в таблице 7. Таблица 7 Результаты выполнения заданий по разделу «Методы познания в химии. Химия и жизнь» № п.п. 1. Средний процент выполнения заданий различного уровня сложности Проверяемый элемент содержания базового г. Мага дан Райо ны повышенного г. Мага дан Раздел «Экспериментальные основы химии» • Правила работы в лаборатории. Лабораторная посуда и оборудование. 81% 71% - высокого Райо ны г. Мага дан Райо ны - - - 1. 1. 2. 3. 4. 5. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. • Качественные реакции на неорганические вещества и ионы. • Идентификация органических соединений. • Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений. Основные способы получения углеводородов и кислородсодержащих соединений (в лаборатории). Раздел «Общие представления о промышленных способах получения веществ» • Понятие о металлургии: общие способы получения металлов. • Общие научные принципы химического 58% 49% производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия. •Природные источники углеводородов, их переработка. • Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки. Раздел «Расчёты по химическим формулам и уравнениям реакций» Вычисление массы растворённого вещества, содержащегося в определённой 56% 48% массе раствора с известной массовой долей. Расчёты объёмных отношений газов при химических реакциях. Расчёты массы вещества или объёма газов по известному количеству вещества, массе 58% 54% или объёму одного из участвующих в реакции веществ. Расчёты теплового эффекта реакции. 75% 63% • Расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси). 24% 23% • Расчёты (объёма, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определённой массовой долей растворённого вещества. • Расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного. • Расчёты массовой доли (массы) химического соединения в смеси. 6. Нахождение вещества. молекулярной формулы - - - 41% 32% Задания по разделу «Экспериментальные основы химии» представляли собой своеобразный «мысленный» эксперимент. Как видно из данных, представленных в таблице, экзаменуемые справились с этими заданиями достаточно успешно. Подтвердим это конкретным примером. Пример 8 И сульфид-ион и ортофосфат-ион можно обнаружить с помощью раствора 1) НNО3 3) Ва(ОН)2 2) Nа2SО4 4) АgNО3 При выборе ответа на это задание выпускникам было необходимо проанализировать состав анионов, применить знания об их свойствах и спрогнозировать результат реакции с выбранным реагентом. Первый и второй реагенты ошибочно выбрали выпускники, т.к. не учли того, что результаты с данными веществами не позволят распознать анионы. Естественно, что для выпускников со слабым уровнем подготовки эти задания оказались трудными, а для хорошо подготовленных учащихся особой трудности не представляли (81% - 71%). Результаты выполнения заданий, проверяющих усвоение элементов содержания раздела «Общие представления о промышленных способах получения важнейших веществ», показывают, что у выпускников менее успешно усвоены знания об общих способах получения металлов, научных принципах химического производства (на примере промышленного получения аммиака, серной кислоты, метанола), природных источниках углеводородов и их переработке (58% - 49%) ( см. пример 9). Пример 9 Верны ли следующие суждения о способах получения железа? А. Железо можно получить восстановлением оксида железа (III) оксидом углерода (II). Б. Железо можно получить при взаимодействии раствора хлорида железа (III) с медью.??? 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны Это задание проверяет знания о промышленном (А) и лабораторном (Б) способах получения железа. Результаты выполнения задания свидетельствуют о недостаточно прочном усвоении этих элементов содержания, особенно выпускниками со слабым уровнем подготовки. Умения выпускников проводить расчёты различного вида проверялись с помощью расчётных задач базового, повышенного и высокого уровня сложности. Результаты, приведённые в таблице 6., позволяют сделать вывод о том, что для выпускников со слабым уровнем подготовки эти задания оказались трудными, а хорошо подготовленные учащиеся успешно выполнили эти расчёты на базовом и повышенном уровнях сложности (48% - 58%). Все экзаменуемые достаточно успешно справились с расчётами теплового эффекта реакции (75% - 63%). Заслуживает внимания анализ результатов выполнения заданий высокого уровня сложности. Выполнение заданий типа С по химии. Основные элементы содержания, проверяемые заданиями с развёрнутым ответом При отборе содержания для заданий с развёрнутым ответом учитывается в первую очередь, какие элементы содержания и умения являются наиболее важными и отвечающими требованиям образовательного стандарта профильного уровня к подготовке выпускников средней (полной) школы. К таким элементам содержания, в частности, были отнесены: реакции окислительно-восстановительные, строение веществ, взаимное влияние атомов в молекулах, механизмы протекания реакций в органической химии, генетическая связь между классами неорганических соединений, вычисления по химическим формулам и уравнениям реакций. При выполнении заданий экзаменуемый должен продемонстрировать понимание сущности единства мира веществ, механизмов протекания реакций, владение умением составлять уравнения реакций применять знания о свойствах веществ различных классов, особенностях строения веществ и др. Большая роль отведена расчётным задачам по химии. Это объясняется тем, что при их решении необходимо опираться на знания химических свойств соединений, использовать умение составлять уравнения химических реакций, т.е. использовать теоретическую базу и определённые операционно-логические и вычислительные навыки. Подход к отбору содержания заданий с развёрнутым ответом, положительно зарекомендовавший себя в ходе эксперимента по ЕГЭ, сохранён применительно к содержанию экзаменационной работы 2013 г. Рейтинг выполнения заданий типа «С» составил от 86 до 71 (5 человек), минимальный – 30 (7 человек), общий – 53 Примеры ответов экзаменуемых и комментарии по их оцениванию Задание С1 - проверяемый ведущий элемент содержания - степень окисления элемента, окислитель, восстановитель, электронный баланс. Рейтинг выполнения задания от 85 до 70 (7 человек), минимальный 26 (11 человек), общий - 53. Таблица 8 Номер задания С1 г. Магадан Районы Средний процент выполнения 56% 44% Примеры выполнения задания С1 Используя метод электронного баланса, составьте уравнение реакции: КNО2 + … + Н2SО4 → I2 + NО + … + … Определите окислитель и восстановитель. Содержание верного ответа и указания по оцениванию Баллы Элементы ответа: 1) составлен электронный баланс: N+3 + 1ē → N+2 2 2I- - 2ē → I20 1 1 2) указано, что йод в степени окисления – 1 является восстановителем, а азот в степени окисления + 3(или нитрит калия за счёт азота в степени окисления + 3) – окислителем. 3) расставлены коэффициенты в уравнении реакции: 1 1 2КNО2 + 2КI + 2Н2SО4 → I2 + 2NО +2 К2SО4 + 2Н2О Максимальный балл 3 Пример 1 2КN+3О2 + 2КI- + 2Н2SО4 → I2 0+ 2N+2О +2 К2SО4 + 2Н2О N+3 + 1ē → N+2 2 В. 0 2I - 2ē → I2 1 О. В ответе экзаменуемого верно выполнены 1-й и 3-й элементы ответа (см. критерии оценивания). Ошибка допущена во 2-м элементе ответа – неверно указан окислитель и восстановитель в данном процессе. Следовательно, оценка за выполнение задания 2 балла. Пример 2 2К+N+3О-22 + 2Н+I- + Н+2S+6О-24 → I2 0+ 2N+2О-2 + К+2S+6О-24 + 2Н+2О-2 N+3 + 1ē → N+2 1 2 восстановитель I- - 1ē·2 →I2 2 1 окислитель Отметим, что экзаменуемый в качестве пропущенного реагента выбрал иное вещество (НI), чем указано в эталоне ответа (КI), что не противоречит химической сущности процесса. В ответе верно выполнены 1-й и 3-й элементы, но допущена ошибка в определении окислителя и восстановителя. Этот ответ можно оценить 2 баллами. Предметом обсуждения являются следующие вопросы: 1) умение правильно определять положительное, отрицательное и нулевое значение степени окисления химических элементов, указывать окислитель и восстановитель; 2) составлять электронный (либо электронно-ионный) баланс; 3) следует подчеркнуть, что подбор коэффициентов не предполагает установления состава продуктов реакции; наоборот, вначале составляют схему реакции, т.е. устанавливают формулы продуктов, исходя из химических свойств реагентов, а затем подбирают коэффициенты в уравнении реакции на основе электронного баланса. Примеры выполнения задания С2 Задание С2 – в условии задания предложено описание конкретного химического эксперимента, ход которого экзаменуемые должны объяснить с помощью уравнений химических реакций. Рейтинг выполнения задания от 87 до 71 (6 человек), минимальный – 28 (11 человек), общий - 53. Таблица 9 Номер задания С1 г. Магадан Районы Средний процент выполнения 36% 28% Фосфат кальция прокалили с кремнезёмом и углём. Образовавшееся простое вещество прореагировало с избытком хлора. Полученный продукт внесли в избыток раствора гидроксида калия. На образовавшийся раствор подействовали известковой водой. Напишите уравнения четырёх описанных реакций. Содержание верного ответа и указания по оцениванию Баллы Элементы ответа: написаны четыре уравнения описанных реакций: 1) Са3(РО4)2 + 5С + 3SіО2 = 2Р↑ + 5СО↑ + 3СаSіО3 2) 2Р + 5СI2 = 2РСI5 3) РСI5 + 8КОН = К3РО4 + 5КСI + 4Н2О 4) 2К3РО4 + 3Са(ОН)2 = Са3(РО4)2 + 6КОН 1 1 1 1 4 Максимальный балл Пример 1 1) Са3(РО4)2 + 5С + 3SіО2 = 2Р↑ + 5СО2↑ + 3СаSіО3 2) 2Р + 5СI2 = 2РСI5 3) РСI5 + 8КОН = К3РО4 + 5КСI + 4Н2О 4) 2К3РО4 + 3СаСО3 = Са3(РО4)2 + 3К2СО3 В данном задании верно выполнены 2-й и 3-й элементы. В первом уравнении один из продуктов реакции должен быть – оксид углерода (II), коэффициенты не соответствуют данному уравнению, а в четвёртом уравнении учащийся не знает формулы известковой воды Са(ОН)2, допущена фактическая ошибка. Такой ответ можно оценить 2 баллами из четырех. Предметом обсуждения являются следующие вопросы: 1) знание химических свойств неорганических веществ различных классов; 2) умение подтверждать существование генетической связи между веществами различных классов путём составления уравнений соответствующих реакций; 3) отрабатывать умение составлять уравнения реакций взаимодействия металлов и неметаллов с азотной и серной кислотами разной концентрации, солей щелочных металлов с перманганатом калия (дихроматом калия) в кислой, щелочной и нейтральной среде, многие участники ЕГЭ не могут писать формулы комплексной соли типа К[АI(ОН)4]. Примеры выполнения задания С3 Задание С3 – проверяют усвоение знаний о взаимосвязи органических веществ и предусматривают проверку пяти элементов содержания: правильности написания пяти уравнений реакций, соответствующих схеме – «цепочке» превращений. Рейтинг выполнения задания от 89 до 71 (7 человек), минимальный – 26 (10 человек), общий 54. Таблица 10 г. Магадан Районы Средний процент выполнения 35% 31% Номер задания С1 Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: С2Н4 С2Н4СI2 изб. КОН (спирт),tº Х1 tº, Сакт. Х2 СН СI, АIСI 3 3 Х3 КМnО , Н SО , tº 4 2 4 С6Н5СООН При написании уравнений реакций используйте структурные формулы органических веществ. Содержание верного ответа и указания по оцениванию Элементы ответа: написаны уравнения реакций, соответствующие схеме превращений: Баллы 1) С2Н4 + СI2 → С2Н4СI2 tº 2) С2Н4СI2 + 2КОН (спирт.) С2Н2 + 2КСI + 2Н2О tº, С акт. 3) 3С2Н2 С6Н6 4) С6Н6 + СН3СI СН3СI, АIСI3 С6Н5СН3 + НСI 5) 5С6Н5-СН3 + 6КмnO4 + 9Н2SО4 → 5С6Н5-СООН + 6МnSО4 + 3К2SО4 + 14Н2О Максимальный балл 1 1 1 1 1 5 Пример 1 С2Н4 + СI2 → С2Н4СI2 tº 2С2Н4СI2 + 2КОН (спирт.) 4С2Н2 + 2КСI 3С2Н2 → С6Н6 С6Н6 + СН3СI → С6Н5СН3СI С6Н5-СН3 + КмnO4 + Н2SО4 → С6Н5-СООН + … В представленном примере верно выполнены 1-й и 3-й элементы ответа (см. критерии оценивания). Во втором уравнении пропущен один из продуктов реакции – вода, четвёртое и пятое уравнение реакции не составлены, экзаменуемый не умеет определить тип реакции (4) и характер продуктов окислительно-восстановительной реакции с участием органических соединений (5). В ответе использованы молекулярные формулы органических веществ, а не структурные, как того требует задание. В данном случае такая запись формул допустима, но она не позволяет судить о понимании экзаменуемым механизмов реакций и умении написания структурных формул. Такой ответ можно оценить 2 баллами. Пример 2 1) СН2 = СН2 FеСI 3 |СН2 – СI СН2 СI 2) СН 2СI - СН2СI + 2КОН (спирт.) 3) СН ≡СН tº СН ≡СН + 2КСI + 2Н2О tº, С акт. СН3 4) + СН3СI АIСI 3 СН3 5) 5 + НСI СООН + 6КмnO4 + 9Н2SО4 → 5 + 14Н2О + 3К2SО4 + 6МnSО4 Данный ответ экзаменуемого можно оценить с разницей в 1 балл (4 и 5 баллов) (см. критерии оценивания). Отметим, что в записи третьего уравнения учащийся пропустил коэффициент 3 перед формулой ацетилена (С2Н2). Эта ошибка является основанием для выставления 4 баллов. В тоже время по представленной записи ответа (см. 2-е и 5-е уравнения) можно судить о сформированности у экзаменуемого умения расставлять коэффициенты в уравнениях реакций. При написании уравнений реакций использованы структурные формул органических соединений. Поэтому возможна оценка ответа и в 5 баллов. Пример 3 1) СН2 = СН2 + СI2 → СН2 СI – СН2СI 2) СН2 СI – СН2СI + 2КОН (спирт.) 3) 3СН ≡СН tº СН ≡СН + 2КСI + 2Н2О tº, С акт. СН3 4) + СН3СI АIСI 3 СН3 5) + НСI СООН + КмnO4 + Н2SО4 → + МnSО4 + К2SО4 + Н2О В данном ответе экзаменуемый не расставил коэффициенты в пятом уравнении реакции (критерии оценивания). В этом случае выполнение задания оценивается однозначно 4 баллами. При сравнении этого ответа с примером 2 следует обратить внимание, что для расстановки коэффициентов в уравнении 5 учащийся должен продемонстрировать более высокий уровень владения умением расставлять коэффициенты в уравнениях окислительно – восстановительных реакций с участием органических веществ, умение определять степень окисления углерода в органических соединениях. Поэтому 4 балла за этот ответ более справедливая оценка, чем в примере 2. Предметом обсуждения являются следующие вопросы: 1) знание характерных химических свойств органических веществ различных классов; 2) умение подтверждать существование генетической связи между веществами различных классов путём составления уравнений соответствующих реакций с учётом заданных условий их протекания; 3) при записи уравнений реакций, экзаменуемые должны использовать структурные формулы органических веществ; 4) отличия в трактовке понятий «схема реакции» и «уравнение реакции». Особенно это касается написания уравнений окислительно-восстановительных реакций с участием органических веществ. Так, например, окисление этилена водным раствором КМnО4 может быть записано в виде схемы реакции, где КМnО4 имеет условное обозначение [О] – окислитель. Такая, не требующая коэффициентов, запись часто используется в школе, но данное задание предполагает подробную запись уравнения с расстановкой коэффициентов соответственно степеням окисления элементов. Примеры выполнения задания С4 Задания С4 – это расчётные задачи. Рейтинг выполнения задания от 92 до 72 (5 человек), минимальный 34 (14 человек), общий - 52. Таблица 11 Номер задания С1 г. Магадан Районы Средний процент выполнения 24% 23% Смешали 100 мл 30%-ного раствора хлорной кислоты (ρ = 1,11 г/мл) и 300 мл 20%-ного раствора гидроксида натрия (ρ = 1,10 г/мл). Сколько миллилитров воды следует добавить к полученной смеси, чтобы массовая доля перхлората натрия в ней составила 8%? Содержание верного ответа и указания по оцениванию Элементы ответа: 1) записано уравнение реакции: НСIО4 + NаОН = NаСIО4 + Н2О 2) рассчитаны количества веществ реагентов и сделан вывод об избытке одного из веществ: n(NаОН) = 300 · 1,1 · 0,2/40 = 1,65 моль – в избытке n(НСIО4) = 100 · 1,11 ·0,3/100,5 = 0,33 моль 3) вычислена масса продукта реакции: n(NаСIО4) = n(НСIО4) = 0,33 моль m(NаСIО4) = 0,33 · 122,5 ≈ 40,4 г 4) вычислена масса добавленной воды: 0,08 = 40,4/ 100 · 1,11 + 300 · 1,1 + х откуда х = 64 г V(Н2О) = 64 мл Максимальный балл Баллы 1 1 1 1 4 Пример 1 Решение НСIО4 + NаОН = NаСIО4 + Н2О m(НСIО4)раств = 100 · 1,11 = 111 г m(НСIО4) = 111/ 100 · 30 = 33,3 г n(НСIО4) = 33,3/100,5 = 0,33 моль m(NаОН)раств = 300 · 1,10 = 330 г m(NаОН) = 330/40 = 66 n(NаОН) = 66/40 = 1,64 моль NаОН в избытке n(НСIО4) : n(NаСIО4) = 1:1 => n(NаСIО4) = 0,33 моль m(NаСIО4) = 0,33 · 122,5 = 40,425 г m (раств) = 100 + 300 = 400 мл ԝ% (NаСIО4) = 40,425/400 · 100 = 10,1% 10,1/400 · 100 = 2,5% в 100 граммах воды растворяется 2,5% NаСIО4 в нам надо 8% => 10,1 – 8 = 2,1% если на 100 г Н2О приход 2,5% то на 2,1% надо примерно 80 г надо чтобы масса раствора увеличилась на 25 г, то есть добавить 80 г Н2О в ответе экзаменуемого верно выполнены 1-й, 2-й и 3-й элементы ответа (см. критерии оценивания). Ошибка допущена в 4-м элементе ответа – вместо массы раствора рассчитан объём раствора. Дальнейший ход решения также неверен. Такое выполнение задания следует оценить 3 баллами. Следует обратить внимание на использование химической терминологии: название и обозначение единиц измерения массы, объема, массовой доли. Место для формулы.Пример 2 Решение НСIО4 + NаОН = NаСIО4 + Н2О ν(НСIО4) = 100 мл · 0,3 · 1,11 г/мл / 100,5 г/мл = 0,33 моль (нед.) ν(NаОН) = 300 мл · 0,2 · 1,10 г/мл / 40 Г/мл = 1,65 моль (изб.) по ур-ию: ν(НСIО4)= ν(NаСIО4)= 0,33 моль m(NаСIО4)= 0,33 моль · 122,5 г/моль = 40,425 г mв(NаСIО4)= 0,08 ·40,425 г = 3,234 г ν(NаСIО4)= 3,234 г / 122,5 г/моль = 0,0264 моль ν(Н2О )=0,0264 моль m(Н2О) = 0,0264 моль · 18 г/моль = 0,4752 г V(Н2О) = 0,4752 г / 1 г/мл = 0,4752 мл Ответ: V(Н2О)= 0, 4752 мл При проверке данного ответа следует обратить внимание на ошибочную последовательность действий экзаменуемого на заключительном этапе решения задания. Поэтому отметка за выполнение задания выставляется с учётом правильно выполненных первых трёх элементов – 3 балла. Задания С4 – это расчётные комбинированные задачи. Их выполнение требует знания химических свойств веществ и предполагает осуществление некоторой совокупности действий, обеспечивающих получение правильного ответа. В числе таких действий назовём следующие: 1) составление уравнений химических реакций (согласно данным задачи), необходимых для выполнения стехиометрических расчётов; 2) выполнение расчётов, необходимых для нахождения ответов на поставленные в условии задачи вопросы; 3) правильное использование единиц измерения используемых величин; 4) формулирование логически обоснованного ответа на все поставленные в условии задания вопросы. Пример 1 Смесь безводных сульфата алюминия и хлорида меди (II) растворили в воде и добавили к избытку раствора гидроксида натрия. При этом образовалось 19,6 г осадка. А если тот же раствор солей добавить к раствору нитрата бария, то выделилось бы 69,9 г осадка. Определите массовую долю сульфата алюминия в исходной смеси. Записаны уравнения реакций: 1) АI2(SО4)3 + 8NаОН = 3Nа2SО4 + 2Nа[АI(ОН)4] 2) СuСI2 + 2NаОН = Сu(ОН)2↓ + 2NаСI 3) АI2(SО4)3 + 3Ва(NО3)2 =3 ВаSО4↓ + 2АI(NО3)3 При написании уравнений реакций учтено условие задачи – избыток раствора гидроксида натрия. (При постепенном добавлении раствора щелочи к раствору соли алюминия сначала наблюдается образование осадка амфотерного гидроксида алюминия, который растворяется в избытке щелочи: АI2(SО4)3 + 6NаОН (нед.) = 3Nа2SО4 + 2АI(ОН)3↓ АI2(SО4)3 + 8NаОН (изб.) = 3Nа2SО4 + 2Nа[АI(ОН)4] ) В этом случае по уравнению 2 легко вычислить массу СuСI2, по уравнению 3 – массу сульфата алюминия, найти массу смеси этих солей и вычислить массовую долю сульфата алюминия в ней по формуле w(АI2(SО4)3) 𝒎(А𝑰𝟐(𝑺О𝟒)𝟑) =𝒎(А𝑰𝟐(𝑺О𝟒)𝟑 )+𝒎(С𝒖С𝑰𝟐 ) = 𝟎,… или …..% . Пример 2 Смесь безводных сульфата алюминия и хлорида меди (II) растворили в воде и добавили к избытку раствора гидроксида натрия, образовалось 19,6 г осадка. А если раствор тех же солей добавить к раствору нитрата бария, то выделилось бы 69,9 г осадка. Определите массовую долю сульфата алюминия в исходной смеси. Записаны уравнения реакций, проигнорировав словосочетание «к избытку»: 1) АI2(SО4)3 + 6NаОН = 3Nа2SО4 + 2АI(ОН)3↓ 2) СuСI2 + 2NаОН = Сu(ОН)2↓ + 2NаСI 3) АI2(SО4)3 + 3Ва(NО3)2 =3 ВаSО4↓ + 2АI(NО3)3 В этом случае будет другим путь вычислений: *по уравнению 3 вычислим количество вещества и массу сульфата алюминия; *по уравнению 1 вычислим количество вещества и массу выпавшего в осадок гидроксида алюминия; *вычитанием из 19,6 г полученной массы гидроксида алюминия найдем массу выпавшего в осадок гидроксида меди; *по уравнению 2 вычислим количество вещества и массу вступившего в реакцию хлорида меди; 𝒎(А𝑰𝟐(𝑺О𝟒)𝟑) * по формуле w(АI2(SО4)3) = =0, … вычислим 𝒎(А𝑰𝟐(𝑺О𝟒)𝟑 )+𝒎(С𝒖С𝑰𝟐 ) массовую долю сульфата алюминия в исходной смеси. Ответ получится другим в отличие от первого примера. Задание из-за неправильно записанного уравнения 1 будет оценена нулем баллов, так как изначально поведет к неверному результату. В лучшем случае – 1 балл возможен за вычисление количества вещества и массы сульфата алюминия по уравнению 3. При проверке в первую очередь обращается внимание на логическую последовательность выполненных действий, поскольку некоторые задачи могут быть решены разными способами. В целях объективной оценки предложенного способа решения задачи проверяется правильность промежуточных результатов, которые используются для получения ответа. Пример выполнения задания С5 Задание С5 – вывод молекулярной формулы вещества. Рейтинг выполнения задания от 87 до 72 (4 человека), минимальный - 35 (19 человек), общий - 52. Таблица 12 Номер задания С1 г. Магадан Районы Средний процент выполнения 41% 32% Сложный эфир массой 30 г подвергнут щелочному гидролизу. При этом получено 34 г натриевой соли предельной одноосновной кислоты и 16 г спирта. Установите молекулярную формулу этого эфира. Содержание верного ответа и указания по оцениванию Баллы Элементы ответа: 1) составлено уравнение гидролиза эфира в общем виде, найдено количество вещества едкого натра: R1СООR2 + NаОН → R1СООNа + R2ОН M(NаОН) = (34 + 16) – 30 = 20 г или n(NаОН) = 20/40 = 0,5 моль 2) определена молярная масса эфира: Из уравнения следует, что n(R1СООR2) = n(NаОН) = 0,5 моль, тогда m(R1СООR2) = m/n = 30/0,5 = 60 г/моль 3) определена молекулярная формула эфира: M(R1 + R2) = 60 - 12 – 32 = 16 г/моль, следователь радикалами R1 и R2 могут быть только атом Н и метил СН3 Формула эфира НСООСН3 Максимальный балл 1 1 1 3 Пример 1 Решение СnН2n+1СОО - СnН2n+1 + NаОН → СnН2n+1СООNа + СnН2n+1ОН m(NаОН) = (mсоли + mспирта) – mэфира = (34 + 16) – 30 = 20 г n(NаОН) = 20 г / 40 г/моль = 0,5 моль n(эфира) = n(NаОН) = 0,5 моль М(эфира) = 30/95 = 60 г/моль 14n + 1 + 12 + 32 + 14n + 1= 60 28n = 14 n = 0,5 не подходит Н – СООСН3 Ответ: НСООСН3 метиловый эфир муравьиной кислоты Первый элемент ответа выполнен экзаменуемым в соответствии с образцом ответа. Записан правильный ответ. Но задача не решена – она списана с плохой шпаргалки, где 0,5 (n(эфира) = n(NаОН) = 0,5 моль) прочитано как 95 (М(эфира) = 30/95 = 60 г/моль), при делении 30 на 95 не получается 60! А отсюда - к правильному ответу дороги нет. Запись «14n + 1 + 12 + 32 + 14n + 1= 60; 28n = 14» и вывод «n = 0,5 не подходит» каким образом привели к правильному ответу? Следовательно, ответ просто списан. В этом случае задание может быть оценено нулем баллов, как признанное списанным, или одним баллом за первый элемент ответа. Задания С5 - предусматривают определение молекулярной формулы вещества. Выполнение этого задания включает три последовательных операции: 1) составление схемы химической реакции; 2) определение стехиометрических соотношений реагирующих веществ; 3) вычисления на их основе, приводящие к установлению состава неизвестного вещества. В заданиях С5 используется комбинирование проверяемых элементов содержания – расчётов, на основе которых приходят к определению молекулярной формулы вещества. К тем действиям, которые выполняются в расчётных задачах С4 (стехиометрические расчёты), во многих задачах этого типа добавляются действия другого уровня сложности – составление общей формулы вещества и далее – определение на её основе молекулярной формулы вещества. Все эти действия могут быть выполнены в различной последовательности. Иными словами, экзаменуемый может прийти к ответу любым, доступным для него, логическим путём. Следовательно, при оценивании задания главное внимание обращается на правильность выбранного способа определения молекулярной формулы вещества. Расхождения в оценке выполнения задания С5, бывают обусловлены следующим: 1) отсутствие записи формулы неизвестного вещества; 2) наличие ошибок, допущенных при расстановке коэффициентов при записи уравнений реакций или при вычислениях на одном из промежуточных этапов решения задачи, что приводит к неверному числовому значению ответа при правильном ходе решения; 3) небрежность оформления записей при решении задач, что ведёт к неправильному использованию полученных данных при дальнейших вычислениях. Выводы и рекомендации Анализ результатов ЕГЭ 2013 г. показал, что выпускники с различным уровнем подготовки продемонстрировали наиболее хороший уровень овладения учебным материалом в основном при выполнении заданий базового и повышенного уровней сложности. В первую очередь, это относится к заданиям по следующим разделам и темам курса химии средней школы: «Современные представления о строении атома», «Электроотрицательность. Степень окисления и валентность химических элементов», «Классификация, номенклатура неорганических и органических веществ», «Взаимосвязь углеводородов и кислородсодержащих органических соединений», «Скорость реакции, её зависимость от различных факторов», «Реакции ионного обмена», «Реакции окислительновосстановительные», «Гидролиз солей», «Электролитическая диссоциация электролитов в водных растворах», «Расчёты теплового эффекта химической реакции». Средний процент выполнения таких заданий находится в пределах 92% - 58%. Между тем, результаты выполнения некоторых заданий повышенного и высокого уровней сложности свидетельствует о наличии определенного числа слабо усвоенных элементов содержания. Среди этих элементов такие общие понятия, как: - «Характерные химические свойства неорганических соединений» (В5-47% - 35%); - «Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей» (В9-56% - 48%); - «Реакции, подтверждающие взаимосвязь различных классов неорганических соединений» (С2-36% - 28%); - «Расчёты массы или объёма продукта реакции, если одно из веществ дано в виде раствора с определённой массовой долей растворённого вещества» (С4-24% - 23%). Результаты ЕГЭ 2013 года позволяют сделать следующие выводы: - единый государственный экзамен даёт возможность объективно и беспристрастно оценить уровень усвоения школьного курса химии; - выполнение отдельными участниками заданий повышенного и высокого уровня, повышение среднего тестового и максимального балла говорит о хорошей подготовке профильно ориентированных выпускников образовательных учреждений и достаточной дифференцирующей способности экзамена для отбора абитуриентов; - доля неудовлетворительных отметок по результатам ЕГЭ изменяется скачкообразно и свидетельствует о том, что часть выпускников выбирает предмет для экзамена «на всякий случай»; - повторяющиеся из года в год ошибки – это проблема не только выпускников, выбравших химию для экзамена в формате ЕГЭ, это проблема обучения химии: недостаточно используются в практической работе материалы анализа результатов экзамена, формы тренировочных и контрольных заданий, идентичные ЕГЭ, недостаточно внимания уделяется в процессе обучения анализу предъявляемых заданий. На основании результатов ЕГЭ 2013 г. можно высказать ряд предложений по совершенствованию отдельных аспектов преподавания химии в школе. Важным основанием для совершенствования учебного процесса является анализ затруднений выпускников в освоении отдельных элементов содержания курса химии. Анализ этих затруднений позволит в рамках учебного процесса организовать подготовку к ЕГЭ по следующим направлениям: 1. Постоянная работа по систематизации и обобщению учебного материала, направленная на развитие умений выделять в содержании изучаемого и изученного главное, устанавливать причинно-следственные связи между отдельными элементами содержания, обращая особое внимание на взаимосвязь состава, строения и свойств веществ. 2. Использование для успешного формирования важнейших теоретических понятий в учебном процессе различных по форме упражнений и заданий на применение этих понятий в различных ситуациях и темах курса. 3. Развитие навыков анализа и выбора адекватной последовательности действий при выполнении любого предлагаемого задания. 4. Ориентирование учащихся 10-11 классов, проявляющих интерес к химии, на использование при подготовке к ЕГЭ Кодификатора элементов содержания и требований к уровню подготовки выпускников общеобразовательных учреждений и Спецификации контрольных измерительных материалов для проведения единого государственного экзамена по химии. В учебном процессе: - постоянно обращать внимание учащихся на требования образовательного стандарта по химии к уровню подготовки выпускников средней (полной) школы; - в ходе изучения курса химии и при проведении тематического и итогового контроля знаний использовать разные формы предъявления заданий по изученному материалу, идентичные заданиям ЕГЭ, обращая внимание на задания по установлению соответствия между названиями веществ и их формулами, формулами веществ и способностью их взаимодействовать с веществами предложенного перечня, исходными веществами и продуктами реакции и т.д.; - применять поэлементное оценивание самостоятельных, проверочных и контрольных работ; - для подготовки к ЕГЭ использовать материалы печатных изданий, разработанных специалистами ФИПИ или рекомендуемых ФИПИ для подготовки к ЕГЭ; тренировочные задания, образцы экзаменационных работ, Кодификатор элементов содержания и требований к уровню подготовки выпускников общеобразовательных учреждений, Спецификацию контрольных измерительных материалов для проведения единого государственного экзамена по химии; - практиковать интерактивную форму подготовки через сеть Интернет. Методическую и практическую помощь учителю и учащимся при подготовке могут оказать: Учебники и учебные пособия: * Габриелян О.С., Остроумов И.Г. Химия. 10 * Габриелян О.С., Остроумов И.Г., Пономарев С.Ю. Химия. 11 * Габриелян О.С., Лысова Г.Г., Введенская А.ГНастольная книга учителя. Химия. 11 класс. II часть. (ОВР) - М.: Дрофа, 2003. *Егоров А.С.. – Ростов н/Д Химия. Новое учебное пособие для поступающих в вузы: Феникс, 2007 *Еремин ВВ., Кузьменко Н.Е., Теренин В.И. Химия 10 (углубленный уровень) *Еремин ВВ., Кузьменко Н.Е., Дроздов А.А. Химия 11 (углубленный уровень) и др. * Кузьменко Н.Е., Еремин В.В., Попков В.А.. Начала химии. Современный курс для поступающих в вузы, учебник - М.: Издательство «Экзамен», 2007 * Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия: Для школьников старших классов и поступающих в вузы: Учеб. Пособие. М.: Дрофа, 1995 * Кузьменко Н.Е., Еремин В.В. 2500 задач по химии с решениями для поступающих в вузы: учебное пособие – М.: Издательство «Экзамен», 2006 (Серия «Абитуриент») * Кузьменко Н.Е., Еремин В.В.,. Чуранов С.С. Сборник конкурсных задач по химии М.: Экзамен, 2001 * Лидин Р.А. ЕГЭ. Химия. Самостоятельная подготовка к ЕГЭ. – М.: Издательство «Экзамен», 2013 * Литвинова Т.Н., Мельникова Е.Д., Соловьёва М.В., Ажипа Л.Т., Выскубова Н.К.. Химия в задачах для поступающих в вузы - М.: ООО «Издательство Оникс»: ООО «Издательство «Мир и Образование», 2009 *Новошинский И.И., Новошшинская Н.С. Химия.8, Химия 9, Химия 10 (углубленный уровень), Химия 11 (углубленный уровень) * Резяпкин В.И. 700 задач по химии с примерами решений для старшеклассников и абитуриентов. – Мн.: ООО «Юнипресс», 2003 (Серия «Всё для школы») * Салыгина М.В.. – СП.: «Виктория плюс», 2011 (Серия «Экзамен на пять») *Турчен Д.Н.. Химия. Расчётные задачи – М.: Издательство «Экзамен», 2009 (Серия «Абитуриент») Информационные ресурсы 1. http://ege.edu.ru/ - информационный портал ЕГЭ 2. http://gia.edu.ru/ - информационный портал ГИА 3. http://www.fipi.ru/ - сайт Федерального института педагогических измерений 4. http://ege49.ru/ - сайт Магаданского Центра мониторинга качества образования. Для локальной сети - lan.ege49.ru. Тренировочное компьютерное тестирование (КЕГЭ) по предварительным заявкам по всем предметам. 5. http://window.edu.ru/ - сайт информационной системы «Единое окно доступа к образовательным ресурсам», 6. www.rustest.ru - сайт Федерального центра тестирования. http://college.ru/ - онлайн подготовка к ЕГЭ, бесплатный экспресс-тест по любому предмету, знакомство с конспектами в свободном доступе, тесты ЕГЭ в режиме тренажёра и стимулятора.




