НОМЕНКЛАТУРА, СПОСОБЫ ПОЛУЧЕНИЯ И СВОЙСТВА СОЛЕЙ.
advertisement
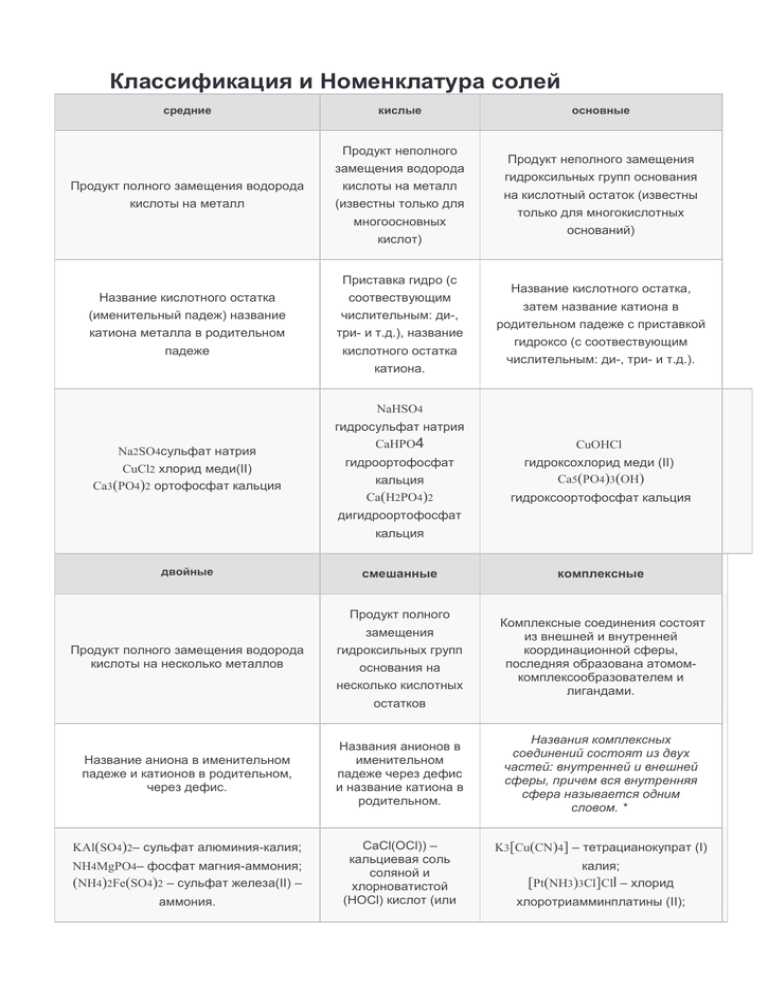
Классификация и Номенклатура солей средние кислые Продукт неполного замещения водорода Продукт полного замещения водорода кислоты на металл кислоты на металл (известны только для многоосновных кислот) Приставка гидро (с Название кислотного остатка соотвествующим (именительный падеж) название числительным: ди-, катиона металла в родительном три- и т.д.), название падеже кислотного остатка катиона. основные Продукт неполного замещения гидроксильных групп основания на кислотный остаток (известны только для многокислотных оснований) Название кислотного остатка, затем название катиона в родительном падеже с приставкой гидроксо (с соотвествующим числительным: ди-, три- и т.д.). NaHSO4 Na2SO4сульфат натрия CuCl2 хлорид меди(II) Ca3(PO4)2 ортофосфат кальция гидросульфат натрия CaHPO4 гидроортофосфат кальция Ca(H2PO4)2 CuOHCl гидроксохлорид меди (II) Ca5(PO4)3(OH) гидроксоортофосфат кальция дигидроортофосфат кальция двойные смешанные Продукт полного замещения Продукт полного замещения водорода кислоты на несколько металлов гидроксильных групп основания на несколько кислотных остатков Название аниона в именительном падеже и катионов в родительном, через дефис. KAl(SO4)2– сульфат алюминия-калия; NH4MgPO4– фосфат магния-аммония; (NH4)2Fe(SO4)2 – сульфат железа(II) – аммония. Названия анионов в именительном падеже через дефис и название катиона в родительном. CaCl(OCl)) – кальциевая соль соляной и хлорноватистой (HOCl) кислот (или комплексные Комплексные соединения состоят из внешней и внутренней координационной сферы, последняя образована атомомкомплексообразователем и лигандами. Названия комплексных соединений состоят из двух частей: внутренней и внешней сферы, причем вся внутренняя сфера называется одним словом. * K3[Cu(CN)4] – тетрацианокупрат (I) калия; [Pt(NH3)3Cl]Cll – хлорид хлоротриамминплатины (II); хлорид-гипохлорит кальция). [Co(H2O)3F3]– трифторотриаквакобальт ОБЩИЕ СПОСОБЫ СИНТЕЗА СОЛЕЙ ПОЛУЧЕНИЕ СРЕДНИХ СОЛЕЙ: Средние соли можно получить путем следующих взаимодействий: 1) металла с неметаллом (получение солей бескилородных кислот): 2Na+Cl2=2NaCl 2) металла с кислотой (за исключением HNO3 любой концентрации и H2SO4(конц. Zn+2HCl=ZnCl2+H2↑ 3) металла с раствором соли менее активного металла. Более активные металлы, расположенные в ряду активности левее, способны вытеснять менее активные (расположенные правее) металлы из их солей: Fe+CuSO4=FeSO4+Cu 4) основного оксида с кислотным оксидом: 4MgO+CO2=MgCO3 5) основного оксида с кислотой: CuO+H2SO4=CuSO4+H2O 6) основания с кислотным оксидом: Ba(OH)2+CO2=BaCO3+H2O 7) реакциями ионного обмена, а именно: основания с кислотой, соли с кислотой, раствора основания с раствором соли, растворов двух солей. Реакции протекают в случае, если образуется газ, осадок или вода (правило Бертолле): Ca(OH)2+2HCl=CaCl2+2H2O MgCO3+2HCl=MgCl2+H2O+CO2↑ BaCl2+H2SO4=BaSO4↓+2HCl Ba(OH)2+Na2SO4=2NaOH+BaSO4↓ 3CaCl2+2Na3PO4=Ca3(PO4)2↓+6NaCl ПОЛУЧЕНИЕ КИСЛЫХ СОЛЕЙ: Для получения кислых солей необходимо обеспечить условия, при которых обеспечивается увеличение концентрации протонов водорода H+ . Поэтому кислые соли получаются при: 1. Взаимодействии кислоты с недостатком основания: KOH+H2SO4=KHSO4+H2O 2. Взаимодействии основания с избытком кислотного оксида: Ca(OH)2+2CO2=Ca(HCO3)2 3. Взаимодействии средней соли с кислотой: Ca3(PO4)2+4H3PO4=3Ca(H2PO4)2 ПОЛУЧЕНИЕ ОСНОВНЫХ СОЛЕЙ: Для получения основных солей, наоборот, необходимо обеспечить условия, при которых увеличивается концентрация анионов гидроксогруппы OH−OH−. К таким условиям относятся: 1. Гидролиз солей, образованных слабым основанием и сильной кислотой ZnCl2+H2O=[Zn(OH)]Cl+HCl 2. Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов: AlCl3+2NaOH=[Al(OH)2]Cl+2NaCl 3. Взаимодействие солей слабых кислот со средними солями: 2MgCl2+2Na2CO3+H2O=[Mg(OH)]2CO3+CO2+4NaCl ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЛЕЙ: Комплексные соли получаются в результате реакций соединения, обмена, окислительновосстановительных реакций, а также при электролизе: HgI2+2KI (изб.) = K2[HgI4] CuSO4+4NH4OH=[Cu(NH3)4]SO4+4H2O, ZnCl2+4NaOH (изб.) = Na2[Zn(OH)4]+2NaCl. Комплексные соли также образуются при взаимодействии солей с лигандами: AgCl+2NH3=[Ag(NH3)2]Cl FeCl3+6KCN]=K3[Fe(CN)6]+3KCl ПОЛУЧЕНИЕ ДВОЙНЫХ СОЛЕЙ: 1.Совместная кристаллизация двух солей: Cr2(SO4)3+K2SO4+24H2O=2[KCr(SO4)2⋅12H2O] ХИМИЧЕСКИЕ СВОЙСТВА средних солей 1. ТЕРМИЧЕСКОЕ РАЗЛОЖЕНИЕ. Карбонаты разлагаются с образованием основного оксида и углекислого газа: CaCO3=CaO+CO2 Нитраты металлов разлагаются с образованием восстановления азотной кислоты до различных продуктов, в зависимости от положения металла в ряду напряжений: Запомнить! Исключение: NH4NO3−→−t∘C,N2O↑+2H2O Соли аммония разлагаются, как правило, с выделением аммиака: NH4Cl−→t∘C NH3↑+HCl Запомнить! Исключения: (NH4)2Cr2O7−→t∘C, Cr2O3+N2↑+4H2O NH4NO2−→t∘C ,N2↑+2H2O 2. ГИДРОЛИЗ. Более подробно эта тема освещена в разделе "Гидролиз солей". Al2S3+6H2O=2Al(OH)3+3H2S FeCl3+H2O=Fe(OH)Cl2+HCl Na2S+H2O=NaHS+NaOH 3. РЕАКЦИИ ИОННОГО ОБМЕНА Соли могут вступать в обменные реакции с кислотами, основаниями и другими солями в соответствии со следующими правилами: ОПРЕДЕЛЕНИЕ 1. Соли, образованные более слабой или летучей кислотой, взаимодействуют с более сильными кислотами. 2. Соли реагируют со щелочами, если образуется осадок нерастворимого гидроксида или выделяется газ. 3. Соли взаимодействуют друг с другом в случае образования осадка. AgNO3+HCl=AgCl↓+HNO3 Fe(NO3)3+3NaOH=Fe(OH)3↓+3NaNO3 CaCl2+Na2SiO3=CaSiO3↓+2NaCl AgCl+2Na2S2O3=Nа3[Ag(S2O3)2]+NaCl 4. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ, ОВР, в которые могут вступать соли, обусловленны свойствами катиона или аниона: 2KMnO4+16HCl=2MnCl2+2KCl+5Cl2+8H2O Соли взаимодействуют с более активными металлами, при этом более активный металл стоит в ряду напряжения (ЭХР) левее: Zn+CuSO4=Cu+ZnSO4 ZnCl2+2Na=2NaCl+Zn В случае, если простое вещество является менее активным металлом (стоит правее металл, входящего в состав соли) замещения не происходит: Zn+NaCl≠ ХИМИЧЕСКИЕ СВОЙСТВА КИСЛЫХ СОЛЕЙ: 1. Термическое разложение с образованием средней соли Ca(HCO3)2=CaCO3+CO2↑+H2O 2. Взаимодействие со щёлочью: образование средней соли. Ba(HCO3)2+Ba(OH)2=2BaCO3+2H2O ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ СОЛЕЙ: 1. Термическое разложение: [Cu(OH)]2CO3=2CuO+CO2↑+H2O 2. Взаимодействие с кислотой: образование средней соли. Sn(OH)Cl+HCl=SnCl2+H2O ХИМИЧЕСКИЕ СВОЙСТВА КОМПЛЕКСНЫХ СОЛЕЙ: 1. Разрушение комплексов за счёт образования малорастворимых соединений: 2[Cu(NH3)2]Cl+K2S=CuS↓+2KCl+4NH3↑ 2. Обмен лигандами между внешней и внутренней сферами. K2[CoCl4]+6H2O=[Co(H2O)6]Cl2+2KCl ХИМИЧЕСКИЕ СВОЙСТВА ДВОЙНЫХ СОЛЕЙ: 1. Взаимодействие с растворами щелочей: KCr(SO4)2+3KOH=Cr(OH)3+2K2SO4


