Одноосновные карбоновые кислоты
advertisement
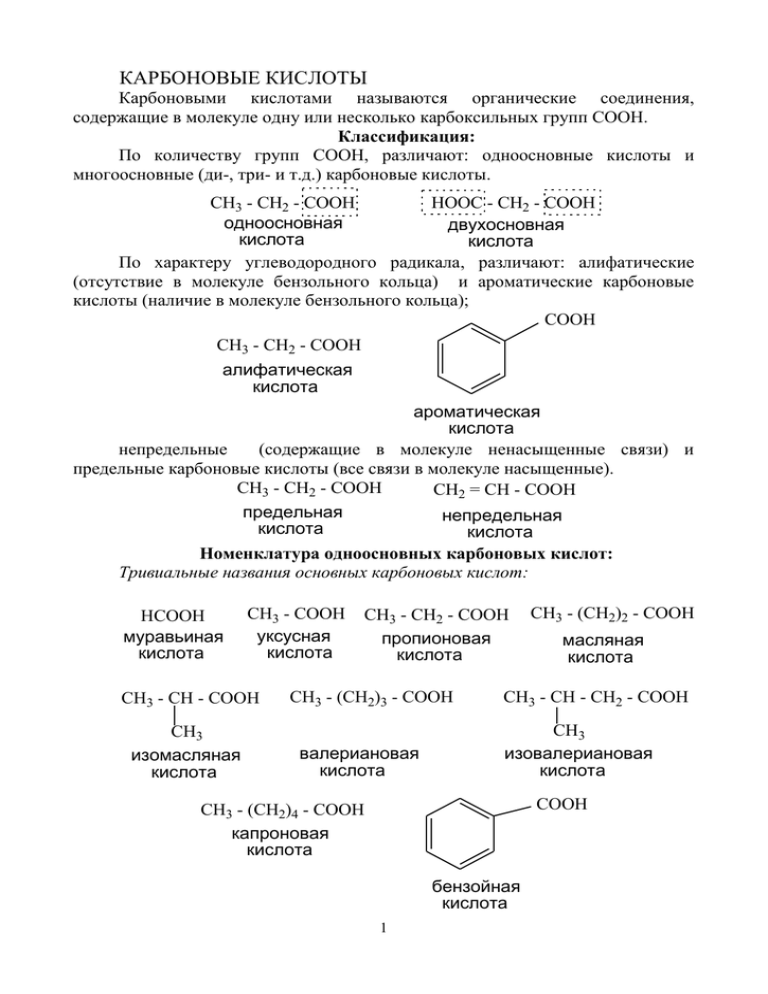
КАРБОНОВЫЕ КИСЛОТЫ Карбоновыми кислотами называются органические соединения, содержащие в молекуле одну или несколько карбоксильных групп СООН. Классификация: По количеству групп СООН, различают: одноосновные кислоты и многоосновные (ди-, три- и т.д.) карбоновые кислоты. CH3 - CH2 - COOH HOOC - CH2 - COOH одноосновная двухосновная кислота кислота По характеру углеводородного радикала, различают: алифатические (отсутствие в молекуле бензольного кольца) и ароматические карбоновые кислоты (наличие в молекуле бензольного кольца); COOH CH3 - CH2 - COOH алифатическая кислота ароматическая кислота непредельные (содержащие в молекуле ненасыщенные связи) и предельные карбоновые кислоты (все связи в молекуле насыщенные). CH3 - CH2 - COOH CH2 = CH - COOH предельная непредельная кислота кислота Номенклатура одноосновных карбоновых кислот: Тривиальные названия основных карбоновых кислот: HCOOH муравьиная кислота CH3 - COOH уксусная кислота CH3 - CH - COOH CH3 изомасляная кислота CH3 - CH2 - COOH пропионовая кислота CH3 - (CH2)3 - COOH валериановая кислота CH3 - (CH2)2 - COOH масляная кислота CH3 - CH - CH2 - COOH CH3 изовалериановая кислота COOH CH3 - (CH2)4 - COOH капроновая кислота бензойная кислота 1 Систематическая номенклатура одноосновных карбоновых кислот (ИЮПАК): 1. Выбирают в молекуле наиболее длинную углеродную цепь, в которую входит атом углерода карбоксильной группы СООН. 2. Нумерацию цепи начинают с атома углерода карбоксильной группы. 3. Называют окружающие радикалы: в порядке возрастания, с указанием количества и положения в цепи. 4. По длине цепи называют углеводород (алкан, алкен, алкин, и т.д.), добавляя –овая кислота. 5. Ароматические карбоновые кислоты называют, как производные бензойной кислоты (см. лекцию «Арены»). Пример1: 6 5 4 3 2 CH3 1 CH3 - CH - CH2 - CH - CH2 - CH - COOH C2H5 CH3 7,8 2,4,6 - триметилоктановая кислота Пример 2: COOH 4 Cl 1 2 COOH CH3 CH3 4-хлор-2-метилбензойная кислота м-метилбензойная кислота Рациональная номенклатура одноосновных карбоновых кислот: По рациональной номенклатуре основа названия – уксусная кислота. Данная номенклатура используется для названия относительно простых карбоновых кислот. Выделяется цепочка из двух атомов углерода (включающая углерод карбоксильной группы), и, в порядке возрастания, с указанием количества, называются окружающие ее радикалы. Пример 1: 2 CH3 - CH - CH - COOH CH3 CH3 метилизопропилуксусная кислота Пример 2: C2H5 - CH - COOH C2H5 диэтилуксусная кислота Изомерия Для одноосновных карбоновых кислот характерна структурная изомерия, связанная со строением углеводородного радикала. Пример: CH3 - CH2 - CH2 - CH2 - CH2 - COOH CH3 - CH - CH2 - CH2 - COOH CH3 гексановая кислота 4-метилпентановая кислота Физические свойства № 1 2 3 4 5 6 Название Агрегатное t- пл., t- кип., 0 0 кислоты состояние С С муравьиная жидкость 8 101 уксусная жидкость 17 118 пропионовая жидкость -21 141 масляная жидкость -5 164 изомасляная жидкость -46 154 бензойная твердое 122 249 вещество рКа Относительная 250С плотность, d420 3,75 1,2126 4,76 1,0492 4,87 0,993 4,81 0,960 4,84 0,950 4,19 1,322 Одноосновные карбоновые кислоты с числом атомов углерода от 1 до 9 – бесцветные жидкости, с резким характерным запахом. Ароматические и высшие алифатические кислоты – твердые 3 вещества. Температуры кипения одноосновных карбоновых кислот выше температур кипения соответствующих альдегидов и спиртов, из-за образования ими, за счет водородных связей, ассоциатов. O: ..... H - O C-R R-C O - H....:O Способы получения одноосновных карбоновых кислот 1. Оксосинтез Исходное соединение (алкен) берется на один атом углерода меньше, чем получаемая кислота. Одновременно образуется два изомера карбоновой кислоты. Реакция осуществляется под действием смеси воды и СО2. -COOH, H R - CH = CH2 алкен CO + H2O R - CH2 - CH2 - COOH t, p, kt COOH R - CH - CH3 карбоновые кислоты Пример 1: -COOH, H CH3 - CH = CH2 пропен CO + H2O t, p, kt CH3 - CH2 - CH2 - COOH бутановая кислота COOH CH3 - CH - CH3 2-метилпропановая кислота 4 Пример 2: -COOH, H COOH CO + H2O CH3 - CH = CH - C2H5 пентен-2 CH3 - CH2 - CH - C2H5 2-этилбутановая кислота t, p, kt COOH CH3 - CH - CH2 - C2H5 2-метилпентановая кислота 2. Окисление спиртов, альдегидов. При окислении первичных спиртов образуются альдегиды, которые, в свою очередь, окисляются до карбоновых кислот. При окислении вторичных спиртов образуются кетоны, которые, при дальнейшем окислении, образуют карбоновые кислоты с меньшим количеством атомов углерода. Подробно данные реакции рассматривались в темах «Спирты», «Альдегиды и кетоны». O O R - CH2 - OH R - CH = O - H2O первичный спирт альдегид R - COOH - H2O карбоновая кислота Пример: O O C3H7 - CH2 - OH бутанол-1 C3H7 - CH = O - H2O - H2O бутаналь O R-CH2 - C = O R -CH2 - CH - OH CH2 -R1 - H2O O C3H7 - COOH бутановая кислота R -CH2 - COOH + R1 - COOH CH2 -R1 R - COOH + R1 -CH2 - COOH Пример: 5 O CH3 - CH - OH CH2 -C2H5 пентанол-2 O O CH3 - C = O - H2O CH2 - C2H5 пентанон-2 CH3 - COOH + C2H5 - COOH этановая пропановая кислота кислота HCOOH + C2H5 -CH2 - COOH метановая бутановая кислота кислота 3. Гидролиз геминальных тригалогенопроизводных Данный способ позволяет получить карбоновую кислоту с тем же количеством атомов углерода, что и в исходном соединении. Реакция протекает по механизму Sn в две стадии (через образование многоатомного спирта). Cl OH 3HOH R - CH2 - C - Cl - 3HCl R - CH2 - C - OH OH Cl R - CH2 - COOH -H2O карбоновая кислота многоатомный спирт тригалогенопроизводное Пример: Cl OH 3HOH CH3 - CH2 - C - Cl - 3HCl CH3 - CH2 - C - OH OH Cl 1,1,1-трихлорпропан многоатомный спирт 6 CH3 - CH2 - COOH -H2O пропановая кислота 4. Гидролиз нитрилов Нитрилы – производные карбоновых кислот, содержащие в молекуле цианогруппу (-CN). Нитрилы образуются при действии цианистого натрия или калия на моногалогенопроизводное. Реакция протекает по механизму Sn. При дальнейшем гидролизе нитрила на первой стадии образуется амид кислоты, а, затем, при подкислении, карбоновая кислота. Исходное моногалогенопроизводное берется на один атом углерода меньше, чем получаемая кислота. KCN R - CH2 - C R - CH2 - Br N H2O -KBr NH2 амид кислоты нитрил кислоты моногалогалогенопроизводное R - CH2 - C = O HOH R - CH2 - C = O HCl OH -NH4Cl Пример: KCN CH3 - CH2 - C CH3 - CH2 - Br N -KBr бромэтан нитрил пропановой кислоты H2O CH3 - CH2 - C = O NH2 амид пропановой кислоты HOH CH3 - CH2 - C = O HCl -NH4Cl OH пропановая кислота 5. Получение кислот из металлорганических соединений Металлорганические соединения (реактив Гриньяра) – органические соединения, содержание в молекуле атомы магния и галогена. Образуются при действии магния (в абсолютном эфире) на моногалогенопроизводное. При дальнейшем действии на реактив Гриньяра СО2 образуется смешанная соль, 7 которая при разложении минеральной кислотой, образует карбоновую кислоту. Исходное моногалогенопроизводное берется на один атом углерода меньше, чем получаемая кислота. O=C=O Mg R - CH2 - Cl R - CH2 - MgCl абс.эфир реактив моногалогеноГриньяра производное R - CH2 - C = O OMgCl смешанная соль HCl R - CH2 - COOH -MgCl2 Пример: O=C=O CH3 - CH2 - Cl CH3 - CH2 - MgCl CH3 - CH2 - C = O абс.эфир этилмагнийOMgCl хлорид смешанная соль Mg HCl CH3 - CH2 - COOH -MgCl2 6. Гидролиз производных карбоновых кислот. Гидролиз различных производных карбоновых кислот (сложных эфиров, ангидридов и др.) позволяет получить карбоновые кислоты, как один из продуктов реакции. Подробно указанные реакции разбираются в лекции «Производные карбоновых кислот». Ниже приведена общая схема указанного процесса. O H OH R-C-Z O R - C - OH + HZ производное карбоновой кислоты карбоновая кислота 7. Получение бензойной кислоты Помимо указанных выше способов, бензойную кислоту можно 8 получить окислением гомологов аренов. Подробно эта реакция рассмотрена в теме «Арены». R COOH O Пример: CH3 COOH O бензойная кислота метилбензол Строение молекулы карбоновой кислоты Характеристика связей в молекуле карбоновой кислоты ТИП СВЯЗИ ДЛИНА СВЯЗИ, НМ С=О 0,123 С - ОН 0,136 О-Н 0,095 Атом углерода в карбоксильной группе находится в состоянии sp 2гибридизации. Три sp2-гибридные орбитали идут на образование связей с соседними атомами кислорода и углерода. Негибридизованная р-орбиталь участвует в образовании π-связи в оксо-(карбонильной) группе. Двойная связь С = О длиннее, чем в альдегидах, а одинарная связь С-ОН, наоборот, короче, чем в спиртах. В результате этого в карбоксильной группе возникает π-р9 сопряжение. р-орбиталь атома кислорода группы ОН взаимодействует с рорбиталью атома углерода карбонильной группы С=О. Исходя из особенностей строения карбоксильной группы можно сделать следующие выводы: 1. Связь С=О поляризована (электронная плотность смещена к кислороду (вследствие более высокой электроотрицательности последнего). На атоме кислорода оксогруппы возникает избыток электронной плотности (δ-), на атоме углерода - недостаток электронной плотности (δ+). Следовательно, атом углерода смещает в свою сторону электронную плотность по связи С – ОН. Связь О – Н поляризуется, и водород способен к отщеплению в виде протона, что указывает на кислотные свойства карбоновых кислот (реакции Se). - O + -C - O H + 2. Связь С-ОН так же поляризована, т.е. электронная плотность по данной связи смещается в сторону кислорода группы ОН. Следовательно, может происходить разрыв связи С-ОН (реакции Sn). + O -C - OH 3. Карбоксильная группа, в целом, является электроноакцепторной группой и способна смещать электронную плотность от соседнего атома углерода (α-углеродного атома). Соответственно, электронная плотность по связи С-Н у α-углеродного атома смещается к углероду и водород приобретает подвижность и способен к отщеплению (реакции Se в углеводородном радикале). + -C R - CH O - OH H Химические свойства. Для кислот характерны следующие типы реакций: 1. Электрофильное замещение (SE). 2. Нуклеофильное замещение (SN). 10 3. Электрофильное замещение (SE) по α-углеродному атому. 1.Реакции электрофильного замещения (SE) Ряд кислотности органических соединений (в порядке снижения кислотных свойств. 1. Карбоновые кислоты 2. Фенолы 3. Вода 4. Спирты 5. Ацетилен Кислотные свойства соединений определяются по рКа (рКа = - logKa, где Ка – константа кислотности). Чем ниже значение рКа, тем выше кислотные свойства. Общие закономерности изменения кислотных свойств карбоновых кислот в зависимости от строения радикала: 1. При увеличении длины цепи кислотность падает. HCOOH CH3 - COOH CH3 - CH2 - COOH 2. При увеличении объема радикала кислотность падает. CH3 CH3 - CH2 - CH2 - COOHCH3 - CH - COOH 3. Чем ближе разветвление к карбоксильной группе, тем ниже кислотность. CH3 CH3 CH3 - CH - CH2 - COOH CH3 - CH2 - CH - COOH 4. Наличие в молекуле донорной группы снижает силу кислоты, акцепторной – повышает. CH3 Cl CH3 - CH - COOH CH3 - CH - COOH 5. Ароматические карбоновые кислоты проявляют более высокую кислотность, чем алифатические. Объясняется это акцепторным действием бензольного кольца. 11 COOH CH3 - COOH 1.1. Реакция солеобразования При взаимодействии карбоновых кислот с металлами (Na, K, Mg и др.), водными растворами щелочей, карбонатами, аммиаком образуются соли. Данная реакция подтверждает кислотные свойства карбоновых кислот. В реакции с аммиаком протон из карбоксильной группы присоединяется к атому азота (по неподеленной электронной паре), затем, катион аммония возвращается и присоединяется к атому кислорода. 12 Na R-C=O R-C=O - 1/2 H2 ONa натриевая соль карбоновой кислоты O-H Mg R-C=O - H2 O Mg O R-C=O магниевая соль карбоновой кислоты KOH R-C=O водн. -H2O OK калиевая соль карбоновой кислоты NaHCO3 R - C= O -CO2 - H2O NH3 ONa натриевая соль карбоновой кислоты R - C= O ONH4 аммониевая соль карбоновой кислоты Пример: 13 Na C3H7 - C = O C3H7 - C = O - 1/2 H2 ONa натриевая соль бутановой кислоты( бутират натрия) O-H бутановая кислота Mg C3H7 - C = O - H2 O Mg O C3H7 - C = O магниевая соль бутановой кислоты( бутират магния) KOH C3H7 - C = O водн. -H2O OK калиевая соль бутановой кислоты( бутират калия) NaHCO3 C3H7 - C= O -CO2 - H2O NH3 ONa натриевая соль бутановой кислоты( бутират натрия) C3H7 - C= O ONH4 аммониевая соль бутановой кислоты( бутират аммония) 2. Реакции нуклеофильного замещения (SN) Данная группа реакций позволяет получить производные карбоновых кислот. Происходит замещение группы ОН в карбоксильной группе на нуклеофильную частицу. Подробно производные карбоновых кислот 14 рассмотрены в аналогичной теме. 2.1. Реакция спиртов с минеральными и карбоновыми кислотами (реакция этерификации). Реакция с карбоновыми кислотами протекает в присутствии серной кислоты, при нагревании. Реакция этерификации процесс обратимый. Наряду с образованием сложного эфира и воды, происходит процесс образования исходных спирта и кислоты. Для того, чтобы сместить равновесие реакции в сторону образования конечных продуктов, необходимо один из компонентов (спирт или карбоновую кислоту) взять в избытке. Реакционная способность кислот и спиртов связана с кислотными свойствами этих соединений. Чем выше кислотные свойства кислоты и спирта, тем легче они вступают в данную реакцию. Реакция спиртов с минеральными кислотами протекает на холоде. O O H2SO4 R1 - C - OR + H2O R - O - H + R1 - C - OH сложный эфир карбоновая кислота Пример1: O O H2SO4 C2H5 - O - H + CH3 - C - OH этанол CH3 - C - OC2H5 + H2O этиловый эфир уксусной кислоты ( этилацетат ) уксусная кислота Механизм реакции этерификации O O H2SO4 C2H5 - O - H + CH3 - C - OH этанол CH3 - C - OC2H5 + H2O этиловый эфир уксусной кислоты ( этилацетат ) уксусная кислота 1.Образование протонированной кислоты При взаимодействии карбоновой кислоты с протоном (из катализатора H2SO4) происходит разрыв π-связи, с образованием протонированной кислоты. 15 + - CH3 - C = O H+ CH3 - C+ - OH OH OH протонированная кислота 2. Взаимодействие протонированной кислоты со спиртом. Молекула спирта (за счет неподеленной электронной пары атома кислорода группы ОН) взаимодействует с молекулой протонированной кислоты, образуя промежуточный продукт. При этом положительный заряд с атома углерода кислоты переходит на атом кислорода группы ОН спирта. Т.к. последний отдал на образование связи неподеленную электронную пару. C2H5 - O+ - H CH3 - C+ - OH + C2H5 - O - H CH3 - C - OH OH OH протонированная кислота промежуточный продукт 3. Перегруппировка. Далее, происходит перегруппировка – протон из группы ОН спирта переходит к кислороду группы ОН карбоновой кислоты. Положительный заряд, также переходит на другой атом кислорода. C2H5 - O+ - H C2H5 - O H CH3 - C - O+ - H CH3 - C - OH OH OH промежуточный продукт ( а) промежуточный продукт 4. Образование промежуточного продукта. Далее, происходит отщепление молекулы воды, с образованием карбкатиона. Положительный заряд переходит на атом углерода карбоксильной группы. 16 C2H5 - O C2H5 - O H CH3 - C+ CH3 - C - O+ - H - H2O OH OH промежуточный продукт ( а) карбкатион 5. Образование конечного продукта. На последней стадии процесса происходит отщепление протона (возвращение его в катализатор) и образование двойной связи С = О (сложного эфира). C2H5 - O C2H5 - O CH3 - C+ - H+ CH3 - C O OH сложный эфир ( этилацетат) карбкатион 2.2. Реакция образования галогенангидридов карбоновых кислот При действии на карбоновую кислоту PCl3, PCl5, SOCl2 (тионилхлорид) происходит замещение группы ОН на галоген, с образованием галогенангидрида кислоты. PCl3 R -C=O -H3PO3 OH PCl5 -POCl3 -HCl SOCl2 -SO2 -HCl Пример: 17 R-C=O Cl хлорангидрид карбоновой кислоты PCl3 CH3 - C = O -H3PO3 OH этановая кислота PCl5 CH3 - C = O -POCl3 -HCl Cl хлорангидрид этановой кислоты ( ацетилхлорид) SOCl2 -SO2 -HCl 2.3. Образование ангидридов карбоновых кислот. При нагревании, в присутствии P2O5, карбоновые кислоты образуют ангидриды. 2R-C=O OH t, P2O5 -H2O R-C=O O R-C=O ангидрид карбоновой кислоты Пример: 2CH3 - C = O OH t, P2O5 -H2O CH3 - C = O O CH3 - C = O ангидрид этановой кислоты ( уксусный ангидрид) 2.4. Образование амида карбоновой кислоты Образование амида происходит ступенчато. На первом этапе из карбоновой кислоты образуется аммонийная (аммониевая) соль, которая при нагревании образует амид. 18 R-C=O NH3 t R-C=O R-C=O -H2O ONH4 OH аммониевая соль карбоновой кислоты NH2 амид карбоновой кислоты Пример: CH3 - C = O NH3 t CH3 - C = O ONH4 OH аммониевая соль уксусной кислоты ( ацетат аммония) 19 -H2O CH3 - C = O NH2 амид уксусной кислоты ( ацетиламид)








