5. Какое соединение неизвестно в цепочке
advertisement

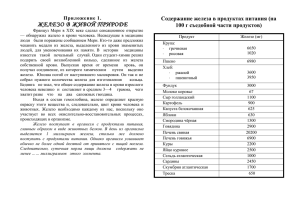
Инструктивная карта для учащегося – вариант 1 УЭ – 0 Цели изучения модуля 1. Ознакомиться с природными минералами, содержащими железо 2.Рассмотреть генетические ряды, характерные для соединений железа(II) и железа(III). 3. Пронаблюдать за качественными реакциями на ионы Fe2+ и Fe3+. 4. Расширить знания о роли железа в природе и жизни человека. УЭ – 1 Входной контроль Цель: определить исходный уровень знаний необходимых для изучения модуля; вырабатывать умения быстро находить верные и отвергать неверные суждения. Задание: 1. Выполните графический диктант, заполните таблицу в протоколе (отметьте шалашиком “^” на отрезке номер верного положения и знаком « - « номер неверного положения). Графический диктант. Вариант 1. 1.Железо – это активный щелочной металл. 2.Железо легко куется. 3.Железо входит в состав сплава бронзы. 4.На внешнем энергетическом уровне атома железа 2 электрона. 5.Железо взаимодействует с разбавленными кислотами. 6.С галогенами образует галогениды со степенью окисления +2. 7.Железо не взаимодействует с кислородом. 8.Железо можно получить путем электролиза расплава его соли. Обменяйтесь протоколами, проверьте правильность выполнения задания и оцените себя (за каждый правильный ответ -1балл, максимальное количество баллов - 8). УЭ – 2 Природные соединения железа. Цель: Ознакомиться с образцами природных соединений железа. Задание: 1. Рассмотрите природные образцы 2. Прослушайте сообщения учащихся 3. Заполните таблицу в протоколе, используя материал учебника на стр. 65, слайд презентации. Заполнение таблицы оценивается в 4 балла, при условии, что всё заполнено правильно. УЭ – 3 Генетические ряды железа(II) и железа(III). Цель: Осуществить цепочки превращений, отражающих генетические ряды соединений железа(II) и железа(III), выполнить лабораторную работу. Работа в парах!!! Задание: 1. Допишите уравнения химических реакций, расставьте коэффициенты. Проверьте правильность выполнения задания и оцените себя (за каждый правильный ответ -1балл, максимальное количество баллов - 6). 2. Выполните лабораторную работу. Лабораторная работа «Качественные реакции на ионы Fe2+ и Fe3+». Задание: 1. В одну пробирку налейте 1 – 2 мл раствора сульфата железа (II) - (№ ЗЗ), а в другую пробирку 1 – 2 мл хлорида железа (III) - (№ 25). Добавьте в обе пробирки по 1 – 2 мл раствора щёлочи (№ 14). Внимание: при проведении эксперимента соблюдайте правила техники безопасности! 2. Составьте отчёт, заполнив таблицу в протоколе к уроку 3. Впишите пропущенные слова в предложения Проверьте правильность выполнения задания и оцените себя (за каждый правильный ответ -1балл, максимальное количество баллов - 5). Проблемная ситуация: Пронаблюдайте, что произошло с гидроксидом железа (II). Как вы думаете, почему происходит изменение цвета осадка? Реакция показана в учебнике на стр 65. Запишите данную реакцию в протокол. УЭ – 4 Качественные реакции на ионы Fe2+ и Fe3+. Цель: Провести качественные реакции на ионы Fe2+ и Fe3+, наблюдать за цветом осадков. Задание: пронаблюдайте за демонстрационным опытом, поучаствуйте в обсуждении. Fe2+ + красная кровяная соль → синий осадок Fe3+ + жёлтая кровяная соль Fe3+ + роданид калия → кроваво-красное окрашивание Олимпиадное задание Определить присутствие солей Fe3+ в солях Fe2 + можно по реакции: 1) с жёлтой кровяной солью 2) с роданидом натрия 3) с гидроксидом натрия 4) с соляной кислотой УЭ – 5 Значение железа в природе и жизни человека. Цель: получить представление о значении железа в природе и жизни человека, о применении железа и его сплавов в народном хозяйстве. Задание: 1. Прослушайте сообщения учащихся. Рассмотрите предложенные слайды презентации. УЭ – 6 Выходной контроль Цель: Проверить уровень усвоения знаний, полученных на уроке. Задание: Выполните тест Вариант 1 1. Чугун – сплав, в состав которого входят: а) железо и сера б) железо и кислород в) железо и углерод г) железо и медь 2. В виде какого минерала железо встречается в природе: а) жёлтый железняк б) красный железняк в) серый железняк г) чёрный железняк 3. Какой цвет имеет осадок гидроксида железа (III): а) зелёный б) бурый в) красный г) синий 2+ 4. Качественной реакцией на Fe является реакция с красной кровяной солью. Какое окрашивание даёт при этом продукт реакции: а) красное б) жёлтое в) синее г) розовое 5. Какое соединение неизвестно в цепочке превращений Fe(OH)3 → Х → FeCl3 а) Fe2O3 б) Fe3O4 в) Al г) Fe(OH)2 Проверьте правильность выполнения и оцените себя (за каждый правильный ответ -1балл, максимальное количество баллов - 5). УЭ – 7 Подведение итогов урока. Домашнее задание. Цель: подвести итоги урока, выставить оценки, записать домашнее задание. Задание: Обратитесь к целям, которые поставлены перед вами на данном уроке, оцените, насколько вы смогли их достичь? В какой степени? Проанализируйте свою работу на уроке и сделайте вывод. Подсчитайте общее количество баллов и поставьте оценку. Домашнее задание: Оценка «5» и «4» - § 14, задача Оценка «3» и «2» - § 14, вопрос 5 стр.68, задача Протокол модульного урока Тема: Соединения железа(II) и железа(III). Класс _______ Фамилия, имя ___________________________________________ УЭ – 1 Входной контроль. Задание: 1. Выполните графический диктант 1 2 3 4 5 6 7 8 Количество баллов _____________ УЭ – 2 Природные соединения железа. Задание: 1. Рассмотрите природные образцы и заполните таблицу Название минерала, Химическая формула; Применение основные месторождения % содержание железа Количество баллов _____________ УЭ – 3 Генетические ряды железа(II) и железа(III). Задание: 1. Допишите уравнения химических реакций, расставьте коэффициенты. Fe → FeSO4 → Fe(OH)2 ↓→ FeO 1. Fe + H2SO4 → 2. FeSO4 + NaOH → 3. Fe(OH)2 ↓ t→ Fe → FeCl3 → Fe(OH)3 ↓→ Fe2O3 1. Fe + Cl2 → 2. FeCl3 + NaOH → 3. Fe(OH)3 ↓ t→ Количество баллов _____________ 2. Составьте отчёт, заполнив таблицу 3. Впишите пропущенные слова Соли железа (II) и железа (III) можно распознать, используя следующие качественные реакции: при добавлении раствора ______________к раствору соли железа (II) образуется ___________________; при добавлении раствора щелочи к раствору соли железа (III) образуется ________________________. Количество баллов _____________ Проблемная ситуация: переход Fe(OH)2↓ в Fe(OH)3↓ Уравнение реакции: ______________________________________________________ УЭ – 6 Выходной контроль Задание: Выполните тест 1. ______2.______ 3.______ 4.______ 5.______ Количество баллов _____________ УЭ – 7 Рефлексия. Общее количество баллов:_________ Оценка:__________ Инструктивная карта для учащегося – вариант 2 УЭ – 0 Цели изучения модуля 1. Ознакомиться с природными минералами, содержащими железо 2.Рассмотреть генетические ряды, характерные для соединений железа(II) и железа(III). 3. Пронаблюдать за качественными реакциями на ионы Fe2+ и Fe3+. 4. Расширить знания о роли железа в природе и жизни человека. УЭ – 1 Входной контроль Цель: определить исходный уровень знаний необходимых для изучения модуля; вырабатывать умения быстро находить верные и отвергать неверные суждения. Задание: 1. Выполните графический диктант, заполните таблицу в протоколе (отметьте шалашиком “^” на отрезке номер верного положения и знаком « - « номер неверного положения). Графический диктант. Вариант 2. 1.Железо – это металл серебристо-белого цвета. 2.Железо не обладает способностью намагничиваться. 3.Атомы железа проявляют окислительные свойства. 4.На внешнем энергетическом уровне атома железа 1 электрон. 5.Железо вытесняет медь из растворов ее солей. 6.С галогенами образует соединения со степенью окисления +3. 7.С раствором серной кислоты образует сульфат железа (III). 8.Техническое железо не подвергается коррозии. Обменяйтесь протоколами, проверьте правильность выполнения задания и оцените себя (за каждый правильный ответ -1балл, максимальное количество баллов - 8). УЭ – 2 Природные соединения железа. Цель: Ознакомиться с образцами природных соединений железа. Задание: 1. Рассмотрите природные образцы 2. Прослушайте сообщения учащихся 3. Заполните таблицу в протоколе, используя материал учебника на стр. 65, слайд презентации. Заполнение таблицы оценивается в 4 балла, при условии, что всё заполнено правильно. УЭ – 3 Генетические ряды железа(II) и железа(III). Цель: Осуществить цепочки превращений, отражающих генетические ряды соединений железа(II) и железа(III), выполнить лабораторную работу. Работа в парах!!! Задание: 1. Допишите уравнения химических реакций, расставьте коэффициенты. Проверьте правильность выполнения задания и оцените себя (за каждый правильный ответ -1балл, максимальное количество баллов - 6). 2. Выполните лабораторную работу Внимание: при проведении эксперимента соблюдайте правила техники безопасности! Лабораторная работа «Качественные реакции на ионы Fe2+ и Fe3+». Задание: 1. В одну пробирку налейте 1 – 2 мл раствора сульфата железа (II) - (№ ЗЗ), а в другую пробирку 1 – 2 мл хлорида железа (III) - (№ 25). Добавьте в обе пробирки по 1 – 2 мл раствора щёлочи (№ 14). 2. Составьте отчёт, заполнив таблицу в протоколе к уроку 3. Впишите пропущенные слова Проверьте правильность выполнения задания и оцените себя (за каждый правильный ответ -1балл, максимальное количество баллов - 5). Проблемная ситуация: Пронаблюдайте, что произошло с гидроксидом железа (II). Как вы думаете, почему происходит изменение цвета осадка? Реакция показана в учебнике на стр 65. Запишите данную реакцию в протокол. УЭ – 4 Качественные реакции на ионы Fe2+ и Fe3+. Цель: Провести качественные реакции на ионы Fe2+ и Fe3+, наблюдать за цветом осадков. Задание: пронаблюдайте за демонстрационным опытом, поучаствуйте в обсуждении. Fe2+ + красная кровяная соль → синий осадок Fe3+ + жёлтая кровяная соль Fe3+ + роданид калия → кроваво-красное окрашивание Олимпиадное задание Определить присутствие солей Fe3+ в солях Fe2 + можно по реакции: 1) с жёлтой кровяной солью 2) с роданидом натрия 3) с гидроксидом натрия 4) с соляной кислотой УЭ – 5 Значение железа в природе и жизни человека. Цель: получить представление о значении железа в природе и жизни человека, о применении железа и его сплавов в народном хозяйстве. Задание: 1. Прослушайте сообщения учащихся. Рассмотрите предложенные слайды презентации. УЭ – 6 Выходной контроль Цель: Проверить уровень усвоения знаний, полученных на уроке. Задание: Выполните тест Вариант 2 1. Сталь – сплав, в состав которого входят: а) железо и сера б) железо и кислород в) железо и углерод г) железо и медь 2. В виде какого минерала железо встречается в природе: а) жёлтый железняк б) бурый железняк в) серый железняк г) чёрный железняк 3. Какой цвет имеет осадок гидроксида железа (II): а) бурый б) зелёный в) красный г) синий 3+ 4. Качественной реакцией на Fe является реакция с роданидом калия. Какое окрашивание даёт при этом продукт реакции: а) синее б) жёлтое в) красное г) розовое 5. Какое соединение неизвестно в цепочке превращений Fe(OH)2 → Х → Fe2O3 а) Fe(OH)3 б) Fe3O4 в) Al г) FeCl3 Проверьте правильность выполнения и оцените себя (за каждый правильный ответ -1балл, максимальное количество баллов - 5). УЭ – 7 Подведение итогов урока.. Домашнее задание. Цель: подвести итоги урока, выставить оценки, записать домашнее задание. Задание: Обратитесь к целям, которые поставлены перед вами на данном уроке, оцените, насколько вы смогли их достичь? В какой степени? Проанализируйте свою работу на уроке и сделайте вывод. Подсчитайте общее количество баллов и поставьте оценку. Домашнее задание: Оценка «5» и «4» - § 14, задача Оценка «3» и «2» - § 14, вопрос 5 стр.68, задача Протокол модульного урока Тема: Соединения железа(II) и железа(III). Класс _______ Фамилия, имя ___________________________________________ УЭ – 1 Входной контроль. Задание: 1. Выполните графический диктант 1 2 3 4 5 6 7 8 Количество баллов _____________ УЭ – 2 Природные соединения железа. Задание: 1. Рассмотрите природные образцы и заполните таблицу Название минерала, Химическая формула; Применение основные месторождения % содержание железа Количество баллов _____________ УЭ – 3 Генетические ряды железа(II) и железа(III). Задание: 1. Допишите уравнения химических реакций, расставьте коэффициенты. Fe → FeSO4 → Fe(OH)2 ↓→ FeO 1. Fe + H2SO4 → 2. FeSO4 + NaOH → 3. Fe(OH)2 ↓ t→ Fe → FeCl3 → Fe(OH)3 ↓→ Fe2O3 1. Fe + Cl2 → 2. FeCl3 + NaOH → 3. Fe(OH)3 ↓ t→ Количество баллов _____________ 2. Составьте отчёт, заполнив таблицу 3. Впишите пропущенные слова Соли железа (II) и железа (III) можно распознать, используя следующие качественные реакции: при добавлении раствора ______________к раствору соли железа (II) образуется ___________________; при добавлении раствора щелочи к раствору соли железа (III) образуется ________________________. Количество баллов _____________ Проблемная ситуация: переход Fe(OH)2↓ в Fe(OH)3↓ Уравнение реакции: ______________________________________________________ УЭ – 6 Выходной контроль Задание: Выполните тест 1. ______ 2.______ 3.______ 4.______ 5.______ Количество баллов _____________ УЭ – 7 Рефлексия. Общее количество баллов:_________ Желаю успехов в изучении химии! Оценка:__________