Самовозгорание органических и минеральных веществ
advertisement

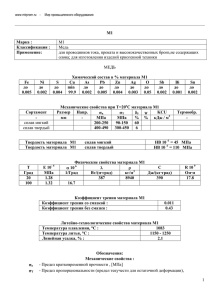
Самовозгорание органических и минеральных веществ и обеспечение пожаробезопасности горных пород Публикация в сборнике материалов Международного научно-практического семинара в Международной академии наук экологии и безопасности (МАНЭБ) «Проблемы производственного травматизма и условий труда». – Санкт-Петербург: МАНЭБ, МОТ ООН. 2006, с. 122-129 Наумов Б.Е. Силламяэский институт экономики и управления Cамовозгорание органических и минеральных веществ наносит большой физический, экономический и экологический ущерб. Это касается скоплений сульфидных руд, углей, сланцев, торфа, хлопка, иных растительных материалов, бытовых отходов и т.п. Горючие сланцы, запасы которых в мире огромны, также способны к автоокислению и, при соблюдении определённых условий, к самовозгоранию с активным загрязнением атмосферы рабочего пространства и населённых пунктов, а также водной среды продуктами горения, в том числе канцерогенами [1, 2, 3]. Предотвращение пожаров на отвалах карьеров и обеспечение экологической безопасности персонала и населения возможно только при знании механизма, условий и параметров самовозгорания. Универсальным показателем, определяющим склонность к самовозгоранию сульфидных руд, углей, сланцев является константа скорости сорбции кислорода [4]. Но процесс автоокисления протекает в совершенно различных условиях, и, несмотря на наличие общих закономерностей процесса, единой теории, объясняющей причины и механизм самовозгорания, нет. Существуют пиритно-железная, микробиологическая, а также теория уголь-кислородных комплексов, где основной причиной самовозгорания рассматриваются соединения железа, органическое вещество (ОВ) и даже деятельность бактерий [5]. Но в Прибалтийских керогенсодержащих аргиллитах (диктионемовых сланцах, далее ДС), богатых ОВ, сульфидом железа (Fe2S), рядом тяжёлых металлов и ураном, сочетаются все вышеперечисленные пирогенные факторы. Ниже приводятся основные положения гипотезы самовозгорания ДС, разработанной автором при изучении механизма самовозгорания ДС на дневной поверхности и в толще отвалов в условиях Маардуского фосфоритного месторождения Эстонии [1, 2, 6]. 1. В любом разрыхленном скоплении влажного ДС (суммарный объём воздушных пустот и пор до 52%) возникает разность электрических потенциалов в зонах с различным содержанием кислорода, образуются замкнутые электрические цепи и протекают гальванические процессы. Кислород всегда содержится в разрыхленном скоплении ДС. В присутствии кислорода, влаги и бактерий (гетеротрофы окисляют ОВ, автотрофы – минеральные соединения), особенно железо-и серобактерий (Tiobacillus ferrooxydans), начинается автоокисление органической (углеводородной) и минеральной сульфидной (FeS2) составляющих ДС [1, 7]. C водородом кислород реагирует по механизму цепных реакций. Но прямая реакция не идёт до преодоления активационного барьера величиной не менее 50 ккал, что на порядок больше энергии активации реакций радикалов с насыщенными молекулами В процессе хемосорбции происходит инициирование цепей, приводящее к зарождению первичных радикалов, - процесс, энергетически наиболее трудноосуществимый, поэтому распад соединений должен происходить в первую очередь по слабейшей цепи. Хемосорбция - это осуществляемая с помощью химических сил связь атомов или молекул с поверхностью. В зависимости от свойств поверхности хемосорбция требует различной, но всегда небольшой (до 10 ккал) энергии активации [8, 9]. 2. Доказано, что кажущаяся лёгкость вступления кислорода в некоторые реакции объясняется свойствами атома О и радикала R-О-О-, обеспечивающими развитие цепной реакции [8, 9]. Но для большинства углеводородных соединений энергия разрыва связи СН весьма велика и составляет 93...102,5 ккал. Присутствие присоединённых атомов хлора, кислорода, бензольного кольца снижает эту, эндотермическую, энергию разрыва химических связей до 77,5...80 ккал [8]. Именно внешняя энергия разрушает внутримолекулярные связи, создавая условия для хемосорбции и снижая до минимума барьер активации, обеспечивая тем самым начало уже экзотермической, с выделением тепловой энергии химической реакции окисления. Каков источник этой внешней энергии? Это может быть результат жизнедеятельности бактерий, при которой 75...90% образующейся тепловой энергии выделяется в окружающую среду [7], это может быть энергия взрывной или механической дезинтеграции пласта ДС, естественного ионизирующего излучения, магнитного поля [10], электрохимической разности потенциалов ЭХРП [1]. 3. Роль влаги заключается в том, что вода сама по себе активно влияет на скорость сорбции кислорода. Так, химическое взаимодействие сухого угля с кислородом начинается при 70 град.Ц, а влажного (W=2%) - уже при 30 град.Ц [8]. При этом химическая константа скорости сорбции кислорода диктионемовым сланцем и пиритизированным песчаником резко растёт и достигает максимума с увеличением влажности до 9% - соответственно 5,3 мл/кв.м час и 3,7 мл/кв.м час. При дальнейшем росте влажности, из-за заполнения пор водой, константа заметно снижается [14]. ДС на 14...16% состоит из органического вещества, и вполне вероятно, что наличие ослабленных связей типа С-Н обусловливает места, атакуемые атомами кислорода, возникающими при хемосорбции. Но главная роль воды состоит в том, что она обеспечивает, будучи электролитом, протекание электрохимических процессов. 4. Из геофизики известно о наличии естественных электрических явлений (теллурических токов) в земной коре и в различных горных породах. Разность потенциалов в горных породах может вызываться различием электрических потенциалов разных минералов, дефектами кристаллических решёток минералов, трибоэлектрическими явлениями при трении о породу воздушных потоков (потенциал протекания), пьезоэлектрическими явлениями при сдавливании и деформации соприкосающихся кристаллов и частичек породы, при неравномерном прогреве. Так, градиент напряжения между отдельными участками только кристалла галенита (PbS) достигает 0,4...0,5 вольт. При продувании породообразующих минералов возникает электростатический заряд. При наличии влаги происходит движение тонких плёнок жидкости на поверхности минералов под воздействием силы гравитации и давления ветра, появляется потенциал протекания, пропорциональный давлению и фильтрационной активности горных пород. В любой рыхлой массе давление кислорода в верхних слоях больше, чем в нижних. В условиях дифференциальной аэрации электроды, введённые в участки с разной концентрацией кислорода и полярностью, становятся анодом и катодом с разностью потенциалов 3,3...5,2 мВ при температуре 8,4...11,5 град.Ц, а в случае самонагрева (48...55 град.Ц) - 200...360 мВ [1, 6]. 5. Вследствие возникновения разности потенциалов в скоплениях горных пород и иных материалов обязательно происходит протекание электрического тока от одних участков к другим. При этом происходит окисление в анодной зоне и гальванический массоперенос ионов металлов с их концентрацией в катодной зоне согласно теории анодного окисления проф. А.И. Камневой [5, 11]. Если предположить, что электрический ток между разноимённо заряженными участками стимулирует активность существующих радикалов, то становится понятным источник энергии, включающий цепные реакции. Этим источником могут быть электроны и ионы, а также джоулево тепло, выделяющееся при прохождении электрического тока. Сила тока при этом может быть значительной на больших площадях: так, плотность тока на электродах достигает значений 2461 мкА/кв.м для ДС [1] и 2875 мкА/кв.м для торфа [11]. Выделяемая в виде тепла энергия служит для преодоления необходимого активационного барьера и начала реакций окисления. 6. После преодоления активационного барьера и разрыва ослабленных связей начинается прямая реакция химического окисления по принципу цепных реакций академика А.А. Семёнова [9]. Деятельность микроорганизмов-мезофилов при начальной температуре ДС в отвалах (6...8 град.Ц) не может создать тепловой фон, достаточный для начала чисто химической реакции, так как она активно начинается в интервале температур 40...65 град.Ц. Но определённый энергетический взнос, безусловно, они обеспечивают. Основные же биохимические процессы подключаются бактериями-термофилами в основном при 25...35 град.Ц, внося тем самым свою долю в ускорение процесса окисления. Адсорбция, то есть поглощение газа поверхностью вещества, протекает также с выделением тепла. Но теплота поглощения кислорода не зависит от температуры: в интервале 0...80 град.Ц она равна 3 кал/мл О2 [12] и поэтому также не может быть единственным источником цепной реакции. Поэтому до 25...35 град.Ц главным источником реакции автоокисления являются всё-таки электрохимические процессы, сначала снижающие порог энергии активации, а затем включающие реакцию хемосорбции. Заметное участие соединений железа (в основном FeS2 и FeO) в процессе автоокисления начинается, как было установлено автором, при температуре около 40 град.Ц [6, 13]. Выделение тепла при температуре от 25 до 60...70 град.Ц носит уже электро-и биохимический характер. При росте температуры в очаге самонагрева сначала исчезает биохимический фактор из-за гибели микроорганизмов (80...100 град.Ц), а затем и электрохимический, по достижении максимума ЭХРП в 600 мВ (до 100 град.Ц) и после окончательного испарения влаги в диапазоне 100...120 град.Ц [1, 6]. 7. После начала хемосорбции и первичного выделения тепла реакция окисления сланца, в зависимости от внешних и внутренних условий, может протекать либо в стационарном режиме при постоянной температуре, либо в режиме цепной реакции при росте температуры. Стационарный режим характеризуется незначительным нагревом, не приводящим к самовозгоранию, дефицитом кислорода и нулевым тепловым балансом (Qаккум.- Qпотерь=0). При наступлении отрицательного теплового баланса (недостаток кислорода, отвод тепла в окружающую среду, затопление водой) процесс затухает ещё до выхода на стационарный режим (Qаккум. < Qпотерь). Режим цепной реакции характеризуется окислением с положительным тепловым балансом и достатком постоянно поступающего кислорода. В течение инкубационного периода, являющегося, по В.С.Веселовскому, «периодом низкотемпературного окисления, скрытой подготовки» [4] при необходимой оптимальной влажности и достаточной концентрации кислорода идёт нарастание ЭХРП, скорости реакции окисления, количества генерируемого тепла и температуры. Эти три показателя взаимосвязаны между собой. Цепная реакция возникает и поддерживается только при наличии следующих условий: а) критической массы влажного материала; б) положительного теплового энергобаланса; в) стабильного восполнения расходуемого кислорода с выносом продуктов реакции из очага. По истечении инкубационного периода процесс самонагревания быстро развивается по экспоненте. Происходит резкий рост температуры от 40...60 град.Ц до 400...600, максимум 800...850 град.Ц при активном горении на стадии красного каления кусков ДС (без языков пламени) с мощным выбросом парогазовоздушной смеси в атмосферу. Нарушение хотя бы одного из вышеперечисленных условий ведёт к невозможности самовозгорания из-за перехода процесса в стационарный режим или даже его угасание. 8. Основные показатели процесса самовозгорания в навале ДС 8.1. Критический объём скопления ДС шаровой формы, куб.м 2547,2 8.2. Критическая масса скопления ДС шаровой формы, кг 4534 8.3. Поверхность теплоотдачи скоплений разной формы, кв.м/куб.м: - сфера 0,38 - шар 0,48 - конус 0,43 - треугольная призма 0,71 - плоский навал высотой 1...6 м 1,15...0,28 8.4. Действующая поверхность хемосорбции, кв.м/куб.м 5015...31412 8.5. Электрохимическая разность потенциалов в скоплении, мВ 3,3...600 8.6. Дипазон температуры в скоплении, град.Ц 8,4...850 9. Основные параметры, обеспечивающие пожаробезопасность 9.1. Максимальная высота плоского навала ДС на поверхности, м 4 9.2. Минимальная поверхность теплоотдачи, кв.м/куб.м 0,35 9.3. Минимальная толщина инертных пород, перекрывающих и изолирующих слой ДС в отвалах, м 4 9.4. Мощность слоя ДС, размещаемого в отвалах, м 7...11 9.5. Предельно допустимая температура отвальной массы, град.Ц 50...60 9.6. Предельное время контакта ДС с атмосферой, сут. 26...31 9.7. Минимальное время самовозгорания при нарушении параметров пожаробезопасности, сут. 86 Литература 1. Наумов Б.Е. Электрохимические особенности процесса самовозгорания керогенсодержащих аргиллитов в отвалах фосфоритного месторождения Маарду. Таллин: Известия АН ЭССР, Геология, 1981, т.30, N4, с. 161...166 2. Наумов Б.Е. Предупреждение самовозгорания горных пород в отвалах при открытых разработках фосфоритных месторождений Прибалтики. Автореферат дисс. на соискание учёной степени кандидата технических наук. Институт горного дела им. А.А. Скочинского. М., 1986. –16 с. 3. Наумов Б.Е. Загрязнение гидросферы при выщелачивании диктионемовых аргиллитов в отвалах Маардуских фосфоритных карьеров. Oil-Shale-Горючие сланцы. Таллин, 1991, 8/3, с. 266...274 4. Перцов Н.В., А.Э. Петросян. Всеволод Степанович Веселовский. М.: Наука, 1983 5. Наумов Б.Е., Беленький П.Г. Опыт открытой разработки месторождения с вскрышными породами, склонными к самовозгоранию. Серия Горнохимическая промышленность. М.: НИИТЭХИМ, 1985. –29 с. 6. Наумов Б.Е. Проблемы предупреждения самовозгорания диктионемового сланца при разработке фосфоритных месторождений Прибалтики. Тез. докл. и сообщений на совещ. «Проблемы снижения вредного влияния горных работ на окружающую среду». Министерство химической промышленности СССР. 23...25 сентября 1980 г, г. Новый Роздол. М., 1980, с.73... 76 7. Авраменко М.Ф. Микробиология. М.: Колос, 1979 8. Семёнов Н.Н. О некоторых проблемах химической кинетики и реакционной способности. М.: АН СССР, 1958 9. Семёнов Н.Н. О цепных реакциях и теории горения. М.: Знание, 1957 10. Возная Н.Ф. Химия воды и микробиология. М.: Высшая школа, 1979 11. Александров И.В., Хохлов Ю.И., Камнева А.И. Электрохимические особенности процесса самонагревания торфа при хранении./Химия твёрдого топлива, 1979, N1, с. 61...65 12. Саранчук В.И. Борьба с горением породных отвалов. Киев: Наукова Думка, 1978 13. Наумов Б.Е., Александров И.В., Войтковский Ю.Б. Фазопреобразование железосодержащих компонентов в процессах автоокисления и самовозгорания диктионемового сланца./Химия твёрдого топлива, 1988, N4, с. 41...52 14. Пихлак А.А. Опыт ориентировочного расчёта изменения во времени температуры очагов самонагревания в скоплениях диктионемового сланца. Таллин: Управление геологии ЭССР, 1978