Процедура декларивания
advertisement

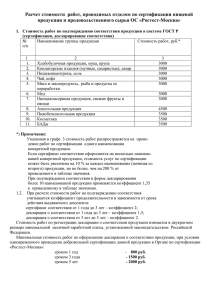
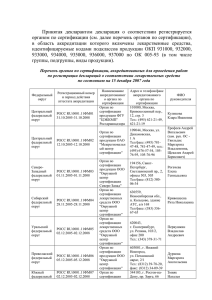
Принятая декларантом декларация о соответствии регистрируется органом по сертификации (см. ссылку на предыдущей странице), в область аккредитации которого включены лекарственные средства, идентифицируемые кодами подклассов продукции ОКП 931000, 932000, 933000, 934000, 935000, 936000, 937000 по ОК 005-93 (в том числе группы, подгруппы, виды продукции). Принятая декларация о соответствии считается зарегистрированной с даты ее внесения в реестр зарегистрированных деклараций органа по сертификации и имеет юридическую силу на всей территории Российской Федерации. Обращение лекарственного средства на фармацевтическом рынке Российской Федерации осуществляется только после регистрации декларации о соответствии лекарственного средства на требования нормативным документам (общим фармакопейным статьям, фармакопейным статьям, фармакопейным статьям предприятий, нормативным документам на лекарственные средства зарубежного производства). При декларировании соответствия лекарственных средств подтверждается их соответствие требованиям нормативным документам (общим фармакопейным статьям, фармакопейным статьям, фармакопейным статьям предприятий, нормативным документам на лекарственные средства зарубежного производства). Декларация о соответствии лекарственных средств может быть принята на конкретную серию (партию) лекарственного средства. Изготовитель (продавец) лекарственных средств принимает декларацию о соответствии в отношении серии (партии) лекарственного средства на основании собственных доказательств соответствия и протокола испытаний, проведенных в аккредитованной испытательной лаборатории (центре), имеющей область аккредитации, идентифицируемую кодами подклассов продукции ОКП 931000, 932000, 933000, 934000, 935000, 936000, 937000 по ОК 005-93 (в том числе группы, подгруппы, виды продукции). В качестве собственных доказательств соответствия используются в совокупности: - паспорт (протокол анализа) производителя (для отечественных лекарственных средств) или сертификат качества (анализа) фирмы (для зарубежных лекарственных средств); - документ, подтверждающий происхождение лекарственного средства; - протоколы входного контроля (испытаний) и сертификаты на сырье, полупродукты, субстанции и материалы, используемые в производстве лекарственного средства; В качестве доказательств соответствия лекарственного средства, полученных с участием аккредитованной испытательной лаборатории (центра), используются протоколы испытаний, проведенных по всем показателям качества, установленным в нормативной документации на данное лекарственное средство. В качестве доказательств соответствия лекарственного средства, полученных с участием органа по сертификации, используются сертификаты соответствия на производство или систему качества Системы сертификации ГОСТ Р, или в системе, признанной в установленном порядке в Системе сертификации ГОСТ Р, другие документы, прямо или косвенно подтверждающие соответствие продукции установленным требованиям. Срок действия декларации о соответствии устанавливается декларантом. При этом срок действия декларации о соответствии серии (партии) лекарственного средства не должен превышать срока его годности. Декларацию о соответствии оформляют на листах формата А4 машинописным способом. Декларация о соответствии подписывается руководителем организации изготовителя (продавца) уполномоченным им лицом или индивидуальным предпринимателем. Принятая декларация о соответствии с комплектом документов, содержащим доказательственные материалы, предоставляется для регистрации в орган по сертификации, аккредитованный в установленном порядке, в область аккредитации которого включены лекарственные средства, идентифицируемые по кодам подклассов продукции ОКП 931000, 932000, 933000, 934000, 935000, 936000, 937000 по ОК 005-93 (в том числе группы, подгруппы, виды продукции). В случае выявления Федеральной службы по надзору в сфере здравоохранения и социального развития случаев несоответствия лекарственного средства, на которое принята и зарегистрирована декларация о соответствии, установленным требованиям, декларант уведомляет о прекращении действия декларации в 3-дневный срок орган по сертификации, проводивший регистрацию данной декларации. Повторное принятие декларации о соответствии на данное лекарственное средство возможно только после устранения выявленных органом государственного надзора несоответствий и уведомления об этом органа государственного надзора и органа по сертификации. Повторная регистрация декларации о соответствии в этом случае осуществляется тем же органом по сертификации, который проводил первичную регистрацию декларации о соответствии.