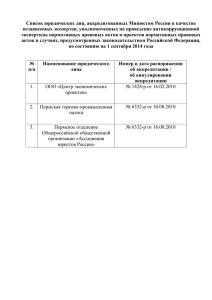
Контрольные лаборатории отделов контроля качества
advertisement
реклама на сайте UralStroyInfo СоюзстройиндустрииСвердловской области Логин: Регистрация Забыли пароль? Пароль: ????? ПрайсОбъекты Оборудование Главная листы | Предприятия строительства и спецтехника Тендеры Статьи Документы Нормативно-техническая литература Исследования Союз стройиндустрии Поиск: Каталоги НОРМАТИВНО-ТЕХНИЧЕСКИЙ ДОКУМЕНТ Контрольные лаборатории отделов контроля качества предприятий-прои лекарственных средств. Требования и порядок аккредитации на техничес компетентность Расширенный поиск по строительному порталу Раздел: ОСТ Номер: ОСТ 64-02-001-2002 Дата введения: 15.04.2003 Статус: действующий Область и условия применения: Стандарт устанавливает требования к ко аналитическим, микробиологическим и биологическим лабораториям отд контроля качества субъектов, производящих лекарственные средства и п территории Российской Федерации, независимо от форм собственности и ведомственной принадлежности, и порядок их аккредитации на техничес компетентность Департаментом промышленной и инновационной полит медицинской и биотехнологической промышленности Минпромнауки РФ распространяется также на самостоятельные (не входящие в состав ОКК аналитические, микробиологические и биологические лаборатории субъе производящих лекарственные средства и препараты. Опубликован в: ФГУП "ГНЦА" № 2002 Разработан в: ФГУП "ГНЦА" Утвержден в: Министерство промышленности, науки и технологий Росси Федерации (15.04.2003) Заменяет собой: ОСТ 42-503-95 Скачать документ (Размер файла, Кб: 123.89) * Документы для скачивания доступны БЕСПЛАТНО только для зарегистрированных - Регистрация юридических лиц; - Регистрация физических лиц. Блок авторизации пользователей находится в правом верхнем углу страницы. МИНИСТЕРСТВО ПРОМЫШЛЕННОСТИ, НАУКИ И ТЕХНОЛОГИЙ РОССИЙСКОЙ ФЕДЕРАЦИИ ДЕПАРТАМЕНТ ПРОМЫШЛЕННОЙ И ИННОВАЦИОНН ПОЛИТИКИ В МЕДИЦИНСКОЙ И БИОТЕХНОЛОГИЧЕС ПРОМЫШЛЕННОСТИ СТАНДАРТ ОТРАСЛИ КОНТРОЛЬНЫЕ ЛАБОРАТОРИИ ОТДЕЛОВ КОНТРОЛЯ КАЧ ПРЕДПРИЯТИЙ - ПРОИЗВОДИТЕЛЕЙ ЛЕКАРСТВЕННЫХ СР ТРЕБОВАНИЯ И ПОРЯДОК АККРЕДИТАЦИИ НА ТЕХНИЧЕ КОМПЕТЕНТНОСТЬ. ОСТ 64-02-001-2002 МОСКВА 2002 ПРЕДИСЛОВИЕ 1. РАЗРАБОТАН: ФГУП «Государственный научный центр по антибио 2. ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ: Распоряжением Министерства промышленности, науки и технологий Российской Федерации от 15 апре Р-11 3. В настоящем стандарте реализованы нормы «Системы аккредитации» РФ, Руководства ИСО, ГОСТ Р 51000.4-96 4. ВВЕДЕН ВЗАМЕН ОСТ 42-503-95. Содержание 1. Область применения 2. Общие положения 3. Критерии аккредитации лабораторий 4. Функции, права и обязанности аккредитованной лаборатории 5. Порядок аккредитации контрольных лабораторий 6. Инспекционный контроль за деятельностью аккредитованных лаборат Приложение А. Приложение Б. Приложение В. Аттестат аккредитации контрольных лабораторий на компетентность Приложение к аттестату аккредитации Примерный перечень документов, которыми должна р аккредитованная контрольная лаборатория Приложение Г. Приложение Д. Приложение Е. Приложение Ж. Приложение 3. Заявка на аккредитацию контрольных лабораторий ОК Положение о контрольной лаборатории Паспорт Требования к «Руководству по качеству» Акт проверки аккредитуемой лаборатории СТАНДАРТ ОТРАСЛИ КОНТРОЛЬНЫЕ ЛАБОРАТОРИИ ОТДЕЛОВ КОНТРОЛЯ КАЧЕСТВА ПРЕДПРИЯТИЙПРОИЗВОДИТЕЛЕЙ ЛЕКАРСТВЕННЫХ СРЕДСТВ. ТРЕБОВАНИЯ И ПОРЯДОК АККРЕДИТАЦИИ НА ТЕХНИЧЕСКУЮ КОМПЕТЕНТНОСТЬ. ОСТ 64-02 Вводитс ОСТ 42 Дата введени 1. ОБЛАСТЬ ПРИМЕНЕНИЯ Настоящий стандарт устанавливает требования к контрольно-аналитичес микробиологическим и биологическим лабораториям отделов контроля к дальнейшем - контрольным лабораториям ОКК) субъектов, производящи лекарственные средства и препараты на территории Российской Федерац независимо от форм собственности и ведомственной принадлежности, и аккредитации на техническую компетентность Департаментом промышл инновационной политики в медицинской и биотехнологической промыш Минпромнауки РФ. Стандарт распространяется также на самостоятельные (не входящие в со аналитические, микробиологические и биологические лаборатории (в дал контрольные лаборатории) субъектов, производящих лекарственные сред препараты. Стандарт не распространяется на аналитические, микробиологические и биологические лаборатории научных Центров и институтов фармацевтич профиля, фармацевтических и медицинских высших учебных заведений, аптечной и лечебной сети, выполняющих функции территориальной (рег контрольно-аналитической лаборатории (центра) контроля качества лека средств и препаратов. Настоящий стандарт предназначен для использования при аккредитации проведении контроля функционирования аккредитованных контрольных ОКК. Участие контрольных лабораторий в «системе аккредитации» Госс и отрасли является добровольным, но обязательным требованием при по предприятием разрешения (лицензии) на вновь создаваемое промышленн производство и реализацию лекарственных средств и препаратов. 2. ОБЩИЕ ПОЛОЖЕНИЯ 2.1. Аккредитация контрольных лабораторий - признание компетентност лаборатории, осуществляющей количественный и качественный химичес контроль качества лекарственных средств и препаратов. 2.2 Аккредитацию контрольных лабораторий ОКК предприятий химикофармацевтической промышленности проводят организации медицинской промышленности с участием ведомственных метрологических служб и представителей органов Госстандарта России (по согласованию) по указа Департамента промышленной и инновационной политики в медицинской биотехнологической промышленности Минпромнауки РФ на основании предприятия. 2.3. Количественный химический анализ (КХА) - экспериментальное опр содержания (массовой или объемной доли, молярной концентрации и т.д ряда компонентов веществ в пробе физическими, физико-химическими, х и другими методами. Качественный химический анализ - экспериментальное определение при (идентификация) одного или ряда компонентов веществ в пробе физичес физико-химическими, химическими и другими методами. 2.4. Аккредитация контрольных лабораторий ОКК является официальны признанием технической компетентности этих лабораторий в проведении качества лекарственных средств и препаратов в соответствии с требовани нормативных документов: государственных и отраслевых стандартов, Государственной фармакопеи, фармакопейных статей. 2.5. При положительных результатах аккредитации контрольных лаборат техническую компетентность предприятию выдается аттестат аккредитац приложения А с областью аккредитации по форме приложения Б. Срок действия аттестата аккредитации не должен превышать 5 лет. 2.6. Аккредитованные контрольные лаборатории осуществляют свою дея области контроля качества лекарственных средств в соответствии с утвер установленном порядке «Положением о контрольной лаборатории», руко качеству и «Паспортом лаборатории», разработанных с учетом требовани настоящего стандарта. 3. КРИТЕРИИ АККРЕДИТАЦИ ЛАБОРАТОРИЙ 3.1. Критериями аккредитации контрольных лабораторий на техническую компетентность являются: - наличие условий, обеспечивающих техническую компетентность лабор соответствие требованиям настоящего стандарта; - положительные результаты экспериментальной проверки качества пров количественного и качественного химического анализа, контроля качест лекарственных средств и препаратов. 3.2. Условием, обеспечивающим техническую компетентность лаборато наличие: - системы обеспечения качества анализов, реализующей принципы, норм требования и процедуры системы обеспечения единства измерений и тре национальных правил GMP к контролю качества лекарственных средств - специалистов, включая руководящий состав, имеющих профессиональн подготовку и квалификацию, необходимую для проведения анализов в за области аккредитации и имеющих должностную инструкцию на каждого специалиста, устанавливающую его функции, обязанности, права и ответ требования к образованию и техническим знаниям; - специальной окружающей среды, в условиях которой проводятся анали которая не должна влиять на результаты и погрешность измерений; - помещений для проведения анализов, которые должны соответствовать характеристикам, состоянию и обеспечиваемым в них условиям (произво площади, температура, влажность, чистота воздуха, освещенность, звуко виброизоляция, снабжение электроэнергией, водой, воздухом, теплом и т требованиям применяемых методик контроля, санитарным нормам и пра требованиям безопасности труда и охраны окружающей среды; - оборудования и средств измерений, необходимых для проведения анали испытательное оборудование и средства измерений должны отвечать тре нормативных документов на методы анализа. Все оборудование и средст измерений должны содержаться в условиях, обеспечивающих их сохранн защиту от повреждений. Для оборудования, требующего периодического технического обслуживания, должны быть разработаны графики техниче обслуживания, а для средств измерений - графики государственной пове - документации, устанавливающей требования к анализируемой продукц ее анализа: фармакопейные статьи, Государственная Фармакопея, станда технические условия, государственные и отраслевые стандарты; - документации на средства измерений и оборудование: паспорта, график методики аттестации испытательного оборудования, методики поверки е средств измерений; - документов, определяющих систему хранения информации и результат (протоколов, рабочих журналов и т.п.); - системы обозначения образцов продукции, предназначенных для анали (документирование, маркировка); правил приемки, хранения, списания о продукции, поступающих на анализы; - системы регистрации анализов продукции, которая обеспечивает: - регистрацию поступивших на контроль образцов лекарственных средст - регистрацию результатов проверки их качества с расчетными данными протоколами анализа; - регистрацию лиц, получивших образцы, готовивших их к анализам и пр анализы и измерения; - систему хранения документации на методы анализа, отчетов о проверка техническом обслуживании оборудования, а также документов, содержащ информацию об анализах. Условия хранения всей документации должны обеспечивать ее сохранно установленного срока и конфиденциальность. Сроки хранения документо соответствовать сроку годности лекарственного средства, плюс один год Примерный перечень документов, который должен иметься в аккредитов лаборатории, приведен в приложении В. 3.3. Если контрольные лаборатории ОКК являются структурным подразд предприятия (или организации), то должен быть оформлен соответствую документ, предусматривающий четкое разграничение ответственности м руководством лаборатории и администрацией предприятия (организации объективность результатов анализа. 4. ФУНКЦИИ, ПРАВА И ОБЯЗАННОСТИ АККРЕДИТОВАННОЙ ЛАБОРАТОРИИ. 4.1 Функцией аккредитованной контрольной лаборатории является прове аналитических, микробиологических и биологических работ в области, о аттестатом аккредитации и Положением о контрольной лаборатории. 4.2. Аккредитованная контрольная лаборатория имеет право в области, о аттестатом аккредитации: - ссылаться на факт аккредитации лаборатории в выдаваемых документа рекламных материалах; - устанавливать расценки на проведение аналитических, микробиологиче биологических работ и услуг; - заключать с другими аккредитованными лабораториями субподрядные проведение конкретных анализов, которые не должны превышать 25 % о проводимого объема работ. 4.3. Аккредитованная лаборатория обязана: постоянно поддерживать свое соответствие критериям аккредитации; - сообщать аккредитирующему органу об изменениях, влияющих на ее со критериям аккредитации; - при ссылках на факт своей аккредитации указывать область аккредитац - обеспечивать конфиденциальность сведений, полученных в процессе ис заказов при проведении аналитических работ и услуг по договору; - обеспечивать заказчику доступ в помещение лаборатории для наблюден проведением анализа по его заказу; - вести регистрацию работ, выполняемых для лаборатории по субподряд - предоставлять аккредитирующему органу возможность осуществлять инспекционный контроль за деятельностью лаборатории и своевременно расходы, связанные с его проведением; - вести учет всех предъявляемых претензий по результатам анализов и инспекционного контроля; - предоставлять органу по аккредитации отчет о результатах своей деятел его запросу); - передавать часть работ в соответствии с субподрядом другой контрольн лаборатории, имеющей соответствующую область аккредитации и лицен вид деятельности; - наличие субподряда не является основанием для расширения области а содействовать в проведении работ по зарубежному и международному п аккредитованных лабораторий; - не использовать права аккредитованной лаборатории по истечении срок аттестата аккредитации. 4.4 Руководитель аккредитованной лаборатории подписывает протоколы несет ответственность за достоверность результатов анализов. 5. ПОРЯДОК АККРЕДИТАЦИ КОНТРОЛЬНЫХ ЛАБОРАТОР 5.1. Аккредитация контрольных лабораторий предусматривает следующи - экспертиза документов, представленных предприятием; - формирование комиссии по проверке лаборатории; - проверка лаборатории комиссией, включая проведение эксперименталь проверки качества проведения анализов в аккредитуемой лаборатории; - оформление, регистрация и выдача аттестата аккредитации. 5.2. Предприятие, претендующее на аккредитацию своих контрольных ла направляет официальную заявку в Департамент промышленной и иннова политики в медицинской и биотехнологической промышленности Минпр по форме приложения Г. 5.2.1. К заявке, направляемой в орган по аккредитации, прилагаются: - проект «Положение об аккредитованной лаборатории» - проект Паспорта аккредитованной лаборатории; - «Руководство по качеству лаборатории». 5.2.2. Положение о лаборатории должно определять функции, права, обя ответственность лаборатории, взаимодействие с другими подразделениям предприятия при проведении анализов, а также другие аспекты деятельн аккредитованной лаборатории (Приложение Д). 5.2.3 Паспорт аккредитованной лаборатории составляют в соответствии с требованиями приложения Е. 5.2.4. Требования к содержанию «Руководства по качеству» приведены в Ж. 5.3. Департамент промышленной и инновационной политики в медицинс биотехнологической промышленности Минпромнауки РФ организует пр экспертизы представленных материалов. Продолжительность экспертизы - не более одного месяца со дня получен материалов. По ее результатам принимается решение о возможности акк устанавливаются сроки проведения проверки. Результаты экспертизы оф виде «Заключения». Отказ в проведении аккредитации должен быть обоснован. Он не должен конкретных рекомендаций, выполнение которых гарантирует аккредитац 5.4. Департамент формирует комиссию по проверке лаборатории и напра аккредитуемую лабораторию. Комиссия формируется с учетом специали контрольной лаборатории из числа квалифицированных специалистов с обязательным привлечением представителей органов общегосударственн контроля и надзора. Состав утвержденной Департаментом комиссии дово сведения контрольной лаборатории (предприятия) и всех участвующих в специалистов. 5.5. Комиссия до начала проверки знакомится с заявкой на аккредитацию результатами экспертизы представленных материалов, при необходимос организует и проводит экспериментальную проверку качества проведени Для контроля точности анализов могут быть использованы стандартные аттестованные смеси, либо другие, метрологически обоснованные прием 5.6. Лаборатория представляет комиссии, проводящей проверку, необход работы материалы: - нормативные, методические, технические документы; - лабораторные журналы по проведению анализов; - другие документы по указанию комиссии. 5.7. Комиссия проверяет на месте соответствие лаборатории критериям аккредитации, а также соответствие представленной информации фактич состоянию. 5.8. По результатам проверки комиссия составляет акт по форме, приведе приложении З, и представляет его в Департамент промышленной и инно политики в медицинской и биотехнологической промышленности Минпр и в аккредитуемую лабораторию. 5.9. На основе акта комиссии Департамент промышленной и инновацион политики в медицинской и биотехнологической промышленности Минпр принимает решение об аккредитации лаборатории или отказе в аккредит положительном решении выдается Аттестат Аккредитации (по форме пр и заносится в Реестр Системы аккредитации. Время оформления аттестата аккредитации не должно превышать 10 дне принятия решения о его выдаче. Аттестат об аккредитации вступает в си регистрации в реестре аккредитованных организаций. При отказе в выдаче аттестата аккредитации Департамент промышленно инновационной политики в медицинской и биотехнологической промыш Минпромнауки РФ сообщает заявителю причины отказа, однако не устан никаких условий, при выполнении которых готов выдать аттестат аккред лаборатории. 5.10. Оплата работ по аккредитации проводится заявителем на договорно исходя из объема работ. 5.11. За 6 месяцев до истечения срока действия аттестата аккредитованно лаборатории, лаборатория должна направить заявку на повторную аккред которая может проводиться по полной или сокращенной процедуре. В от случаях по истечении срока действия аттестата аккредитации продление быть осуществлено без процедуры повторной аккредитации. Такое реше аккредитирующий орган принимает не менее чем за месяц до истечения действия аттестата аккредитации на основании результатов инспекционн контроля. 5.12. Для расширения области аккредитации, закрепленной аттестатом ак лаборатория направляет в Департамент промышленной и инновационной медицинской и биотехнологической промышленности Минпромнауки РФ основании которой проводится аккредитация и при положительных резу выдается новый аттестат с сохранением срока действия ранее выданного 5.13. Признание аккредитации лабораторий, осуществленной другими ор (зарубежными, международными) проводится при получении положител результатов эксперимента по проверке качества выполнения анализов и в силу с момента регистрации документа об аккредитации. 5.14. Аттестат по аккредитации может быть аннулирован или приостанов действие на определенный срок при отрицательных результатах контрол Департаментом промышленной и инновационной политики в медицинск биотехнологической промышленности Минпромнауки РФ. 5.15. После устранения причин, вызвавших приостановку действия аттес аккредитации, действие его возобновляется, в противном случае аттестат аннулируется. 5.16. В случае изменения правового положения аккредитованной лаборат владельца или наименования), не влияющих на персонал, оборудование и организационную структуру, орган по аккредитации по заявлению право переводит аттестат аккредитации на его имя. 6. ИНСПЕКЦИОННЫЙ КОНТР ЗА ДЕЯТЕЛЬНОСТЬЮ АККРЕДИТОВАННЫХ ЛАБОРАТОРИЙ 6.1. Инспекционный контроль за деятельностью аккредитованных лабора осуществляться путем: - периодических проверок деятельности контрольных лабораторий на ме Департаментом промышленной и инновационной политики в медицинск биотехнологической промышленности Минпромнауки РФ или другой ор по его поручению; - сбора и анализа этим Департаментом от потребителей и других организ осуществляющих общественный и государственный контроль за качеств продукции, информации и рекламаций. 6.2. Орган, проводивший аккредитацию контрольных лабораторий, имее проводить контроль за деятельностью аккредитованной лаборатории, при нему специалистов территориальных органов Госстандарта России и баз организации метрологической службы (ведомственный метрологический Приложение А (обязательное) Министерство промышленности, науки и технологий Российской Фе Департамент промышленной и инновационной политики в медици биотехнологической промышленности АТТЕСТАТ Аккредитации контрольных лабораторий на техническую компетентность Зарегистрирован в Реестре Д промышленной и инновационн в медицинской и биотехн промышленности Минпр « ___ » _ № _____ Дей « ___ » Департамент промышленной и инновационной политики в медицинской биотехнологической промышленности Минпромнауки РФ удостоверяет, _______________________________________________________________ наименование _______________________________________________________________ контрольных лабораторий, предприятия (организации), адре соответствует требованиям «Системы аккредитации контрольных лабора предъявляемым к контрольным лабораториям ОКК по контролю качеств лекарственных средств и препаратов, и аккредитованы на техническую компетентность в проведении контроля качества лекарственных средств. Область аккредитации приведена в приложении к аттестату. Руководитель Д промышленной и инновационн в медицинской и биотехн промышленности Минпр М. П. _________ ___ (подпись) (инициа Приложение Б (обязательное) Руководитель Д промышленной и инновационн в медицинской и биотехн промышленности Минпр _________ ___ (подпись) (инициа Приложение к аттестату аккредитации № ________________________ от«_____» ____________20___г. ОБЛАСТЬ АККРЕДИТАЦИИ контрольных лабораторий ОКК _____________________________________________________________ (наименование предприятия) №№ п/п Наименование контролируемой продукции Код ОКП 1 2 3 Обозначение нормативного документа на продукцию, содержащую значения определяемых параметров 4 Об нор док мето Руководитель контрольной _________ ___ (подпись) (инициа Приложение В (обязательное) Примерный перечень документов, которыми должна распола аккредитованная контрольная лаборатория (включая документы организации, в которую входит лаборат 1. Правовая документация: - положение о контрольной лаборатории; - паспорт лаборатории; аттестат аккредитации; - руководство по качеству. 2. Нормативная документация по контролю качества лекарственных сред препаратов: - фармакопейные статьи; - технические условия; - Государственная Фармакопея X, XI изданий; - зарубежные фармакопеи; - государственные стандарты и стандарты отрасли; - инструкции по контролю качества лекарственных средств; - справочная литература. 3. Документация на испытательное оборудование и средства измерений: - регистрационные документы на оборудование (журнал, карты, листы и включающие следующие сведения: - наименование и вид оборудования; - предприятие-изготовитель (фирма), тип (марка), заводской и инвентарн - дата изготовления и ввода в эксплуатацию; - данные о техническом обслуживании, об имеющихся неисправностях, р - данные о калибровке, аттестации, поверке; - документы по эксплуатации и техническому обслуживанию средств изм - паспорт средств измерений; - порядок калибровки и утверждения единичных средств измерений; - документ по поверке на каждое средство измерений; - график поверки средств измерений. 4. Документация по персоналу лаборатории: - должностные инструкции - материалы по аттестации сотрудников лабораторий; - сертификаты обучения правилам GMP. 5. Документация на контролируемые образцы лекарственных средств: - аналитический паспорт; - акт отбора проб; - инструкция о порядке обеспечения сохранности образцов. 6. Документация на порядок проведения анализа и регистрации результа - рабочие журналы с расчетными данными оценки качества лекарственны - протоколы анализов; - журнал регистрации протоколов анализов. 7. Документация по поддержанию условий в помещениях: - инструкции по поддержанию порядка в производственных помещениях - журнал контроля санитарного состояния в помещениях; - эксплутационная документация на оборудование, контролирующее сост в помещении. 8. Документация по архиву: - инструкция о порядке ведения архива данных при оценке качества лека средств: рабочих журналов, расчетных данных, протоколов, отчетов и т.д Приложение Г (обязательное) Бланк организации Руководителю Д промышленной и инновационн в медицинской и биотехн промышленности Минп _____________________ ЗАЯВКА НА АККРЕДИТАЦИЮ контрольных лабораторий ОКК 1. _________________________________________________________ про (наименование предприятия-заявителя) провести аккредитацию контрольных лабораторий ОКК на право провед контроля качества лекарственных средств и препаратов. 2. Адрес, телефон, телекс, факс, номер расчетного счета _______________________________________________________________ _______________________________________________________________ 3. Фамилия, имя, отчество руководителя предприятия-заявителя: _______________________________________________________________ 4. Фамилия, имя, отчество, телефон руководителя контрольной лаборато _______________________________________________________________ _______________________________________________________________ 4. Заявитель обязуется: а) выполнить процедуру аккредитации; б) отвечать требованиям, предъявляемым к контрольным лабораториям в соответствии со стандартом отрасли ОСТ 64-02-001-2002; в) оплатить в соответствии с заключенным договором все расходы, связа проведением работ по аккредитации, независимо от их результатов, а так связанных с последующим инспекционным контролем за деятельностью аккредитованной лаборатории. Приложения: 1. Положение о лаборатории. 2. Паспорт лаборатории. 3. Руководство по качеству. Подпись руководителя Подпись главно Дата Приложение Д (обязательное) Форма титульного листа Положения и перечень его разделов Руководитель п в состав кот контрольная _________ ___ (подпись) (инициа « ____ » _________ ПОЛОЖЕНИЕ о контрольной лаборатории ___________________________________________ (наименование предприятия) аккредитованной на техническую компетентность ____________________________________________ (вид аккредитации) На _______ ___ (подпись) (инициа « ___ » ________ Заведующий ________ __ (подпись) (инициа « ___ » _______ Перечень разделов Положения о контрольной лаборатори Введение. 1. Общие положения. 2. Область аккредитации лаборатории. 3. Состав и структура лаборатории. 4. Функции лаборатории. 5. Права лаборатории. 6. Обязанности лаборатории. 7. Ответственность лаборатории. 8. Взаимодействие лаборатории с другими подразделениями предприяти которого входит лаборатория, и с другими организациями и предприятия Приложение Е (обязательное) ____________________________________________________________ (наименование предприятия, организации) Руководитель п в состав кот контрольная _______ ____ (подпись) (инициа « __ » __________ ПАСПОРТ _______________________________________ (наименование _______________________________________ лаборатории) На ________ ___ (подпись) (инициа « ___ » _________ Заведующий ________ ___ (подпись) (инициа « ____ » ________ 1. В паспорте аккредитованной лаборатории должны быть представлены информационные данные аккредитованной лаборатории и отражены свед нормативном и методическом обеспечении аналитических, микробиолог биологических работ, материально - технической базе, отвечающей треб современного уровня; составе и квалификации персонала, включая инфо повышении квалификации специалистов и получении сертификата по пр о производственных помещениях и условиях работы в них. Сведения пре в виде следующих форм. Форма 1. Информационные данные об аккредитованной контрольной лаб 1. Наименование лаборатории. 2. Юридический адрес лаборатории. 3. Телекс (факс). 4. Телефон. 5. Фамилия, имя, отчество руководителя лаборатории, телефон. 6. Фамилия, имя, отчество заместителя руководителя лаборатории, телеф 7. Расчетный счет юридического лица и реквизиты. 8. Организация, в структуру которой входит контрольная лаборатория, ес является юридическим лицом. 9. Фамилия, имя, отчество руководителя организации, телефон. 10. Данные об утверждении Положения о лаборатории. 11.Фамилия, имя, отчество должностного лица, ответственного за систем обеспечения качества. 12.Фамилия, имя, отчество должностного лица, ответственного за «Руков качеству». 13.Дата и регистрационный номер аттестата аккредитации. 14. Срок действия аттестата аккредитации. Форма 2. Виды анализов, проводимых контрольной лабораторией В форме приводятся сведения об объектах анализа, определяемых компо нормативных документах, регламентирующих показатели химического с анализируемого объекта, а также микробиологические и биологические п №№ п/п Объект анализа Определяемые компоненты 1 2 3 Нормативны регламен методик Форма 3. Сведения о средствах измерений (СИ), используемы аккредитованной лаборатории, при проведении анализов. версия для печати * Документы для скачивания доступны БЕСПЛАТНО только для зарегистрированных - Регистрация юридических лиц; - Регистрация физических лиц. Блок авторизации пользователей находится в правом верхнем углу страницы. Назад Наверх Главная | Союз стройиндустрии | Прайс-листы | Тендеры | Объекты строительства | Предприятия | Оборудование и спецтехника | Каталоги | Литература | Допуск СРО [AD]