АОО «Назарбаев Интеллектуальные школы» Образец
advertisement
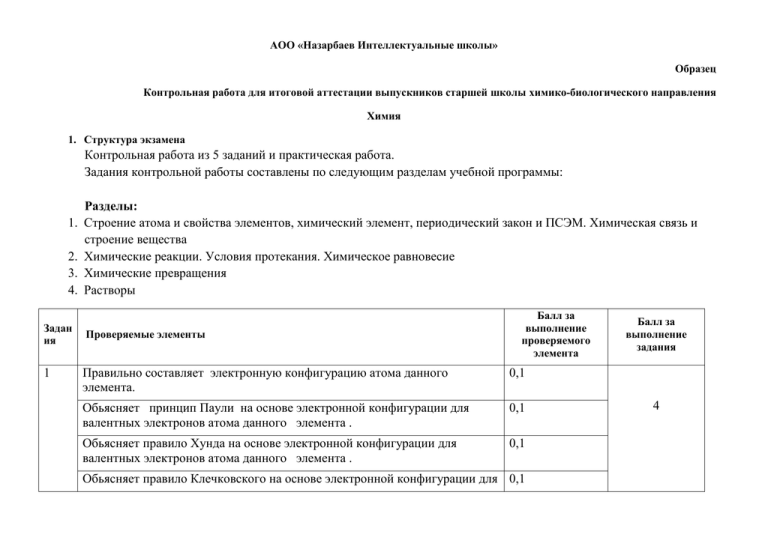
АОО «Назарбаев Интеллектуальные школы» Образец Контрольная работа для итоговой аттестации выпускников старшей школы химико-биологического направления Химия 1. Структура экзамена Контрольная работа из 5 заданий и практическая работа. Задания контрольной работы составлены по следующим разделам учебной программы: 1. 2. 3. 4. Задан ия 1 Разделы: Строение атома и свойства элементов, химический элемент, периодический закон и ПСЭМ. Химическая связь и строение вещества Химические реакции. Условия протекания. Химическое равновесие Химические превращения Растворы Проверяемые элементы Балл за выполнение проверяемого элемента Правильно составляет электронную конфигурацию атома данного элемента. 0,1 Обьясняет принцип Паули на основе электронной конфигурации для валентных электронов атома данного элемента . 0,1 Обьясняет правило Хунда на основе электронной конфигурации для валентных электронов атома данного элемента . 0,1 Обьясняет правило Клечковского на основе электронной конфигурации для 0,1 Балл за выполнение задания 4 валентных электронов атома данного элемента . 2 Правильно описывает состояние электронов в атоме данного элемента, используя все квантовые числа( главное, орбитальное, магнитное и спин). 0,2 Определяет валентные возможности атома . Степень окисления 0,2 На примере элементов III- периода обьясняет изменение окислительвосстановительных свойств 1 На примере элементов III- периода обьясняет изменение кислотноосновных свойств 1 Обьясняет образование ковалентной полярной связи по механизму обобществления электронов. 0,2 Обьясняет образование ковалентной полярной связи по донорноакцепторному механизму 0,2 Обьясняет электронное строение центрального атома и тип его гибридизации 0,2 В соотвествии с типом гибридизации определяет геометрическую форму молекулы в пространстве. 0,2 Объясняет строение молекулы по методу валентных связей (ВС) 0,2 Показывает насыщенность связей центрального атома 0,2 Скорость химических реакций, ее определение и математическое выражение 0,4 Закон действия масс. Объяснить влияние концентрации на скорость химических реакций 0,4 Объяснить влияние температуры на скорость химических реакций (правило Вант –Гоффа). 0,4 4 3 4 5 Объяснить влияние катализатора на скорость химических реакций : а) гомогенных; б) гетерогенных 0,8 Роль катализа в химии и биохимии. 0,2 Химическое равновесие. Уметь применять правило Ле-Шателье 0,4 Оъяснять влияние концентрации на смещение химического равновесия 0,4 Оъяснять влияние давления на смещение химического равновесия 0,4 Оъяснять влияние температуры на смещение химического равновесия 0,4 Выразить математическии константу равновесия для реакция протекающеи по уравнению 0,2 Составить уравнения реакций 10*0,2 Указать условия протекания реакций 5*0,2 5 Для реакции, обозначенной звездочкой, объяснить механизм реакции 1 Для реакции, обозначенной звездочкой, составить уравнение гидролиза солей в ионном и молекулярном виде Записывает условие задачи 1 Определение массы растворенного вещества 1б Определение мольного фактора 1б Составление пропорции по уравнению реакции. 1б Расчет выхода продукта 1б Составить уравнение реакции между ацетатом натрия и гидроксидом натрия, рассчитать массу. Объем и количество метана, выделяющегося в данной реакции. 1 1б 5 6 Составить уравнение реакции между соляной кислотой и диоксидом марганца, рассчитать массу, объем и количество хлора, выделяющегося в данной реакции 1 Составить уравнение реакции хлорирования метана и рассчитать массу. объем и количество хлороводорода 1 Рассчитать массу, объем и количество непрореагировавшего хлора. 1 Составить уравнение реакции между хлором и водой, рассчитать массу. объем и количество хлороводорода и хлорноватистой кислоты 1 Рассчитать массу, объем и количество соляной кислоты, образовавшейся в результате реакции 0,5 Для получившихся кислот составить уравнения нейтрализайи с гидроксидом натрия и рассчитать массу щелочи 0,5 2. Шкала перевода количества баллов в оценку: 30- баллов - максимальное количество «5»-89-100% 26-30 баллов «4»-72-88% 22-25 баллов «3»-55-71% 17-21 баллов «2»- 54 и ниже 16 баллов и ниже 3. Время проведения экзамена: Контрольная работа 4 астрономических часа (240минут) Практическая работа – 1 час Перечень лабораторных работ 1. Качественное определение углерода, водорода и хлора в органических соединениях. Оформить результаты в тетрадь. 2. Получение этилена и изучение его свойств. Оформить результаты в тетрадь. 3. Окисление спиртов до альдегидов. Оформить результаты в тетрадь. 4. Качественные реакции многоатомных спиртов. Оформить результаты в тетрадь. 5. Изучение свойств карбоновых кислот. Оформить результаты в тетрадь. 6. Получение мыла и изучение его свойств. Оформить результаты в тетрадь. 7. Изучение свойств сахарозы. Оформить результаты в тетрадь. 8. Изучение свойств белков. Оформить результаты в тетрадь. 9. Определение эквивалента магния. Оформить результаты в тетрадь. 10.Доказательство кислотно-основных и амфотерных свойств а) гидроксида натрия, б) гидроксида цинка и в) серной кислоты. Оформить результаты в тетрадь. 11.Получение комплексов меди (II), железа (II) и (III) исследование их свойств. Оформить результаты в тетрадь. 12.Коррозия железа при контакте его с цинком и/или оловом. Оформить результаты в тетрадь. 13.Скорость химических реакций. Оформить результаты в тетрадь. 14.Качественные реакции на хлорид, сульфат, нитрат, карбонат анионы и катион аммония. Оформить результаты в тетрадь. 15.Получение аммиака, изучение свойств водного раствора аммиака. Оформить результаты в тетрадь. 16.Смещение химического равновесия в системе/ на примере роданида аммония (или калия) и хлорида жедеза (III) путем изменения концентрации. Оформить результаты в тетрадь. 17.Гидролиз солей. Реакции ионного обмена. Оформить результаты в тетрадь. 18.Распознование минеральных удобрений. Оформить результаты в тетрадь. 19.Получение, собирание и изучение свойств газов неорганического органического происхождения. Оформить результаты в тетрадь. Оформить результаты в тетрадь. 20.Получение и распознавание неорганических и органических веществ. Пример практической работы «Получение этилена и изучение его химических свойств» Критерии оценивания 1. Правильно сформулирована цель работы. 2. Составлен план проведения работы 3. Приведена теоретическая часть с обоснованием того или иного способа выполнения задания (методика выполнения данного эксперимента) 4. Представлен химизм процесса посредством конкретных уравнений химических реакций 5. Приведена экспериментальная часть, результаты представлены в виде таблиц, данные которых использованы для математических расчетов и построения графиков (ПРИ НЕОБХОДИМОСТИ) 6. Соблюдены правила ТБ, сделан анализ полученных результатов и сформулированы выводы, касающиеся цели работы. Итого Балл 1 1 1 1 1 1 6 баллов Выполнение работы. Получение этилена гидратацией этанола В сухую пробирку налейте 1-1,5 мл этанола и осторожно добавьте 2-3 мл концентрированной серной кислоты. При нагревании смеси для равномерного кипения добавьте в реакционный сосуд фарфоровые камешки. Плотно закройте пробирку газоотводной трубкой и закрепите в штативе, как показано на рисунке. Нагревание проводите, соблюдая правила техники безопасности. Изучение свойств этилена: А) конец газоотводной трубки опустите в пробирку с 1,5-2 мл бром (йод) ной воды и пропускайте этилен до полного обесцвичивания бромной воды. Б) конец газоотводной трубки опустите в пробирку с 1,5-2 мл раствора перманганата калия и пропускайте этилен до полного его обесцвичивания. . В) к концу газоотводной трубки поднесите пламя и наблюдайте реакцию горения этилена. После нагревания, дождитесь охлаждения прибора, разберите его, и приведите в порядок рабочее место. Контрольная работа 1- вариант I.1. В соответствии с принципом Паули , правилом Хунда, правилом Клечковского составьте электронно-графическую формулу элемента с порядковым номером №19. Для валентных электронов определите:а) валентность и степень окисления ; б) квантовые числа I.2. По ПСЭ Д.И Менделеева на примере элементов III- периода проследить а) изменение окислительвосстановительных свойств; б) кислотно-основных свойств элементов . I.3. Для молекулы хлорида бора определите: а) тип гибридизации атома бора; б) геометрическую форму молекулы в пространстве; в) механизм образования химической связи. II.1 Скорость химической реакции. Факторы, влияющие на скорость химических реакций: природа реагирующих веществ, температура (правило Вант-Гофф ), концентрация- закон действия масс.Константа скорости реакции. Энергетика и баланс – закон Гесса, катализаторы и ингибиторы, гомогенный и гетерогенный катализ, роль катализа в химии и биохимии. II.2 Химическое равновесие. Обьяснит условия смещения равновесия по принципу Ле Шателье при изменении: а) температуры; б) давления ; в) концентрации веществ для реакции : 2CO +O2 = 2CO2 ; ∆H = -566,4 кДж III. Выполните цепочку превращений и для реакции, обозначенной звездочкой, объяснить механизм реакции. Для реакции, обозначенной звездочкой, составить уравнение гидролиза солей в ионном и молекулярном виде NaCl *→ Cl2 →HCl →C2H5Cl → C2H5OH ↓ ↑ NaOH→ *Na2CO3→NaHCO3 →CO2→C6H12O6 IV. К 10% раствору (плотность 1,109 г/мл) объемом 300 мл гидроксида натрия прибавили 500мл 30%раствора с плотностью 1,180 г/мл азотной кислоты, образовалось 65 г соли. Рассчитайте выход продукта. V. При нагревании 20,5 г безводного ацетата натрия и гидроксида натрия выделился газ, взаимодействующий с хлором на свету. Хлор, в свою очередь, был получен в результате взаимодействия 130,5 г диоксида марганца с соляной кислотой. После окончания реакции хлорирования все газообразные вещества растворили в воде. Рассчитайте количество гидроксида натрия, необходимого для нейтрализации полученного раствора. ( 2моль) Контрольная работа (ответы). 1- задание I.1. В соответствии с принципом Паули , правилом Хунда, правилом Клечковского составьте электронно-графическую формулу элемента с порядковым номером №19. Для валентных электронов определите:а) валентность и степень окисления ; б) квантовые числа Элемент с №19 – калий, щелочной металл, расположен в IV периоде, I группе, главной подгруппе таблицы Д.И. Менделеева. Следовательно, заряд ядра атома калия +19, протонов – 19, электронов – 19, нейтронов -20. Распределение электронов по четырем энергетическим уровням для атома К: 1s2 2s2 2p6 3s2 3p6 4s1 , электронно-графическая формула имеет вид: +19 )2e )8e )8e )1e 1s22s22p63s23p64s1 4s1 Валентный электрон – 1, валентность – 1, степень окисления: 0;+1 ↑ Квантовые числа для валентного электрона: n = 4; l= 0; ml = 0; ms = +1/2 По принципу Паули: В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел Например : в атоме калия на первом энергетическом уровне имеется 2 электрона 1s2 : ↑↓ n=1 l= 0 ml = 0 ms = +1/2 n=1 l= 0 ml = 0 ms = -1/2 квантовые числа отличаются значением магнитного спинового числа ms Правило Хунда: При данном значении l (т.е. в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным. Калий: 4s1 ↑ ↓ а) ms = +1/2 б) ms = -1/2 ms1 > ms2 , следовательно, а) верно Правило Клечковского: Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел . При одинаковой сумме раньше заполняется орбиталь с меньшим значением . Для атома калия: 1s22s22p63s23p64s1 1.2. По ПСЭ Д.И Менделеева на примере элементов III- периода проследить а) изменение окислительновосстановительных свойств; б) кислотно-основных свойств элементов . Элементы III- периода: Na , Mg, Al, Si, P, S, Cl , Ar а) Зависимость атомных радиусов (r) от заряда ядра (Z) имеет периодический характер. В пределах одного периода с увеличением Z проявляется тенденция к уменьшению размеров атомов. Например, в третьем периоде атомные радиусы имеют следующие значения: Na( пм) , Mg(), Al(), Si(), P(), S(), Cl() , Ar() Это объясняется увеличением притяжения электронов внешнего слоя к ядру по мере возрастания заряда ядра. В третьем периоде с ростом положительного заряда ядер атомов возрастает число электронов на внешнем уровне (от 1 до 8), что объясняет изменение свойств элементов: в начале периода находится Na - щелочной металл, затем металлические свойства постепенно ослабевают и усиливаются свойства неметаллические. С увеличением заряда ядра восстановительные свойства атомов уменьшаются, а окислительные свойства увеличиваются. Например : натрий легко отдает внешний электрон, превращаясь в катион натрия Na0 -1e → Na+ , а хлор легко присоединяет один электрон и превращается в анион Cl0+1e → Clб)Na2O , MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7 NaOH, Mg(OH)2 , Al(OH)3, H2SiO3, H3PO4, H2SO4, HClO4 основные свойства уменьшаются, а кислотные возрастают. щелочь основание амфотерное слабая кислота сильная кислота основание Na2O сильный основной оксид Na2O + H2O = 2NaOH Na2O + CO2 = Na2CO3 Na2O + H2SO4 = Na2SO4+H2O Al2O3 амфотерный оксид Al2O3 +3H2SO4 = Al2(SO4)3+3 H2O Al2O3 + 2NaOH = 2NaAlO2+H2O SO3 сильный кислотный оксид SO3 +H2O = H2SO4 SO3 + 2KOH = K2SO4+ H2O SO3 + K2O = K2SO4 1.3. BCl3 молекула хлорида бора: В - центральный атом, строение которого в основном и возбужденном состоянии выглядит так: а) +5 )2e)3e B 2s2 ↑↓ 2p1 ↑ B* 2s2 ↑ 2p1 ↑ ↑ тип гибридизации – sp2, геометрическая форма в пространстве: 1200 плоский треугольник: в) механизм образования ковалентной связи: B* 2s2 2p1 ↑ ↑ ↑ 3s2 3p5 ↑↓ 3s2 3p5 ↑↓ ↓ ↑↓ ↑↓ 3s2 3p5 ↓ ↑↓ ↑↓ ↑↓ ↑↓ ↓ ↑↓ ↓ Спаривание одиночных(валентных) электронов: Cl• + •B• + •Cl • + Cl• Cl :B: Cl Cl – B – Cl .. Cl Cl 2- задание. Скорость химической реакции. Факторы, влияющие на скорость химических реакций: природа реагирующих веществ, температура (правило Вант-Гофф ), концентрация- закон действия масс.Константа скорости реакции. Энергетика и баланс – закон Гесса, катализаторы и ингибиторы, гомогенный и гетерогенный катализ, роль катализа в химии и биохимии. б) Раздел химии, изучающий скорость химических реакций называется химической кинетикой. Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции) υ = ; [моль/л•мин (сек)]. При постоянной температуре, скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в некоторые степени. Если реакционное пространство состоит из одной фазы (гомогенное пространство), то скорость химической реакции рассчитывается по уравнению: υгом = [моль/л•мин] Если реакционное пространство состоит из нескольких фаз (гетерогенное пространство), то скорость химической реакции рассчитывается по уравнению: υгетер = [моль/м2•мин] На скорость химических реакций влияют следующие факторы: - Природа реагирующих веществ; - Концентрация (давление для газов); - Температура; - Катализатор ; - Поверхность раздела; а) Природа реагирующих веществ, например реакция между кислородом и водородом протекает быстро, а между водородом и азотом медленно, так как: энергия связи в молекуле кислорода равна 494 кДж/моль, а в молекуле азота энергия связи 942 кДж/моль. Поэтому азот с водородом реагирует с трудом. б) Температура. При увеличении температуры на каждые 100С скорость реакции увеличивается в 2-4 раза (правило Вант-Гоффа). = ; в) Концентрация. Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в некоторые степени (закон действующих масс) г) Давление. По уравнению Менделеева-Клапейрона видно, что давление и концентрация находятся в прямопропорциональной зависимости, следовательно скорость химической реакции в каждый момент времени пропорциональна давлениям реагентов, возведенным в некоторые степени (закон действующих масс) д) Катализаторы. Гомогенный и гетерогенный катализ, роль катализа в химии и биохимии. Катализаторами называют вещества, ускоряющие химические реакции и остающиеся после реакций химически неизменными. Физическое состояние катализатора может изменяться. Вещества, замедляющие скорость химических реакций называются ингибиторами. Многие катализаторы обладают селективностью или избирательностью, т.е. способностью ускорять только одну из возможных реакций или только реакции одного класса. Если катализатор и реагирующие вещества находятся в одном агрегатном состоянии, обычно газообразном или жидком, то катализ называется гомогенным. В роли катализаторов в гомогенном катализе часто выступают растворы кислот, оснований, солей d-элементов, растворители. Механизм действия катализаторов основан на теории промежуточных соединений (Н.Д.Зелинский, П.Сабатье). Согласно этой теории катализатор образует с реагирующими веществами промежуточные соединения. Энергия активации этого процесса меньше, чем энергия активации некаталитической реакции, что и ведет к увеличению скорости превращения. Например: реакция А+В ––>С, протекает в две стадии: А + К ––> АК АК + В ––> С + К Примером такого процесса может служить реакция разложения ацетальдегида, энергия активации которой E A = 190 кДж/моль: СН3СНО ––> СН4 + СО В присутствии катализатора - паров йода этот процесс протекает в две стадии: СН3СНО + I2 ––> СН3I + НI + СО СН3I + НI ––> СН4 + I2 Уменьшение энергии активации этой реакции в присутствии катализатора составляет 54 кДж/моль; константа скорости реакции при этом увеличивается приблизительно в 105 раз. Гомогенными каталитическими реакциями являются ферментативные процессы, протекающие в живых организмах. Катализ является гетерогенным, если катализатор и реагирующие вещества находятся в разных агрегатных состояниях или образуют самостоятельные фазы. В роли катализаторов в этом случае чаще всего выступают твердые вещества, обычно d-элементы или их соединения. Исходной стадией гетерогенного катализа является адсорбция реагентов, т.е. связывание молекул реагирующих веществ с поверхностью другого вещества. Процесс адсорбции происходит в несколько стадий. Благодаря диффузии, молекулы реагирующих веществ подходят к поверхности, где происходит их адсорбция и химическая реакция на поверхности:[Cu] катализатор, (т) СО(г)+ Н2 (г)––> СН3ОН(ж), [Ni] катализатор, (т) СО + Н2 ––> СН4 + Н2О Ферментативный катализ – каталитические реакции, протекающие с участием ферментов – биологических катализаторов белковой природы. Ферментативный катализ имеет две характерные особенности: 1. Высокая активность и высокая специфичность: амилаза катализирует процесс расщепления крахмала, представляющего собой цепь одинаковых глюкозных звеньев, но не катализирует гидролиз сахарозы, молекула которой составлена из глюкозного и фруктозного фрагментов. Характерной особенностью действия ферментов является также высокая чувствительность активности ферментов к внешним условиям – рН среды и температуре. По словам Кусто, земной шар напоминает “одиноко несущийся в космическом пространстве автомобиль без выхлопной трубы”. Химики - каталитики настойчиво работают над этой проблемой и уже добились некоторых результатов. Разработаны специальные устройства для дожигания выхлопных газов автомобилей, работающие на основе каталитического окисления вредных компонентов газов. Подобраны катализаторы и условия для обезвреживания отходящих газов химических производств. Многие важнейшие химические производства, такие, как получение серной кислоты, аммиака, азотной кислоты, синтетического каучука и др., проводятся в присутствии катализаторов. II.2 Химическое равновесие. Обьяснить условия смещения равновесия по принципу Ле-Шателье при изменении: а) температуры; б) давления ; в) концентрации веществ для реакции : 2CO +O2 2CO2 ; ∆H = -566,4 кДж Принцип Ле - Шателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия. а) Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции. Так как данная реакция – экзотермическая, протекает с выделением теплоты, то при повышении температуры химическое равновесие сместится в обратном направлении, в сторону эндотермической реакции, а при понижении температуры равновесие сместится в прямом направлении, в сторону экзотермической реакции. б) Давление существенно влияет на положение равновесия в реакциях с участием газообразных веществ, сопровождающихся изменением объёма за счёт изменения количества вещества при переходе от исходных веществ к продуктам: 2CO +O2 2CO2 ; Сумма исходных газов – 3 моль, продуктов – 2 моль, при повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов, т.е в прямом направлении, а при понижении давления равновесие сдвигается в направлении, в котором увеличивается суммарное количество молей газов, т.е в обратном направлении. в) При повышении концентрации одного из исходных веществ (СО или О2) равновесие сдвигается в направлении образования продуктов реакции; 2CO +O2 2CO2 ; а при повышении концентрации одного из продуктов реакции (СО2) равновесие сдвигается в направлении образования исходных веществ. 3-задание 1) NaCl(раствор)электролиз NaOH + Cl2↑ +H2↑ 2) Cl2+H2 →2HCl 3) HCl+C2H4→ C2H5Cl 4) C2H5Cl+H2O→ C2H5OH+HCl 5) NaCl(р-р) электролиз NaOH + Cl2↑ +H2↑ 6) 2NaOH+CO2→Na2CO3+H2O 7) Na2CO3+H2CO3→2NaHCO3 8) 2NaHCO3 t CO2+H2O+Na2CO3 9) 6CO2+H2O фотосинтез С6Н12О6 10) С6Н12О6 спиртовое брожение 2С2Н5ОН+2СО2 механизм процесса электролиза К(-) : Na+ , H+ 2H+ +2e → H2 A(+): Cl- , OH- 2Cl- -2e → Cl2 NaCl(р-р) электролиз NaOH + Cl2↑ +H2↑ Гидролиз Na2CO3 в молекулярном, полном и сокращенном ионном виде: ** Na2CO3+H2O→NaHCO3+NaOH 2Na++CO32-+H2O→Na++HCO3-+Na++OHCO32-+H2O→ HCO3-+ OHNaHCO3+H2O→H2O+CO2↑+NaOH Na++HCO3-+H2O→ H2O+CO2↑+Na++OHHCO3-+H2O→ H2O+CO2↑+ OHрН > 7 щелочная среда 4-задание Дано: ω(NaOH) =10% V(NaOH) = 300 мл ρ = 1,109 г/мл ω(HNO3)= 30% v(HNO3) = 500 мл ρ = 1,180 г/мл m(NaNO3)= 65 г Решение: ω(р-го в-ва) = m (р-го в-ва) = г m(NaOH) = m(HNO3) = г Найти : η=? NaOH+HNO3→NaNO3+H2O ν,моль 1 1 1 1 Mr 40 63 85 18 M,г/моль 40 63 85 18 m ,г 40 63 85 18 М.Ф(NaOH)= М.Ф(HNO3)= моль моль m(NaNO3)= г η= Ответ : η=91,95% = 5-задание: Дано: m(CH3COONa)=20,5г m(MnO2)=130,5г Рещение:1) Рассчитаем массу метана по реакции: т/к ν(NaOH)=? 20,5 г х,г CH3COONa + NaOH→ CH4 + Na2CO3 ν,моль 1 1 Mr 82 16 M,г/моль 82 16 m 82 16 m(CH4) = = 4г 2) Рассчитаем массу хлора по реакции: 130,5 х,г 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O ν,моль 1 1 Mr 87 71 M,г/моль 87 71 m 87 71 m(Cl2)= 3) Рассчитаем массу хлороводорода по реакции: 4г х,г CH4+4Cl2→CCl4+4HCl ν,моль 1 4 4 Mr 16 71 36,5 M,г/моль 16 71 36,5 m 16 284 146 моль Mf (CH4) = моль Mf(Cl2) = Mf (CH4) < Mf(Cl2) , следовательно, выход продукта HCl Рассчитываем по метану (в недостатке) ν(HCl) = m(HCl) = моль 4) Рассчитаем массу непрореагировавшего хлора по реакции: 4г х,г CH4+4Cl2→CCl4+4HCl ν,моль 1 4 Mr 16 71 M,г/моль 16 71 m 16 284 масса хлора, вступившего в реакцию; m(Cl2) = Масса непрореагировавшего хлора: m(Cl2) = 106,5 – 71= 35,5г ν(Cl2)= моль 5) Рассчитаем массу соляной и хлорноватистой кислоты по реакции: 0,5 моль х у ν,моль 1 ν(HCl) = ν(HClO) = 1 моль Cl2 + H2O = HCl + HClO 1 = 0,5 моль 6) Рассчитаем суммарное количество соляной кислоты по реакциям : ∑ν(HCl) = 1+0,5 = 1,5 моль и хлорноватистой кислоты ν(HClO) = 0,5 моль По реакции нейтрализации рассчитаем количество HClO На 1 моль кислоты необходимо 1моль щелочи HClO + NaOH = NaClO + H2O ν, моль 1 1 HCl +NaOH = NaCl + H2O ν, моль 1 1 Следовательно, на нейтрализацию кислот надо взять 2 моль щелочи; ∑ν(HCl) + ν(HClO) = 1,5+0,5 = 2 моль Ответ: ν (NaOH) = 2 моль





