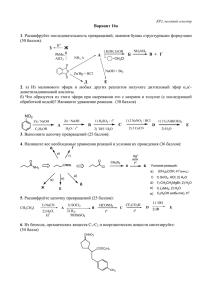
Взаимодействие кислот с простыми веществами:
advertisement

ГАЛОГЕНЫ ОВР (закончите уравнения, самостоятельно поставьте коэффициенты и проследите за переходом электронов в реакциях) Восстановительные свойства галогенид-ионов Хлорид-ион может быть окислен только очень сильными окислителями KCl+ H2SO4 (к) ≠ KMnO4+HCl → MnCl2+ Cl2+KCl+ H2O (лаб. способ получения хлора) MnO2+HCl → MnCl2+ Cl2+ H2O(лаб. способ получения хлора) KClO3 + HCl→ Cl2 + KCl+H2O(лаб. способ получения хлора) K2Cr2O7 + HCl → CrCl3+ Cl2+KCl+ H2O(лаб. способ получения хлора) бромид-ион окисляется: KBr+ H2SO4 (к)→S(или SO2)+ Br2+H2O KBr+ KMnO4+ H2SO4→ MnSO4+Br2+K2SO4+H2O CrBr3+H2O2+H2SO4(среда) → Cr2(SO4)3+Br2+H2O (Br- в кислой среде окисляется пероксидом водорода, CrBr3+H2O2+KOH(среда) → K2CrO4+KBr+H2O а в щелочной пероксидом водорода окисляется Cr(III) до NaBr+NaBrO3+H2SO4(среда) → Br2+K2SO4+H2O hv AgBr Ag +Br2 галогениды серебра (на свету) I– очень хороший восстановитель : KI +Cl2 → KCl+I2 KI + K2Cr2O7 +H2SO4(среда) → Cr2(SO4)3+I2 +K2SO4+H2O KI +Fe(OH)3 → FeI2+I2+KOH KI +FeCl3 → FeI2+I2+KCl KI + CuSO4 → CuI↓+I2+K2SO4 KI + KNO2 +H2SO4(среда) →I2+NO+K2SO4+H2O t FeI2+NO2 Fe2O3+I2+NO ( два элемента – восстановителя!) KI+ H2SO4 (конц.) →H2S+ I2+K2SO4 KI + O3 + H2O → I2+О2 + КОН(качественная реакция на озон) KI + KIO3 + H2SO4→ I2+K2SO4+H2O Галогены (простые вещества) –окислители F2+ KOH → NaF+OF2+H2O F2+ O2 эл. разряд OF2 СI2 + Fe → FeСI3 Cl2 + Br2 +H2O → HBrO3+HCl Cl2 + I2 +H2O → HIO3+HCl Cl2+ KI → KCl+I2 Cl2 + K2SO3 +H2O → K2SO4+HCl NH3+Сl2 → N2+HCl (если NH3 в избытке, то NH4Cl) Cl2 можно окислить озоном: Cl2 + 2O3 → Cl2O6 Br2+SO2+ 2H2O → Н2SO4+2HBr Br2 + Fe → FeBr3 Br2+CrCl3+ KOH(среда) →K2CrO4+KBr+ H2O Br2 можно окислить хлором: Br2+ Cl2 +H2O → HBrO3+HCl I 2 + H2 →2HI I 2 + H2S →2HI+S I2 + Fe → FeI2 I2 +2Na2S2O3 →2 NaI +Na2S4O6 (тетратионат натрия) I2+ KCl ≠ I2 можно окислить пероксидом водорода: I 2 + H2O2 → HIO3+H2O или хлором: I2 +Cl2 + H2O → HIO3+HCl Кислородсодержащие кислоты и соли галогенов - окислители HClO+ H2O2 → HCl+ O2 + H2O NaClO+ As + H2O →H3AsO4 +NaCl KClO3+ HCl →Cl2 + KCl +H2O Cr(VI)….) HClO3+ K2SO3 → K2SO4+HCl+H2O KClO3+ Fe2O3+ KOH(среда) → K2FeO4+KCl+H2O KClO3+K2MnO4 + HCl(среда) → KMnO4+KCl+H2O KClO3 MnO 2 KCl+O2 t KClO4 KCl+O2 t NH4ClO4 N2+ HCl +O2+H2O Диспропорционирование Cl2+H2O ↔HCl+HClO Cl2+NaOH→ NaCl+NaClO+H2O t Cl2+NaOH NaCl+NaClO3+H2O Cl2+Ca(OH)2→ CaCl2+Ca(ClO)2+H2O I2+Ba(OH)2 → BaI2+Ba(IO3)2+H2O t KClO3 KClO4+KCl Не ОВР Растворение осадков с образованием комплексных соединений AgCl+ 2NH4OH→[Ag(NH3)2]Cl+2H2O AgCl+ 2Na2S2O3→Na3[Ag(S2O3)2] + NaCl AgBr+ 2Na2S2O3→Na3[Ag(S2O3)2] + NaBr (реакция используется в фотографии) AgI+ 2Na2S2O3→Na3[Ag(S2O3)2] + NaI Обменные реакции с образованием KI+ Pb(CH3COOH) 2 → осадка KI(KBr,KCl) +AgNO3 → осадка NaCl(ТВ.) + H2SO4(конц.)→ газа(лаб. способ получения хлороводорода) 4HF + SiO2(стекло)→2H2О+ SiF4 газа