Конспект урока Атом-сложная частица - yaruga
advertisement
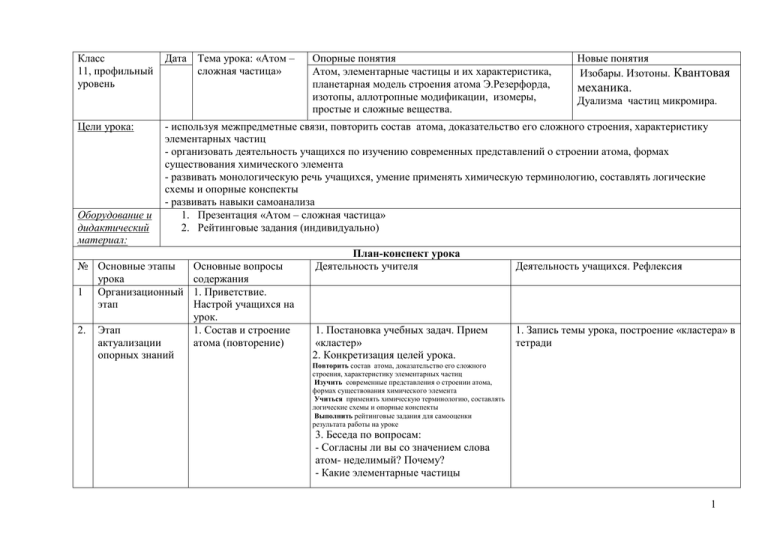
Класс 11, профильный уровень Цели урока: Оборудование и дидактический материал: Дата Тема урока: «Атом – сложная частица» Новые понятия Изобары. Изотоны. Квантовая механика. Дуализма частиц микромира. - используя межпредметные связи, повторить состав атома, доказательство его сложного строения, характеристику элементарных частиц - организовать деятельность учащихся по изучению современных представлений о строении атома, формах существования химического элемента - развивать монологическую речь учащихся, умение применять химическую терминологию, составлять логические схемы и опорные конспекты - развивать навыки самоанализа 1. Презентация «Атом – сложная частица» 2. Рейтинговые задания (индивидуально) № Основные этапы урока 1 Организационный этап 2. Опорные понятия Атом, элементарные частицы и их характеристика, планетарная модель строения атома Э.Резерфорда, изотопы, аллотропные модификации, изомеры, простые и сложные вещества. Этап актуализации опорных знаний Основные вопросы содержания 1. Приветствие. Настрой учащихся на урок. 1. Состав и строение атома (повторение) План-конспект урока Деятельность учителя 1. Постановка учебных задач. Прием «кластер» 2. Конкретизация целей урока. Деятельность учащихся. Рефлексия 1. Запись темы урока, построение «кластера» в тетради Повторить состав атома, доказательство его сложного строения, характеристику элементарных частиц Изучить современные представления о строении атома, формах существования химического элемента Учиться применять химическую терминологию, составлять логические схемы и опорные конспекты Выполнить рейтинговые задания для самооценки результата работы на уроке 3. Беседа по вопросам: - Согласны ли вы со значением слова атом- неделимый? Почему? - Какие элементарные частицы 1 образуют атом? Дайте им характеристику. - Представьте модель строения атома. - Как определить состав атома? Приведите пример, использую ПСХЭ. 4. Выполнение тестовых заданий (Интернет-ресурс) 3. Этап изучения новых знаний и способов деятельности 1. Сложность строения атома: - опыты Дж.Томсона (1897г.). Модель строения атома - опыте Резерфорда (1907г.), планетарная модель атома. - квантовые постулаты Бора - протонно-нейтронная модель ядра 1. Рассказ учителя, использование иллюстративного материала презентации. Формулировка понятия. 3. Участие в беседе. 4. Выполнение заданий (индивидуальное рабочее место), 1 ученик совместно с учителем у доски. 1. Сложность строения атома. - Составление опорной схемы. Вопросы по содержанию материала. - Познакомьтесь с выводами Дж. Томсона и кратко их сформулируйте. 1. Что атомы не неделимы, так как из них могут быть вырваны отрицательно заряженные частицы под действием электрических сил, удара быстро движущихся частиц, ультрафиолетового света или тепла. 2. Что эти частицы все одинаковой массы, несут одинаковый заряд отрицательного электричества, от какого бы рода атомов они ни происходили, и являются компонентами всех атомов. 3. Масса этих частиц меньше, чем одна тысячная массы атома водорода. Я вначале назвал эти частицы корпускулами, но они теперь называются более подходящим именем «электрон». - Используя иллюстрацию, опишите модель строения атома Дж. Томсона «сливовый пудинг» - Познакомившись с результатами опытов Э. Резерфорда и используя схематические модели атомов, объясните главное открытие ученого. Резерфорд предложил планетарную модель 2 атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, под действием кулоновских сил со стороны ядра вращаются электроны. Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро. - Запишите постулаты Н.Бора о строении атома Первый постулат: Атомы имеют ряд стационарных состояний соответствующих определенным значениям энергий: Е1, Е2...En. Находясь в стационарном состоянии, атом энергии не излучает, несмотря на движение электронов. 2. 2. Микро и макромир. Квантовая механика. Корпускулярноволновые свойства микромира. 3. Химический элемент. Изотопы, Рассказ учителя. 3. Формулировка понятия атом, химический элемент. - Самостоятельно сформулируйте понятие атом. Познакомьтесь с определением атома, данным в учебнике (стр. 4). -Сформулируйте понятие химический Второй постулат: В стационарном состоянии атома электроны движутся по стационарным орбитам Третий постулат: Излучение или поглощение энергии атомом происходит при переходе его из одного стационарного состояния в другое. При этом излучается или поглощается порция энергии (квант) - Запись положений протонно-нейтронной модели строения атома - Рассмотрение АНИМАЦИОННЫХ 3 изобары, изотоны. элемент (совокупность атомов с одинаковым зарядом атомного ядра, т.е. с одинаковым числом протонов в нем). 4. Содержание определяет форму, форма влияет на содержание – философское понимание научных закономерностей. 4. Формы существования химического элемента: свободные атомы, простые вещества (аллотропные модификации), сложные вещества (изомеры). МОДЕЛЕЙ АТОМОВ 2. Учебное слушание. Запись значения новых терминов. 3. Учебное слушание. Запись значения понятий изотопы, изобары, изотоны (самостоятельно сформулировать определение). Задание. Определение состава изотопов, вычисление Ar элемента: Элемент бор существует в виде двух изотопов: 10В и 11В. Содержание в природе первого изотопа равно 19,6 %, второго -80,4% . Вычислите относительную атомную массу 39 39 19К 18Ar 40 40 19К 18Ar Изобары – атомы различных химических элементов с одинаковой атомной массой. Изотоны - атомы различных химических элементов с одинаковым числом нейтронов. - Приведите пример изотонов. 4. Участие в учебной беседе, составление логической цепочки: Форма → содержание → химические объекты → примеры Свободные атомы → одинаковое число протонов в ядре атома→ изотопы → протий, дейтерий, тритий Простые вещества → одинаковый 4 химический состав аллотропы → алмаз графит и Сложные вещества → одинаковая молекулярная формула →изомеры → нбутан, изобутан 4. 5. 6. Этап информации о домашнем задании Этап обобщения и систематизации. Итог урока Этап контроля усвоения знаний и способов деятельности §1, №2, стр. 6. Подготовить устный развернутый ответ на вопрос Просмотр видеофрагмента «Строение атома» 1. Самоконтроль знаний, выполнение разноуровневых заданий Предлагается в ходе изучения темы выполнить серию рейтинговый заданий. Каждый вопрос, в зависимости от сложности, оценивается разным числом баллов. Вы можете выполнить все задания, а можете часть. Вам необходимо набрать как можно больше баллов. По итогам выполнения рейтинговых заданий мы проведем рейтинг вашей успешности и выявим лучшего ученика. Выполнение рейтингового задания. 2балла: Чему равен порядковый номер элемента, массовое число одного из изотопов которого равно 31, а число нейтронов равно 16? 4 балла: Определите состав изотопов 15N, 119 Sn, 235U, иона 52 24Cr 3+ 6 баллов: Элемент медь существует в виде двух изотопов: 63Сu и 65Сu. Содержание в природе первого изотопа равно 73%, второго27% . Вычислите относительную атомную массу меди 5
