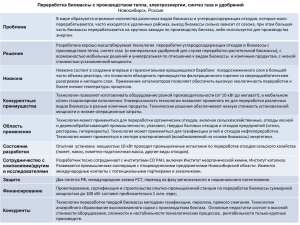
Из обзора научной и патентной ... Coriolus обладают иммуномодулирующей активностью. Они ...
advertisement

Из обзора научной и патентной литературы известно, что грибы рода Coriolus обладают иммуномодулирующей активностью. Они способны оказывать влияние на клеточный иммунитет, усиливать фагоцитоз. Наиболее исследуемым в клинике и эксперименте является гриб Coriolus versicolor. Имеются также единичные сведения о влиянии на иммунитет гриба Coriolus pubescens [заявка Японии В №63-28418]. Задача данного исследования заключалась в изучении иммунотропной активности сухой биомассы высшего базидиального гриба Trametes (Coriolus) pubescens для производства биологически активной добавки «Трамелан». Для оценки иммунотропного действия биомассы использовали информативную методику, рекомендованную в «Руководстве по экспериментальному (доклиническому) изучению новых фармакологических веществ» в разделе «Методические указания по изучению иммунотропной активности фармакологических веществ», в подразделе «Оценка влияния препарата на гуморальный иммунный ответ» [1]. Суть методики заключается в оценке действия исследуемого вещества на гуморальный иммунный ответ путём определения числа антителообразующих клеток (АОК) с помощью метода локального гемолиза по Ерне и Нордину. Для определения количества зон гемолиза, клетки селезёнки иммунизированных мышей (опытных и контрольных) и эритроциты барана помещают в агарозный гель. Клетки селезёнки в экспериментальных условиях in vitro продолжают синтезировать антитела, которые лизируют эритроциты и образуют видимые зоны гемолиза. Иммуностимулирующая активность препарата характеризуется индексом стимуляции (ИС). Величину ИС получают делением числа антителообразующих клеток селезёнки мышей, после инъекции препарата (опытная группа), на число антителообразующих клеток селезёнки мышей контрольной группы. Величина ИС, равная 2,0 и более свидетельствует о наличии иммунотропной активности исследуемого вещества. 2 ИССЛЕДОВАНИЯ В эксперименте использовали мышей линии F1 (СВА*С57/BL) массой 19–25 г. Постановка каждого опыта осуществлялась с использованием контрольной группы. В опытную и контрольную группу включали не менее 10 особей. Эксперименты проведены на 230 животных 4 поступлений из филиала «Андреевка» ГУ НЦБМТ РАМН (Крюково). Животные содержались в стандартных условиях вивария, на рационе, соответствующем действующим нормам (Приказ Минздрава СССР № 1179 от 14.10.83 года «Об утверждении нормативов затрат кормов для лабораторных животных в учреждениях здравоохранения»). Было проведено исследование иммунотропной активности двух серий сухой биомассы (серия 1 и серия 2). Так как сухая биомасса гриба практически не растворяется в воде, максимально измельченный гриб суспендировали в 1% растворе желатина. Методика выполнения эксперимента заключалась в следующем. За 100 часов (примерно четверо суток) до проведения опыта in vitro мышам внутрибрюшинно вводили биомассу в исследуемых концентрациях, в объёме 0,5 мл 1% раствора желатина. Через 30 мин. после введения испытуемого вещества проводили иммунизацию мышей. Животным вводили внутрибрюшинно 0,2% раствор эритроцитов барана в объёме 0,3 мл. За период экспериментальных исследований проведено 8 опытов. Кроме вычисления индекса стимуляции, характеризующего иммуностимулирующую активность биомассы, определяли массу тела и иммунокомпетентных органов (тимуса и селезёнки). Подсчитывали величину их относительной массы (ОМТ и ОМС соответственно), которую вычисляли по следующей формуле: Относительная масса м—масса соответствующего органа, мг; М—масса тела, г. м 100% , где М 3 Это позволяет получить дополнительную информацию о реакции иммунной системы мышей на введение различных концентраций грибной биомассы. В начале эксперимента в выборе концентрации раствора биомассы, вводимого внутрибрюшинно, опирались на данные отчета ГНЦА «Материалы по обоснованию ПДК в воздухе рабочей зоны препарата «Витакор» (вкусовая добавка на основе биомассы Trametes) 1995 года. Согласно материалам отчёта, концентрация витакора, вводимого внутрибрюшинно мышам, составляла 60 мг/мл (30 мг/мышь). Однако, при введении нами биомассы в концентрации 50 мг/мл, т.е. 25 мг/мышь, 7 из 10 иммунизированных мышей на третьи сутки погибли. В связи с этим возникла необходимость определить диапазон оптимальных концентраций, позволяющих с большей эффективностью проводить эксперименты. Для этого были изучены следующие концентрации: 0,1 мг/мл, 0,75 мг/мл, 1,5 мг/мл, 3 мг/мл, 6 мг/мл, т.е. 0,05 мг/мышь, 0,375 мг/мышь, 0,75 мг/мышь, 1,5 мг/мышь, 3 мг/мышь соответственно (таблицы 1–5). Серия 1 биомассы была исследована во всех вышеперечисленных концентрациях. В таблице 1 отражены данные, полученные на трёх мышах, оставшихся на четвёртые сутки после однократного введения им раствора биомассы в концентрации 50 мг/мл (25 мг/мышь). Величина ИС, полученная в опыте, проведенном на выживших мышах, равнялась двум. Однако из-за небольшого числа животных, эту величину мы рассматривали как ориентировочную и требующую уточнения. В дальнейшем, с целью предотвращения гибели животных и поиска оптимальных концентраций, их последовательно снижали, начиная с 6,0 мг/мл до 0,1 мг/мл (3,0–0,05 мг/мышь). Гибели животных при введении данных доз не наблюдали. Как видно из таблицы 1, после введения биомассы с концентрацией 6,0 мг/мл (3,0 мг/мышь) величина ИС была ниже 2. Поэтому, данная концентрация была исключена из исследований. 4 Дальнейшие эксперименты планировали таким образом, чтобы в одном опыте изучить несколько концентраций грибной биомассы одновременно. Это позволяло проверить достаточно широкий диапазон доз в одинаковых экспериментальных условиях при максимально эффективном использовании животных. Так как эксперименты выполняли на животных разных дат поступления из питомника, действие одной и той же концентрации препарата на гуморальный иммунный ответ исследовали несколько раз. Это способствовало получению более точных объединённых результатов. В таблицах 2– 4 представлены данные, отражающие реакцию мышей на введение раствора биомассы в концентрации 3,0, 1,5 и 0,75 мг/мл (1,5; 0,75; 0,375 мг/мышь) соответственно. Как следует из таблиц 2 и 3, препарат в концентрации 3,0 и 1,5 мг/мл (1,5 и 0,375 мг/мышь) обладает иммуностимулирующим действием, о чём свидетельствуют величины ИС. Наибольшая средняя величина ИС (2,7) получена при введении раствора биомассы в концентрации 3,0 мг/мл (1,5 мг/мышь). Для определения нижней границы диапазона разведений препарата, влияющих на гуморальный иммунный ответ мышей, было проведено одновременное исследование действия препарата в концентрации 0,75 и 0,1 мг/мл, т.е. 0,375 и 0,05 мг/мышь (таблицы 4 и 5). Результаты этого опыта показали, что величины ИС в исследуемых концентрациях биомассы составили 1,1 и 0,59 соответственно, т.е. в данных разведениях иммуностимулирующего эффекта обнаружено не было. По результатам шести экспериментов, в которых исследовали биомассу в концентрации 0,75 мг/мл (0,375 мг/мышь), среднее значение ИС составило 1,8, т.е. было меньше двух. Иммунотропное действие биомассы серии 2, хранившейся в течение пяти лет, изучали в концентрации 3,0 мг/мл, т.е. 1,5 мг/мышь (таблица 6). Полученная величина ИС была практически равна ИС, вычисленной при исследовании серии 1 в этой концентрации (2,5 и 2,7 соответственно). Это сви- 5 детельствует о том, что данная серия обладает иммуностимулирующей активностью. Наряду с определением ИС, для каждой группы животных, получавших определённую дозу препарата, проводили сравнение средней массы селезёнки и тимуса с массой иммунокомпетентных органов контрольных мышей, и выражали разницу в процентах. Полученные в этих опытах обобщённые результаты представлены в таблице 7. Таблица 7. Средние показатели, отражающие биологическую активность трамелана в зависимости от его разведений. Показатели Разность в опыте и контроле, % Концентрация трамелана, мг/мл 0,10 0,75 1,50 3,00 6,00 ИС 0,59 1,82 2,50 2,70 1,58 Масса селезёнки Масса тимуса 19,0 25,5 47,8 39,4 22,0 –8,9 –8,7 –21,3 –32,8 –28,8 Для того, чтобы проверить наличие зависимости трёх указанных в таблице показателей от концентрации биомассы, был проведён графический анализ данных с помощью программы «Statistica 6.0». Для каждого показателя был установлен диапазон концентраций, в котором наблюдался дозозависимый эффект (таблица 8). 6 Таблица 1. Изучение иммунотропного действия биомассы в дозах 25,0 и 3,0 мг/мышь Концентра ция биомассы, мг/мл Контроль (эритроциты) Масса тела, г Селезёнка Опыт (биомасса) Тимус Масса, мг ОМС Масса, мг ОМТ Масса тела, г Селезёнка Тимус Масса, мг ОМС Масса, мг ОМТ Разность в опыте и контроле, % Масса Масса Масса тела селетимуса зёнки ИС 50 21,3 75,0 3,5 34,0 1,6 20,4 88,0 4,3 29,0 1,4 –4,1 +3,5 –14,7 2,1 6 24,7 145,0 5,9 30,9 1,3 22,0 177,0 8,1 22,0 1,0 –10,9 +22,1 –28,8 1,58 7 Таблица 2. Изучение иммунотропного действия биомассы в дозе 1,5 мг/мышь (3,0 мг/мл) № п/п Контроль (эритроциты) Масса тела, г Селезёнка Опыт (биомасса) Тимус Масса, мг ОМС Масса, мг ОМТ Масса тела, г Селезёнка Тимус Масса, мг ОМС Масса, мг ОМТ Разность в опыте и контроле, % Масса Масса Масса тела селетимуса зёнки ИС 1. 24,6 119,0 4,8 31,7 1,3 23,3 150,0 6,42 20,0 0,9 –5,3 +26,1 –36,9 3,4 2. 22,5 89,0 4,0 41,3 1,8 19,92 161,0 8,1 25,5 1,3 –11,5 +80,1 –38,3 3,0 3. 21,4 104,0 4,9 44,7 2,1 19,2 128,0 6,7 21,9 1,1 –10,3 +26,7 –51,0 1,3 4. 24,7 109,0 4,4 30,4 1,2 24,9 137,0 5,48 23,4 0,9 +0,8 +25,7 –23,0 – 5. 25,5 120,0 4,8 29,0 1,2 25,3 169,0 6,85 28,0 1,1 –0,8 +40,8 –3,5 2,9 23,7 108,2 4,6 35,4 1,5 22,5 149,0 6,7 23,8 1,1 –5,4 +39,9 –30,5 2,7 Среднее значение 8 Таблица 3. Изучение иммунотропного действия биомассы в дозе 0,75 мг/мышь (1,5 мг/мл) № п/п Контроль (эритроциты) Масса тела, г Селезёнка Опыт (биомасса) Тимус Масса, мг ОМС Масса, мг ОМТ Масса тела, г Селезёнка Тимус Масса, мг ОМС Масса, мг ОМТ Разность в опыте и контроле, % Масса Масса Масса тела селе- тимуса зёнки ИС 1. 24,6 119,0 4,8 31,7 1,3 24,2 194,0 8,0 24,6 1,0 –1,6 +63,0 –22,4 2,6 2. 19,9 98,3 4,9 48,6 2,4 17,4 137,0 7,9 39,0 2,2 –12,6 +39,4 –19,8 2,7 3. 4. 5. 6. Среднее значение 22,5 21,4 24,7 25,5 23,1 89,0 104,0 109,0 120,0 106,6 4,0 4,9 4,4 4,8 4,6 41,3 44,7 30,4 29,0 37,6 1,8 2,1 1,2 1,2 1,7 21,7 19,4 23,8 25,4 22,0 153,0 146,0 123,0 192,0 158,0 7,0 7,5 5,2 6,5 7,0 42,9 21,3 29,5 20,0 29,6 2,0 1,1 1,3 0,7 1,4 –3,6 –9,3 –3,6 –0,4 –5,2 +71,9 +40,4 +12,8 +60,0 +47,9 +3,9 –52,3 –3,0 –31,0 –20,8 2,4 2,6 – 2,0 2,5 9 Таблица 4. Изучение иммунотропного действия биомассы в дозе 0,375 мг/мышь (0,75 мг/мл) № п/п Контроль (эритроциты) Масса тела, г Селезёнка Опыт (биомасса) Тимус Масса, мг ОМС Масса, мг ОМТ Масса тела, г Селезёнка Тимус Масса, мг ОМС Масса, мг ОМТ Разность в опыте и контроле, % Масса Масса Масса тела селетимуса зёнки ИС 1. 19,9 98,3 4,9 48,6 2,4 20,4 116,0 5,7 44,6 2,2 +2,5 +18,0 –8,2 2,3 2. 22,5 89,0 4,0 41,3 1,8 21,5 128,0 6,0 42,4 2,0 –4,4 +43,8 +2,7 1,6 3. 21,4 104,0 4,9 44,7 2,1 19,6 129,0 6,6 36,9 1,9 –8,4 +24,0 –17,4 2,1 4. 24,7 109,0 4,4 30,4 1,2 24,9 132,0 5,3 24,0 1,0 +0,8 +21,1 –21,1 – 5. 25,5 120,0 4,8 29,0 1,2 23,6 154,0 6,8 26,0 1,2 –7,5 +28,3 –10,3 2,0 6. 21,9 103,1 4,8 41,7 1,9 22,0 123,0 6,2 41,4 1,9 +0,5 +19,3 –0,7 1,1 Среднее значение 22,7 103,9 4,6 39,3 1,8 22,0 130,0 6,1 35,9 1,7 –2,8 +25,8 –9,2 1,8 10 Таблица 5. Изучение иммунотропного действия биомассы в дозе 0,1 мг/мышь (0,2 мг/мл) № п/п Контроль (эритроциты) Масса тела, г 1. 21,9 Селезёнка Опыт (биомассы) Тимус Масса, мг ОМС Масса, мг ОМТ Масса тела, г 103,7 4,8 41,7 1,9 21,8 Селезёнка Тимус Масса, мг ОМС Масса, мг ОМТ 123,0 5,7 38,0 1,8 Разность в опыте и контроле, % Масса Масса Масса тела селетимуса зёнки –0,5 +19,0 –8,9 ИС 0,59 11 Таблица 6. Изучение иммунотропного действия биомассы серии 2 (2000 г.) в дозе 1,5 мг/мышь (3,0 мг/мл) № п/п Контроль (эритроциты) Масса тела, г Селезёнка Опыт (биомасса) Тимус Масса, мг ОМС Масса, мг ОМТ Масса тела, г Селезёнка Тимус Масса тела Масса селезёнки Масса тимуса ОМТ Разность в опыте и контроле, % Масса Масса Масса тела селезён- тимуса ки ИС 1. 24,7 109,0 4,4 30,4 1,2 24,6 148,0 5,8 22,5 0,9 –0,4 +35,8 –26,0 – 2. 25,5 120,0 4,8 29,0 1,2 24,7 158,0 6,5 17,0 0,7 –3,1 +31,7 –41,4 2,5 Среднее значение 25,2 114,5 4,6 29,7 1,2 24,65 153,0 6,2 19,8 0,8 –1,8 +33,8 –33,7 2,5 12 Для оценки значимости данной зависимости, был проведён корреляционный анализ. Его результаты также представлены в таблице 8. Таблица 8. Коэффициенты корреляции r, между полученными показателями и концентрацией вводимого раствора биомассы ИС (0,1–3,0 мг/мл) Коэффициенты корреляции r, p<0,05 Разность в опыте и контроле, % Масса селезёнки Масса тимуса (0,1–1,5 мг/мл) (0,75–3,0 мг/мл) –0,96 0,92 –0,98 Значения коэффициентов корреляции говорят о том, что в указанных в таблице диапазонах концентраций имеется значимая зависимость всех трёх показателей от концентрации биомассы (для ИС—прямая, а для остальных двух показателей—обратная, p<0,05). Наряду с этим с помощью корреляционного анализа («Statistica 6.0») была проанализирована взаимосвязь между ИС, разностью массы селезёнки и тимуса в опыте и контроле. Полученные результаты представлены на рис.1– 3. Разность массы селезёнки между опытными и контрольными группами, % r = 0.72151 50 40 30 20 10 0 0.4 0.6 0.8 1.0 1.2 1.4 1.6 ИС Рис.1. 1.8 2.0 2.2 2.4 2.6 95% confidence 2.8 13 r = -0.6784 Разность массы тимуса между опытными и контрольными группами, % 20 10 0 -10 -20 -30 -40 -50 0.4 0.6 0.8 1.0 1.2 1.4 1.6 1.8 2.0 2.2 2.4 2.6 2.8 95% confidence ИС Рис.2. 95% confidence Разность массы тимуса между опытными и контрольными группами, % r = -0.4484 0 -10 -20 -30 -40 -50 15 20 25 30 35 40 45 50 Разность массы селезёнки между опытными и контрольными группами, % Рис.3. Корреляционный анализ не выявил статистически значимую зависимость трёх вышеуказанных показателей в диапазоне концентраций биомассы 0,1–6,0 мг/мл, т.е. 0,05–3,0 мг/мышь (таблица 9). Данная таблица представляет собой корреляционную матрицу и построена таким образом, что коэффициенты корреляции, характеризующие взаимосвязь между двумя конкретными показателями, расположены в ячейках, соответствующих точке их пересечения. 14 Таблица 9. Коэффициенты корреляции r между показателями, характеризующими биологическую активность биомассы Показатели Коэффициенты корреляции r для пяти концентраций биомассы 0,1–6,0 мг/мл (0,05–3,0 мг/мышь) Разность массы сеРазность массы тилезёнки между муса между опытИС опытными и конными и контрольтрольными ными группами, % группами, % ИС 1 0,721506 –0,67843 Разность массы селезёнки между опытными и контрольными группами, % 0,721506 1 –0,4484 Разность массы тимуса между опытными и контрольными группами, % –0,67843 –0,4484 1 Ввиду отсутствия линейной корреляции между показателями, отражающими его биологическую активность, можно предположить, что действие биомассы в исследованных дозах не ограничивается только влиянием на гуморальный иммунный ответ, но возможно, оказывает также гемостимулирующий эффект, о чём свидетельствует наблюдаемый прирост массы селезёнки в опытных группах. Для проверки гипотезы о возможном гемостимулирующем действии биомассы, опыты были продолжены с использованием модели иммунодепрессии у мышей, вызванной цитостатиком (циклофосфаном). Использование данной модели позволяет выяснить, какое влияние оказывает биомасса на поврежденную лимфоидную ткань при её восстановлении. В проведённых экспериментах подбирали оптимальные условия для выявления гемостимулирующего эффекта биомассы: исследовали как ее концентрации, так и продолжительность опыта. Ввиду того, что работу вы- 15 полняли в течение нескольких месяцев, в опыте использовали мышей с различными датами поступления из питомника. В связи с этим, у животных наблюдались некоторые различия в силе иммунного ответа на введение одной и той же дозы биомассы. Схема проведения эксперимента была следующей. В опыт брали три группы белых мышей обоего пола с массой тела 27–33 г (не менее 10 особей в каждой группе). Группа 1—интактный контроль, который служил фоном для оценки ингибирующего действия циклофосфана (ЦФ) в процессе развития иммунодепрессии у мышей. Группы 2 и 3—контрольная и опытная соответственно. Мышам контрольной группы однократно подкожно вводили раствор ЦФ в дозе 250 мг/кг. Группе 3 последовательно вводили сначала подкожно ЦФ в той же дозе, что и контрольным животным, а затем внутрибрюшинно биомассу в 1% растворе желатина (0,5 мл на животное) в дозах 12,5 мг/мышь, 3,0 мг/мышь, 1,5 мг/мышь и 0,75 мг/мышь. Мышей усыпляли эфирным наркозом. Вскрытие животных осуществляли в разные сроки от момента последовательного введения циклофосфана и биомассы. У животных определяли массу тела (в начале и в конце опыта), а также взвешивали селезёнку и тимус на электронных весах «Sartorius» с точностью до 1 мг. Для каждого животного вычисляли величину ОМС и ОМТ. Препарат считали биологически активным, если величины ОМС и ОМТ в опытной группе были не менее чем на 20% больше, чем в контрольной. Результаты опытов представлены в таблицах 10–12. Всего было поставлено десять опытов на 330 животных. Наиболее подробно изучена биомасса серии 1 в дозе 12,5 мг/мышь. В пяти экспериментах, выполненных на самцах и самках разных поступлений, после однократного введения ЦФ в дозе 250 мг/кг и раствора биомассы в дозе 12,5 мг/мышь проводили вскрытие животных в разные интервалы времени. В двух из пяти опытов животных вскрывали через 2 дня, еще в двух—через 3 и в одном—через пять дней после начала эксперимента (таблица 10). 16 Как следует из таблицы, на второй и третий день после начала эксперимента в опытной и контрольной группе, как у самцов, так и у самок наблюдалось резкое снижение массы селезёнки и тимуса по сравнению с интактным контролем. При этом в опытных группах отмечена тенденция к большему, чем в контроле, снижению массы тимуса, и, в большинстве случаев, менее выраженному снижению массы селезёнки. На пятые сутки (начало интенсивного восстановления гемопоэтической и лимфоидной ткани), было обнаружено, что у мышей опытной группы масса селезёнки и ОМС больше, чем в контрольной, получавшей только ЦФ (p<0,05), т.е. они практически сравнялись с интактным контролем. Полученный факт позволяет предположить, что биомасса в исследуемой дозе может способствовать более быстрому восстановлению лимфоидной ткани. Выраженный гемостимулирующий эффект был обнаружен также в эксперименте, где животным одновременно с ЦФ вводили раствор биомассы в дозе 3 мг/мышь (таблица 11). У этих животных масса селезёнки на пятые сутки была выше на 128% по сравнению с контрольными (ЦФ) (p<0,05). Вскрытие животных на шестые сутки после введения биомассы в дозе 1,5 мг/мышь показало увеличение средней массы селезёнки на 18% по сравнению с контролем, получавшим ЦФ (таблица 11). Гемостимулирующее действие биомассы исследовали также в дозе 0,75 мг/мышь в трех опытах через 5, 6, и 8 дней от начала эксперимента (таблица 11). В опыте, где вскрытие мышей проводили на пятые сутки от момента развития иммунодепрессии, масса селезёнки увеличилась на 38% по сравнению с животными, получившими ЦФ (p<0,05), но не достигла средней величины массы селезёнки интактных животных. Анализ результатов следующего эксперимента показал, что на шестые сутки масса селезёнки в опытной группе, получившей биомассу в дозе 0,75 мг/мышь, всё ещё оставалась выше по отношению к массе селезёнки контрольной группы, но процент увеличения был значительно меньше (9%). В третьем эксперименте, где забой мышей проводили на восьмые сутки, определить гемостимулирующий эффект 17 биомассы не удалось, так как наблюдался известный феномен «овершюта», когда масса селезёнки у мышей, получивших ЦФ, становится выше, чем у интактных животных. Это связано со «сверхрегенерацией» гемопоэтической и лимфоидной ткани после повреждения и гибели значительного числа клеток в результате цитотоксического действия ЦФ. Развитие процесса «овершюта», как видно из таблицы 11, нивелирует обнаруженные на пятые и шестые сутки различия в массе селезёнки, у контрольных и опытных мышей в исследуемых ранее дозах. В рамках данной серии экспериментов проведено исследование, в ходе которого в течение 8 дней мышам с иммунодепрессией осуществляли ежедневное пероральное введение раствора биомассы в дозе 2,5 мг/мышь (таблица 12). Как видно из таблицы, введение биомассы внутрь вызывает увеличение массы селезёнки и ОМС по сравнению с контрольной группой. Однако для получения достоверных данных о гемостимулирующем действии биомассы, как и при внутрибрюшинном введении, целесообразнее было провести вскрытие мышей в более ранние сроки (до развития процесса «овершюта», который, как уже сказано, выше сглаживает различия между опытными и контрольными группами). На основании данных, полученных при внутрибрюшинном введении биомассы и ЦФ в дозе 250 мг/кг, можно заключить, что для оценки ее эффективности наиболее перспективными оказались пятые сутки с момента введения циклофосфана и биомассы гриба. 18 Таблица 10. Изучение иммунотропного действия биомассы при одновременном введении циклофосфана Продолжительность опыта в сутках и пол животных 2, самки 2, самцы 3, самки 3, самцы 5, самки Доза трамелана, мг/мышь Контроль (интактный) Контроль (ЦФ 250 мг/кг) Опыт (трамелан на фоне ЦФ 250 мг/кг) Масса селезёнки, мг ОМС Масса тимуса, мг ОМТ Масса тела, г Масса селезёнки, мг ОМС Масса тимуса, мг ОМТ Снижение массы тела, г* Масса селезёнки, мг** ОМС Масса тимуса, мг** ОМТ Снижение массы тела, г* 12,5 191,0 6,9 43,5 1,6 28,0 81,3 3,0 33,4 1,3 6,7 40,5 1,5 27,5 52,7 2,1 18,2 0,7 12,5 175,3 5,7 48,0 1,6 31,0 89,1 3,1 21,5 0,7 12,5 119,3 3,7 39,8 1,3 32,0 70,4 2,3 26,8 0,9 12,5 264,4 8,0 64,0 1,9 33,2 228,0 5,0 35,5 1,0 22,5 (–32,7%) 11,0 (–40%) 13,2 (–39%) 5,20 (–81%) 30,3 (–15%) 0,94 183,0 84,5 (+3,9%) 57,8 (+10%) 78,1 (–12%) 77,6 (+10%) 260 (+14%) 3,5 12,5 0,8 (3%) 0,8 (3%) 0,8 (2%) 0,9 (3%) 0,8 (2%) 2,8 (10%) 3,1 (11%) 2,9 (9%) 5,4 (17%) 2,5 (7,5%) * В скобках указана разность средней массы тела по сравнению с интактным контролем, в %. ** В скобках указана разность средней массы органа по сравнению с контролем, в % (ЦФ 250 мг/кг). 2,7 2,9 3,0 8,3 0,50 0,66 0,20 0,96 19 Таблица 11. Изучение иммунотропного действия биомассы на фоне однократного введения циклофосфана Продолжительность опыта в сутках и пол животных 5, самки 6, самки 5, самки 6, самки 8, самки Доза биомассы, мг/мышь Контроль (интактный) Контроль (ЦФ 250 мг/кг) Масса селезёнки, мг ОМС Масса тимуса, мг ОМТ Масса тела, г Масса селезёнки, мг ОМС Масса тимуса, мг ОМТ 3,0 275,0 11,2 58,0 2,4 25,0 127,0 5,6 25,0 1,1 1,5 176,0 5,2 65,9 1,9 34,5 132,0 4,3 27,0 0,9 0,75 119,0 3,9 33,0 1,1 31,0 75,7 2,4 14,0 0,5 0,75 292,5 10,3 62,0 2,2 28,5 114,5 3,7 19,7 0,8 0,75 173,0 5,4 43,0 1,3 34,0 343,0 10,0 33,3 1,0 Опыт (биомасса на фоне ЦФ 250 мг/кг) Снижение массы тела, г* 2,6 (10%) 1,6 (5%) 1,0 (3%) 0,0 1,6 (5%) Масса селезёнки, мг** ОМС Масса тимуса, мг** ОМТ 290,0 (+128%) 156,0 (+18%) 104,3 (+38%) 125,0 (+9%) 342,0 (0%) 12,0 22,5 (–10%) 29,7 (+10%) 18,3 (+30%) 15,4 (–22%) 24,7 (–26%) 0,98 * В скобках указана разность средней массы тела по сравнению с интактным контролем, в %. ** В скобках указана разность средней массы органа по сравнению с контролем, в % (ЦФ 250 мг/кг). 5,7 3,7 4,7 11,0 1,10 0,64 0,59 0,83 Снижение массы тела, г* 2,2 (9%) 2,6 (8%) 1,2 (4%) 3,0 (10%) 2,2 (6%) 20 Таблица 12. Изучение иммунотропного действия биомассы при ежедневном введении внутрь на фоне иммунодепрессии Продолжительность опыта, сут. Дозабиомассы, мг/мышь 8. 2,5 Контроль (интактный) Контроль (ЦФ 250 мг/кг) Опыт (биомасса на фоне ЦФ 250 мг/кг) Масса селезёнки, мг ОМС Масса тимуса, мг ОМТ Масса тела, г Масса селезёнки, мг ОМС Масса тимуса, мг ОМТ Снижение массы тела, г* Масса селезёнки, мг** ОМС Масса тимуса, мг** ОМТ Снижение массы тела, г* 143,5 4,7 36,0 1,2 31,6 259,0 7,9 32,8 1,0 1,0 (3%) 274,0 (+6%) 9,5 26,5 (–19%) 0,9 4,1 (13%) * В скобках указана разность средней массы тела по сравнению с интактным контролем, в %. ** В скобках указана разность средней массы органа по сравнению с контролем, в % (ЦФ 250 мг/кг). 21 Заключение Биологическая активность гриба Trametes (Coriolus) pubescens была изучена с использованием двух экспериментальных моделей. 1. При оценке иммунотропной активности биомассы установлено, что в диапазоне концентраций 1,5–3,0 мг/мл (0,75–1,5 мг/мышь) она обладает иммуностимулирующим действием (оказывает влияние на гуморальный иммунный ответ). Об этом свидетельствует величина ИС, которая составляет 2,5–2,7. 2. Выяснено, что биомасса серии 2, хранившаяся в архиве в течение пяти лет, сохраняет иммунотропную активность на исходном уровне. 3. На модели с иммунодепрессией установлено, что грибная биомасса в исследуемых дозах обладает выраженной гемостимулирующей активностью, о чем свидетельствует более интенсивное восстановление массы селезёнки у опытных животных по сравнению с контролем. Литература 1. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ./Минздрав РФ, ЗАО «ИИА «Ремедиум», М.: 2000 г.