Приложение № 2 комиссии Министерства образования и науки Российской
advertisement
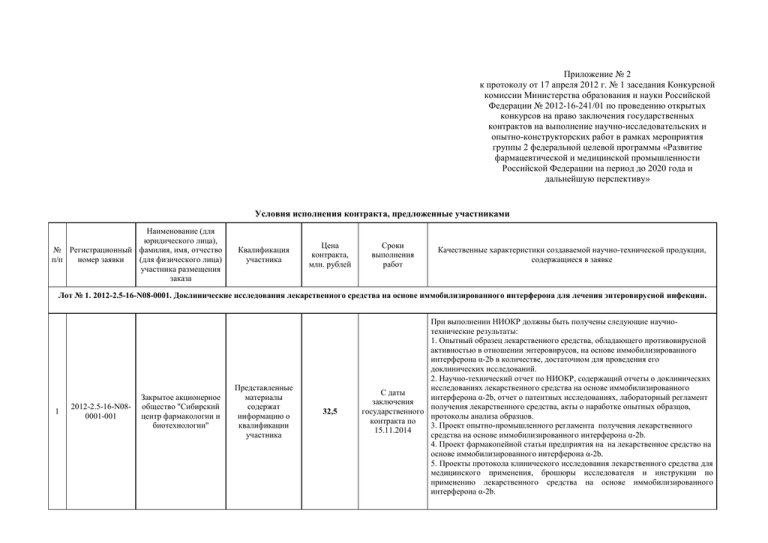
Приложение № 2 к протоколу от 17 апреля 2012 г. № 1 заседания Конкурсной комиссии Министерства образования и науки Российской Федерации № 2012-16-241/01 по проведению открытых конкурсов на право заключения государственных контрактов на выполнение научно-исследовательских и опытно-конструкторских работ в рамках мероприятия группы 2 федеральной целевой программы «Развитие фармацевтической и медицинской промышленности Российской Федерации на период до 2020 года и дальнейшую перспективу» Условия исполнения контракта, предложенные участниками Наименование (для юридического лица), № Регистрационный фамилия, имя, отчество п/п номер заявки (для физического лица) участника размещения заказа Квалификация участника Цена контракта, млн. рублей Сроки выполнения работ Качественные характеристики создаваемой научно-технической продукции, содержащиеся в заявке Лот № 1. 2012-2.5-16-N08-0001. Доклинические исследования лекарственного средства на основе иммобилизированного интерферона для лечения энтеровирусной инфекции. 1 2012-2.5-16-N080001-001 Закрытое акционерное общество "Сибирский центр фармакологии и биотехнологии" Представленные материалы содержат информацию о квалификации участника 32,5 При выполнении НИОКР должны быть получены следующие научнотехнические результаты: 1. Опытный образец лекарственного средства, обладающего противовирусной активностью в отношении энтеровирусов, на основе иммобилизированного интерферона α-2b в количестве, достаточном для проведения его доклинических исследований. 2. Научно-технический отчет по НИОКР, содержащий отчеты о доклинических исследованиях лекарственного средства на основе иммобилизированного С даты интерферона α-2b, отчет о патентных исследованиях, лабораторный регламент заключения получения лекарственного средства, акты о наработке опытных образцов, государственного протоколы анализа образцов. контракта по 3. Проект опытно-промышленного регламента получения лекарственного 15.11.2014 средства на основе иммобилизированного интерферона α-2b. 4. Проект фармакопейной статьи предприятия на на лекарственное средство на основе иммобилизированного интерферона α-2b. 5. Проекты протокола клинического исследования лекарственного средства для медицинского применения, брошюры исследователя и инструкции по применению лекарственного средства на основе иммобилизированного интерферона α-2b. Лот № 2. 2012-2.5-16-N08-0002. Доклинические исследования лекарственного средства для экстренной профилактики бешенства на основе терапевтических моноклональных антител. 2 2012-2.5-16-N080002-002 Открытое акционерное общество "Всероссийский научный центр молекулярной диагностики и лечения" Представленные материалы содержат информацию о квалификации участника 33 В рамках НИОКР будут проведены доклинические исследования специфической активности, безопасности, фармакокинетики и др. лекарственного средства на основе гуманизированных моноклональных антител против гликопротеина вируса бешенства для экстренной профилактики бешенства. На основе полученных экспериментальных данных будет С даты разработан лабораторный регламент получения лекарственного средства; заключения проект опытно-промышленного регламента получения лекарственного государственного средства; проект фармакопейной статьи на лекарственное средство; проект контракта по протокола клинического исследования лекарственного средства для 15.11.2014 медицинского применения, проект брошюры исследователя и проект инструкции по применению лекарственного средства. В результате выполнения НИОКР будет создана технология получения лекарственного средства "Рекомбинантные гуманизированные антирабические антитела для экстренной профилактики бешенства" фармакопейного качества Лот № 3. 2012-2.5-16-N08-0003. Доклинические исследования инновационного лекарственного средства, на основе производного малоновой кислоты, обладающего антиоксидантным и антиишемическим действием на миокард. 3 2012-2.5-16-N080003-003 Государственное бюджетное образовательное учреждение высшего профессионального образования "СанктПетербургская государственная химикофармацевтическая академия" Министерства здравоохранения и социального развития Российской Федерации Представленные материалы содержат информацию о квалификации участника 31,7 В рамках НИОКР будут проведены доклинические исследования специфической активности и безопасности лекарственного средства (далее – ЛС) на основе производного малоновой кислоты, обладающего антиоксидантным и антиишемическим действием на миокард. Разрабатываемое лекарственное средство будет эффективным для лечения ишемической болезни сердца и хронической сердечной недостаточности. С даты Разрабатываемое лекарственное средство будет удовлетворять следующим заключения требованиям: государственного - по механизму действия – предотвращать прямое повреждающее действие контракта по продуктов ПОЛ (перекисное окисление липидов) на миокард, повышать 15.11.2014 эффективность использования кислорода кардиомиоцитами, предупреждать ишемические и реперфузионные повреждения сердечной мышцы; - по безопасности – не обладать токсичностью и реактогенностью; соответствовать требованиям 4 класса опасности «вещества малоопасные» (ГОСТ 12.1.007-76 «Вредные вещества»); - по структуре - представлять собой индивидуальное органическое соединение, производное малоновой кислоты с молекулярной массой 251. Лот № 4. 2012-2.5-16-N08-0004. Доклинические исследования гемостатического лекарственного средства на основе синтетического трипептидного фрагмента ингибитора плазмина. 4 2012-2.5-16-N080004-014 Федеральное государственное унитарное предприятие "Государственный научноисследовательский институт генетики и Представленные материалы содержат информацию о квалификации участника 33 С даты заключения государственного контракта по 15.11.2014 Будет наработана опытная партия пептидной лекарственной субстанции. Будет оптимизирован способ синтеза пептидной лекарственной субстанции. Будут разработаны методы анализа пептидной субстанции и способы получения стерильной пептидной субстанции. Будет разработана лабораторная методика и протокол выделения и очистки акадезина. Будет разработана технология масштабирования метода наработки пептидной лекарственной субстанции и план доклинических исследований лекарственного средства. селекции промышленных микроорганизмов" Будет определена зависимость гемостатического эффекта от дозы и длительности применения лекарственного средства проведены доклинические испытания пептидного лекарственного средства как кандидата в гемостатические препараты местного действия. Будет разработан лабораторный регламент получения пептидной субстанции. Будут разработаны проекты технологической и нормативно-технической документации на пептидную субстанцию и лекарственную форму гемостатического лекарственного средства, в т.ч. проект опытнопромышленного регламента. Будет разработан проект фармокопейной статьи предприятия на лекарственную субстанцию и лекарственную форму. Будет разработан проект протокола клинических исследований лекарственного средства. Будет разработан проект инструкции по применению лекарственного средства Лот № 5. 2012-2.5-16-N08-0005. Доклинические исследования нового лимфотропного радиофармацевтического препарата на основе меченого технецием-99m гамма-оксида алюминия. 5 2012-2.5-16-N080005-004 Федеральное государственное бюджетное учреждение "Научноисследовательский институт онкологии" Сибирского отделения Российской академии медицинских наук Представленные материалы содержат информацию о квалификации участника 33 С даты заключения Разработка радиофармпрепарата на основе оксида алюминия, меченого государственного Технецием-99м. контракта по 15.11.2014 Лот № 6. 2012-2.5-16-N08-0006. Доклинические исследования лекарственного средства, на основе a(1,2)-L-рамно-a(1,4)-D-галактопиранозилуронана Acorus calamus L., снижающего гематотоксичность и повышающего противоопухолевую и антиметастатическую активность цитостатических препаратов. 6 2012-2.5-16-N080006-005 Государственное бюджетное образовательное учреждение высшего профессионального образования "Сибирский государственный медицинский университет" Министерства здравоохранения и социального развития Российской Федерации Представленные материалы содержат информацию о квалификации участника 33 С даты заключения государственного контракта по 15.11.2014 Будут разработаны отчеты по результатам доклинического исследования специфической активности, фармакокинетики, острой, хронической токсичности и специфических видов токсичности; опытно-промышленный регламент на производство лекарственного средства на основе a(1,2)-L-рамноa(1,4)-D-галактопиранозилуронана Acorus calamus L.; проект Протокола клинических исследований препарата на основе a(1,2)-L-рамно-a(1,4)-Dгалактопиранозилуронана Acorus calamus L. Лот № 7. 2012-2.5-16-N08-0007. Доклинические исследования лекарственного средства пролонгированного действия на основе рекомбинантного аналога полноразмерного паратиреоидного гормона для лечения остеопороза. 7 2012-2.5-16-N080007-006 Федеральное государственное бюджетное учреждение Представленные материалы содержат информацию о 33 С даты заключения государственного контракта по Будет разработан лабораторный регламент получения лекарственного средства пролонгированного действия на основе рекомбинантного фрагмента паратиреоидного гормона состоящего из N-концевых 84 аминокислот (ПТГ (184)) и полимера олигосахаридной природы. На основе разработанного "Государственный научный центр "Институт иммунологии" Федерального медикобиологического агентства квалификации участника 15.11.2014 регламента будут проводиться все манипуляции по получению лекарственного средства в количестве, необходимом для проведения доклинических исследований. Будет синтезирован полимер олигосахаридной природы и проведена его активация. Полимер будет проанализирован методами хроматографии и массспектрометрии. Рекомбинантный белок-предшественник паратиреоидного гормона (ПТГ) будет наработан в ферментере. Индукция синтеза данного рекомбинантного белка будет проводиться с помощью βизопропилтиоглюкопиранозида (ИПТГ), что увеличит выход выход рекомбинантного белка. Наработка биомассы будет проходить селективно в присутствии антибиотика, что будет способствовать индукции синтеза только целевого продукта, что также улучшит выход рекомбинантного белка. Наличие белка в биомассе будет определяться методом электрофореза в полиакриламидном геле (ПААГ). Биомасса, содержащая целевой продукт, будет дезинтегрирована ультразвуком в присутствии ферментов и ингибиторов протеаз. Рекомбинантный белокпредшественник ПТГ будет очищен методами FPLC-хроматографии (Fast protein liquid chromatography – высокочувствительная белковая хроматография), такими как металл-афинная хроматография, катионобменная хроматография и гель-фильтрация. Детекция всех фракций на наличие целевого белка будет осуществляться с помощью хроматографов, оборудованных датчиками ультрафиолета (УФ) и рН. Полученные данные будут обрабатываться специализированными компьютерными программами. Фракции несущие целевой белок дополнительно будут проанализированы методом электрофореза в ПААГ. Рекомбинантный белок-предшественник будет расщеплен ферментами из семейства энтерокиназ, в результате чего образуется рекомбинантный ПТГ (184). Рекомбинантный ПТГ (1-84) будет выделен методами металл-афинной хроматографии. Очитка его будет осуществлена методами HPLC-хроматографии (High performance liquid chromatography - высокоэффективная жидкостная хроматография), а именно обращеннофазовой хроматографией. Детекция всех фракций на наличие рекомбинантного ПТГ (1-84) будет осуществляться с помощью хроматографов, оборудованных датчиками УФ и рН. Полученные данные будут обрабатываться специализированными компьютерными программами. Фракции несущие целевой белок дополнительно будут проанализированы методом электрофореза в ПААГ. Очищенный рекомбинантный ПТГ (1-84) будет оценен в массспектрометрическом анализе, ему будут сняты CD-спектры (Circular dichroism spectroscopy – спектроскопия кругового дихроизма). Т.о. будет показана его стабильность и подтверждена аминокислотная последовательность. Биологическая активность рекомбинантного ПТГ (1-84) будет оценена методом активации цАМФ на клеточной линии остеобластомы крысы. Рекомбинантный ПТГ (1-84) будет конъюгирован с полимером олигосахаридной природы, в результате чего будет получено лекарственное средство. Будет проведена очистка методами HPLC и FPLC-хроматографии лекарственного средства от не конъюгированых компонентов. Будут получены опытные образцы лекарственного средства. Будут разработаны методики количественного определения лекарственного средства. Так же будут разработаны методики количественного определения компонентов лекарственного средства и примесей, которые в дальнейшем будут включены в опытно-промышленный регламент (ОПР). С помощью разработанных методик будет проведен анализ опытных образцов лекарственного средства. Будут разработаны экспресс-методики определения подлинности полимера олигосахаридной природы, активированного полимера и рекомбинантного ПТГ (1-84) как компонентов лекарственного средства. Будут разработаны экспрессметодики определения подлинности лекарственного средства. Будут разработаны экспресс-методики определения биологической активности полимера олигосахаридной природы и ПТГ (1-84) как компонентов лекарственного средства. Будут разработаны экспресс-методики определения биологической активности самого лекарственного средства. Будут разработаны экспресс-методики оценки канцерогенности. В дальнейшем эти методики войдут в ОПР. Будет разработан план доклинических исследований согласно существующим методическим указаниям, нормам и ГОСТам. Будут проведены в строгом соответствии с разработанным планом доклинические исследования: изучение фармакокинетики лекарственного средства; изучение острой и хронической токсичности лекарственного средства; изучение иммунотоксического действия лекарственного средства при его однократном и курсовом введении; изучение биологической активности лекарственного средства на клеточных линиях по уровню цАМФ, фосфолипазы С и протеинкиназы С; изучение аллергизирующих свойств лекарственного средства; изучение иммуногенной активности лекарственного средства; изучение репродуктивной токсичности, мутагенности и канцерогенности лекарственного средства, а также изучение канцерогенности лекарственного средства в краткосрочных тестах. Будет разработан отчет о результатах доклинический исследований. Будет проведена оценка полученных результатов и их обобщение. Будет разработан проект опытно-промышленного регламента (ОПР) получения лекарственного средства, который будет включать, в том числе, все разработанные для него методики. Будет разработан проект фармакопейной статьи предприятия на лекарственное средство. Будет разработан проект протокола клинических исследований лекарственного средства для медицинского применения. Будет разработан проект брошюры исследователя. Будет разработан проект инструкции по применению лекарственного средства. В процессе выполнения НИР будут достигнуты следующие значения программных индикаторов и показателей: - будет получен 1 патент на результаты интеллектуальной деятельности; Для финансирования проекта будут привлечены внебюджетные средства в размере 11 000 000 рублей. Лот № 8. 2012-2.5-16-N08-0008. Доклинические исследования нового лекарственного средства на основе липополисахарида для предупреждения и лечения эндотоксинового шока. 8 2012-2.5-16-N080008-009 Федеральное государственное Представленные материалы 33 С даты заключения Доклинические характеристик, исследования определяющих специфической активности и других биологическую активность, а также бюджетное учреждение науки Институт фундаментальных проблем биологии Российской академии наук содержат информацию о квалификации участника государственного безопасности и фармакокинетики лекарственного препарата нового класса на контракта по основе липополихарида для лечения и предупреждения эндотоксинового шока. 15.11.2014 Лот № 9. 2012-2.5-16-N08-0009. Доклинические исследования лекарственного средства пролонгированного действия для лечения рассеянного склероза на основе рекомбинантного человеческого интерферона бета-1а. 9 2012-2.5-16-N080009-010 Закрытое акционерное общество "БИОКАД" Представленные материалы содержат информацию о квалификации участника 22,00044 Механизм действия препарата - Лекарственная форма должна способствовать ограничению повреждений ЦНС и обладать С даты пролонгированным эффектом. заключения Безопасность препарата - Лекарственная форма должна не обладать государственного токсичностью и реактогенностью. контракта по Молекулярная масса белка - Должна составлять более 38000 Дальтон. 15.11.2014 Модификация ИФН-бета - Должна проходить по свободным стерически доступным аминогруппам белка Чистота и гомогенность белка - Должна составлять более 90%. Лот № 10. 2012-2.5-16-N08-0010. Доклинические исследования лекарственного средства пролонгированного действия на основе рекомбинантного аналога интерферона альфа для лечения вирусных заболеваний. 10 11 2012-2.5-16-N080010-011 2012-2.5-16-N080010-013 Закрытое акционерное общество "БИОКАД" Федеральное государственное унитарное предприятие "Государственный научноисследовательский институт генетики и селекции промышленных микроорганизмов" Представленные материалы содержат информацию о квалификации участника Представленные материалы содержат информацию о квалификации участника 15,2448 - по механизму действия – должно быть аналогичным интерферону альфа - по безопасности – не обладать токсичностью и реактогенностью; С даты - по времени действия – должно превосходить немодифицированный заключения рекомбинантный альфа интерферон государственного - по структуре – представлять собой белок, включающий полную контракта по аминокислотную последова-тельность зрелого альфа интерферона человека и 15.11.2014 дополнительную оригинальную аминокис-лотную последовательность, обеспечивающую пролонгированное действие 33 1. При выполнении НИОКР будут получены следующие научно-технические результаты: Отчет о НИОКР, содержащий: - отчет о доклинических исследованиях эффективности, острой и хронической токсичности, иммунотоксичности, аллергенности, канцерогенности лекарственного средства; - обзор и анализ современной научно-технической, нормативной, методической литературы, затрагивающей научно-техническую проблему, исследуемую в С даты рамках НИОКР, в том числе обзор научных информационных источников: заключения государственного статьи в ведущих зарубежных и российских научных журналах, монографии и патенты - не менее 50 научно-информационных источников за период 2006 – контракта по 2011 г.г.; 23.11.2014 - отчет о патентных исследованиях. - план доклинических исследований лекарственного средства. Лабораторный регламент получения субстанции лекарственного средства; Акты о наработке опытных образцов субстанции и готовой лекарственной формы лекарственного средства для про-ведения доклинических исследований; Протоколы контроля качества опытных образцов субстанции и готовой лекарственной формы лекарственного средства. 2. При выполнении НИОКР будет создана следующая научно-техническая продукция: - опытные образцы в количестве, достаточном для проведения доклинических исследований лекарственного средства; - проект опытно-промышленного регламента получения лекарственного средства; - проект фармакопейной статьи предприятия на субстанцию; - проект фармакопейной статьи предприятия на готовую лекарственную форму; - проект протокола клинических исследований лекарственного средства для медицинского применения; - проект брошюры исследователя; - проект инструкции по применению лекарственного средства. Лот № 11. 2012-2.5-16-N08-0011. Доклинические исследования противоопухолевого лекарственного средства на основе хлорина Е6, снабженного эффективной системой доставки. 12 13 2012-2.5-16-N080011-007 2012-2.5-16-N080011-012 Федеральное государственное бюджетное учреждение "Научноисследовательский институт биомедицинской химии имени В.Н. Ореховича" Российской академии медицинских наук Федеральное государственное бюджетное учреждение науки Институт элементоорганических соединений им. А.Н.Несмеянова Российской академии наук Представленные материалы содержат информацию о квалификации участника Представленные материалы содержат информацию о квалификации участника 33 В ходе выполнения работ будут проведены доклинические исследования (специфической активности, острой и хронической токсичности и др.) оригинального противоопухолевого лекарственного средства на основе хлорина Е6, встроенного в фосфолипидные наночастицы предельно малого С даты размера как систему транспорта, для фотодинамической терапии рака кожи. заключения Разработка оптимального состава готовой формы лекарственного средства. государственного Планируется наработка опытной партии лекарственного средства и изучение контракта по физико-химических свойств разработанной композиции лекарственного 15.11.2014 средства: -исследование фармакокинетики разработанной композиции. -изучение биодоступности Также будет разработан комплект документов для клинического изучения препарата. 25 Фотодинамическая терапия (ФДТ) – одно из наиболее динамично развивающихся направлений противоопухолевой терапии. Действие ФДТ основано на облучении раковых клеток, содержащих фотосенсибилизатор, светом с определенной длиной волны. Образующиеся в опухолевой клетке свободные радикалы кислорода 1О2 при ФДТ обладают высоким терапевтическим потенциалом. Особенно важно, что сублетальные и потенциально летальные повреждения, наносимые этими частицами не С даты восстанавливаются – это позволяет использовать препарат для опухолей заключения (например, меланом и глиобластом) с высокой интенсивностью репаративных государственного процессов. Немаловажным свойством является и диагностическая функция контракта по данных соединений: после их введения в организм возможно определять 15.11.2014 наличие опухоли путем облучения и судить о ее границах. После введения фотосенсибилизаторов в клетки опухоли последняя подвергается облучению светом с длиной волны, возбуждающей данные соединения. Энергия света при этом должна быть подобрана таким образом, чтобы не происходило поражения находящихся рядом здоровых клеток. В настоящее время существует несколько официальных препаратов для ФДТ опухолей. Отдельную группу представляют препараты "Фотофрин I" и "Фотофрин II" (США), "Фотосан" (Германия), "Фотогем" (Россия), созданные на основе соединений порфиринового ряда и являющиеся близкими аналогами. Поиск новых фотосенсибилизаторов продолжается. В связи с этим большое внимание уделяется различным производным хлорофилла. Производные хлорофилла широко используются в клинической практике наряду с такими препаратами, как "Фотофрин-II". Эти же вещества используются как диагностические препараты в онкологии. Несмотря на высокую эффективность ряда синтезированных потенциальных противораковых соединений, остаются открытым вопрос о снижении их токсичности, поскольку большинство разработанных веществ при введении в организм проявляли нежелательные эффекты – тромбообразование, органную токсичность. Таким образом, вопрос о синтезе ФС, лишенных этих недостатков, остается открытым. Требуется разработка способов химической модификации структуры фотосенсибилизаторов для сохранения их высокой противоопухолевой активности и снижении побочного действия (оптимизация). Ранее нами был синтезировано новое соединение – амидное производное хлорина Е6, проявляющее свойства фотосенсибилизатора. Было показано, что данный фотосенсибилизатор обладает высокой токсичностью для культивируемых клеток рака легкого и лейкоза в сравнении с неопухолевыми фибробластами и при этом обладает низкой темновой токсичностью. Важным фактором эффективности фотосенсибилизатора является внутриклеточная локализация. Полученный фотосенсибилизатор накапливается преимущественно в митохондриях, аппарате Гольджи и эндоплазматическом ретикулуме, что позволяет фотосенсибилизатору действовать наиболее эффективно. Для снижения тоскичности и повышения стабильности разрабатываемого противоопухолевого препарата нами будет проведена инкапсуляция фотосенсибилизатора в липосомы из яичного фосфатидилхолина. Для придания большей устойчивости липосом в кровотоке предполагается ввести в состав липосом фосфатидилхолин, коньюгированный с полиэтиленгликолем. Для увеличения активностипрепарата в липидный состав липосом из яичного фосфатидилхолина будет введен химический конъюгат фосфолипида c полиэтиленгликолем и фолиевой кислотой. Предполагается, что полученный препарат будет накапливаться в раковых клетках, несущих на своей поверхности фолатные рецепторы, и проявлять свою фотодинамическую и цитотоксическую активность. 14 2012-2.5-16-N080011-015 Общество с ограниченной ответственностью "ЭкоБиоФарм" Представленные материалы содержат информацию о квалификации участника 30 В ходе выполнения работ будут проведены доклинические исследования (специфической активности, острой и хронической токсичности и др.) оригинального противоопухолевого лекарственного средства на основе хлорина Е6, встроенного в фосфолипидные наночастицы предельно малого размера как систему транспорта, для фотодинамической терапии рака кожи. С даты Разработка оптимального состава готовой формы лекарственного средства. заключения Планируется наработка опытной партии лекарственного средства и изучение государственного физико-химических свойств разработанной композиции лекарственного контракта по средства: 15.11.2014 -исследование фармакокинетики разработанной композиции. -изучение биодоступности Также будет разработан комплект документов для клинического изучения препарата. Лот № 12. 2012-2.5-16-N08-0012. Доклинические исследования радиофармпрепарата на основе меченого технецием-99m антибиотика фторхинолонового ряда для медицинской диагностики. 15 2012-2.5-16-N080012-008 Федеральное государственное бюджетное учреждение "Научноисследовательский институт кардиологии" Сибирского отделения Российской академии наук Представленные материалы содержат информацию о квалификации участника 33 С даты заключения Будут выполнены доклинические исследования радиофармпрепарата на основе государственного меченного технецием-99m антибиотика фторхинолонового ряда для контракта по медицинской диагностики. 15.11.2014 Подписи: Председатель Конкурсной комиссии: _____________ Заместитель председателя Конкурсной комиссии _______________ В.Г. Дроженко Члены Конкурсной комиссии: Секретарь Конкурсной комиссии: В.М. Байрамов _______________ А.А. Семин _______________И.Г. Денисова Заказчик: заместитель Министра образования и науки Российской Федерации ____________ А.К. Пономарев



