ВЛИЯНИЕ ЭКЗОГЕННЫХ ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ
advertisement

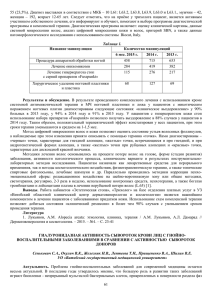
ОЦЕНКА ВЛИЯНИЯ ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ НА ПЕРЕДАЧУ ПЛАЗМИДНЫХ ГЕНОВ В БАКТЕРИАЛЬНЫХ БИПЛЕНКАХ В.В. Тец, д.м.н., профессор, академик РАЕН; Ю.И. Стернин, д.м.н., доцент; Г.В. Тец, к.м.н.; Н.В. Заславская, к.м.н.; Н.К. Артеменко, к.м.н.; Г.Ю. Кнорринг, к.м.н. Санкт-Петербургский государственный медицинский университет им. академика И.П. Павлова, Санкт-Петербургская медицинская Академия последипломного образования Открытие бактериальных биопленок, образующихся в ходе практически любого инфекционного процесса, показало неизвестные ранее причины недостаточной эффективности использования антибиотиков. Исследования последних лет свидетельствуют, что действие антибиотиков на бактерии в сообществе зависит не только от свойств микроба и антибиотика, но также строения и состава биопленок. Бактерии в биопленках имеют повышенную выживаемость в присутствии агрессивных веществ, факторов иммунной защиты и антибиотиков. В биопленках они выживают в присутствии антибиотиков, добавленных в количестве в 500-1000 раз большем, чем их минимальная подавляющая концентрация. Микробные биопленки, образованные разными бактериями, имеют сложное строение и включают в себя бактерии, внеклеточный матрикс и поверхностную оболочку, богатую липидами. Установлено, что в основе повышенной выживаемости лежат свойства клеток и внеклеточного матрикса. Устойчивость бактерий в биопленках связывают с уменьшение доступа препарата за счет барьерной функции поверхностной оболочки и компонентов матрикса и образования бактерий, получивших название «персистеры», находящихся в состоянии полной устойчивости практически ко всем препаратам. Также возможным механизмом устойчивости следует признать развитие резистентности, реализуемой за счет передачи хромосомных или плазмидных генов, в том числе – через матрикс биопленок. Недавно было показано, что для повышения эффективности действия антибиотиков можно воздействовать не только на сами бактерии, но и на компоненты матрикса – белки, липиды и нуклеиновые кислоты, например, используя ферменты: протеазы, липазы, нуклеазы. Ранее проведенные нами исследования показали ряд неизвестных эффектов ферментов: способность изменять морфологию и свойства формирующихся микробных биопленок, уменьшать количество матрикса и оптическую плотность колоний, а также усиливать угнетающее действие антибактериальных препаратов. Свойства бактерий внутри сообщества значительно отличаются от таковых у изолированных клеток. Показано, что биопленка является идеальной нишей для обмена генетической информацией между бактериями. Трансформация в биопленках S.mutans наблюдается в 10-600 раз чаще, чем в планктонных клетках. На модели биопленки была продемонстрирована передача между стрептококками конъюгативного транспозона, кодирующего резистентность к тетрациклину. Передача генетической информации посредством конъюгации в биопленочных культурах P.aeruginosa также наблюдалась чаще, чем среди планктонных клеток. В связи с этим целью настоящего исследования было изучение возможности влияния на изменчивость бактерий за счет действия экзогенных ферментов на бактериальные биопленки. Объектом исследования служили стандартные штаммы E.coli HB101, tetR, несущий хромосомный ген устойчивости к тетрациклину и E. coli DH5 alfa, puc 19 ampR, несущие ген устойчивости к ампициллину. Использованы: мясопептонный бульон (МПБ), мясопептонный агар (МПА), минимальная синтетическая среда М9, бульон Мюллер-Хинтон (bioMerieux), агар Мюллер-Хинтон (bioMerieux), среда LB (Sigma). В работе использованы различные природные и синтетические антибиотики: ампициллин (Hemofarm DD, 2 Югославия), тетрациклин (BioMerieux, Франция), из ферментных препаратов использовался Вобэнзим (Мукос Фарма, Германия). Для проверки штаммов и последующего поиска переданных генов методом полимеразной цепной реакции были созданы праймеры для соответствующих генов. В качестве маркерного признака оценена передача плазмидных генов устойчивости к ампициллину. Оценка передачи устойчивости признака в биопленках после 24 – 48 – 72- 96120-144 и 168 часов инкубации в присутствии Вобэнзима и без него в качестве контроля. Для выявления передаваемого признака в генах ДНК матрикса, из смешанных 24часовых биопленок, разделяли матрикс и клетки центрифугированием при 9000 g в течение 30 минут. Из матрикса выделяли ДНК фенол-хлороформным методом, и после электрофореза в материале полосы, ДНК, по размеру соответствующей плазмиде данного штамма, определяли наличие плазмидных генов методом ПЦР. В результате установлено, что плазмида штамма Escherichia coli DH5 alfa, puc 19, ampR присутствует во внеклеточном матриксе смешанных бактериальных биопленок, может быть выделена из него и идентифицирована методом ПЦР. По данным молекулярного анализа происходит передача плазмиды, контролирующей устойчивость к ампициллину к штамму, несущему ген устойчивости к тетрациклину. Выявлено, что при действии высоких концентраций Вобэнзима на биопленки различного возраста происходит изменение числа выявления рекомбинантов антибиотикоустойчивости. При этом число рекомбинантов снижается в 2 раза. Полученные данные свидетельствуют, что ферменты, входящие в состав Вобэнзима, воздействуют на смешанные микробные биопленки. Эти данные подтверждают ранее полученным результаты об универсальности действия различных ферментов, когда объектом воздействия являются не собственно бактерии, а компоненты внеклеточного матрикса биопленок. В матриксе смешанных биопленок однаружена внеклеточная ДНК, несущая маркерные гены антибиотикоустойчивости. При действии ферментов, входящих в состав Вобэнзима, зарегистрировано уменьшение количества внеклеточного матрикса, что очевидно снижает эффективность передачи генов между бактериями биопленок. При этом установлено статистически значимое снижение частоты передачи плазмидных генов антибиотикоустойчивости в бактериальных биопленках использованных штаммов. Таким образом, полученные данные свидетельствуют о влиянии ферментов на частоту передачи плазмидных генов антибиотикоустойчивости в бактериальных биопленках.