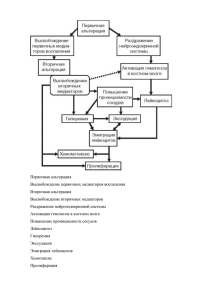
1 - Pedis.ru
advertisement

1. Патофизиология как фундаментальная наука и учебная дисциплина, основа теоретической и практической базовой подготовки врача. Предмет, задачи, методы и разделы патофизиологии; её роль в медицине Патфиз - т.е. наука, изучающая жизнедеятельность больного организма. Иначе: основные закономерности возникновения, механизма развития (т.е. патогенез) и исхода болезни (выздоровление, реабилитация или смерть). Знание этих общих закономерностей позволяет практическому врачу вести направленный поиск специфических признаков болезни, позволяющих поставить правильный диагноз. Патофизиологию можно разделить на три части: 1. Нозология - общее учение о болезни. 2. Типические патологические процессы - общие закономерности процессов, лежащих в основе многих заболеваний. 3. Частная патофизиология, изучающая нарушения в отдельных органов и системах. Предмет патфиза -> болезни и болезн сост, типовые пат процессы, типовые ормы патол органов, тк., и их систем. Изучение: этиология(причины), патогенез(мех разв болезни), принципы и методы диагностики(+методы лечения и профилактики) Задачи: - выяснить, описать объяснить (причины и услов возник), мех-мы разв и завершен; сформулир и обосновать принципы: диагностики, профил, терапии; разработка учения. Методы: Клинические исследования, моделирование (болезней, пациента); теоретич разработки: учение о болезни и больном, положения мед-ны и биологии 2. Моделирование патологических процессов и болезней - основной метод патофизиологии. Виды моделирования. Возможности и ограничения экспериментального метода изучения патологии человека: научные, деонтологические и правовые аспекты. В медицине метод моделирования был разработан и внедрен именно патофизиологами. Метод моделирования включает модел на физич объектах и моделирование формализованное. - Моделирование на физич объектах (материальное): на животных, их органах, тканях, клетка и отдельных комп клеток. Проводят только с использованием оптимального биологического вида, а также кол-ва животных, с применением обезболивающих средств. Прим также на искусственных физических системах (искуст почка, сердце). - Формализованное (нематериальное) моделирование: применяют при логическом моделировании в процессе обучения; 1. логическое моделирование – болезней и пат процессов а также самого пациента (в клин практике) 2. компьютерное моделирование – например, пат процессов или эффектов лечебных мероприятий 3. Форм у студентов основ врач мышления 3. Общая нозология как раздел патофизиологии. Характеристика компонентов общей нозологии: учение о болезни, общая этиология, общий патогенез. Понятие о саногенезе. Задачи нозологии. Формулирование общих представ о болезни базируется на изуч закономерностей возникн, разв и завершения конкретных болезней и болезненных сост (нозологических единиц) Н.Е.= отдельная болезнь Собственно нозология-учение о болезни в строгом узком смысле этого термина. Общая этиология - общие положения о причинах, условиях и закономерностях возникновения болезней и пат процессов. Общий патогенез- общее учение о закономерностях развития и исходов болезней и пат процессов. Задачи нозологии: • формулирование научно обоснованных понятий, используемых в медицине (таких, как здоровье и болезнь, патологические процесс, состояние, реакция, стадии болезни, ее осложнения, и других, имеющих существенное смысловое значение для медицины); • разработка номенклатуры болезней и болезненных состояний; • разработка рациональных классификаций болезней; • формулирование положений общего учения о болезни; • формулирование теоретических концепций медицины. Саногенез .- (латин. sanitas - здоровье, греч. genesis - происхождение, процесс образования), означает "развитие здоровья". Саногенез . - учение о механизмах поддержания здоровья и выздоровления при болезни 4. Характеристика основных понятий нозологии: норма, здоровье, болезнь, патологический процесс, патологическая реакция, типовой патологический процесс, типовая форма патологии органов и физиологических систем, патологическое состояние, преморбидное состояние. Норма - сост оптимальной жизнедеятельности организма в конкретных условиях его существования. Здоровье - это состояние полного физического, психического и социального благополучия, а не только отсутствие болезней или физических дефектов. Для здорового состояния человека характерно: 1. поддержание устойчивой неравновесности организма и среды; 2. сохранение целостности организма человека; 3. сохранение трудоспособности. Патологический процесс - сочетание патологических и защитно-приспособительных реакций в поврежденных тканях, органах или организме, проявляющихся в виде морфологических, метаболических и функциональных нарушений. Патологический процесс лежит в основе болезни, но не является ею. Часто различные патологические процессы и отдельные патологические реакции клеток, тканей у человека и животных встречаются в виде постоянных сочетаний или комбинаций, сформировавшихся и закрепленных в процессе эволюции. Это типовые патологические процессы. К ним относятся воспаление, отек, опухоль, лихорадка, дистрофия и др. Патологическая реакция - неадекватный и биологически нецелесообразный (вредный или бесполезный) ответ организма или отдельных его систем на воздействие обычных или чрезвычайных (патогенных) раздражителей. Патологическое состояние - стойкое отклонение от нормы, имеющее биологически отрицательное значение для организма. Болезнь - это сложная качественно новая реакция организма на действие чрезвычайного раздражителя, возникающая вследствии расстройства взаимодействия его с окружающей средой и характеризуется: - нарушением функций и морфологических структур организма, регуляции функций и жизнедеятельности; - расстройством взаимодействия организма с окружающей средой, т.е. снижением приспосабливаемости; - ограничением работоспособности и социально-полезной деятельности. Предболезнь - это состояние организма, являющееся следствием ослабления некоторых саногенетических механизмов и их комплексов. Преморбидная стадия . отличается возникновением специфических, обычно единичных, симптомов, предопределяющих общую направленность развивающейся патологии - кардиологическую, пульмонологическую, гастроэнтерологическую. 6 . Общая этиология как раздел патофизиологии . Характеристика поняти и : причина и условия болезней и патологических процессов. Свойства патологических факторов. Этиотропная терапия и профилактика Этиология - учение о причинах и условиях возникновения и развития болезней. Причиной болезни называют тот фактор (главный этиологический, производящий, специфический), который вызывает заболевание и сообщает ему специфические черты. Различают причины болезней внешние и внутренние. К внешним причинам относят механические, физические, химические, биологические и социальные факторы, к внутренним наследственность, конституцию, возраст, пол. Факторы, влияющие на возникновение и развитие болезней, называются условиями возникновения болезни. В отличие от причинного фактора условия не являются обязательными для развития заболевания. К внутренним условиям, способствующим развитию болезни, относят наследственное предрасположение к заболеванию, патологическую конституцию (диатез), ранний детский или старческий возраст. К внешним условиям, способствующим развитию болезней, относят нарушения питания, переутомление, невротические состояния, ранее перенесенные болезни, плохой уход за больным. К внутренним условиям, препятствующим развитию болезней, относят наследственные, расовые и конституциональные факторы. К ним относится, например, видовой иммунитет человека к некоторым инфекционным заболеваниям животных. Человек не болеет чумой собак и кошек, пневмонией рогатого скота и многими другими инфекционными болезнями животных. Люди, страдающие серповидно-клеточной анемией, не болеют малярией. К внешним условиям, препятствующим развитию болезней, относят хорошее и рациональное питание, правильную организацию режима рабочего дня, физкультуру, а в случае заболевания - хороший уход за больным. 7. Реактивность организма; основные факторы, определяющие реактивность; типовые формы нарушения реактивности организма. Роль реактивности в возникновении и развитии патологии. Методы направленного изменения реактивности. Реактивность .- способность организма как целого, а также его органов и клеток, отвечать адекватными изменениям жизнедеятельности на воздействия окружающей среды. Выделяют следующие виды реактивности: 1. Повышенная - гиперергия 2. Пониженная - гипергия 3. Извращенная - дизергия Реактивность может проявляться в следующих формах: 1. Неизмененная или первичная форма 2. Измененная под влиянием внешних или внутренних воздействий или вторичная форма. 1. Неспецифическая форма 2. Специфическая форма 1. Общая реактивность 2. Местная реактивность 1. Биологическая или видовая реактивность 2. Групповая (типовая реактивность) реактивность 3. Индивидуальная реактивность (наследственность, конституция, пол, возраст, влияние среды): 1. Физиологическая: а) иммунологическая или специфическая; б) неспецифическая 2. Патологическая: а) специфическая; б) неспецифическая Реактивность надо дифференцировать от таких понятий как: 1. Раздражимость - свойство клетки изменять интенсивность своего обмена веществ в ответ на воздействие 2. Возбудимость - способность к возникновению и распространению возбуждения 3. Чувствительность - способность чувствовать, т.е. определять характеристику, силу и локализацию раздражителя 4. Реакция - способность отвечать на раздражение _Резистентность .- это свойство организма противостоять различным воздействиям или невосприимчивость к воздействиям повреждающих факторов внешней среды. 8. Общий патогенез как раздел патофизиологии. Характеристика понятий; пусковой механизм; основное звено болезни или патологического процесса; динамичность и цепной характер патогенеза; порочный круг; специфические и неспецифические звенья патогенеза; патогенные и адаптивные реакции при развитии болезней и патологических процессов. Методы патогенетической терапии и профилактики Патогенез (от греч. pathos-страдание, genesis - происхождение) - раздел патологической физиологии, изучающий механизмы развития болезней. Главный этиологический (специфический) фактор действует как пусковой механизм развития болезни. В развитии болезней и патологических процессов чрезвычайно важно определить основное, главное звено в цепи возникающих в организме нарушений - изменение (один из патогенетических факторов), определяющее развитие остальных этапов болезни. Устранение основного звена патогенеза приводит к выздоровлению организма. Без установления основного звена патогенеза невозможно проведение патогенетической терапии - комплекса мер, направленных на прерывание цепи причинноследственных отношений между различными структурными, метаболическими и функциональными нарушениями, возникающими в организме вследствие воздействия главного этиологического фактора, путем устранения основного звена патогенеза. Возникшее в ходе развития патологического процесса нарушение функции органа или системы нередко само становится фактором (причиной), вызывающим это нарушение, иными словами, причинноследственные отношения меняются местами. Это положение в медицине называют "порочным кругом". "Порочный круг". .Нередко цепь явлений при болезни замыкается в порочный круг, в результате которого организм не может без помощи извне выйти из этого состояния Ведущие патогенетические факторы патологического процесса . - факторы, определяющие причинно-следственные отношения,основную цепь явлений при болезни. 9. Наследственная и врождённая патология: характеристика понятий. Мутагены как причина изменений в геноме. Мутации - инициальное звено патогенеза наследственных форм патологии. Виды мутаций Наследственность — свойство организмов сохранять и обеспечивать передачу признаков потомкам, а также программировать особенности их индивидуального развития в конкретных условиях среды. Отсюда следует, что состояние здоровья и нездоровья (болезнь) являются результатом взаимодействия наследственных и средовых факторов. Наследование — процесс передачи генетической информации о признаках — осуществляется через гаметы (в случае полового размножения) и через соматические клетки (при бесполом). Наследуемость — доля фенотипической изменчивости, обусловленная генетическими различиями между особями, а показатель наследуемости (h2) — доля участия генетических факторов в общей (фенотипической) изменчивости признака. Обычно показатель наследуемости рассчитывают для количественных признаков: рост, масса тела, АД, ГПК и т.д. При полной генетической детерминации признака h2=l,0, при Ь2-0 влияние наследственности не обнаруживается. Экзогенные мутагены. Их большинство, к ним относятся различные и многочисленные факторы внешней среды (например, радиационное излучение, :лкилирующие агенты, окислители, многие вирусы).Эндогенные мутагены образуются в процессе жизнедеятельности организма например, мутации могут возникать под влиянием свободных радикалов, продуктов липопероксидации). Физические мутагены — ионизирующее излучение и температурный фактор:ионизирующее излучение (например, а-, р*-, у-лучи, рентгеновское излучение, нейтроны); радиоактивные элементы (например, радий, радон, изотопы калия, углерода и т.д. — источники ионизирующего излучения);УФизлучение;чрезмерно высокая или низкая температура. Химические мутагены — самая многочисленная группа мутагенов. К химическим мутагенам относятся:сильные окислители или восстановители (например, нитраты, нитриты, активные формы кислорода);алкилирующие агенты (например, йодацетамид); t пестициды (например, гербициды, фунгициды);некоторые пищевые добавки (например, ароматические углеводороды, цикламаты);продукты переработки нефти; f органические растворители;ЛС (например, цитостатики, содержащие ртуть средства, иммунодеп-рессанты);другие химические соединения. Биологические мутагены: вирусы (например, кори, краснухи, гриппа); t Аг некоторых микроорганизмов. Спонтанные мутации возникают под влиянием естественных мутагенов экзо-или эндогенного происхождения, без специального (целенаправленного) вмешательства человека. Спонтанные мутации возникают, например, в результате действия химических веществ, образующихся в процессе метаболизма; воздействия естественного фона радиации или УФ-излучения; ошибок репликации и т.д. Индуцированные мутации вызваны направленным воздействием факторов внешней или внутренней среды. Индуцированный мутационный процесс может быть контролируемым и неконтролируемым.Контролируемые мутации возникают, например, в эксперименте с целью изучения механизмов мутагенеза и/или его последствий.Неконтролируемые мутации, например при случайном выбросе радиоактивных элементов в среду обитания. Гаметические мутации — мутации в половых клетках. Они наследуются потомками и, как правило, обнаруживаются во всех клетках организма. Соматические мутации — мутации в неполовых (соматических) клетках — проявляются у того индивида, у которого они возникают. Они передаются при делении только дочерним клеткам и не наследуются следующим поколением индивида. Мозаики. Если соматическая мутация возникает на ранних стадиях дробления зиготы (но не первого деления) возникают клеточные линии с различными генотипами. Чем раньше в онтогенезе происходит соматическая мутация, тем больше клеток содержит данную мутацию. Подобные организмы получили название мозаичных. Патогенные мутации приводят к гибели эмбриона (или плода) и к развитию наследственных и врождённых заболеваний. Нейтральные мутации обычно не влияют на жизнедеятельность организма (например, мутации, вызывающие веснушки, изменение цвета волос, радужной оболочки глаза). Благоприятные мутации (улучшают жизнеспособность организма, например темная окраска кожных покровов) Генные (точковые) мутации-любые изменения структуры ДНК 10. Генные мутации, хромосомные абберации, изменения генома: виды, механизмы, последствия. Виды наследственных форм патологии Генной (точковой, истинной) мутацией - называется неразличимое с помощью микроскопа изменение внутренней организации хромосомы на уровне отдельных генов, которое обнаруживается по появлению в потомстве измененного признака. Генные мутации могут быть: 1. Спонтанными (самопроизвольными), которые происходят вне прямой связи с каким-либо физическим или химическим фактором внешней среды. 2. Индуцированными, которые намеренно вызываются воздействием на организм факторов известной природы. По характеру изменений в составе гена различают следующие типы мутаций: Делеции — утрата сегмента ДНК размером от одного нуклеотида до гена. Дупликации — удвоение или повторное дублирование сегмента ДНК от одного нуклеотида до целых генов. Инверсии — поворот на 180° сегмента ДНК размером от двух нуклеотидов до фрагмента, включающего несколько генов. Инсерции — вставка фрагментов ДНК размером от одного нуклеотида до целого гена. Трансверсии — замена пуринового основания на пиримидиновое или наоборот в одном из кодонов. Транзиции — замена одного пуринового основания на другое ггуриновое или одного пиримидинового на другое в структуре кодона. По последствиям генных мутаций их классифицируют на нейтральные, регуляторные и динамические, а также на миссенс- и нонсенс-мутации. Нейтральная мутации (молчащая мутация) — мутация не имеет фенотипического выражения (например, в результате вырожденности генетического кода). Миссенс-мутация — замена нуклеотида в кодирующей части гена — приводит к замене аминокислоты в полипептиде. Нонсенс-мутация — замена нуклеотида в кодирующей части гена — приводит к образованию кодона-терминатора (стоп-кодона) и прекращению трансляции Регуляторная мутация — мутация в 5'- или З'-нетранслируемых областях гена, такая мутация нарушает экспрессию гена. Динамические мутации — мутации, обусловленные увеличением числа три-нуклеотидных повторов в функционально значимых частях гена. Такие мутации могут привести к торможению или блокаде транскрипции, приобретению белковыми молекулами свойств, нарушающих их нормальный метаболизм. Хромосомные мутации (аберрации) характеризуются изменением структуры отдельных хромосом. Дупликация — удвоение (или умножение) какого-либо участка хромосомы (например, трисомия по короткому плечу хромосомы 9 приводит к появлению множественных ВПР, включая микроцефалию, задержку физического, психического и интеллектуального развития). Межхромосомные аберрации — обмен фрагментами между негомологичными хромосомами. Они получили название транслокаций. Различают три варианта транслокаций: реципрокные (обмен фрагментами двух хромосом), нереципрокные (перенос фрагмента одной хромосомы на другую), роберт-соновские (соединение двух акроцентрических хромосом в районе их центромер с потерей коротких плеч, в результате образуется одна метацентри-ческая хромосома вместо двух акроцентрических). Изохромосомные аберрации — образование одинаковых, но зеркальных фрагментов двух разных хромосом, содержащих одни и те же наборы генов. Это происходит в результате поперечного разрыва хроматид через центромеры (отсюда другое название — центрическое соединение). Геномные мутации характеризуются изменением числа хромосом. Полиплоидия — увеличение числа наборов хромосом, кратное гаплоидному (Зп, 4п, 5п и т.д.). Причины: двойное оплодотворение и отсутствие первого мейотического деления. У человека полиплоидия, а также большинство анеуплоидий приводят к формированию деталей. Анеуплоидия — изменение (уменьшение — моносомия, увеличение — трисомия) числа хромосом в диплоидном наборе, т.е. не кратное гаплоидному (2п+1, 2п—1 и т.д.). Механизмы возникновения: нерасхождение хромосом (хромосомы в анафазе отходят к одному полюсу, при этом на каждую гамету с одной лишней хромосомой приходится другая — без одной хромосомы) и «анафазное отставание» (в анафазе одна из передвигаемых хромосом отстаёт от всех других). Трисомия — наличие трёх гомологичных хромосом в кариотипе (например, по 21-й паре, что приводит к развитию синдрома Дауна', по 18-й паре — синдрома Эдвардса; по 13-й паре — синдрома Папку). Моносомия — наличие только одной из двух гомологичных хромосом. При моносомии по любой из аутосом нормальное развитие эмбриона невозможно. 11. Генные болезни; характеристика понятия; типы наследования и их основные признаки; примеры болезней Генные болезни 1) Моногенные - строго наследуемые (мутации одного гена). 2) Полигенные - с наследственной предрасположенностью (мутации многих генов) АУТОСОМНО-ДОМИНАНТНЫЙ ТИП НАСЛЕДОВАНИЯ Примеры заболеваний: синдром Марфана, гемоглобинопатия М, хорея Хантингтона, полипоз толстой кишки, семейная гиперхолестеринемия, нейрофиброматоз, полидактилия. Признаки заболевания Одинаковая частота патологии у лиц мужского и женского пола. Наличие больных в каждом поколении родословной, т.е. регулярная передача болезни из поколения в поколение (так называемый вертикальный характер распределения болезни). Вероятность рождения больного ребёнка равна 50% (независимо от пола ребёнка и количества родов). Непоражённые члены семьи, как правило, имеют здоровых потомков (поскольку не имеют мутантного гена). Перечисленные признаки реализуются при условии полного доминирования (наличие одного доминантного гена достаточно для развития специфической клинической картины заболевания). АУТОСОМНО-РЕЦЕССИВНЫЙ ТИП НАСЛЕДОВАНИЯ Примеры заболеваний: фенилкетонурия, адреногенитальный синдром, кожно-глазной альбинизм, галактоземия, гликогенозы, гиперлипопротеинемии, муковисцидоз. Признаки заболевания Равная частота патологии у лиц мужского и женского пола. Проявление патологии в родословной «по горизонтали», часто у сибсов.Отсутствие заболевания у единокровных (дети одного отца от разных матерей) и единоутробных (дети одной матери от разных отцов) братьев и сестёр. Родители больного, как правило, здоровы. Это же заболевание может обнаруживаться у других родственников, например у двоюродных или троюродных братьев (сестёр) больного. Появление аутосомно-рецессивной патологии более вероятно при кровнородственных браках за счёт большей вероятности встречи двух супругов, гетерозиготных по одному и тому же патологическому аллелю, полученному от их общего предка. Чем больше степень родства супругов, тем эта вероятность выше. СЦЕПЛЕННОЕ С ХРОМОСОМОЙ Х-ДОМИНАНТНОЕ НАСЛЕДОВАНИЕ Примеры заболеваний: одна из форм гипофосфатемии — витамин D-рези-стентный рахит, болезнь Шарко—Мари—Тута Х-сцепленная доминантная, ротолице-пальцевой синдром типа I. Признаки заболевания Поражены лица мужского и женского пола, но женщины в 2 раза чаще. Передача больным мужчиной патологического аллеля всем дочерям и только дочерям, но не сыновьям. Сыновья получают от отца хромосому Y. Передача больной женщиной заболевания и сыновьям, и дочерям с равной вероятностью. Более тяжёлое течение заболевания у мужчин, чем у женщин. СЦЕПЛЕННОЕ С ХРОМОСОМОЙ Х-РЕЦЕССИВНОЕ НАСЛЕДОВАНИЕ Примеры заболеваний: гемофилия А, гемофилия В, Х-сцепленная рецессивная болезнь Шарко—Мари—Тута, дальтонизм, мышечная дистрофия Дюшенна—Бек-кера, синдром Калльмана, болезнь Хантера (мукополисахаридоз типа II), гипо-гаммаглобулинемия брутоновского типа. Признаки заболевания Больные рождаются в браке фенотипически здоровых родителей.Заболевание наблюдается почти исключительно у лиц мужского пола. Матери больных — облигатные носительницы патологического гена. Сын никогда не наследует заболевание от отца. У носительницы мутантного гена вероятность рождения больного ребёнка равна 25% (независимо от пола новорождённого), вероятность рождения больного мальчика равна 50%. ГОЛАНДРИЧЕСКИЙ, ИЛИ СЦЕПЛЕННЫЙ С ХРОМОСОМОЙ Y, ТИП НАСЛЕДОВАНИЯ Гены, ответственные за развитие патологического признака, локализованы в хромосоме Y. Примеры признаков: гипертрихоз ушных раковин, избыточный рост волос на средних фалангах пальцев кистей, азооспермия. Передача признака от отца всем сыновьям и только сыновьям. Дочери никогда не наследуют признак от отца. «Вертикальный» характер наследования признака. Вероятность наследования для лиц мужского пола равна 100%. МИТОХОНДРИАЛЬНОЕ НАСЛЕДОВАНИЕ Геном митохондрий полностью секвенирован. Он содержит 16 569 пар оснований и кодирует две рибосомные РНК (12S и 16S), 22 транспортные РНК и 13 поли-пептидов — субъединиц ферментативных комплексов окислительного фосфо-рилирования. Другие 66 субъединиц дыхательной цепи кодируются в ядре. Примеры заболеваний (митохондриальные болезни): атрофия зрительного нерва Лебера, синдромы Лея (митохондриальная миоэнцефалопатия), MERRF (миоклоническая эпилепсия), кардиомиопатия дилатационная семейная. Признаки заболевания Наличие патологии у всех детей больной матери. Рождение здоровых детей у больного отца и здоровой матери. Указанные особенности объясняются тем, что митохондрии наследуются от ютери. Доля отцовского митохондриального генома в зиготе составляет ДНК от 0 до 4 митохондрий, а материнского генома — ДНК примерно 2500 митохондрий. К тому же похоже, что после оплодотворения репликация отцовской ДHK блокируется. 12. Хромосомные болезни: характеристика понятия; виды в зависимости от изменений структуры хромосом, их числа и вида клеток организма. Хромосомные болезни->начальное звено патогегенеза- геномная или хромосомная мутация. (частота рожд 1:6000) ТРИСОМИИ Синдром Патау-Трисомия 13 выявляется с чистотой 1:6000. Летальность высокая: более 96% больных погибают до 1—1,5 лет. Проявления: сниженная масса тела, микроцефалия, недоразвитие мозга, аномалии лица (запавшая переносица, расщелина верхней губы и нёба), полидактилия, ВПР внутренних органов (поджелудочной железы, селезёнки, сердца). Синдром Эдвардса - Трисомия 18 выявляется у 1 из 7000 новорождённых. Около 2/3 детей с синдромом Эдвардса умирают в первые 6 мес жизни. Проявления: сниженная масса тела, аномалии лицевого и мозгового черепа (долихоцефалия, деформация ушных раковин, гипоплазия нижней челюсти, микростомия), короткая грудина, узкие межрёберные промежутки, короткая и широкая грудная клетка, ВПР сердца и других внутренних органов, нарушения психомоторного развития. Синдром Дауна - Трисомия 21 наблюдается с частотой 1:750 новорождённых и цитогенетически характеризуется простой трисомией (96% всех случаев болезни), транслокацией акроцентрических хромосом (3%), мозаицизмом (1%). Характерна малая средняя продолжительность жизни (35 лет). Проявления: аномалии лицевого и мозгового черепа (уплощенный затылок; запавшая спинка носа; косой, монго-лоидный разрез глаз; толстые губы; утолщённый язык с глубокими бороздами; маленькие, низко расположенные уши; высокое нёбо), гипотония мышц, аномалии развития внутренних органов (сердца, почек, кишечника), короткие пальцы; аномалии дерматоглифики (ладонная складка), умственная отсталость разной степени (от минимальной дебильности до тяжёлой идиотии). Частичные трисомии- Частичные трисомии характеризуются присоединением части хромосомы к хромосоме другой пары и встречаются редко (1:100 000 новорождённых). При-мер частичной трисомии: трисомия по короткому плечу хромосомы 9 (9р+) в результате дупликации части короткого плеча хромосомы 9. Продолжительность жизни при трисомии 9р+ обычно не уменьшена. Проявления: отставание в умственном развитии, задержка физического развития, аномалии лицевого и мозгового черепа (микроцефалия, короткая верхняя губа, округлый кончик носа, большие оттопыренные ушные раковины), длинные ладони, короткие пальцы, единственная ладонная складка, синдактилия на стопах. МОНОСОМИИ Частичные моносомии характеризуются делецией части какой-либо хромосомы и встречаются редко (примерно 1:50 000—1:100 000 родившихся детей). Пример: синдром кошачьего крика (5р-), развивающийся в результате делеции части короткого плеча хромосомы 5. Проявления: плач новорождённого, похожий на мяуканье кошки (причиной являются аномалии гортани в виде её сужения, отёчности слизистой оболочки и уменьшения величины надгортанника),, че-репно-лицевые аномалии (микроцефалия, антимонголоидный разрез глаз, ги-пертелоризм, круглое лицо у новорождённых, узкое, вытянутое — у взрослых), отставание умственного и физического развития у детей, идиотия у взрослых (у \% IQ менее 20), нарушения структуры рёбер и позвонков. АНОМАЛИИ ПОЛОВЫХ ХРОМОСОМ Нарушение расхождения половых хромосом приводит к образованию аномальных гамет: у женщин — XX и 0 (в последнем случае гамета не содержит половых хромосом); у мужчин — XY и 0. При слиянии половых клеток в подобных случаях возникают количественные нарушения половых хромосом. Синдром Кляйнфелтера Частота 2-2,5 на 1000 новорождённых мальчиков. В кариотипе разнообразные цитогенетические варианты (47,XXY; 48,XXXY; 49,XXXXY и др.), но чаще встречается классический вариант 47,XXY. Проявления: высокий рост, непропорционально длинные конечности, отло-жение жира по женскому типу, евнухоидное телосложение, скудное оволосение, гинекомастия, гипогенитализм, бесплодие (в результате нарушения спермаогенеза, снижения продукции тестостерона и увеличения продукции женских - товых гормонов), снижение интеллекта (чем больше в кариотипе добавоч-JLU.X хромосом, тем более выражено). Течение описанной патологии мужскими половыми гормонами направлено на ррекцию вторичных половых признаков. Однако и после терапии больные -остаются бесплодными. Синдромы полисемии X Трясомия X. Наиболее частым синдромом из группы полисемии X является ,г*ндром трисомии X (47,ХХХ): частота 1:1000 новорождённых девочек, карио-тмп 47,ХХХ; пол женский, фенотип женский; как правило, физическое и пси-ииеское развитие у женщин с этим синдромом не имеет отклонений от нормы. Тетра- и пентасомии X: высокий рост, телосложение по мужскому типу, челюст-ао-лицевые дисплазии (эпикант, гипертелоризм, готическое нёбо и т.д.), нарушения менструального цикла, бесплодие, преждевременный климакс, снижение интеллекта различных степеней (отмечено у 2/3 больных), нередки психические заболевания (шизофрения, маниакально-депрессивный психоз, эпилепсия). Синдром Шерешевского-Тёрнера- Частота синдрома 1:3000 новорождённых девочек; кариотип 45,ХО, но встречаются и другие варианты (например, изохромосома длинного плеча X — Xqi, лелеция короткого плеча — Хр-, делеция длинного плеча — Xq-). Проявления: низкий рост, короткая шея с избытком кожи или крыловидной складкой, широкая, часто деформированная грудная клетка, деформация локтевых суставов, недоразвитие первичных и вторичных половых признаков, бесплодие. У новорождённых почти во всех случаях находят лимфатический отёк кистей и стоп. Раннее лечение женскими половыми гормонами может оказаться эффективным. 20 Воспаление (inflammatio) - это сложная местная защитно-приспособительная реакция соединительной ткани, сосудов и нервной системы целостного организма, выработанная в процессе эволюции у высокоорганизованных существ в ответ на повреждение, направлена на изоляцию и удаление повреждающего агента и ликвидацию последствий повреждения. Это типовой патологический процесс с изменением обмена веществ и кровообращения, фагоцитозом и пролиферацией. В основе любого воспаления лежит: 1) повреждение и 2) защитные реакции. Причины воспаления : а) физические факторы, б) химические факторы, в) биологические факторы, г) расстройства кровообращения, д) опухолевый рост, е) иммунные реакции. Различаются 4 стадии: 1. альтерация (alteratio), 2. экссудация (exsudatio), 3. эмиграция (emigratio), 4. пролиферация (proliferatio). Компоненты механизма воспаления: Альтерация – Сосудистые реакции,изменение крово-лимфообращения Экссудация жидкости,выход ФЭК в ткань Фагоцитоз Полиферация 21 Первичная альтерация может проявляться специфическими изменениями, а также неспецифическими изменениями, которые развиваются стереотипно независимо от свойств и особенностей действия патогенного фактора. Эти изменения связаны: 1) с повреждением мембранных структур, 2) с повреждением мембраны митохондрий, 3) с повреждением лизосом. Нарушения структуры мембраны клеток ведет к нарушению клеточных насосов. Отсюда теряется способность клетки адекватно реагировать изменением собственного метаболизма на изменения гомеостаза окружающей среды, изменяются ферментативные системы и митохондрии. В клетке накапливаются недоокисленные продукты обмена: пировиноградная, молочная и янтарная кислоты. Первоначально эти изменения являются обратимыми и могут исчезнуть, если этиологический фактор прекратил свое действие. Клетка полностью восстанавливает свои функции. Если же повреждение продолжается и в процесс вовлекаются лизосомы, то изменения носят необратимый характер. Поэтому лизосомы называют "стартовыми площадками воспаления" и именно с них начинается формирование вторичной альтерации. Вторичная альтерация обусловлена повреждающим действием лизосомальных ферментов. Усиливаются процессы гликолиза, липолиза и протеолиза. В результате распада белков в тканях увеличивается количество полипептидов и аминокислот; при распаде жиров возрастают жирные кислоты; нарушения углеводного обмена ведет к накоплению молочной кислоты. Все это вызывает физико-химические нарушения в тканях и развиваются гиперосмия с повышением концентрации ионов K+, Na+, Ca2+, Cl-; гиперонкия - повышение количества белковых молекул из-за распада крупных на более мелкие; гипериония H+ - в связи с диссоциацией большого количества кислот с высвобождением ионов водорода. И как следствие всего этого - развивается метаболический ацидоз в связи с повышением кислых продуктов обмена. В процесс вовлекаются все компоненты ткани и альтерация носит необратимый характер, итогом которого будет аутолиз клеток. Образуются вещества, которые могут не только усиливать, но и ослаблять альтерацию, оказывая влияние на различные компоненты воспаления, т.е. регулируя микроциркуляцию, экссудацию, эмиграцию лейкоцитов и пролиферацию клеток соединительной ткани. . 22 Физико-химические механизмы нарушения функций биологических мембран Повреждение компонентов биологических мембран при патологических процессах. Биологические мембраны наряду с элементами цитоскелета формируют ультраструктуру протоплазмы. Кроме того, они выполняют множество функций, нарушение любой из которых может привести к изменению жизнедеятельности клетки в целом и даже к ее гибели. На рис. 4 дано схематическое изображение типичной мембраны с указанием тех ее элементов, повреждение которых может иметь место в патологии и лежать в основе развития различных заболеваний. Наиболее тяжелые последствия вызывает повреждение липидного слоя мембран, называемого часто липидным бислоем, так как он образован двумя слоями липидных молекул (рис. 4,1). Липидный бислой клеточной и внутриклеточных мембран выполняет две основные функции - барьерную и матричную (структурную). В нормально функционирующей клетке срединная часть липидного бислоя представляет собой сплошную пленку, образованную углеводородными "хвостами" фосфолипидных молекул. Эта пленка, по свойствам близкая к расплавленному парафину, практически непроницаема для ионов и молекул водорастворимых веществ, таких, как углеводы, аминокислоты, белки, нуклеотиды и нуклеиновые кислоты. Повреждение этого сплошного барьера приводит к нарушению регуляции внутриклеточных процессов и тяжелым расстройствам обмена веществ в клетке. С другой стороны, липидный слой мембран формирует в клетке особую жидкую фазу, отделенную от водной фазы цитоплазмы поверхностями мембран. На этой поверхности раздела фаз и внутри липидной фазы "плавают" многочисленные ферменты, многие субстраты биохимических реакций, белковые клеточные рецепторы, гликолипиды (рис. 4,3) и гликолипопротеиды (рис. 4.4), образующие гликокаликс. Во многих клетках до 80 % белков связано с мембранами или входит в их состав. Липидный бислой выполняет, таким образом, роль структурной основы или матрицы для всех этих белковых, липопротеидных, гликопротеидных и гликолипидных компонентов мембран. От свойств липидной фазы мембран, таких, как вязкость, поверхностный заряд, полярность, зависит работа мембранных ферментов и рецепторов. Изменение этих характеристик под действием неблагоприятных факторов приводит к дезорганизации согласованной работы элементов мембраны и нарушению ее функционирования. Для наружных клеточных мембран характерно наличие гликокаликса, образованного гликолипидами и гликопротеидами (рис. 4.3 и 4.4). Гликокаликс выполняет ряд функций, в частности, от него зависят свойства клеточной поверхности, способность клеток к фагоцитозу и адгезия с другими клетками. Гликокаликс эритроцитов препятствует их агглютинации. К тяжелым последствиям приводят те нарушения в гликокаликсе, которые изменяют антигенные свойства поверхности клеток. Действие многих токсических соединений направлено на белковые компоненты клеточной мембраны. Например, цианистый калий блокирует цитохромоксидазу - фермент, входящий в состав внутренних мембран митохондрии. Ионы тяжелых металлов (ртуть, серебро, свинец) связывают SHгруппы белков, в том числе мембранных ферментов и ионных каналов (рис. 4.7 и 4.8), вызывая их инактивацию. На белки плазматических мембран или элементы цитоскелета (рис. 4.5 и 4.6) направлено действие большинства бактериальных токсинов. Изменения в активности мембранных ферментов, каналов и рецепторных белков, вызванные всеми этими и многими другими неблагоприятными факторами, приводят к нарушению функции клеток, органов и развитию болезней. Причины повреждения мембран в патологии. Живая клетка, входящая в состав тканей организма, "узнает" о неблагополучной ситуации в организме человека на основании тех изменений, которые происходят в ее непосредственном окружении. Эти изменения могут привести к нарушению функционирования биологических мембран. Непосредственные факторы, вызывающие нарушение структуры и функции мембран в живом организме, можно назвать мембранотропными повреждающими агентами. По своему происхождению они бывают внеклеточными или внутриклеточными. По своей природе мембранотропные повреждающие агенты можно разделить на механические, электрические, радиационные и химические. Механическое воздействие на ткань при травме может привести к разрыву клеток или к сильному растяжению мембран. И то и другое сопровождается потерей мембранами их барьерных свойств. Но это - ситуация относительно редкая. Значительные постоянные механические нагрузки выдерживают клетки опорно-двигательного аппарата, а также эпителия различных слизистых оболочек: кишечника, ротовой полости, почечных канальцев и т. д. Механические нагрузки приводят к отрыву отдельных клеток от эпителиального слоя. Нарушение баланса между скоростью эрозии эпителия и темпом его восстановления за счет деления эпителиальных клеток приводит к повреждению эпителиального слоя, нарушению его функционирования, развитию язв и другим осложнениям. К механическим повреждениям можно по-видимому, причислить повреждение клеточных мембран под действием нарушения осмотического баланса между внутриклеточной и окружающей средой. Большинство клеток сравнительно легко переносит недолговременную гиперосмию - повышение осмотического давления окружающего раствора, отвечая на нее уменьшением внутриклеточного объема (вода выходит из клетки, клетка "сокращается"). Но в гипотоническом окружении, когда осмотическое давление молекул и ионов в окружающей клетку среде ниже, чем в клетке, происходит увеличение объема клетки ("набухание"), растяжение и, наконец, разрыв клеточных мембран. Сильное механическое растяжение мембраны, даже если оно не сопровождается видимым ее разрывом, приводит к потере липидным слоем его барьерных свойств. Из клетки выходят ионы К + и различные метаболиты, в нее входят ионы Na+ и Ca2+, нарушается нормальное функционирование клетки. Осмотическое набухание клеток может быть также следствием нарушения работы мембранных ионных насосов, поддерживающих равенство осмотической концентрации ионов внутри и вне клетки. Действие сильных электрических полей приводит к нарушению барьерных свойств клеточных мембран. Если, например, суспензию эритроцитов в физиологическом растворе поместить между двумя электродами и подать на электроды достаточно мощный импульс электрического напряжения (выше 12 кВ/см), то в мембранах эритроцитов появляются мелкие отверстия - поры, через которые из клеток выходят ионы калия, а в клетки входят ионы натрия. Осмотическая концентрация солей выравнивается внутри и вне клетки, но благодаря высокой концентрации белка (гемоглобина) в эритроцитах происходит их набухание из-за высокого онкотического давления в клетках. В конце концов наступает гемолиз - разрыв мембран эритроцитов. Появление пор в мембране под действием сильного электрического поля называют электрическим пробоем мембраны, а гемолиз, вызванный онкотическим давлением гемоглобина в условиях выравнивания осмотической концентрации ионов К + и Na+ внутри и вне клетки, носит название коллоидноосмотического. Электрический пробой мембран внешним электрическим полем может иметь место при поражении электрическим током высокого напряжения, а в искусственных условиях используется для введения лекарственных препаратов в эритроциты. Лекарства входят в клетки из окружающего раствора, если подать на суспензию клеток импульс высокого напряжения; поры в мембранах через некоторое время самопроизвольно затягиваются, после чего эритроциты вводят в пидного слоя мембран и увеличением его текучести. При этом общего повышения температуры ткани не происходит. С другой стороны, СВЧ вызывают движение молекул в примембранных слоях воды, способствуют лучшему перемешиванию жидкости в этом малоподвижном слое и облегчают тем самым прохождение молекул, в частности кислорода, через барьеры, создаваемые системами: мембрана + примембранные слои воды. С этими двумя эффектами связано наблюдаемое иногда лечебное действие СВЧ. В подавляющем большинстве случаев нарушение нормального функционирования мембран в клетке обусловлено воздействием различных химических соединений. Из внеклеточной среды на плазматические мембраны действуют антитела (если они появляются в организме), микробные токсины и токсические соединения другого происхождения (вещества, входящие в яд змеи, скорпиона, пчелы, осы, промышленные яды и т. д.). Изменение рН в окружающей среде, недостаток кислорода хотя и не приводят непосредственно к повреждению мембранных структур клеток, вызывают изменения в обмене веществ, которые могут затем послужить причиной повреждения биологических мембран. К основным внутриклеточным химическим повреждающим агентам следует в первую очередь отнести свободные радикалы и избыток ионов кальция. Активация процессов, сопровождающихся образованием свободных радикалов, как правило, приводит к нарушению функционирования клеточных структур, включая биологические мембраны. Увеличение концентрации ионов кальция в клетке выше 10-6-10-5 моль/л вызывает активацию сократительных структур цитоплазмы и ряда ферментных систем, дезорганизацию внутриклеточных процессов. Наиболее тяжелые последствия действия избытка ионов кальция в клетке связаны с тем, что эти ионы активируют мембраносвязанные ферменты-фосфолипазы, которые гидролизуют фосфолипиды и разрушают таким образом липидный слой в мембранах 23 медиаторы или модуляторы воспаления. Медиаторы воспаления различаются ● по времени их активности: ранние и поздние; ● по точке приложения: влияющие на сосуды или на клетки и ● по происхождению: гуморальные (плазменные) и клеточные. Источниками медиаторов воспаления могут быть белки крови и межклеточной жидкости, все клетки крови, клетки соединительной ткани, нервные клетки, неклеточные элементы соединительной ткани. Различают преформированные и вновь образующиеся медиаторы. Преформированные медиаторы синтезируются постоянно без всякого повреждения, накапливаются в специальных хранилищах и высвобождаются немедленно после повреждения (например - гистамин). Синтез других медиаторов начинается после повреждения, как ответная мера. Такие медиаторы называются вновь образующимися (например простагландины). Повреждение ткани сопровождается активацией специальных протеолитических систем крови, что ведет к появлению в очаге воспаления различных пептидов, выполняющих роль медиаторов воспаления. Вазоактивные кинины образуются так же при активации фибринолитической системы активированным фактором Хагемана, который превращает циркулирующий в крови неактивный плазминоген в активный фермент плазмин. Плазмин расщепляет фибрин (а своевременное переваривание фибрина необходимо для успешного заживления ран). При этом образуются пептиды, способные расширять сосуды и поддерживать увеличенную сосудистую проницаемость. Плазмин активирует систему комплемента 24 Расстройства кровообращения и микроциркуляции в воспаленной ткани Расстройства микроциркуляции. Сосудистые явления развиваются вслед за воздействием воспалительного агента, поскольку первоначальные из них являются по своей природе рефлекторными. Они хорошо прослеживаются под микроскопом в классическом опыте Ю. Конгейма на брыжейке лягушки и включают ряд стадий: 1. Кратковременный спазм артериол, сопровождающийся побледнением ткани. Является результатом рефлекторного возбуждения вазоконстрикторов от воздействия воспалительного агента. Длится от нескольких десятков секунд до нескольких минут, так что его не всегда удается отметить. 2. Артериальная гиперемия, обусловленная расширением артериол, механизм которого, с одной стороны, связан с аксон-рефлекторным возбуждением вазодилятаторов, а с другой стороны, - с непосредственными сосудорасширяющими эффектами медиаторов воспаления: нейропептидов, ацетилхолина, гистамина, брадикинина, простагландинов и др. Артериальная гиперемия лежит в основе двух основных . внешних местных признаков воспаления покраснения и повышения температуры ткани. Кроме того, в воссоздании жара имеет значение повышенная теплопродукция в очаге из-за усиленного обмена веществ. 3. Венозная гиперемия. Она может развиться уже через несколько минут после воздействия воспалительного агента, однако характеризуется значительной продолжительностью - сопровождает весь ход воспалительного процесса. Одновременно, поскольку при ее участии осуществляются основные воспалительные явления, она считается истинной воспалительной гиперемией. В механизме венозной гиперемии различают три группы факторов: а) нарушения реологических свойств крови и собственно ее циркуляции. Сюда относятся повышение вязкости крови вследствие ее сгущения, обусловленного экссудацией, потери альбуминов, увеличения содержания глобулинов, изменения коллоидного состояния белков; усиление сопротивления кровотоку в результате краевого стояния лейкоцитов, набухания и агрегации эритроцитов; тромбообразование вследствие активации свертывающей системы крови; нарушение характера кровотока - замедление тока крови в осевой зоне, уменьшение краевой плазматической зоны; б) изменения сосудистой стенки, которые включают потерю сосудистого тонуса вследствие паралича нервно-мышечного аппарата сосудов; снижение эластичности сосудистой стенки; набухание эндотелия и повышение его адгезивности, в результате чего просвет сосудов сужается, создаются условия для прилипания лейкоцитов к эндотелию; в) тканевые изменения, состоящие в сдавлении венул и лимфатических сосудов отечной, инфильтрированной тканью; снижении упругости соединительной ткани. Следует заметить, что многие из вышеперечисленных факторов являются, с одной стороны, непосредственными причинами, а с другой - одновременно следствиями развивающейся венозной гиперемии, подсоединяющимися к ее патогенезу в ходе воспаления. Воспалительная гиперемия отличается от других видов гиперемии (вызываемой, например, механическим фактором) значительным ослаблением или даже извращением реакции сосудов воспаленной ткани на действие сосудосуживающих агентов (адреналин, кофеин) и на раздражение симпатических нервов. Это явление может быть связано с “десенсибилизацией”, или тахифилаксией, сосудов, т. е. сниженной или качественно измененной их чувствительностью к действию вазоконстрикторных стимулов, обусловленной блокадой или разрегуляцией рецепторов. Другие отличия воспалительной гиперемии связаны с более выраженным кровенаполнением воспаленного участка органа или ткани, расширением и увеличением количества функционирующих капилляров, интенсивностью микроциркуляции, отставанием линейной скорости кровотока и др., что позволяет рассматривать воспалительную гиперемию как специальный вид нарушений микроциркуляции (А. Д. Адо, Г. И. Мчедлишвили). 4. Стаз, который может развиться в некоторых разветвлениях сосудов воспаленной ткани. Распространенный стаз характерен для острого, быстро развивающегося, например гиперергического, воспаления. Стазу предшествует предстатическое состояние, характеризующееся маятникообразным движением крови, когда, вследствие нарастающего застоя крови, потери сосудистого тонуса и резкого расширения капилляров и венул, во время систолы она движется от артерий к венам, а во время диастолы - в обратном направлении. Как правило, нарушение кровотока при воспалительном стазе является преходящим, однако при возникновении повреждений сосудистой стенки и тромбов во многих микрососудах стаз становится необратимым 25 Экссудация (exsudatio; от лат. ex-sudare - потеть) - выпотевание белоксодержащей жидкой части крови через сосудистую стенку в воспаленную ткань. Соответственно жидкость, выходящая при воспалении из сосудов в ткань, называется экссудатом. Термины “экссудат” и “экссудация” употребляются только по отношению к воспалению. Они призваны подчеркнуть отличие воспалительной жидкости (и механизма ее образования) от межклеточной жидкости и транссудата - невоспалительного выпота, выходящего при других, невоспалительных, отеках. Если транссудат содержит до 2 % белка, то экссудат - более 3, до 8 %. Механизм экссудации включает три основных фактора: 1) повышение проницаемости сосудов (венул и капилляров) в результате воздействия медиаторов воспаления и в ряде случаев самого воспалительного агента; 2) увеличение кровяного (фильтрационного) давления в сосудах очага воспаления вследствие гиперемии; 3) возрастание осмотического и онкотического давления в воспаленной ткани в результате альтерации и начавшейся экссудации и, возможно, снижение онкотического давления крови из-за потери белков при обильной экссудации. Ведущим фактором экссудации является повышение проницаемости сосудов. По отношению к сосудистой проницаемости медиаторы воспаления могут быть разделены на две группы: 1) прямодействующие, влияющие непосредственно на эндотелиальные клетки, вызывая их контракцию, - гистамин, серотонин, брадикинин, С5а, С3а, лейкотриены С4 и D4; 2) нейтрофилзависимые, эффект которых опосредуется лейкоцитарными факторами. Такие медиаторы не способны повышать проницаемость сосудов у лейкопенических животных. Это компонент комплемента С5а des Arg, лейкотриен В4, цитокины, в частности интерлейкин-1, отчасти фактор, активирующий тромбоциты. Повышенная проницаемость сосудов в сочетании с увеличенным фильтрационным давлением крови и осмотическим и онкотическим давлением ткани обеспечивает выход жидкой части крови из сосуда и задержку ее в ткани. По некоторым данным, экссудация осуществляется также путем фильтрации и диффузии через микропоры в самих эндотелиальных клетках (трансцеллюлярные каналы), а также не столько пассивным путем, сколько активным - с помощью так называемой микровезикуляции, состоящей в микропиноцитозе эндотелиальными клетками плазмы крови, транспорте ее в виде микропузырьков (микровезикул) по направлению к базальной мембране и выбросе (экструзии) ее в ткань (А. М. Чернух). В зависимости от качественного состава различают следующие виды экссудатов: серозный, фибринозный, гнойный, гнилостный, геморрагический, смешанные (рис. 28). Скопление в ткани экссудата обусловливает такой внешний местный признак воспаления, как припухлость. Кроме того, наряду с действием брадикинина, гистамина, простагландинов, нейропептидов давление экссудата на окончания чувствительных нервов имеет некоторое значение в возникновении воспалительной боли. Выход лейкоцитов в воспаленную ткань (эмиграция лейкоцитов) Эмиграция (emigratio; от лат. emigrare- выселяться, переселяться) - выход лейкоцитов из сосудов в ткань. Осуществляется путем диапедеза главным образом через стенку венул. Эмиграция лейкоцитов в очаг является ключевым событием патогенеза воспаления. Лейкоциты служат основными эффекторами воспаления. . Механизм эмиграции состоит в явлении хемотаксиса ( Пусковым моментом активации фагоцитов является воздействие на рецепторы, часто специфические, их клеточных мембран разнообразных хемотаксических агентов, высвобождаемых микроорганизмами или фагоцитами, а также образующихся в ткани в результате действия воспалительного агента или под влиянием самих фагоцитов Лейкоциты выходят из осевого тока крови в плазматический. Этому способствует нарушение реологических свойств крови, замедление кровотока, изменение его характера, в частности уменьшение краевой плазматической зоны. Вследствие возрастания адгезивных свойств не только лейкоцитов, но прежде всего и главным образом эндотелиальных клеток происходит приклеивание лейкоцитов к эндотелию - развивается феномен краевого стояния лейкоцитов 26 фагоцитоз-активный биологический процесс,заключающийся в поглащениии чужеродного материала и его внутриклеточной деструкции специализированными клетками организма- фагоцитами 27 Воспаление делят на острое и хроническое. Острое воспаление (inflammatio acuta) развивается в связи с внезапным повреждением - ожогом, отморожением, механической травмой, некоторыми инфекциями. Его продолжительность обычно не превышает нескольких суток. Острое воспаление характеризуется выраженными экссудативными реакциями, в ходе которых вода, белки, форменные элементы крови (в основном лейкоциты) покидают кровоток и поступают в зону повреждения. Хроническое воспаление (inflammatio chronica) развивается, когда повреждающий агент действует в течение длительного времени. Хроническое воспаление продолжается недели, месяцы и годы. Оно характеризуется не столько экссудацией, сколько пролиферацией фибробластов и сосудистого эндотелия, а также скоплением в очаге воспаления специальных клеток - макрофагов, лимфоцитов, плазматических клеток и фибробластов. Большая часть наиболее тяжелых болезней человека характеризуется как раз хроническим воспалительным процессом - это лепра, ревматоидный артрит, туберкулез, хронический пиелонефрит, сифилис, цирроз печени и так далее. Хроническое воспаление обычно сопровождается необратимыми повреждениями нормальной паренхимы, дефекты которой заполняются фиброзной соединительной тканью, деформирующей пораженные органы. 47. Стаз: виды, причины, проявления, последствия. Стаз — значительное замедление или прекращение тока крови и/или лимфы в сосудах органа или ткани. Причины ∙ Ишемия и венозная гиперемия. Они приводят к стазу вследствие существенного замедления кровотока (при ишемии в связи со снижением притока артериальной крови, при венозной гиперемии в результате замедления или прекращения её оттока) и создания условий для образования и/или активации веществ, обусловливающих склеивание форменных элементов крови, формирования из них агрегатов и тромбов. ∙ Проагреганты — факторы, вызывающие агрегацию и агглютинацию форменных элементов крови. Виды стаза Все разновидности стаза подразделяют на первичные и вторичные. ∙ Первичный (истинный) стаз. Формирование стаза первично начинается с активации форменных элементов крови и выделения ими большого количества проагрегантов и/или прокоагулянтов. На следующем этапе форменные элементы агрегируют, агглютинируют и прикрепляются к стенке микрососуда. Это и вызывает замедление или остановку кровотока в сосудах. ∙ Вторичный стаз (ишемический и застойный). I Ишемический стаз развивается как исход тяжёлой ишемии в связи со снижением притока артериальной крови, замедлением скорости её тока, турбулентным его характером. Это и приводит к агрегации и адгезии клеток крови. ∙ Застойный (венозно-застойный) вариант стаза является результатом замедления оттока венозной крови, сгущения её, изменения физико-химических свойств, повреждения форменных элементов крови (в частности, в связи с гипоксией). В последующем клетки крови адгезируют друг с другом и со стенкой микрососудов. Проявления стаза При стазе происходят характерные изменения в сосудах микроциркуляторного русла: ∙ уменьшение внутреннего диаметра микрососудов при ишемическом стазе, ∙ увеличение просвета сосудов микроциркуляторного русла при застойном варианте стаза, ∙ большое количество агрегатов форменных элементов крови в просвете сосудов и на их стенках, ∙ микрокровоизлияния (чаще при застойном стазе). В то же время проявления ишемии или венозной гиперемии могут перекрывать проявления стаза. Последствия стаза При быстром устранении причины стаза ток крови в сосудах микроциркуляторного русла восстанавливается и в тканях не развивается каких-либо существенных изменений. Длительный стаз приводит к развитию дистрофических изменений в тканях, нередко — к гибели участка ткани или органа (инфаркт). 48. Расстройства микроциркуляции: причины, типовые формы. Интраваскулярные нарушения: основные формы, причины, проявления и последствия. Микроциркуляция – движение крови по микрососудам и перемещение жидкостей во внесосудистом пространстве. Сосуды микроцитарного русла: артериолы, прекапилляры, посткапилляры, венулы, артериоловентулярные шунты, лимфатические сосуды Ф-ции микроцитарного русла: -капиллярно-трофические: газообмен, поступление субстратов, БАВ; -поддержание системного АД; -терморегуляция Причины Расстройства кровообращения: -СН; -артериальная гиперемия; -венозная гиперемия; -ишемия; изм-ия вязкости и объема крови: -гемоконцентрации; -гемодилюции; -агрегации форменных элементов крови; повреждения стенок сосудов: атеросклероз; -воспаление; -цирроз; -опухоли Интраваскулярные расстройства Замедление и стаз(прекращение) тока крови и лимфы; -ускорение тока крови и лимфы; гипергидрозность - ↓ вязкости Сладж – агрегация, адгезия, агглютинация форменных элементов крови, ведущие к ее сепарации на клеточные элементы, состоящие из эритроцитов, тромбоцитов, лейкоцитов и плазмы. Механизмы Патологические факторы → 1.активация форменных элементов крови и высвобождение из них проагрегантов (АДФ, тромбоксан А2, ПГ, кинины, гистамин); 2.снятие отрицательного поверхностного заряда клеток крови и «перезарядка» его на положительный (кл. сближаются, нач-ся их адгезия); В тканях возникает гипоксия (т.к. эритроциты разносят O2) →выделяются серотонин, гистамин, кинины→нарушения стенок сосудов→жидкость выходит из сосудистого русла 49. Трансмуральные нарушения микроциркуляции: виды, причины, проявления, последствия. Диапедез – чрезмерный выход лейкоцитов, тромбоцитов и эритроцитов через стенки сосудов при повышении проницаемости или нарушении целостности сосудистой стенки ↑ проницаемости –при действии БАВ(гистамины, кинины), рН (происходит деполимеризация базальных мембран) ↓ проницаемости – отложение измененных белков в стенках сосудов (утолщение сосудистой стенки - периваскулярный оттек) Изм-ия могут протекать –без структурных изменений; -с выраженными структурными изменениями (воспаление) 50. Экстраваскулярные расстройства микроциркуляции: основные формы, причины, проявления и последствия. Экстраваскулярные нарушения микроциркуляции Внесосудистые (экстраваскулярные) нарушения микроциркуляции сопровождаются увеличением или уменьшением объёма межклеточной жидкости, что приводит к замедлению оттока её в сосуды микроциркуляторного русла. сы (воспаление, аллергические реакции, рост новообразований, склеротические процессы, венозная гиперемия и/или стаз). Последствия. мального и нарушенного метаболизма. Они могут оказывать цитотокси-ческое и цитолитическое действие. прокоагу-лянтов, мембраноатакующего комплекса), способных усугубить повреждение клеток, потенцировать расстройства крово- и лимфообращения, пластических процессов. 2, СО2, субстратов и продуктов обмена веществ. $ Сдавление клеток избытком интерстициальной жидкости. 51. Капилляро-трофическая недостаточность: характеристика понятия, причины возникновения, механизмы развития, проявления и последствия. Капилляротрофическая недостаточность — состояние, характеризующееся нарушением крово- и лимфообращения в сосудах микроциркуляторного русла, расстройствами транспорта жидкости и форменных элементов крови через стенки микрососудов, замедлением оттока межклеточной жидкости и нарушениями обмена в-в в тканях и органах ( Признаки капилляротрофической недостаточности: В результате комплекса указанных изменений развиваются различные варианты дистрофий, нарушаются пластические процессы в тканях, расстраивается жизнедеятельность органов и организма в целом. 52. Сладж: характеристика понятия, причины, механизмы формирования, проявления и последствия. Сладж – агрегация, адгезия, агглютинация форменных элементов крови, ведущие к ее сепарации на клеточные элементы, состоящие из эритроцитов, тромбоцитов, лейкоцитов и плазмы. Механизмы Патологические факторы → 1.активация форменных элементов крови и высвобождение из них проагрегантов (АДФ, тромбоксан А2, ПГ, кинины, гистамин); 2.снятие отрицательного поверхностного заряда клеток крови и «перезарядка» его на положительный (кл. сближаются, нач-ся их адгезия); В тканях возникает гипоксия (т.к. эритроциты разносят O2) →выделяются серотонин, гистамин, кинины→нарушения стенок сосудов→жидкость выходит из сосудистого русла Классификация иммунопатологических процессов: I. Защитно-приспособительные реакции ИС: 1. 1) B-тип иммунного ответ Типовые нарушения иммуногенной реактивности организма. Общая этиология и патогенез основных форм иммунопатологических состояний и реакций. 2. Иммунодефициты и иммунодефицитные состояния (ИДС): характеристика понятий, виды. Этиология, патогенез, проявления, последствия, принципы терапии наиболее часто встречающихся иммунодефицитов (синдромы ретикулярной дисгенезии, Шедьяка-Хигаси, Луи-Бар, Ди Джорджи; агаммаглобулинемия (болезнь) Брутона; комбинированный иммунодефицит швейцарского типа. 3. Патологическая иммунная толерантность: причины, механизмы формирования, последствия. Понятие об индуцированной (медицинской) толерантности. 4. Реакция “трансплантант против хозяина”: причины, механизмы развития, проявления, возможные последствия. а (ИО), 2) T-тип иммунного ответа , 3) Иммунологическая толерантность (ИТ). II. Патологические реакции ИС - феномены аллергии и аутоиммуноагрессии. III. Иммунологическая недостаточность: 1) Первичные (наследственные) иммунодефициты (ИД), 2) Вторичные (приобретенные) иммунодефициты или иммунодепрессия. Механизмы и формы ио B-типа (гуморальный ио). Индуктивная фаза начинается с фагоцитоза антигена - процессинг: поглощение и переваривание антигена с разделением его на отдельные антигенные структуры. Большая часть поглощенного антигена разрушается. Около 10 % его в переработанной форме появляется на мембране макрофага в виде одинаково ориентированных в пространстве повторяющихся антигенных детерминант - "антигенная обойма". С этой обоймой взаимодействует антигенраспознающий рецептор T-хелперов, причем происходит кеппинг T-рецепторов (образование "шапочки" из рецепторов на мембране лимфоцитов при контакте с антигенной обоймой на мембране макрофагов). Это взаимодействие является специфическим активирующим сигналом. Помимо этого макрофаги начинают секретировать ИЛ-1 (интерлейкин-1). Под влиянием этих двух сигналов T-хелперы активируются, пролиферируют и дифференцируются в продуценты ИЛ-2. ИЛ-2 служит неспецифическим активирующим сигналом для T-B--хелперов, специфический сигнал тот же самый. T-B-хелперы необходимы как источники ИЛ-4, ИЛ-5 и антиген-специфических хелперных факторов. Следующая фаза - продуктивная - активация и пролиферация покоящихся B-лимфоцитов с рецепторами к данному антигену. Активация вызывается кэппингом мембранных иммуноглобулинов и поддерживается ИЛ-1, ИЛ-2 и ИЛ-4. Образуются предшественник плазматических клеток - продуцентов IgM, а в части этих клеток происходит переключение синтеза с IgM на IgG. Одновременно образуются B-клетки памяти. Под действием ИЛ-2, ИЛ-5 и ИЛ6 промежуточные формы B-лимфоцитов превращаются (пролиферируют и дифференцируются) в плазматические клетки, секретирующие IgM или IgG. Эффекторная фаза гуморального иммунного ответа заключается в накоплении достаточного количества IgM, IgG, IgA или IgE, их транспортировке к месту локализации антигена. При встрече антигена и антитела происходит специфическое взаимодействие активного центра иммуноглобулиновой молекулы и антигенной детерминанты, в результате которой всегда образуется иммунный комплекс. Последствия образования иммунного комплекса могут быть различны, поэтому различают следующие эффекторные функции антител: 1) нейтрализация (токсинов, вирусов), 2) агглютинация и преципитация (бактерий, растворимых антигенов), 3) опсонизация, 4) комплемент-зависимый лизис клеток-мишеней. 5) антителозависимая клеточная цитотоксичность, 6) дегрануляция вспомогательных клеток-эффекторов, 7) регуляция по типу обратной связи силы и продолжительности ИО: IgM через Fc IgM усиливают клональную экспансию T-B-хелперов. IgG через Fc IgG усиливают клональную экспансию T-супрессоров. Виды гуморального иммунного ответа: он может быть первичным и вторичным. Для первичного характерна более продолжительная индуктивная фаза (3-5 дней), первоначальное накопление IgM, со сменой на IgG, а затем IgA, ограниченная продолжительность пиковой продукции Ig. При вторичном иммунном ответе индуктивная фаза укорочена благодаря наличию долгоживущих клеток памяти, сразу преобладает накопление IgG, пик продукции антител выше, затухание иммунного ответа происходит значительно позднее. Формы гуморального иммунного ответа: 1) продукция IgM и IgG, 2) продукция IgE, 3) продукция IgA. Значение гуморального иммунного ответа в том, что создается: 1) иммунитет при острых бактериальных инфекциях, 2) иммунитет против растворимых и свободно перемещающихся корпускулярных антигенов. В меньшей степени: 3) противовирусный иммунитет, 4) противоопухолевый и трансплантационный иммунитет. Механизмы и формы ио T-типа (клеточно-опосредованный ио (КОИО)). Существуют 2 основные формы клеточно-опосредованного иммунного ответа: 1. Индуцированная T-клеточная цитотоксичность (ИКЦ) - опосредуется цитотоксическими T-лимфоцитами - (T-киллерами) - ЦТЛ , 2. Реакция гиперчувствительности замедленного типа (РГЗТ) - опосредуется T-эффекторами ГЗТ. Механизмы индуцированной клеточной цитотоксичности. В индуктивную фазу первоначально происходит клональная экспансия T-индукторов ЦТЛ данной специфичности. Макрофаги презентуют им антиген и выделяют ИЛ-1. T-индукторы необходимы, как источник ИЛ-2 и ИЛ-6. Под влиянием этих интерлейкинов, а также специфического взаимодействия с антигеном на поверхности макрофага, генетически измененной собственной или генетически чужеродной клетки предшественники ЦТЛ активируются, пролиферируют и превращаются в клетки памяти или дифференцируются в эффекторы ЦТЛ. В продуктивную фазу ИО наблюдается концентрация ЦТЛ, их перемещение в зону локализации антигена. Значение клеточно-опосредованного иммунного ответа: 1) противовирусный иммунитет, 2) противогрибковый, 3) при хронических бактериальных инфекциях, 4) противоопухолевый, 5) трансплантационный. Феномены трансплантационного иммунитета: 1) РХПТ (реакция хозяин против трансплантата или реакция отторжения трансплантата), 2) РТПХ (реакция трансплантат против хозяина). Развитие этих реакций связано с различиями в специфичности клеточных трансплантационных антигенов сильных и слабых) между донором и реципиентом. Механизм РХПТ: Антигены клеток трансплантата (алло-, ксено-) вызывают выработку антител в регионарных лимфоузлах и в инфильтрате, кроме того происходит мобилизация T-эффекторов ГЗТ и ЦТЛ. Вокруг пересаженной ткани формируется инфильтрат из Т-лимфоцитов, макрофагов и плазматических клеток. Некроз трансплантата наступает вследствие прямого цитотоксического эффекта ЦТЛ, макрофагов, антител и местного расстройства кровообращения. Механизм РТПХ : При аллотрансплантации суспензии клеток селезенки, костного мозга, лимфоузлов реципиенту с неполноценной иммунной системой лимфоциты, прежде всего ЦТЛ, иммунокомпетентного донора повреждают клетки органов и тканей хозяина (т.е. имеет место T-тип ИО). У молодых или новорожденных животных в результате агрессии чужих лимфоцитов развивается болезнь малорослости (синонимы - "гомологическая болезнь", болезньРАНТ). Иммунологическая толерантность (ИТ) (tolerantia - терпимость) - отсутствие ИО на определенный антиген, т.е. специфическая ареактивность ИС, не связанная с ее повреждением (иммунодепрессией), при сохранении способности развивать ИО на другие антигены. Благодаря феномену иммунологической толерантности не происходит специфическая элиминация антигена. Виды иммунологической толерантности: I. Врожденная или естественная ИТ - развивается при контакте с антигеном в эмбриональном или неонатальном периоде развития особи. II. Приобретенная ИТ: а) иммунологическая толерантность "низкой дозы", б) иммунологическая толерантность "высокой дозы". Механизмы иммунологической толерантности: 1. Естественная иммунологическая толерантность обусловлена селекцией клонов, активацией в период внутриутробного развития T-супрессоров аутореактивных клонов лимфоцитов. а) приобретенная иммунологическая толерантность "низкой дозы" опосредована активацией антиген-специфических T-супрессоров, блокирующих ИО, б) иммунологическая толерантность "высокой дозы" отчасти опосредована активацией T-супрессоров, реагирующих на супраоптимальные дозы антигена, кроме того действует механизм "иммунологического паралича". Формы и механизмы первичных иммунодефицитов: - первично повреждение локализовано в иммунной системе и обусловлено аномальным генотипом (унаследованным). Ранними симптомами при первичных ИД являются поражения кожных и слизистых оболочек в виде пятен цвета "кофе с молоком", депигментации, экземы, нейродерматита, ангионевротического отека. I. Комбинированная иммунологическая наследственная недостаточность: а) ретикулярная дисгенезия представляет собой дефект системы костномозгового кроветворения, в результате которого не образуются клеткипредшественницы миело- и лимфопоэза, б) агаммаглобулинемия швейцарского типа. II. T-клеточный иммунодефицит : а) синдром Ди Джорджи, характеризуется гипоплазией тимуса, в результате чего нарушается дальнейшая дифференцировка претимических Tпредшественников, б) синдром Незелоф характеризуется гипоплазией тимуса, очевидно из-за нарушения процесса миграции T-предшественников в тимус, в) наследственная недостаточность фермента пурин-нуклеозид-фосфорилазы, из-за чего страдают процессы дифференцировки T-клеток в тимусе, г) синдром Луи-Бар (атаксия-телеангиоэктазия) нарушена посттимическая дифференцировка T-клеток, что сочетается с недостаточностью IgE и IgA. III. B-клеточный иммунодефицит: а) агаммаглобулинемия Брутона обусловлена нарушением дифференцировки клеток-предшественниц лимфопоэза в клетки предшественницы Bлимфопоэза. б) гипоиммуноглобулинемия с макроглобулинемией нет IgG и IgA. в) селективный дефицит IgA. IV. Дефицит клеток миелоидного ряда: а) хронический гранулематоз, наследственный дефект ферментов гексозомонофосфатного цикла ведет к снижению микробоцидного потенциала нейтрофилов и они фагоцитируют, но не убивают микроорганизмы, б) синдром Вискотта-Олдрича. Нарушена способность макрофагов презентировать антиген, в) синдром Чедиака-Хигаси - нарушена структура и функциональная активность лизосом, г) наследственная недостаточность миелопероксидазы, д) синдром "ленивых лейкоцитов" - нарушена реакция нейтрофилов на хемотаксические стимулы. V. Дефицит системы комплемента: а) дефицит ингибиторов и инактиваторов, стабилизирующих систему, что приводит к перерасходу компонентов комплемента, б) дефицит начальных факторов отменяет активацию комплемента в целом, в) дефицит терминальных компонентов C5-C9 нарушает образование МАК (мембранно-атакующего комплекса). Основные механизмы вторичных иммунодефицитов. Повреждение системы имеет первичный или вторичный характер и может быть обусловлено инфекциями иммунной системы, лимфопролиферативными заболеваниями, истощением ИС вследствие ее патологических реакций и многими другими факторами: 1) химическая, в том числе лекарственная и токсическая иммунодепрессия, 2) лучевая иммунодепрессия, 3) иммунодепрессия гормонами и биологически активными веществами, 4) метаболическая иммунодепрессия, 5) иммунодепрессия в процессе старения, 6) истощение звеньев ИС вследствие иммунопатологических реакций, 7) истинная блокада РЭС, 8) лимфопролиферативные заболевания, 9) инфекционная иммунодепрессия, 10) иммунологическая иммунодепрессия, 11) хирургическая иммунодепрессия. Основные проявления ИД: 1) рецидивирующие инфекции, вызванные различными инфекционными агентами в зависимости от вида ИД. При нарушении В-звена - рецидивирующие бактериальные инфекции (сепсис, пневмония), при недостаточности Т-звена - вирусные и грибковые инфекции, 2) опухолевый рост, лимфопролиферативные заболевания, 3) склонность к аутоиммуноагрессии и аллергии, 4) нарушение гемопоэза, 5) патология желудочно-кишечного тракта - расстройства переваривания, 6) при первичных ИД часто встречаются врожденные уродства, патология опорно-двигательного аппарата и нервной системы. При вторичных ИД нередко также страдает пролиферация и дифференцировка клеток, может сокращаться численность клеток-эффекторов или возникать их функциональная неполноценность, избыток одних гуморальных факторов регуляции и недостаток других факторов, патологическая активация Тсупрессоров и избирательное подавление хелперного потенциала. Принципы патогенетической терапии ид: 1. Заместительная терапия - восполнение дефектного звена. 2. Предупреждение инфекционных осложнений (антибиотики, безмикробная среда). 3. Коррекция нарушений обмена веществ (белки, витамины, микроэлементы). 4. Иммуностимуляторы: Т-активин, В-активин, нуклеин 5. Типовые нарушения регионарного кровотока: общая характеристика. Артериальная гиперемия: виды, причины, механизмы развития, проявления и последствия. 6. Венозная гиперемия: виды, причины, механизмы развития, проявления и последствия. Артериальная гиперемия Артериальная гиперемия – увеличение кровоснабжения органов и тканей за счет притока артериальной крови. Виды Физиологические – в связи с ↑ уровня ф-ции органов и тканей; патологические – вне связи с изм-ием ф-ции органа или ткани, сопровождается патогенным действием Причины Постэритативная – после раздражения, массажей, горчичника; поствокантная – вследствие раздражения; коллатеральная – пересжатие мамстральных сосудов; постишемическая (после малокровий); перегрузочная – гиперемия работающих органов Механизмы Нейрогенный: преобладание парасимпатических влияний на артериолы и прекапилляры в сравнении с симпатическими. Нейротонический - ↑ парасимпатических эффекторных влияний; нейропаралитический - ↓ симпатической импульсации Гуморальный: ↑ уровня сосудорасширающих БАВ (аденозина, ПГ А, Е, I2, кининов) Нейромиопаралитический: ↓ тонуса мышечных волокон артериол и прекапилляров вследствие действия физических факторов (грелки, горчичники, механическое давление) Проявления Линейная скорость кровотока: ↑ Объемная скорость кровотока: ↑ Окраска органа и ткани: краснота Температура: ↑ Объем органов: незначительно ↑ Лимфообразование: ↑ Боль: Значение Объем в-в (окислительное фосфорилирование): При физиологической: ↑ ф-ции органов и тканей,↑ обеспечение процессов гипертрофии и гиперплазии клеток и тканей Гликолиз: норма При патологической: -перерастяжение и микроразрывы стенок сосудов микроциркуляторного русла; -микро- и макрокровоизлияния, кровотечения наружные и внутренние Венозная гиперемия Венозная гиперемия - ↑ кровенаполнения в органах и тканях в результате нарушения оттока венозной крови. Виды Компрессионная – сужение просвета вены или венулы опухолью, рубцом, жгутом, тугой повязкой Обтурационная – закупорка тромбом, эмболом, опухолью Застойная – нарушение работы сердца (насосной ф-ции); нарушение работы венозных клапанов Врожденные или приобретенные дефекты клапанного аппарата вен Проявления Линейная скорость кровотока: ↓ Объемная скорость кровотока: ↓ Окраска органа и ткани: цианоз (синюшность) Температура: ↓ Объем органов: ↑↑ (за счет тканей) Лимфообразование: ↑↑↑ (кр. скапл-ся в тк. и происх. отек) Боль: + Объем в-в (окислительное фосфорилирование): ↓ Гликолиз: ↑ Значение -↓ функции органов и тканей; -гипотрофия и гипоплазия клеток и тканей; -некроз клеток и развитие соединительной ткани (склероз, цирроз) 7. Ишемия Ишемия: характеристика понятия, причины, механизмы возникновения, проявления и последствия. Понятие об эмболии. Компенсаторные реакции при ишемии. Ишемия – несоответствие притоком к тканям крови и потребностью в ней. (потребность всегда выше притока) Причины Физические – низкая температура, механические воздействия) Химические – никотин, эфедрин, мезатон Биологические – катехоламины, ангиотензин-II, ПГ F, вазопрессин; продукты жизнедеятельности бактерий, паразитов Механизмы Нейротонический – преобладание симпатоадреналовых влияний на артериолы и прекапилляры в сравнении с парасимпатическими; Нейропаралитический - ↓ активности парасимпатических влияний на артеиолы. Гуморальный - ↑ содержание в ткани агентов с вазоконстрикторным эффектом (ангиотензин II, вазопрессина, ПГ F, тромбоксан А2, катехоламины) Механические – сдавление сосуда (опухолью, рубцом, жгутом, отечной жидкостью), закупорка (тромбом, эмболом) Проявления Линейная скорость кровотока: ↓ Значение Объемная скорость кровотока: ↓ -↓ функции органов и тканей; -гипотрофия и атрофия тканей и органов; некроз ткани Окраска органа и ткани: бледность Температура: ↓ (очень резко) Объем органов: ↓ Лимфообразование: ↓ развития 14Врождённые пороки Боль: +++ резкая боль (при ↓ рН, Н+ вызывают раздражение болевых рецепторов, выделяются мед. серотонин, АХ) Объем в-в (окислительное фосфорилирование): ↓↓ Врождённые Гликолиз: ↑↑↑пороки развития (ВПР), включая аномалии развития, дисплазии и стигмы дизэмбриогенеза, а также причины их появления изучает тератология. Механизм формирования ВПР в ходе внутриутробного развития обозначается как тератогенез, а термин «тератоген» подразумевает фактор, вызвавший ВПР. Большинство ВПР обусловлено воздействием факторов внешней среды, генетическими дефектами или их сочетанием. В ряде случаев не удаётся установить причину ВПР (спорадические заболевания). Число новорождённых с ВПР составляет 2—3% общего количества родившихся живыми детей. Причины ВПР многочисленны: вирусная инфекция (краснуха, цитомегаловирусная и герпетическая инфекции), токсошгазмоз, сифилис, радиация, ЛС, наркотические вещества, химические факторы окружающей среды, болезни матери и т.д. Восприимчивость к действию тератогенов зависит от стадии развития. Риск возникновения ВПР особенно велик в эмбриогенезе и органогенезе. ПРИЧИНЫ ВПР Тератогенные воздействия Тератогенные факторы — те средовые факторы, которые нарушают развитие эмбриона и/или плода, воздействуя на эмбрион и/или плод в течение беременности. По крайней мере 10% всех ВПР обусловлено воздействием факторов внешней среды. Эффект тератогенов обусловлен влиянием на гисто- и органогенез, рост и развитие плода. Генетические нарушения Генетические факторы могут приводить как к единичным ВПР, так и к развитию многообразных синдромов. Спорадические заболевания Спорадические заболевания часто бывают следствием нарушения эмбрионального развития или патологического течения беременности (например, при окклюзии кровеносных сосудов). Некоторые врождённые аномалии могут возникать в результате спонтанной доминантной мутации (91) соматических клеток, либо приводящей к летальному исходу, либо оказывающей воздействие на репродуктивную функцию и не передающейся потомству. ФАКТОРЫ РИСКА ВПР Факторы риска развития ВПР подразделяют на эндогенные и экзогенные (средовые). Эндогенные факторы риска Среди эндогенных факторов риска ВПР выделяют мутагены, эндокринные и метаболические заболевания матери, аномалии половых клеток, возраст родителей. ∙ Мутагены могут вызвать изменения генетического аппарата, на долю генных и хромосомных мутаций приходится более 30% всех ВПР. ∙[∙ Генные мутации являются причиной около 20% от всех ВПР (например, расщелины губы и нёба как одно из клинических проявлений синдрома Ван дер Вуда). ∙(∙ Хромосомные мутации обусловливают развитие примерно 10% ВПР (например, пороки сердца при синдроме Дауна). ∙ Эндокринные заболевания и метаболические расстройства в организме матери нарушают развитие органов плода или приводят к самопроизвольным абортам. Наиболее часто ВПР наблюдаются при СД, вирилизирую-щих опухолях половых желёз и коры надпочечников, фенилкетонурии. ∙ При аномалиях половых клеток (результат нарушения спермато- и/или овогенеза) возникают анеуштоидии и триплоидии. ∙ Возраст родителей. | Возраст отца. Установлена прямая зависимость между нарастанием частоты некоторых ВПР (например, расщелины губы и нёба) и аутосом-нодоминантных наследственных заболеваний (например, ахондропла-зии) и увеличением возраста отца. ∙(∙ Возраст матери. ВПР дыхательной системы чаще отмечаются у юных матерей. У матерей старших возрастных групп увеличена частота рождения детей с геномными мутациями (классический пример: значительное увеличение трисомий, в том числе синдром Дауна). >« зогенные факторы риска : долю средовых факторов риска приходится около 10% всех ВПР. Природа генных факторов риска может быть физической, химической, биологичес-I сочетанной. ∙ Физические воздействия: радиационные, вибрационные, шумовые, температурные, механические. Из механических факторов большое клиническое значение имеют амниотические сращения, маловодие и миомы матки. + Амниотические сращения (тяжи Симонара) могут приводить к перетяжкам на конечностях, вызывая гипоплазию их дистальных отделов или ампутацию. * Маловодие может обусловить развитие ВПР конечностей, гипоплазии нижней челюсти и др. * Крупные миомы препятствуют нормальному росту и развитию эмбриона или плода. пческие агенты г Некоторые ЛС (например, антиконвульсант гидантоин вызывает развитие расщелины губы и нёба, микроцефалию, гипоплазию ногтей и концевых фаланг пальцев, деформацию носа; транквилизатор талидомид может вызвать ВПР верхних и нижних конечностей [вплоть до амелии], расщелины губы и нёба) * Химические вещества, применяемые в быту и в промышленности (например, продукты метаболизма этанола могут привести к алкогольной ∙мбрио- или фетопатии; бензин, бензол, фенол, соли тяжёлых металлов обладают эмбриотоксическими свойствами). 15 Патофизиология наследственных болезней Наследственность - это присущее всем орга низмам свойство обеспечивать в ряде поколений преемственность одинаковых признаков и особенностей развития - морфологической, физиологической и биохимической организации живых существ, характера их индивидуального развития (онтогенеза). Классификация наследственных болезней: доминантные и рецессивные; спонтанные и индуцированные. Спонтанные мутации - не ясна причина, но оказывает влияние радиационный фон, химические мутагены, ошибки репликации в структуре ДНК. Но спонтанный мутагенез уровновешивается способностью организма к выведению (элиминации) этих структур сохраняется равновесие, но с возрастом мутагенез нарастает. Индуцированный мутагенез - при внешнем воздействии элиминации, как защиты, уже недостаточно. В настоящее время актуальность учения о наследственности все больше возрастает, поскольку постоянно выдвигаются на повестку дня социальные проблемы генетики человека: а) развивается генная инженерия, получение наиболее полноценного поколения, б) философские взгляды на основы наследственности используются буржуазными идеологами для объяснения различных философских направлений, в) успехи борьбы со злокачественными опухолями тесно связаны с успехами в области генетики, г) успехи в области генетики открывают перспективы в области освоения космического пространства, д) все более актуальной становится проблема профилактики и лечения наследственных заболеваний, число которых непрерывно увеличивается. Частота наследственных заболеваний увеличилась по следующим причинам: 1. Резко снизилась (в 10-12 раз) детская смертность, что ведет к выявлению мутантов (лиц с наследственной патологией) в более позднем возрасте. 2. Резко увеличилась продолжительность жизни больных людей (например, раньше при сахарном диабете женщины умирали, а сейчас живут и рожают детей, больных диабетом. Методы изучения наследственных болезней: 1. Генеалогический - изучение родословных семей в ряде поколений. 2. Близнецовый. Близнецы бывают похожие, монозиготные, идентичные, одинаковые - конкордантные, даже линии на коже ладони расположены однотипно, а есть и непохожие, неодинаковые, дискордантные - дизиготные. Установлено, что у истинных конкордантных близнецов чаще бывает одна и та же патология, поскольку они развиваются из одной оплодотворенной яйцеклетки путем ее расщепления. Иногда это расщепление бывает неполным и, хотя развиваются два самостоятельных организма (2 человека), но они могут быть соединены между собой. 3. Географический и популяционно-статистический. 4. Кариологические исследования половой принадлежности клеток организма - эпителия, лейкоцитов. 5. Исследование генетики соматических клеток при их скрещивании при культивировании в питательной среде in vitro - получение гибридом опухолевых и плазматических клеток -наработка антител. 6. Иммунологические исследования - патология генов, ответственных за выработку определенных факторов - предсказание риска отторжения пересаженных тканей. 7. Иммуногематологические исследования - определение групп крови. 8. Биохимические исследования - определение ферментов или их продуктов. Чрезвычайно важна ранняя диагностика. Сейчас применяют скрининг-тесты - экспресс-диагностика. Вводится положение о том, чтобы у всех родившихся была исследована кровь на фенилкетонурию, галактоземию и др. Механизм передачи энзимопатий - рецессивный, т.е. папа и мама могут быть здоровы, а ребенок может быть болен. При подозрении во время беременности делается амниоцитодиагностика (исследования амниотической жидкости в 12-16 недель беременности) и при угрозе заболевания - прерывание. Виды мутаций: 1. Хромосомные аберрации : а) делеция - утрата хромосом, б) дубликация - удлинение хромосомы за счет повторения сегмента, в) транслокация - перенос части хромосомы на другую, г) инверсия - перевертывание сегментов хромосомы. Такие дети погибают. Доминантные болезни: синдактилия - сращение пальцев, брахидактилия - укорочение пальцев, полидактилия - многопалость, ахондроплазия - укорочение рук и ног, нарушение роста хрящей длинных трубчатых костей (а голова и туловище нормальные). Рецессивные болезни (частая причина кровные браки. Могут быть изоляты по 1 признаку: имущественному, классовому, религиозному, кастовому, сословному, профессиональному, образовательному. Наследственные болезни по рецессивному типу: 1) связанные с полом - гемофилия, дальтонизм, всего 60 заболеваний. 2) не связанные с полом - носители генов аутосомы - аутосомные болезни: заячья губа, волчья пасть, микроцефалия, ихтиоз (кожа как рыбья чешуя), нарушения аминокислотного обмена - альбинизм, фенилкетонурия. Проявление болезни зависит от свойств генов: 1) пенетрантность (частота проявления патологического признака), 2) плейотропия - влияние гена на многие другие признаки организма, 3) экспрессивность - интенсивность проявления признака может быть - усилена или ослаблена. Хромосомные болезни - или аномалии - нарушение нормального распределения при редукционном делении XX хромосом женщины. Патология половых хромосом: 4 типа хромосомных болезней: XXY - синдром Клейнфельтера - мужской пол, высокий рост, астеничное телосложение, длинные ноги, инертность, часто умственная отсталость, снижение сперматогенеза, бесплодие. Это хроматинположительные мужчины с половым хроматином в эпителии, лейкоцитах (у здоровых его нет). X - синдром Шершевского-Тернера-Бонневи-Ульриха - женщина низкорослая 125-140 см., инфантилизм, аменорея, бесплодие, отсутствие вторичных половых признаков, хроматинотрицательные. XXX - синдром трисомии впервые описан у женщины с наличием двух телец полового хроматина, проявляется гипофункцией яичников, часто бесплодием, умственной отсталостью. Y - не жизнеспособен, т.к. нет X-хромосомы. Моносомия по X-признаку. Нарушение хромосомного комплекта аутосом у человека описаны в виде трисомии по 21 паре, 13-15, 17, 18 и 22. Трисомия по 21 паре хромосом - болезнь Дауна - одинаково часто встречается у мужчин и женщин. В соматических клетках у детей 47 хромосом, это разновидность детской олигофрении. Она проявляется: умственная отсталость, малый размер черепа, плоский затылок, микробрахицефалия (дети одной матери), косое расположение глаз, отсталость в росте, короткие конечности, недоразвитие половых органов. Нерасхождение 21 пары и возникновение болезни Дауна: а) поздняя беременность (19 лет - 0,04%, 45-49 лет-2,17%=более чем в 50 раз), б) условия жизни (у женщин в концлагерях - 0,9% (обычно 0,15-0,2%), чаще в городе-0,16%, на селе 0,12%). Нерасхождение других аутосом - может быть моносомичные и трисомичные, всего 44 аномальных наследственных конституционных типа. Может быть одновременно XXY Клейнфельтера и +21 пара Дауна. Интересно, что трисомия всего хромосомного комплекта дает менее резкие отклонения. Нерасхождение может быть при делениях, дроблениях и закладке признаков. Трисомия 13 пары ведет к возникновению синдрома Патау (это сублетальная аномалия) - микроцефалия, пороки сердца в 100%, дети живут около 100 дней. Трисомия 18 пары синдром Эдвардса (так же сублетальная аномалия, живут от 2 до 10 месяцев, характерна микроцефалия, пороки развития полости рта, идиотизм, пороки сердца. Уровни проявлений наследственных мутаций : 1) морфологический - волчья пасть, пороки сердца, многопалость, 2) физиологический - гипертония, диабет, гемофилия, дальтонизм, опухоли, 3) биохимический (энзимопатии) - нарушение обмена веществ, галактоземия, алкаптонурия, фенилкетонурия. Принципы диагностики: 1. Исследование кариотипа - брать клетки из амниотической жидкости. 2. Массовые биохимические исследования - скрининг на выявление фенилкетонурии, муковисцидоза. 3. Экспресс-анализ мочи и кала. 4. Массовые скрининг-иммунологические исследования. 5. Генетические исследования в культуре клеток. Признаки наследственной патологии: 1. Затяжные заболевания и отсутствие эффекта от терапии. 2. Наличие врожденной патологии. 3. Генеалогические исследования. Лечение - для некоторых обменных заболеваний диета, замещение недостающих факторов, подсадка генов, отвечающих за выработку необходимых ферментов. Пути профилактики: 1. Ранняя диагностика и лечение (исключение пищи фенилаланила, галактозы). 2. Профилактика: а) на фенотипическом уровне атеросклероза, гипертонии, подагры, б) на генотипическом - изучение родословных, консультации по поводу риска иметь ребенка с дефектом. Принципы патогенетической терапии наследственных болезней. Главной задачей является фенотипическая коррекция, которая, несмотря на сохранение мутантного генотипа, позволила бы вести комфортабельный и здоровый образ жизни. 1) диетическое ограничение субстрата, 2) возмещение дефицита конечного продукта, 3) истощение накапливающихся веществ (холестерина, цистина, меди, железа, мочевой кислоты фармакологическими средствами), 4) усиление активности ферментов, 5) замещение мутантного белка, 6) трансплантация органов, 7) хирургическое вмешательство, 8) коррекция гормонального дисбаланса, 9) гензамещающая терапия. 8. Повреждение клетки: характеристика понятия; основные причины и типовые механизмы повреждения клетки. Повреждение клетки Клетка – элементарная саморегулирующейся структурно-функциональная единица организма. Повреждение клетки – изм-ия ее структуры, метаболизма, физико-химических св-в и ф-ций, к-рые ведут к нарушению жизнедеятельности. Причины Физические –механические воздействия; -термические воздействия; -изменения осмотического давления в клетках; -избыток свободных радикалов Химические –органические и неорганические к-ты и щелочи; -соли тяжелых Ме; -цитотоксические в-ва; -лекарственные в-ва Биологические – микроорганизмы; -цитотоксические Ig; -цитотоксические клетки; -дефицит или избыток БАВ Механизмы Расстройства регуляции энергообеспечения: -↓ интенсивности и эффективности процессов ресинтеза-нарушения АТФ; -нарушение транспорта энергии АТФ; Расстройства ф-ций клеток: -нарушения образования вторичных посредников; фосфорилирования протеинкиназ нарушение использования энергии АТФ Повреждение мембран и ферментов клеток: -↑ свободнорадикальных р-ций; -активация гидролаз; -↓ процессов ресинтеза Дистрофии поврежденных компонентов мембран; -нарушение конформации молекул белка, липопротеидов, фосфолипидов; -перерастяжение и Дистрофии – нарушения обмена в-в в клетках, сопроваждающиеся расстройствами их ф-ций, пластических процессов и структурными разрыв мембран набухших клеток изменениями, ведущими к нарушению их жизнедеятельности Дисбаланс ионов и жидкости: -изм-иетипа соотношение отдельных ионов в гиалоплазме; -гипергидратация клеток; -дегидратация клеток Виды (в зависимости от нарушенного обмена в-в) Нарушения(диспротеинозы); генетической программы -мутации; -дерепрессия патогенных генов; -репрессия жизненно важных генов; -нарушения -белковые -жировыеклеток: (липидозы; -углеводные; -пигментные; -минеральные митоза и мейоза характеристика понятия, Виды аллергических реакций, их стадии и общие звенья патогенеза 32. Аллергия: Аллергия (от греч. allos - иной, ergon - действую) - иммунная реакция организма на какие-либо вещества антигенной или гаптенной природы, сопровождающаяся повреждением структуры и функции клеток, тканей и органов. -Общими особенностями, объединяющими все аллергические болезни, являются: 1) этиологическая роль различных аллергенов;2) иммунологический механизм развития;3) повреждающее действие комплекса АГАТ или АГ-сенсибилизированных лимфоцитов на клетки и ткани организма. I тип, к которому относятся аллергические реакции немедленного типа, включает 2 подвида: 1) реагиновый, связанный с выработкой антител IgE-класса и лежащий в основе атопических заболеваний;2) анафилактический, обусловленный в основном IgG4антителами и наблюдающийся при анафилактическом шоке. II тип - цитотоксический, связан с образованием IgG (кроме IgG4)- и IgM-антител к детерминантам, имеющимся на собственных клетках. По этому типу протекают некоторые гематологические заболевания, например аутоиммунная гемолитическая анемия, миастения и др. III тип - иммунокомплексный, связан с образованием комплексов аллергенов и аутоаллергенов с IgG- или IgM-антителами и с повреждающим действием этих комплексов на ткани организма. По этому типу развиваются, например, сывороточная болезнь, анафилактический шок и др. IV тип - клеточно-опосредованный (другое название - гиперчувствительность замедленного типа, ГЗТ), связан с образованием сенсибилизированных лимфоцитов (Т-эффекторов). По этому типу развиваются: аллергический контактный дерматит, реакция отторжения трансплантата. -Независимо от того, к какому типу относится аллергическая реакция, в ее развитии можно выделить три стадии. I. Стадия иммунных реакций (иммунологическая). Начинается с первого контакта организма с аллергеном и заключается в образовании в организме аллергических антител (или сенсибилизированных лимфоцитов) и их накоплении. В результате организм становится сенсибилизированным или повышенно чувствительным к специфическому аллергену. При повторном попадании в организм специфического аллергена происходит образование комплексов АГ-АТ (или АГ-сенсибилизированный лимфоцит), которые и обусловливают следующую стадию аллергической реакции. II. Стадия биохимических реакций (патохимическая). Суть ее состоит в выделении готовых и образовании новых биологически активных веществ (медиаторов аллергии) в результате сложных биохимических процессов, запускаемых комплексами АГ-АТ или АГсенсибилизированным лимфоцитом. III. Стадия клинических проявлений (патофизиологическая). Представляет ответную реакцию клеток, органов и тканей организма на образовавшиеся в предыдущей стадии медиаторы. 33. Аллергические реакции реагинового (анафилактического, атонического) типа -1 тип по Gel), Coombs: причины, особенности патогенеза и проявления. В основе аллергических реакций I типа лежит выработка в организме IgE-антител, т. е. IgE-ответ - главное звено развития аллергической реакции 1 типа. IgE-антитела значительно отличаются по своим свойствам от других антител Прежде всего они обладают цитотропностью (цитофильностью). Фиксация антител клетками происходит при помощи рецептора, встроенного в мембрану клеток. Самой высокой способностью связывать IgE-антитела обладают рецепторы для IgE, найденные на тучных клетках и базофилах крови, поэтому эти клетки получили название клетки-мишени I порядка. Связывание IgE на клетках - зависимый от времени процесс. Оптимальная сенсибилизация может наступить через 24-48 ч. В патогенезе аллергических реакций I типа выделяют следующие стадии: I. Стадия иммунных реакций-, IgEответ является главным звеном развития аллергической реакции I типа Введение антигена (1-й сигнал) активирует макрофаги и вызывает в них секрецию факторов (интерферон, интерлейкины), стимулирующих Т-клетки Итак, первичное попадание аллергена в организм запускает через кооперацию макрофагов, Т- и В-лимфоцитов сложные и до конца не ясные механизмы синтеза IgE-антител, фиксирующихся на клетках-мишенях. II. Стадия биохимических реакций. В этой стадии основная роль принадлежит тучным клеткам и базофилам, т. е. клеткам- мишеням I порядка. Образование комплекса АГ-АТ на поверхности тучной клетки (или базофила) приводит к стягиванию белков-рецепторов для IgE, клетка активируется и секретирует медиаторы. В результате присоединения аллергена рецепторы приобретают энзиматическую активность и запускается каскад биохимических реакций. Увеличивается проницаемость клеточной мембраны для ионов кальция. По окончании реакции АГ-АТ клетка остается жизнеспособной. III. Стадия клинических проявлений. В результате действия медиаторов развивается повышение проницаемости микроциркуляторного русла, что сопровождается выходом жидкости из сосудов с развитием отека и серозного воспаления. В развитии аллергических реакций I типа выделяют раннюю и позднюю стадии. Ранняя стадия появляется в течение первых 10-20 мин в виде характерных вздутий (пузырей). В ней преобладает влияние первичных медиаторов. Поздняя стадия аллергической реакции наблюдается через 2-6 ч после контакта с аллергеном и в основном связана с действием вторичных медиаторов 34. Аллергические реакции цитотоксического (цитолитического) типа - II тип по Gelt, Coombs: причины, особенности патогенеза и проявления. Цитотоксическим его называют потому, что образовавшиеся к антигенам клеток антитела соединяются с клетками и вызывают их повреждение и даже лизис (цитолитическое действие). Причиной цитотоксических реакций является возникновение в организме клеток с измененными компонентами клеточной мембраны. Большую роль в процессе приобретения клетками аутоаллергенных свойств играет действие на клетки различных химических веществ, чаще лекарств, попадающих в организм. Повреждающее действие на клетку могут оказывать лизосомальные ферменты фагоцитирующих клеток, бактериальные энзимы, вирусы. I. Иммунологическую стадию- В ответ на появление аутоаллергенов начинается выработка аутоантител IgG- и IgM-классов. Антитела (IgG) участвуют в К-клеточном лизисе Fab- и Fc-фрагментами (рис. 16). Считается, что антитела служат “мостиком” между эффекторной клеткой и клеткой-мишенью. II патохимическую стадию появляются медиаторы, иные, чем в реакциях реагинового типа.1. Основным медиатором комплементопосредованной цитотоксичности являются активированные по классическому пути (через комплекс АГ-АТ) компоненты комплемента: С4в2а3в; За,С5а; С567; С5678; С56789. В результате в мембране клетки образуется гидрофильный канал, через который начинают проходить вода и соли.2. Во время поглощения опсонизированных клеток фагоциты выделяют ряд лизосомальных ферментов, которые могут играть роль медиаторов повреждения. 3. В ходе реализации антителозависимой клеточной цитотоксичности также принимает участие секретируемый гранулоцитами крови супероксидный анион-радикал. III. Патофизиологическую стадию. Конечным звеном комплемент- и антителозависимой цитотоксичности являются повреждение и гибель клеток с последующим удалением их путем фагоцитоза. Цитотоксический тип играет важную роль в системе иммунитета, когда в качестве антигена выступают чужеродные для данного организма клетки, например, микробы, простейшие, опухолевые или отработавшие свой срок клетки организма. В клинике цитотоксический тип реакции может быть одним из проявлений лекарственной аллергии в виде лейкопении, тромбоцитопении, гемолитической анемии. 35. Аллергические реакции иммунокомплексного (преципитинового) типа - III тип по Gell, Coombs: причины, особенности патогенеза и проявления Повреждение при этом типе аллергической реакции вызывается иммунными комплексами АГ-АТ. Причиной иммунокомплексных заболеваний являются экзо- и эндоантигены и аллергены. Среди них: лекарственные препараты (пенициллин, сульфаниламиды и др.), антитоксические сыворотки, гомологичные гамма-глобулины, пищевые продукты (молоко, яичные белки и др.), ингаляционные аллергены (домашняя пыль, грибы и др.), бактериальные и вирусные антигены, ДНК, антигены клеточных мембран и др. Важно, что антиген имеет растворимую форму.I. Иммунологическая стадия. В ответ на появление аллергена или антигена начинается синтез антител, преимущественно IgG- и IgM-классов (рис. 17). Эти антитела называют также преципитирующими за их способность образовывать преципитат при соединении с соответствующими антигенами. II. Патохимическая стадия. Под влиянием ИК и в процессе его удаления образуется ряд медиаторов, основная роль которых заключается в обеспечении условий, способствующих фагоцитозу комплекса и его перевариванию. Однако при неадекватности сложившихся условий (см. III стадию) процесс образования медиаторов может оказаться чрезмерным, и тогда они начинают оказывать и повреждающее действие. Основными медиаторами являются:1. Комплемент, в условиях активации которого различные компоненты и субкомпоненты оказывают цитотоксическое действие. Ведущую роль играет образование СЗ, С4, С5, которые усиливают определенные звенья воспаления (СЗв усиливает иммунную адгезию ИК к фагоцитам, СЗа играет роль анафилатоксина, как и С4а,и т. д.). 2. Лизосомальные ферменты, освобождение которых во время фагоцитоза усиливает повреждение базальных мембран, соединительной ткани и т. д.3. Кинины, в частности брадикинин. При повреждающем действии ИК происходит активация фактора Хагемана; в результате из альфа-глобулинов крови под влиянием калликреина образуется брадикинин.4. Гистамин, серотонин играют большую роль в аллергических реакциях III типа. Источником их являются тучные клетки, тромбоциты и базофилы крови. Они активируются СЗа- и С5а-компонентами комплемента.5. Супероксидный анион-радикал также принимает участие в развитии реакции этого типа.Действие всех перечисленных основных медиаторов характеризуется усилением протеолиза. III. Патофизиологическая стадия. В результате появления медиаторов развивается воспаление с альтерацией, экссудацией и пролиферацией. Развиваются васкулиты, приводящие к появлению узловатой эритемы, узелкового периартериита, гломерулонефрита. Могут возникать цитопении (например, гранулоцитопении). Вследствие активации фактора Хагемана или/и тромбоцитов иногда происходит внутрисосудистое свертывание крови. Третий тип аллергических реакций является ведущим в развитии сывороточной болезни, экзогенных аллергических альвеолитов, некоторых случаев лекарственной и пищевой аллергии, в ряде случаев аутоиммунных заболеваний (ревматоидный артрит и др.). При значительной активации комплемента развивается системная анафилаксия в виде шока 36. Аллергические реакции туберкулинового (клеточно-опосредованного, замедленного) типа - IV тип по Geil, Coombs: причины, особенности патогенеза и проявления Гиперчувствительность IV типа лежит в основе многих аллергических и инфекционных заболеваний, аутоиммунных болезней, отторжения трансплантата (трансплантационный иммунитет), контактного дерматита (контактная аллергия), противоопухолевого иммунитета. Самым ярким ее проявлением является туберкулиновая реакция, которая в клинической практике используется в виде реакции Манту. Иммунологическая стадия. Поступающий в организм антиген чаще всего встречается с макрофагом, обрабатывается им, а затем в переработанном виде передается Т-лимфоцитам-индукторам, имеющим на своей поверхности рецепторы для антигена. Клетки-индукторы распознают антиген, а затем с помощью интерлейкинов (веществ-посредников, выделяемых макрофагами и лимфоцитами) запускают пролиферацию антигенраспознающих клеток - Т-эффекторов (Т-киллеров), а также клеток памяти. II. Патохимическая стадия. Антигенная стимуляция лимфоцитов сопровождается их трансформацией, образованием и дальнейшим выделением медиаторов ГЗТ-лимфокинов. Для каждого медиатора на клетках-мишенях обнаружены рецепторы. Действие медиаторов неспецифично (для их действия не нужен антиген). Биологический эффект лимфокинов разнообразен (табл. 13). Они изменяют клеточную подвижность, активируют клетки, участвующие в воспалении, способствуют пролиферации и созреванию клеток, регулируют кооперацию иммунокомпетентных клеток. Клетками-мишенями для них служат: макрофаги и нейтрофилы, лимфоциты, фибробласты, стволовые клетки костного мозга, опухолевые клетки, остеокласты и др. Все лимфокины - белки, большинство из них - гликопротеиды. В зависимости от оказываемого эффекта лимфокины делят на две большие группы: 1) факторы, подавляющие функциональную активность клеток (фактор, угнетающий миграцию макрофагов или лимфоцитов; фактор, агглютинирующий макрофаги; хемотаксические факторы; лимфотоксины);2) факторы, усиливающие функциональную активность клеток (фактор переноса; факторы, активирующие макрофаги или лимфоциты; митогенный фактор и др.). III. Патофизиологическая стадия. Зависит от природы этиологического фактора и той ткани, где “разыгрывается” патологический процесс. Это могут быть процессы, протекающие в коже, суставах, внутренних органах. В воспалительном инфильтрате преобладают мононуклеарные клетки (лимфоциты, моноциты и макрофаги). Нарушение микроциркуляции в очаге повреждения объясняется повышением проницаемости сосудов под влиянием медиаторов белковой природы (кинины, гидролитические ферменты, фактор проницаемости), а также активацией свертывающей системы крови и усилением образования фибрина. Отсутствие значительного отека, так характерного для аллергических поражений при реакциях немедленного типа, связано с весьма ограниченной ролью гистамина в ГЗТ. Составной частью ГЗТ является воспаление, которое подключается к иммунной реакции действием медиаторов патохимической стадии. 40. Венозная гиперемия: виды, причины, механизмы развития, проявления и последствия Гиперемия - . увеличение кровенаполнения участка ткани. Венозная гиперемия. Она может развиться уже через несколько минут после воздействия воспалительного агента, однако характеризуется значительной продолжительностью - сопровождает весь ход воспалительного процесса. Одновременно, поскольку при ее участии осуществляются основные воспалительные явления, она считается истинной воспалительной гиперемией.В механизме венозной гиперемии различают три группы факторов:а) нарушения реологических свойств крови и собственно ее циркуляции. Сюда относятся повышение вязкости крови вследствие ее сгущения, обусловленного экссудацией, потери альбуминов, увеличения содержания глобулинов, изменения коллоидного состояния белков; усиление сопротивления кровотоку в результате краевого стояния лейкоцитов, набухания и агрегации эритроцитов; тромбообразование вследствие активации свертывающей системы крови; нарушение характера кровотока - замедление тока крови в осевой зоне, уменьшение краевой плазматической зоны;б) изменения сосудистой стенки, которые включают потерю сосудистого тонуса вследствие паралича нервно-мышечного аппарата сосудов; снижение эластичности сосудистой стенки; набухание эндотелия и повышение его адгезивности, в результате чего просвет сосудов сужается, создаются условия для прилипания лейкоцитов к эндотелию;в) тканевые изменения, состоящие в сдавлении венул и лимфатических сосудов отечной, инфильтрированной тканью; снижении упругости соединительной ткани. Патогенетические варианты венозной гиперемии. 1. Обтурационная - закупорка вен тромбом, эмболом и т.д. 2. Компрессионная - сдавление вен опухолью, отечной жидкостью, рубцом и т.д. 3. Застойная - нарушение движения крови по венам вследствии сердечной недостаточности, недостаточности клапанного аппарата вен, снижении мышечного тонуса и т.д 41. Ишемия: характеристика понятия, причины, механизмы возникновения, проявления и последствия. Понятие об эмболии. Компенсаторные реакции при ишемии. Ишемия - типовой патологический процесс, характеризующийся снижением притока артериальной крови к участку ткани или органу. Причины ишемии могут иметь различное происхождение и природу. • По природе причины ишемии делят на физические, химические и биологические. t Физические факторы: сдавление артериальных сосудов (например, опухолью, рубцовой тканью, инородным телом, жгутом), сужение или закрытие просвета изнутри (например, тромбом, эмболом, атеросклеротической бляшкой), действие чрезмерно низкой температуры. t Химические факторы. Многие химические соединения обладают способностью вызывать сокращение ГМК артериальных сосудов и сужение и\ просвета. Примеры: никотин, ряд ЛС (мезатон, эфедрин, препараты адреналина, АДГ, ангиотензины). f Биологические факторы: БАВ с сосудосуживающими эффектами (например, катехоламины, ангиотензин II, АДГ, эндотелии), БАВ микробногс происхождения: их экзо- и эндотоксины, метаболиты с вазоконстриктор-ным действием. По происхождению выделяют ишемии, причина которых имеет эндогенное или экзогенное происхождение (инфекционное и неинфекционное). • Нейрогенный механизм (нейротонический и нейропаралитический). * Нейротонический. Характеризуется преобладанием эффектов симпатической нервной системы на стенки артериол в сравнении с парасимпатической Причины: активация симпатических влияний на ткани и органы и повышение адренореактивных свойств стенок артериол * Нейропаралитический. Характеризуется устранением или снижением («параличом») парасимпатических влияний на стенки артериол. Причина. Торможение или блокада проведения нервных импульсов по парасимпатическим волокнам к артериолам (и в связи с этим — высвобождения ацетилхолина из терминальных нервных волокон в стенках артерий, артериол и прекапилляров). • Гуморальный механизм. Заключается в увеличении содержания в тканях веществ с вазоконстрикторным действием • Этиологический фактор механического характера. Характеризуется наличием механического препятствия движению крови по артериальным сосудам. • Причины: сдавление (компрессия) артериального сосуда опухолью, рубцом, отёчной тканью, жгутом и уменьшение (вплоть до полного закрытия — обтурации) просвета артериолы (например, тромбом, агрегатом клеток крови, эмболом). • Эмбол и эмболия. Последствия ишемии зависят от степени развития коллатералей и времени ишемии. Эмболия - птологический процесс,который характеризуется циркуляцией в сосудах малого и большого круга кровообращения инородных тел, не смешивающихся с кровью. Эмболия может быть антеградной (эмбол из вен попадает в правый желудочек и в ле гочный ствол) и парадоксальной, когда эмбол попадает в большой круг кровообращения через дефект в межжелудочковой перегородке либо через сохранившееся овальное отверстие. Ретроградная эмболия возникает при попадании эмбола из полой вены в вены печени при повышении внутригрудного давления. 42. Стаз: виды, причины, проявления, последствия. Стаз - прекращение кровотока или лимфотока по капиллярам. Прчины: ишемия, венозная гиперемия; проагреганты-факторы, вызывающие агрегацию и агглютинацию форменных элементов крови. Все разновидности стаза подразделяют на первичные и вторичные. • Первичный (истинный) стаз. Формирование стаза первично начинается с активации форменных элементов крови и выделения ими большого количества проагрегантов и/или прокоагулянтов. На следующем этапе форменные элементы агрегируют, агглютинируют и прикрепляются к стенке микрососуда. Это и вызывает замедление или остановку кровотока в сосудах. • Вторичный стаз (ишемический и застойный). | Ишемический стаз развивается как исход тяжёлой ишемии в связи со снижением притока артериальной крови, замедлением скорости её тока, турбулентным его характером. Это и приводит к агрегации и адгезии клеток крови. • Застойный (венозно-застойный) вариант стаза является результатом замедления оттока венозной крови, сгущения ее, изменения физико-химических свойств, повреждения форменных элементов крови (в частности, в связи с гипоксией). В последующем клетки крови адгезируют друг с другом и со стенкой микрососудов. Проявления стаза При стазе происходят характерные изменения в сосудах микроциркуляторного русла: • уменьшение внутреннего диаметра микрососудов при ишемическом стазе, • увеличение просвета сосудов микроциркуляторного русла при застойном варианте стаза, • большое количество агрегатов форменных элементов крови в просвете сосудов и на их стенках, • микрокровоизлияния (чаще при застойном стазе). В то же время проявления ишемии или венозной гиперемии могут перекрывать проявления стаза. Последствия стаза- при быстром устранении причины стаза ток крови в сосудах микроциркуляторного русла восстанавливается и в тканях не развивается каких-либо существенных изменений. Длительный стаз приводит к развитию дистрофических изменений в тканях, нередко — к гибели участка ткани или органа (инфаркт).