Справка о замечаниях и предложениях СПЗ
advertisement
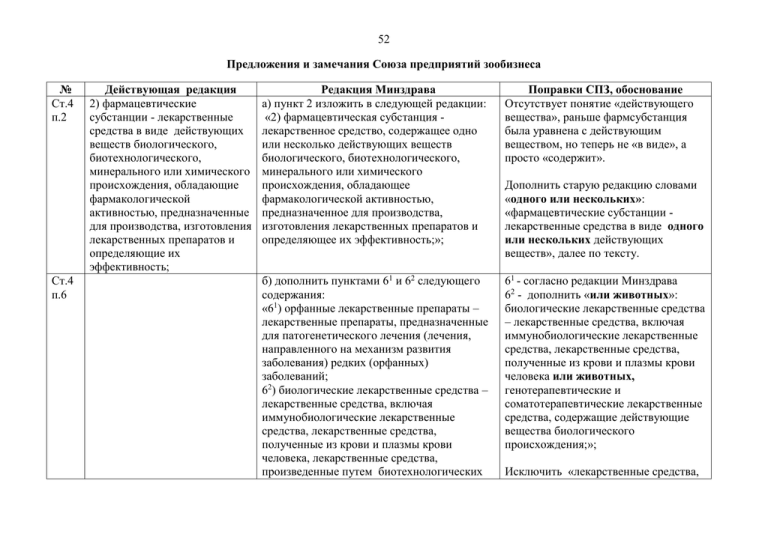
52 Предложения и замечания Союза предприятий зообизнеса № Ст.4 п.2 Ст.4 п.6 Действующая редакция 2) фармацевтические субстанции - лекарственные средства в виде действующих веществ биологического, биотехнологического, минерального или химического происхождения, обладающие фармакологической активностью, предназначенные для производства, изготовления лекарственных препаратов и определяющие их эффективность; Редакция Минздрава а) пункт 2 изложить в следующей редакции: «2) фармацевтическая субстанция лекарственное средство, содержащее одно или несколько действующих веществ биологического, биотехнологического, минерального или химического происхождения, обладающее фармакологической активностью, предназначенное для производства, изготовления лекарственных препаратов и определяющее их эффективность;»; Поправки СПЗ, обоснование Отсутствует понятие «действующего вещества», раньше фармсубстанция была уравнена с действующим веществом, но теперь не «в виде», а просто «содержит». б) дополнить пунктами 61 и 62 следующего содержания: «61) орфанные лекарственные препараты – лекарственные препараты, предназначенные для патогенетического лечения (лечения, направленного на механизм развития заболевания) редких (орфанных) заболеваний; 62) биологические лекарственные средства – лекарственные средства, включая иммунобиологические лекарственные средства, лекарственные средства, полученные из крови и плазмы крови человека, лекарственные средства, произведенные путем биотехнологических 61 - согласно редакции Минздрава 62 - дополнить «или животных»: биологические лекарственные средства – лекарственные средства, включая иммунобиологические лекарственные средства, лекарственные средства, полученные из крови и плазмы крови человека или животных, генотерапевтические и соматотерапевтические лекарственные средства, содержащие действующие вещества биологического происхождения;»; Дополнить старую редакцию словами «одного или нескольких»: «фармацевтические субстанции лекарственные средства в виде одного или нескольких действующих веществ», далее по тексту. Исключить «лекарственные средства, 53 Ст.4 п.19 Ст.4 п.30 30) разработчик лекарственного средства организация, обладающая правами на результаты доклинических исследований лекарственного средства, клинических исследований лекарственного препарата, а также на технологию производства лекарственного процессов (технологий и методов), генотерапевтические и соматотерапевтические лекарственные средства, содержащие действующие вещества биологического происхождения;»; д) дополнить пунктом 191 следующего содержания: «191) фармакопейные стандартные образцы – вещества, с которыми проводят сравнение испытуемых лекарственных средств при проведении анализа с использованием физико-химических и биологических методов при контроле качества лекарственных средств, подтверждении соответствия лекарственных средств требованиям, установленным при их государственной регистрации, нормативная документация на которые утверждена в порядке, установленном уполномоченным федеральным органом исполнительной власти;» е) пункт 30 изложить в следующей редакции: «30) разработчик лекарственного средства организация, обладающая правами на результаты доклинических исследований лекарственного средства, клинических исследований лекарственного препарата и (или) технологию производства лекарственного средства;»; произведенные путем биотехнологических процессов (технологий и методов)», так как под это определение подпадают антибиотики. Исключить слово «фармакопейные», потому что существуют оригинальные стандартные образцы компаний, не включенные в Фармакопею Вернуться к формулировке прежней редакции, чтобы не было одновременно двух организацийразработчиков 54 средства; Ст.4 п.45 Ст.4 45) исследование биоэквивалентности лекарственного препарата - вид клинического исследования лекарственного препарата, проведение которого осуществляется для определения скорости всасывания и выведения фармацевтической субстанции, количества фармацевтической субстанции, достигающего системного кровотока, и результаты которого позволяют сделать вывод о биоэквивалентности воспроизведенного лекарственного препарата в определенных лекарственной форме и дозировке соответствующему оригинальному лекарственному препарату; ж) пункт 45 изложить в следующей редакции: «45) исследование биоэквивалентности лекарственного препарата - вид клинического исследования лекарственного препарата, проведение которого осуществляется для определения скорости всасывания и выведения фармацевтической субстанции, количества фармацевтической субстанции, достигающего системного кровотока, и результаты которого позволяют сделать вывод о биоэквивалентности воспроизведенного лекарственного препарата в определенных лекарственной форме и дозировке соответствующему оригинальному лекарственному препарату или препарату сравнения;»; дополнить пунктами 55-57 следующего содержания: Дополнить «за исключением лекарственных препаратов, которые не определяются в системном кровотоке»: «45) исследование биоэквивалентности лекарственного препарата - вид клинического исследования лекарственного препарата, проведение которого осуществляется для определения скорости всасывания и выведения фармацевтической субстанции, количества фармацевтической субстанции, достигающего системного кровотока, за исключением лекарственных препаратов, которые не определяются в системном кровотоке, и результаты которого позволяют сделать вывод о биоэквивалентности воспроизведенного лекарственного препарата в определенных лекарственной форме и дозировке соответствующему оригинальному лекарственному препарату или препарату сравнения;»; Дополнить пункт 55 «производителя лекарственных средств»: 55 «55) производственная площадка – территориально обособленный производственный комплекс, предназначенный для выполнения всего или определенной части производственного процесса лекарственных средств; 56) группировочное наименование лекарственного препарата - наименование лекарственного препарата, используемое с целью объединения под одним наименованием в группу согласно составу действующих веществ лекарственные средства, не имеющие рекомендованного международного непатентованного наименования; 57) владелец (держатель) регистрационного удостоверения – юридическое лицо, подавшее в установленном порядке заявление на регистрацию лекарственного препарата, и на имя которого выдано регистрационное удостоверение.»; Ст.5 дополнить пунктами 18-24 следующего содержания: «18) утверждение перечня взаимозаменяемых лекарственных препаратов, порядка его формирования и ведения; 19) ведение реестра инструкций по медицинскому применению производственная площадка – территориально обособленный производственный комплекс производителя лекарственных средств, предназначенный для выполнения всего или определенной части производственного процесса лекарственных средств. Обоснование: данная поправка позволить связать новое понятие с действующим текстом закона, предусматривающим понятие «производитель лекарственных средств». Пункт 56 - согласно редакции Минздрава Пункт 57 следует исключить, так как а) статус владельца может не совпадать со статусом держателя; б) не понятен статус правообладания по отношению к разработчику (пункт 30) Пункты 18, 19, 20 - согласно редакции Минздрава Пункты 21 и 22 дополнить «для ветеринарного применения»: 21) утверждение порядка оформления проектов макетов упаковок на лекарственные препараты для 56 взаимозаменяемых лекарственных препаратов; 20) утверждение правил рационального выбора наименований лекарственных препаратов для медицинского применения; 21) утверждение порядка оформления проектов макетов упаковок на лекарственные препараты для медицинского применения; 22) утверждение правил подготовки инструкций по применению лекарственных препаратов для медицинского применения; 23) утверждение перечня наименований лекарственных форм; 24) выдача разрешений на ввоз лекарственных средств в Российскую Федерацию;»; Ст.9 дополнить пунктами 7-11 следующего содержания: «7. Федеральный государственный контроль качества лекарственных средств осуществляет уполномоченный федеральный орган исполнительной власти по контролю (надзору) в сфере здравоохранения в порядке, установленном Правительством Российской Федерации. 8. Федеральный государственный контроль качества лекарственных средств осуществляется для всех лекарственных медицинского и ветеринарного применения; 22) утверждение правил подготовки инструкций по применению лекарственных препаратов для медицинского и ветеринарного применения; Пункты 23 и 24 - согласно редакции Минздрава Добавить пунктом 25: «25) утверждение порядка оформления отчетов о результатах доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов для ветеринарного применения». Дополнить пункты 7, 9, 11 «для медицинского применения»: «7. Федеральный государственный контроль качества лекарственных средств для медицинского применения», далее по тексту; 9. « Субъекты обращения лекарственных средств для медицинского применения предоставляют в уполномоченный федеральный орган исполнительной власти по контролю (надзору) в сфере 57 средств, поступающих в оборот в Российской Федерации. 9. Субъекты обращения лекарственных средств предоставляют в уполномоченный федеральный орган исполнительной власти по контролю (надзору) в сфере здравоохранения в установленном им порядке сведения о лекарственных средствах, выпущенных в обращение в Российской Федерации. Федеральный орган исполнительной власти по контролю (надзору) в сфере здравоохранения ведет реестр лекарственных средств, выпущенных в обращение в Российской Федерации. Не допускается реализация лекарственных препаратов, не внесенных в реестр лекарственных средств, выпущенных в обращение. 10. Осуществление государственного контроля качества лекарственных средств является расходным обязательством Российской Федерации. 11. За несоблюдение или сокрытие сведений, представляемых в уполномоченный федеральный орган исполнительной власти по контролю (надзору) в сфере здравоохранения, субъекты обращения лекарственных средств несут ответственность в соответствии с законодательством Российской Федерации.»; здравоохранения в установленном им порядке сведения о лекарственных средствах для медицинского применения, выпущенных в обращение в Российской Федерации. Федеральный орган исполнительной власти по контролю (надзору) в сфере здравоохранения ведет реестр лекарственных средств для медицинского применения, выпущенных в обращение в Российской Федерации. Не допускается реализация лекарственных препаратов для медицинского применения, не внесенных в реестр лекарственных средств, выпущенных в обращение. 11. За несоблюдение или сокрытие сведений, представляемых в уполномоченный федеральный орган исполнительной власти по контролю (надзору) в сфере здравоохранения, субъекты обращения лекарственных средств для медицинского применения несут ответственность в соответствии с законодательством Российской Федерации. 58 Ст.12 2) подбора оптимальных п.5 дозировок лекарственных препаратов и курса лечения на конкретной группе животных с определенным заболеванием; В пункте 5: а) убрать слово «лечения», заменить на «применения»; б) дополнить «или для профилактики определенных заболеваний»: Ст.12 Контроль за проведением п.8 доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов для ветеринарного применения осуществляется уполномоченным федеральным органом исполнительной власти. 2) подбора оптимальных дозировок лекарственных препаратов и курса применения на конкретной группе животных с определенным заболеванием или для профилактики определенных заболеваний; Пункт 8 изложить в следующей редакции: «Результаты проведения доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов для ветеринарного применения могут быть представлены в уполномоченный федеральный орган исполнительной власти в установленном порядке в целях государственной регистрации лекарственного препарата». Оставить формулировку прежней редакции, так как новая формулировка позволяет выпускать фальсифицированные продукты Ст.13 6. Не допускается государственная регистрация: 1) различных лекарственных препаратов под одинаковым торговым наименованием; Ст.13 пункт 1 части 6 изложить в следующей редакции: «1) лекарственных препаратов с разным качественным составом действующих веществ под одинаковым торговым наименованием;»; дополнить частью 7 следующего содержания: Исключить пункт 7 в связи с 59 Ст.16 Ст.18 5) описание фармакологических и «7.Уполномоченным федеральным органом исполнительной власти, в установленном им порядке, осуществляется консультирование по вопросам практического применения законодательства об обращении лекарственных средств в части осуществления государственной регистрации лекарственных средств.». часть 4 дополнить текстом следующего содержания: «Уполномоченный федеральный орган исполнительной власти направляет заявителю запрос в электронном и (или) письменном виде, с уведомлением о его получении, о предоставлении дополнительных документов и (или) данных. Заявитель обязан в срок, не превышающий девяносто рабочих дней со дня получения запроса уполномоченного федерального органа исполнительной власти, предоставить запрошенные документы и (или) данные либо обосновать невозможность их предоставления. Время со дня отправления запроса и до дня получения уполномоченным федеральным органом исполнительной власти ответа заявителя на запрос не учитывается при исчислении срока государственной регистрации лекарственного средства.»; пункт 5 изложить с следующей редакции: «5) фармакотерапевтическая группа навязыванием услуги, которая приведет к усилению административных барьеров Категорически поддерживаем принятие данного пункта Дополнить «для медицинского применения»: 60 фармакодинамических или иммунобиологических свойств лекарственного препарата; Ст.18 7) отсутствие необходимости проведения клинического исследования, исследования биоэквивалентности лекарственного препарата, разрешенного для медицинского применения на территории Российской Федерации более двадцати лет, с указанием нормативных правовых актов, подтверждающих данный срок применения Ст.18 3. Регистрационное досье формируется из следующих документов: 1) проекты макетов первичной упаковки и вторичной (потребительской) упаковки лекарственного препарата; 2) документ, переведенный на русский язык, подтверждающий соответствие лекарственного препарата, код международной анатомо-терапевтическохимической (АТХ) классификации, заявляемые показания к применению лекарственного препарата»; в) часть 3 изложить в следующей редакции: «3. Регистрационное досье формируется и представляется поэтапно из следующих документов: 1) документ, переведенный на русский язык, подтверждающий соответствие производителя регистрируемого лекарственного препарата, фармацевтической субстанции, в случае ее внесения в государственный реестр 5) фармакотерапевтическая группа лекарственного препарата, код международной анатомотерапевтическо-химической (АТХ) классификации, заявляемые показания к применению лекарственного препарата для медицинского применения» Дополнить «для ветеринарного применения»: 7) отсутствие необходимости проведения клинического исследования, исследования биоэквивалентности лекарственного препарата, разрешенного для медицинского и ветеринарного применения на территории Российской Федерации более двадцати лет, с указанием нормативных правовых актов, подтверждающих данный срок применения Дополнить пункт 1 части 3 «документ на русском языке»: 1) документ на русском языке (переведенный на русский язык), подтверждающий соответствие производителя регистрируемого лекарственного препарата, фармацевтической субстанции, в случае ее внесения в государственный реестр лекарственных средств, 61 производителя регистрируемого лекарственного препарата требованиям правил организации производства и контроля качества лекарственных средств, выданный компетентным органом страны производителя регистрируемого лекарственного препарата и заверенный в установленном порядке; 3) проект нормативной документации или нормативного документа на лекарственный препарат либо указание соответствующей фармакопейной статьи; 4) схема технологического процесса производства лекарственного препарата, ее описание и (или) схема технологического процесса производства фармацевтической субстанции, ее описание; 5) документ, переведенный на русский язык, подтверждающий соответствие производителя лекарственных средств, требованиям правил организации производства и контроля качества лекарственных средств, выданный компетентным органом страны производителя регистрируемого лекарственного препарата и заверенный в установленном порядке; 2) отчет о результатах доклинического исследования лекарственного средства для медицинского применения; 3) отчет о результатах доклинического исследования лекарственного средства и клинического исследования лекарственного препарата для ветеринарного применения; 4) проект протокола клинического исследования лекарственного препарата для медицинского применения; 5) брошюра исследователя; 6) информационный листок пациента; 7) информация о выплатах и компенсациях пациентам (здоровым добровольцам, больным) (далее - пациенты), привлеченным к проведению клинических исследований лекарственного препарата для медицинского применения, исследований биоэквивалентности и (или) терапевтической эквивалентности; 8) проект инструкции по применению лекарственного препарата, содержащий следующие сведения: а) наименование лекарственного средства требованиям правил организации производства и контроля качества лекарственных средств, выданный компетентным органом страны производителя регистрируемого лекарственного препарата и заверенный в установленном порядке; Пункты 5 и 6 части 3 дополнить «для препаратов для медицинского применения» 5) брошюра исследователя для препаратов для медицинского применения; 6) информационный листок пациента для препаратов для медицинского применения; Подпункт д пункта 8 дополнить «для препаратов для медицинского применения»: фармакотерапевтическая группа лекарственного препарата, код международной анатомотерапевтическо-химической (АТХ) классификации для препаратов для медицинского применения; В подпункте е пункта 8 убрать понятие «традиционный» или определить понятие «традиционный 62 фармацевтической субстанции требованиям правил организации производства и контроля качества лекарственных средств, выданный компетентным органом страны производителя фармацевтической субстанции, заверенный в установленном порядке и содержащий: а) наименование фармацевтической субстанции (международное непатентованное или химическое и торговое наименования); б) наименование и адрес производителя фармацевтической субстанции; в) срок годности фармацевтической субстанции; 6) документ, содержащий сведения о показателях качества фармацевтической субстанции, используемой при производстве лекарственных препаратов; 7) нормативная документация или нормативный документ на фармацевтическую субстанцию либо указание (международное непатентованное, или группировочное, или химическое и торговое наименования); б) лекарственная форма с указанием наименований и количественного состава действующих веществ и качественного состава вспомогательных веществ; в) описание внешнего вида лекарственного препарата; г) физико-химические свойства (для радиофармацевтических лекарственных препаратов); д) фармакотерапевтическая группа лекарственного препарата, код международной анатомо-терапевтическохимической (АТХ) классификации; е) фармакодинамика и фармакокинетика (кроме гомеопатических и традиционных растительных лекарственных препаратов); ж) показания к применению; з) противопоказания к применению; и) меры предосторожности при применении; к) указание возможности и особенностей медицинского применения лекарственного препарата беременными женщинами, женщинами в период грудного вскармливания, детьми, взрослыми, имеющими хронические заболевания (только для лекарственных препаратов для медицинского применения) или указание возможности и особенностей применения у растительный лекарственный препарат», пункт изложить в следующей редакции е) фармакодинамика и фармакокинетика (кроме гомеопатических и растительных лекарственных препаратов и биологических лекарственных средств. Для биологических лекарственных средств в указываются биологические свойства); В подпункте к пункта 8 убрать «у потомства»: к) указание возможности и особенностей медицинского применения лекарственного препарата беременными женщинами, женщинами в период грудного вскармливания, детьми, взрослыми, имеющими хронические заболевания (только для лекарственных препаратов для медицинского применения) или указание возможности и особенностей применения у беременных и лактирующих животных в ветеринарии; Дополнить подпункт ч пункта 8 словом «продуктивному»: ч) сроки возможного использования 63 соответствующей фармакопейной статьи; 8) информация об условиях хранения, перевозки лекарственного препарата и иная информация; 9) отчет о результатах доклинического исследования лекарственного средства для медицинского применения, содержащий описание, результаты и статистический анализ результатов данного доклинического исследования; 10) отчет о результатах доклинического исследования лекарственного средства и клинического исследования лекарственного препарата для ветеринарного применения; 11) проект протокола клинического исследования лекарственного препарата для медицинского применения; 12) брошюра исследователя; 13) информационный листок пациента; 14) информация о выплатах и компенсациях пациентам (здоровым добровольцам, больным) (далее - пациенты), беременных и лактирующих животных, у потомства в ветеринарии; л) режим дозирования, способ введения и применения, при необходимости время приема лекарственного препарата, продолжительность лечения (в том числе у детей до и после одного года (только для лекарственных препаратов для медицинского применения)); м) возможные побочные действия при применении лекарственного препарата; н) симптомы передозировки, меры по оказанию помощи при передозировке; о) взаимодействие с другими лекарственными препаратами и (или) пищевыми продуктами, кормами (только для лекарственных препаратов для ветеринарного применения); п) формы выпуска лекарственного препарата; р) указание, при необходимости, особенностей действия лекарственного препарата при первом приеме или при его отмене; с) описание, при необходимости, действий врача (фельдшера), специалиста в области ветеринарии, пациента, владельца животного при пропуске приема одной или нескольких доз лекарственного препарата; т) сведения о возможном влиянии лекарственного препарата для медицинского применения на способность управлять продукции животного происхождения после введения продуктивному животному лекарственного препарата для ветеринарного применения; Дополнить подпункт ш пункта 8 «препарата для медицинского применения» ш) условия отпуска препарата для медицинского применения; Дополнить подпункт щ пункта 8 «или адреса»: щ) наименование, адрес или адреса производителей лекарственного препарата и адрес места производства лекарственного препарата; Заменить в подпункте э пункта 8 слова «владельцем (держателем) регистрационного удостоверения» на «разработчиком»: э) наименование, адрес организации, уполномоченной разработчиком на принятие претензий от покупателя (потребителя); В пункте 9 убрать слово «потребительской»: 9) проекты макетов первичной упаковки и вторичной (при наличии) 64 привлеченным к проведению клинических исследований лекарственного препарата для медицинского применения, исследований биоэквивалентности и (или) терапевтической эквивалентности; 15) отчет о результатах международных многоцентровых клинических исследований лекарственного препарата для медицинского применения, часть из которых проведена на территории Российской Федерации; 16) проект инструкции по применению лекарственного препарата, содержащий следующие сведения: а) наименование лекарственного средства (международное непатентованное или химическое и торговое наименования); б) лекарственная форма с указанием наименований и количественного содержания (активности) фармацевтических субстанций транспортными средствами, механизмами; у) срок годности и указание на запрет применения лекарственного препарата по истечении срока годности; ф) условия хранения; х) указание на необходимость хранения лекарственного препарата в местах, недоступных для детей; ц) указание, при необходимости, специальных мер предосторожности при уничтожении неиспользованных лекарственных препаратов; ч) сроки возможного использования продукции животного происхождения после введения животному лекарственного препарата для ветеринарного применения; ш) условия отпуска; щ) наименование, адрес производителя лекарственного препарата и адрес места производства лекарственного препарата; э) наименование, адрес организации, уполномоченной владельцем (держателем) регистрационного удостоверения на принятие претензий от покупателя (потребителя); 9) проекты макетов первичной упаковки и вторичной (потребительской) упаковки лекарственного препарата; 10) проект нормативной документации или нормативного документа на лекарственный препарат; упаковки лекарственного препарата; Обоснование: первичная упаковка также может быть потребительской. В пункте 11 заменить «документ, содержащий» на «документы, содержащие» 11) документы, содержащие следующие сведения о фармацевтической субстанции, входящей в состав лекарственного препарата: Добавить в подпункт в пункт 11 «для препаратов медицинского применения»: в) описание производственного процесса и его контроля; Подпункты е, з, и дополнить «для препаратов медицинского применения»: е) описание аналитических методик для препаратов медицинского применения; з) перечень стандартных образцов или веществ, используемых в процессе контроля качества для препаратов медицинского применения; и) описание характеристик и свойств упаковочных и укупорочных 65 и вспомогательных веществ; в) фармакотерапевтическая группа лекарственного препарата; г) показания для применения; д) противопоказания для применения; е) режим дозирования, способ введения, при необходимости время приема лекарственного препарата, продолжительность лечения (в том числе у детей до и после одного года); ж) меры предосторожности при применении; з) симптомы передозировки, меры по оказанию помощи при передозировке; и) указание, при необходимости, особенностей действия лекарственного препарата при первом приеме или при его отмене; к) описание, при необходимости, действий врача (фельдшера), специалиста в области ветеринарии, пациента, владельца животного при пропуске приема одной или нескольких доз лекарственного препарата; 11) документ, содержащий следующие сведения о фармацевтической субстанции, входящей в состав лекарственного препарата: а) наименование фармацевтической субстанции, ее структура, общие свойства; б) наименование и адрес производителя; в) описание производственного процесса и его контроля; г) информация о примесях; д) спецификация на фармацевтическую субстанцию и ее обоснование; е) описание аналитических методик; ж) результаты анализа серий фармацевтической субстанции; з) перечень стандартных образцов или веществ, используемых в процессе контроля качества; и) описание характеристик и свойств упаковочных и укупорочных материалов; к) данные о стабильности; л) срок годности; 12) документ, содержащий следующие сведения о фармацевтических свойствах лекарственного препарата: а) описание и состав лекарственного препарата; б) описание фармацевтической разработки; в) описание производственного процесса и контроля процесса; г) описание контроля критических этапов и промежуточной продукции; материалов для препаратов медицинского применения; В пункте 12 изменить «документ» на «документы»: 12) документы, содержащие следующие сведения о фармацевтических свойствах лекарственного препарата: Подпункты б,з,к пункта 12 дополнить «для препаратов медицинского применения»: б) описание фармацевтической разработки для препаратов медицинского применения; з) материальный баланс для производства серии готового продукта для препаратов медицинского применения; к) валидация процесса и/или его оценка для препаратов медицинского применения; Из подпункта л пункта 12 исключить «и ее обоснование»: л) спецификация на вспомогательные вещества; Подпункты м,н, п пункта 12 дополнить «для препаратов медицинского 66 л) возможные побочные действия при применении лекарственного препарата; м) взаимодействие с другими лекарственными препаратами и (или) пищевыми продуктами, кормами; н) указание возможности и особенностей медицинского применения лекарственного препарата беременными женщинами, женщинами в период грудного вскармливания, детьми, взрослыми, имеющими хронические заболевания; о) сведения о возможном влиянии лекарственного препарата для медицинского применения на способность управлять транспортными средствами, механизмами; п) срок годности и указание на запрет применения лекарственного препарата по истечении срока годности; р) условия хранения; с) указание на необходимость хранения лекарственного препарата в местах, недоступных для детей; д) наименование и адреса производственных площадок; е) фармацевтическая совместимость; ж) микробиологические характеристики; з) материальный баланс для производства серии готового продукта; и) описание характеристик и свойств упаковочных и укупорочных материалов; к) валидация процесса и/или его оценка; л) спецификация на вспомогательные вещества и ее обоснование; м) аналитические методики, используемые при контроле качества вспомогательных веществ; н) валидация аналитических методик, используемых при контроле качества вспомогательных веществ; о) информация об использовании вспомогательных веществ человеческого и животного происхождения; п) информация об использовании новых вспомогательных веществ; р) спецификация на лекарственный препарат и ее обоснование; с) аналитические методики, используемые при контроле качества лекарственного препарата; т) валидация аналитических методик используемых при контроле качества лекарственного препарата; у) результаты анализов серий лекарственного применения»: м) аналитические методики, используемые при контроле качества вспомогательных веществ для препаратов медицинского применения; н) валидация аналитических методик, используемых при контроле качества вспомогательных веществ для препаратов медицинского применения; п) информация об использовании новых вспомогательных веществ для препаратов медицинского применения; Из подпункта р пункта 12 исключить «и ее обоснование»: р) спецификация на лекарственный препарат; Подпункт т пункта 12 дополнить «для препаратов для медицинского применения, метрологическая характеристика аналитических методик используемых при контроле качества лекарственного препарата для лекарственных препаратов для ветеринарного применения»: т) валидация аналитических методик используемых при контроле качества 67 т) указание, при необходимости, специальных мер предосторожности при уничтожении неиспользованных лекарственных препаратов; у) сроки возможного использования продукции животного происхождения после введения животному лекарственного препарата для ветеринарного применения; ф) наименование, адрес производителя лекарственного препарата и адрес места производства лекарственного препарата; х) условия отпуска; (пп. "х" введен Федеральным законом от 29.11.2010 N 313ФЗ) 17) переведенная на русский язык и заверенная в установленном порядке копия документа, подтверждающего регистрацию лекарственного препарата в случае его регистрации вне пределов Российской Федерации; 18) документы, представляемые в соответствии препарата; ф) характеристика примесей; х) перечень фармакопейных стандартных образцов, используемых в процессе контроля качества лекарственного препарата; ц) данные о стабильности; 13) отчеты о результатах клинических исследований лекарственного препарата для медицинского применения; 14) отчет о результатах международных многоцентровых клинических исследований лекарственного препарата для медицинского применения, часть из которых проведена в Российской Федерации; 15) переведенная на русский язык и заверенная в установленном порядке копия документа, подтверждающего регистрацию лекарственного препарата в случае его регистрации вне пределов Российской Федерации; 16) документы, подтверждающие возможность рассматривать лекарственный препарат при его государственной регистрации в качестве орфанного лекарственного препарата: а) копии документов, заверенные в установленном порядке, о регистрации лекарственного препарата на территории других государств в качестве орфанного лекарственного препарата; б) документ по эпидемиологии орфанного лекарственного препарата для препаратов для медицинского применения, метрологическая характеристика аналитических методик используемых при контроле качества лекарственного препарата для лекарственных препаратов для ветеринарного применения; Подпункт ф пункта 12 дополнить «для препаратов для медицинского применения»: ф) характеристика примесей для препаратов для медицинского применения; Дополнить пункт 13 словами «и ветеринарного»: 13) отчеты о результатах клинических исследований лекарственного препарата для медицинского и ветеринарного применения; Изложить пункт 15 в следующей редакции: 15) документ, содержащий информацию о регистрации лекарственного препарата в случае его регистрации вне пределов Российской Федерации; 68 со статьями 19 - 23 настоящего Федерального закона. заболевания в Российской Федерации, в терапии которого предполагается использовать заявляемый лекарственный препарат в качестве орфанного лекарственного препарата; 17) иные документы, представляемые в соответствии со статьями 20-23 настоящего Федерального закона.»; Ст.25 2. Повторная экспертиза в части 2 слово «сорока» заменить словом лекарственного средства «двадцати»; проводится в срок, установленный уполномоченным федеральным органом исполнительной власти и не превышающий сорока рабочих дней со дня получения экспертным учреждением задания на проведение повторной экспертизы лекарственного средства, повторная этическая экспертиза - в срок, не превышающий пятнадцати рабочих дней со дня получения советом по этике задания на проведение повторной этической экспертизы. Ст.25 3. Финансовое обеспечение в части 3 слова «и средства, перечисленные Дополнить пункт 16 «для медицинского применения»: 16) документы, подтверждающие возможность рассматривать лекарственный препарат для медицинского применения при его государственной регистрации в качестве орфанного лекарственного препарата Оставить в прежней редакции, 20 дней, исходя из практики, не достаточно. Оставить в прежней редакции 69 выполнения задания на проведение повторной экспертизы лекарственного средства не осуществляется, и средства, перечисленные ранее на проведение такой экспертизы, подлежат возврату в федеральный бюджет. Ст.26 1. Ускоренная процедура экспертизы лекарственных средств в целях государственной регистрации лекарственных препаратов применяется в отношении воспроизведенных лекарственных препаратов. При проведении такой процедуры представляются информация, полученная при проведении клинических исследований лекарственных препаратов и опубликованная в специализированных печатных изданиях, а также документы, содержащие результаты исследования биоэквивалентности и (или) терапевтической эквивалентности лекарственного препарата для медицинского применения или ранее на проведение такой экспертизы, подлежат возврату в федеральный бюджет» исключить; части 1-3 в статье 26 изложить в следующей редакции: «1. Ускоренная процедура экспертизы лекарственных средств в целях государственной регистрации лекарственных препаратов применяется в отношении орфанных лекарственных препаратов, а также воспроизведенных лекарственных препаратов, впервые регистрируемых в Российской Федерации для взаимозаменяемости оригинального лекарственного препарата. При проведении такой процедуры представляются информация, полученная при проведении клинических исследований лекарственных препаратов (для орфанных лекарственных препаратов признаются результаты доклинических и клинических исследований, выполненные за пределами Российской Федерации в соответствии с правилами надлежащей лабораторной практики и надлежащей клинической практики) и опубликованная в специализированных Исключить из пункта 1 «впервые регистрируемых в Российской Федерации для взаимозаменяемости оригинального лекарственного препарата», что соответствует прежней редакции: « 1. Ускоренная процедура экспертизы лекарственных средств в целях государственной регистрации лекарственных препаратов применяется в отношении орфанных лекарственных препаратов, а также воспроизведенных лекарственных препаратов». Дополнить пункт 1 «на целевом или одном из целевых виде животных при условии возможности определения действующих веществ лекарственного препарата в системном кровотоке и (или) результаты сравнительных клинических испытаний при 70 результаты исследования биоэквивалентности лекарственного препарата для ветеринарного применения. 2. Ускоренная процедура экспертизы лекарственных средств не применяется в отношении иммунобиологических лекарственных препаратов, препаратов инсулина и лекарственных препаратов, впервые регистрируемых в Российской Федерации. 3. Ускоренная процедура экспертизы лекарственных средств проводится по решению соответствующего уполномоченного федерального органа исполнительной власти в срок, не превышающий шестидесяти рабочих дней. При этом экспертиза документов, содержащихся в регистрационном досье, для получения разрешения на проведение клинического исследования лекарственного препарата для медицинского применения и этическая печатных изданиях, а также документы, содержащие результаты исследования биоэквивалентности и (или) терапевтической эквивалентности лекарственного препарата для медицинского применения или результаты исследования биоэквивалентности лекарственного препарата для ветеринарного применения. 2. Ускоренная процедура экспертизы лекарственных средств не применяется в отношении биоаналогов и оригинальных лекарственных препаратов (кроме орфанных лекарственных препаратов), воспроизведенных лекарственных препаратов (кроме впервые регистрируемых в Российской Федерации для взаимозаменяемости оригинального лекарственного препарата), новых комбинаций зарегистрированных ранее лекарственных препаратов, лекарственных препаратов, зарегистрированных ранее, но произведенных в других лекарственных формах, в новой дозировке. 3. Ускоренная процедура экспертизы лекарственных средств проводится по решению соответствующего уполномоченного федерального органа исполнительной власти в срок, не превышающий девяноста рабочих дней. При этом экспертиза документов и невозможности определения компонентов действующих веществ в системном кровотоке»: При проведении такой процедуры представляются информация, полученная при проведении клинических исследований лекарственных препаратов (для орфанных лекарственных препаратов признаются результаты доклинических и клинических исследований, выполненные за пределами Российской Федерации в соответствии с правилами надлежащей лабораторной практики и надлежащей клинической практики) и опубликованная в специализированных печатных изданиях, а также документы, содержащие результаты исследования биоэквивалентности и (или) терапевтической эквивалентности лекарственного препарата для медицинского применения или результаты исследования биоэквивалентности лекарственного препарата для ветеринарного применения на целевом или одном из целевых виде животных при условии возможности определения действующих веществ лекарственного препарата в системном кровотоке и(или) 71 экспертиза проводятся в срок, не превышающий пятнадцати рабочих дней, экспертиза качества лекарственного средства и экспертиза отношения ожидаемой пользы к возможному риску применения лекарственного препарата - в срок, не превышающий сорока пяти рабочих дней. Ст.28 фармацевтическая экспертиза лекарственного препарата для получения разрешения на проведение клинического исследования лекарственного препарата для медицинского применения проводятся в срок, не превышающий тридцати рабочих дней, экспертиза качества лекарственного средства и экспертиза отношения ожидаемой пользы к возможному риску применения лекарственного препарата - в срок, не превышающий шестидесяти рабочих дней.». статью 28 дополнить частями 3 и 4 следующего содержания: «3. В случае внесения в соответствии со результаты сравнительных клинических испытаний при невозможности определения компонентов действующих веществ в системном кровотоке. В пункте 2 дополнить «для медицинского применения»: 2. Ускоренная процедура экспертизы лекарственных средств не применяется в отношении биоаналогов и оригинальных лекарственных препаратов (кроме орфанных лекарственных препаратов), воспроизведенных лекарственных препаратов (кроме впервые регистрируемых в Российской Федерации для взаимозаменяемости оригинального лекарственного препарата для медицинского применения), новых комбинаций зарегистрированных ранее лекарственных препаратов, лекарственных препаратов, зарегистрированных ранее, но произведенных в других лекарственных формах, в новой дозировке. В пунктах 3 и 4 заменить «владельца (держателя)» на «разработчика» 72 статьей 30 настоящего Федерального закона по письменному заявлению владельца (держателя) регистрационного удостоверения лекарственного препарата или уполномоченного им другого юридического лица изменений в документы, содержащиеся в регистрационном досье на зарегистрированный лекарственный препарат, затрагивающих сведения, отраженные в регистрационном удостоверении, на основании принятого решения уполномоченный федеральный орган исполнительной власти выдает новое регистрационное удостоверение лекарственного препарата, содержащее внесенные в него согласованные изменения. 4. В случае утраты, повреждения регистрационного удостоверения лекарственного препарата по письменному заявлению владельца (держателя) регистрационного удостоверения или уполномоченного им другого юридического лица о выдаче дубликата регистрационного удостоверения лекарственного препарата уполномоченный федеральный орган исполнительной власти в срок, не превышающий десяти рабочих дней со дня поступления заявления, выдает дубликат регистрационного удостоверения лекарственного препарата. За выдачу дубликата регистрационного удостоверения 73 лекарственного препарата взимается государственная пошлина.»; Ст.29 3. К заявлению о первое предложение части 3 изложить в подтверждении следующей редакции: государственной регистрации «3. К заявлению о подтверждении лекарственного препарата государственной регистрации прилагаются документ, лекарственного препарата прилагается подтверждающий уплату документ, содержащий результаты государственной пошлины за мониторинга безопасности лекарственного подтверждение препарата, проводимого заявителем, по государственной регистрации форме, установленной соответствующим лекарственного препарата для уполномоченным федеральным органом медицинского применения или исполнительной власти. С заявлением о лекарственного препарата для подтверждении государственной ветеринарного применения, регистрации лекарственного препарата документ, содержащий заявитель вправе по собственной инициативе результаты мониторинга представить документ, подтверждающий безопасности лекарственного уплату государственной пошлины за препарата, проводимого подтверждение государственной регистрации заявителем, по форме, лекарственного препарата для медицинского установленной применения или лекарственного препарата соответствующим для ветеринарного применения. В случае уполномоченным федеральным непредставления указанного документа органом исполнительной уполномоченный федеральный орган власти. Нормативная исполнительной власти проверяет факт документация или уплаты государственной пошлины с нормативный документ, проект использованием информации об уплате инструкции по применению государственной пошлины, содержащейся в лекарственного препарата, Государственной информационной системе о проекты макетов первичной государственных и муниципальных упаковки и вторичной платежах.»; Заменить «заявителем» во фразе «мониторинга безопасности лекарственного препарата, проводимого заявителем» на «разработчиком или уполномоченным им лицом» 74 (потребительской) упаковки лекарственного препарата прилагаются к заявлению о подтверждении государственной регистрации лекарственного препарата вновь только в случае, если в них вносятся изменения Ст.29 7. В период проведения процедуры подтверждения государственной регистрации лекарственного препарата его гражданский оборот осуществляется на территории Российской Федерации. Ст.32 2) подачи разработчиком лекарственного средства или уполномоченным им другим юридическим лицом заявления об отмене государственной регистрации лекарственного препарата; Ст.32 5) осуществления в части 7: слова «на территории Российской Федерации» заменить словами «в Российской Федерации»; дополнить абзацем следующего содержания: «Допускается обращение лекарственных препаратов для медицинского применения, произведенных до и в течение 180 календарных дней после принятия уполномоченным федеральным органом исполнительной власти решения о внесении изменений в документы, содержащиеся в регистрационном досье на такие лекарственные препараты.»; пункт 2 изложить в следующей редакции: «2) подачи владельцем (держателем) регистрационного удостоверения лекарственного препарата, разработчиком, производителем или уполномоченными ими другими юридическими лицами заявления об отмене государственной регистрации лекарственного препарата;»; пункт 5 дополнить словами «, Дополнить «и ветеринарного»: «Допускается обращение лекарственных препаратов для медицинского и ветеринарного применения, произведенных до и в течение 180 календарных дней после принятия уполномоченным федеральным органом исполнительной власти решения о внесении изменений в документы, содержащиеся в регистрационном досье на такие лекарственные препараты.» Оставить в прежней редакции, так как новая редакция допускает отмену госрегистрации , например, организацией-производителем без ведома организации-разработчика Оставить в прежней редакции в связи с 75 государственной регистрации лекарственного препарата под торговым наименованием зарегистрированного ранее под этим торговым наименованием лекарственного препарата; Ст.33 в) наименование разработчика лекарственного препарата; Ст.33 Ст.33 д) фармакотерапевтическая группа лекарственного препарата; Ст.33 отличающегося качественным составом действующих веществ;»; тем, что действующие вещества, как правило, не могут отличаться качественным составом, так как соответствуют нормативной документации подпункт "в" изложить в следующей редакции: «в) наименование владельца (держателя) регистрационного удостоверения лекарственного препарата;»; г) наименование и адрес производителя лекарственного препарата подпункт "д" изложить в следующей редакции: «д) наименование фармакотерапевтической группы лекарственного препарата, код международной анатомо-терапевтическохимической (АТХ) классификации;»; Оставить в действующей редакции дополнить подпунктами "н" - "р" следующего содержания: «н) качественный и количественный состав лекарственного препарата; о) информация обо всех разрешенных видах потребительской упаковки; п) регистрация в качестве орфанного лекарственного препарата; р) наличие лекарственного препарата в перечне жизненно необходимых и Заменить «адрес» на «адреса» Дополнить «(для медицинского применения)»: «д) наименование фармакотерапевтической группы лекарственного препарата, код международной анатомотерапевтическо-химической (АТХ) классификации (для препаратов для медицинского применения);» Дополнить подпункт о «для препаратов для медицинского применения»: о) информация обо всех разрешенных видах потребительской упаковки для препаратов для медицинского применения; 76 важнейших лекарственных препаратов;»; Ст.34 5. Основанием для отказа в часть 5 изложить в следующей редакции: направлении в экспертное «5. Основанием для отказа в направлении в учреждение задания на экспертное учреждение задания на проведение экспертизы проведение экспертизы качества указанной в качества указанной в части 1 части 1 настоящей статьи фармацевтической настоящей статьи субстанции является непредставление фармацевтической субстанции документов, указанных в части 2 настоящей является непредставление статьи, а также отсутствие информации, документов, перечисленных в подтверждающей факт уплаты части 2 и пункте 2 части 3 государственной пошлины за проведение настоящей статьи. экспертизы качества фармацевтической субстанции, произведенной в целях реализации.»; Ст.46 1. Лекарственные препараты, за пункты 1 и 2 после слов «международное исключением лекарственных непатентованное» дополнить словами «или препаратов, изготовленных группировочное,»; аптечными организациями, ветеринарными аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность, должны поступать в обращение, если: 1) на их первичной упаковке (за исключением первичной упаковки лекарственных растительных препаратов) хорошо читаемым шрифтом на «указанных в части 2» заменить на « указанных в части 3» Из пункта 2 убрать «потребительской» Дополнить пункт 2 «для препаратов для медицинского применения» фразу «условия отпуска»: 2) на их вторичной упаковке хорошо читаемым шрифтом на русском языке указаны наименование лекарственного препарата (международное непатентованное или химическое и торговое наименования), наименование производителя лекарственного препарата, номер серии, дата выпуска (для иммунобиологических лекарственных препаратов), номер регистрационного удостоверения, срок годности, способ применения, дозировка или концентрация, объем, 77 русском языке указаны наименование лекарственного препарата (международное непатентованное, или химическое, или торговое наименование), номер серии, дата выпуска (для иммунобиологических лекарственных препаратов), срок годности, дозировка или концентрация, объем, активность в единицах действия или количество доз; (в ред. Федерального закона от 11.10.2010 N 271-ФЗ) 2) на их вторичной (потребительской) упаковке хорошо читаемым шрифтом на русском языке указаны наименование лекарственного препарата (международное непатентованное или химическое и торговое наименования), наименование производителя лекарственного препарата, номер серии, дата выпуска (для иммунобиологических лекарственных препаратов), номер регистрационного удостоверения, срок годности, активность в единицах действия либо количество доз в упаковке, лекарственная форма, условия отпуска для препаратов для медицинского применения, условия хранения, предупредительные надписи. (в ред. Федерального закона от 11.10.2010 N 271-ФЗ) 78 способ применения, дозировка или концентрация, объем, активность в единицах действия либо количество доз в упаковке, лекарственная форма, условия отпуска, условия хранения, предупредительные надписи. (в ред. Федерального закона от 11.10.2010 N 271-ФЗ) Ст.46 12. На вторичную (потребительскую) упаковку лекарственного препарата наносится штриховой код. Ст.47 8. Вывоз лекарственных средств из Российской Федерации осуществляется без применения ограничений, установленных таможенным законодательством Таможенного союза и (или) законодательством Российской Федерации о государственном регулировании внешнеторговой деятельности. Вывоз лекарственных препаратов, предназначенных для гуманитарной помощи (содействия) или помощи при часть 8 статьи 47 изложить в следующей редакции: «8. Вывоз лекарственных средств из Российской Федерации осуществляется без применения ограничений, установленных таможенным законодательством Таможенного союза и (или) законодательством Российской Федерации о государственном регулировании внешнеторговой деятельности. Вывоз лекарственных препаратов, предназначенных для гуманитарной помощи (содействия) или помощи при чрезвычайных ситуациях, из Российской Федерации осуществляется в порядке, установленном Правительством Исключить «вторичную», заменить «штриховой код» на «код идентификации товара»: 12. На потребительскую упаковку лекарственного препарата наносится код идентификации товара. Согласно редакции Минздрава 79 чрезвычайных ситуациях, из Российской Федерации осуществляется на основании решения Правительства Российской Федерации или решения органов государственной власти субъектов Российской Федерации об оказании помощи иностранному государству. (в ред. Федерального закона от 06.12.2011 N 409-ФЗ) Ст.59 1. Недоброкачественные лекарственные средства, фальсифицированные лекарственные средства подлежат изъятию из гражданского оборота и уничтожению в порядке, установленном Правительством Российской Федерации. Основанием для уничтожения лекарственных средств является решение владельца лекарственных средств, решение соответствующего уполномоченного федерального органа исполнительной власти или Российской Федерации.»; в частях 1 и 2 статьи 59 слова «из Вернуться к прежней редакции, гражданского оборота» заменить словами «из поскольку в определение «обращение» обращения»; входят манипуляции для целей регистрации 80 решение суда. 2. Контрафактные лекарственные средства подлежат изъятию из гражданского оборота и уничтожению по решению суда. Порядок уничтожения контрафактных лекарственных средств устанавливается Правительством Российской Федерации. Ст.64 2. Мониторинг безопасности лекарственных препаратов осуществляется уполномоченным федеральным органом исполнительной власти на всех этапах их обращения на территории Российской Федерации. часть 2 изложить в следующей редакции: «2. Мониторинг безопасности лекарственных препаратов осуществляется уполномоченным федеральным органом исполнительной власти, экспертными организациями, осуществляющими экспертизу качества, эффективности и безопасности лекарственных средств в порядке, установленным уполномоченным федеральным органом исполнительной власти, держателями регистрационных удостоверений лекарственных препаратов, юридическими лицами, на имя которых выданы разрешения на проведение клинических исследований в Российской Федерации, уполномоченными ими другими юридическими лицами, медицинскими и фармацевтическими организациями на всех этапах обращения лекарственных препаратов в Российской Федерации.»; Заменить «держателями регистрационных удостоверений» на «разработчиками»: 2. Мониторинг безопасности лекарственных препаратов осуществляется уполномоченным федеральным органом исполнительной власти, экспертными организациями, осуществляющими экспертизу качества, эффективности и безопасности лекарственных средств в порядке, установленным уполномоченным федеральным органом исполнительной власти, разработчиками лекарственных препаратов, юридическими лицами, на имя которых выданы разрешения на проведение клинических исследований в Российской Федерации, уполномоченными ими другими 81 Ст.64 юридическими лицами, медицинскими и фармацевтическими организациями на всех этапах обращения лекарственных препаратов в Российской Федерации. дополнить частью 6 следующего содержания: Дополнить «для медицинского «6. При выявлении информации о применения»: нежелательных реакциях при применении «6. При выявлении информации о лекарственных препаратов, особенностях их нежелательных реакциях при взаимодействия с другими лекарственными применении лекарственных препаратов препаратами, а также об иных фактах и для медицинского применения, а обстоятельствах, влияющих на изменение также об иных фактах и соотношения ожидаемой пользы к обстоятельствах, влияющих на возможному риску применения изменение соотношения ожидаемой лекарственного препарата, держатели пользы к возможному риску регистрационных удостоверений применения лекарственного препарата лекарственных препаратов, юридические для медицинского применения, лица, на имя которых выданы разрешения на держатели регистрационных проведение клинических исследований в удостоверений лекарственных Российской Федерации, а также препаратов, юридические лица, на имя уполномоченные ими другие юридические которых выданы разрешения на лица, обязаны проводить установленные проведение клинических исследований законодательством Российской Федерации в Российской Федерации, а также мероприятия, направленные на устранение уполномоченные ими другие негативных последствий применения данных юридические лица, обязаны проводить лекарственных препаратов, предупреждения установленные законодательством вреда жизни и здоровью пациентов, защиты Российской Федерации мероприятия, населения от применения таких препаратов, направленные на устранение а также дополнительного изучения негативных последствий применения эффективности и безопасности данных лекарственных препаратов, лекарственного препарата.»; предупреждения вреда жизни и 82 Ст.65 При получении информации о побочных действиях, не указанных в инструкции по применению лекарственного препарата, серьезных нежелательных реакциях, непредвиденных нежелательных реакциях при применении лекарственного препарата, об особенностях его взаимодействия с другими лекарственными препаратами, которые могут представлять угрозу жизни или здоровью пациентов, а также сведений, не соответствующих сведениям о лекарственном препарате, содержащимся в инструкции по его применению, уполномоченный федеральный орган исполнительной власти рассматривает вопрос о возможности приостановления применения такого лекарственного препарата в в статье 65 слова «возможности приостановления применения» заменить словами «возможности приостановления обращения»; здоровью пациентов, защиты населения от применения таких препаратов, а также дополнительного изучения эффективности и безопасности лекарственного препарата.»; Оставить в прежней редакции 83 порядке, установленном уполномоченным федеральным органом исполнительной власти. Статья 3 Настоящий Федеральный закон вступает в силу со дня его официального опубликования. Дополнить: «В части лекарственных средств для ветеринарного применения предусмотреть переходный период 6 месяцев». 84 Предложения Ассоциации производителей фармацевтической продукции и изделий медицинского назначения № Номер п/п статьи Текст статьи Предложение по поправке к статье 4 Исключить пункт Предлагаемая редакция статьи Примечание 5 6 Защита прав интеллектуальной собственности является предметом действия Гражданского кодекса Российской Федерации. Данное изменение позволит снизить административные барьеры для производителей готовых лекарственных препаратов. Данное изменение позволит снизить административные барьеры для производителей готовых - 1 1. 2 Статья 18, ч.2, новый п.11 3 11) наличие интеллектуальных прав; 2. Статья 18, ч.2, новый п.13 13) иные сведения, перечень которых утверждается уполномоченным федеральным органом исполнительной власти.»; Исключить пункт - 3. Статья18, ч.3, п.11 11) документ, содержащий следующие сведения о фармацевтической субстанции, входящей в состав лекарственного препарата: а) наименование Дополнить текст словами: «в случае если фармацевтическая субстанция внесена в 11) документ, содержащий следующие сведения о фармацевтической субстанции, входящей в состав лекарственного препарата: а) наименование 85 4. Статья 62, фармацевтической субстанции, ее структура, общие свойства; б) наименование и адрес производителя; в) описание производственного процесса и его контроля; г) информация о примесях; д) спецификация на фармацевтическую субстанцию и ее обоснование; е) описание аналитических методик; ж) результаты анализа серий фармацевтической субстанции; з) перечень стандартных образцов или веществ, используемых в процессе контроля качества; и) описание характеристик и свойств упаковочных и укупорочных материалов; к) данные о стабильности; л) срок годности; государственный реестр лекарственных средств сведения по пунктам в, г, д, е, з, и, к не представляются;» фармацевтической субстанции, ее структура, общие свойства; б) наименование и адрес производителя; в) описание производственного процесса и его контроля; г) информация о примесях; д) спецификация на фармацевтическую субстанцию и ее обоснование; е) описание аналитических методик; ж) результаты анализа серий фармацевтической субстанции; з) перечень стандартных образцов или веществ, используемых в процессе контроля качества; и) описание характеристик и свойств упаковочных и укупорочных материалов; к) данные о стабильности; л) срок годности; в случае если фармацевтическая субстанция внесена в государственный реестр лекарственных средств сведения по пунктам в, г, д, е, з, и, к не представляются; лекарственных препаратов, т.к. документы, касающиеся фармацевтических субстанций, предоставляются производителем субстанции в процессе внесения ее в государственный реестр лекарственных средств. в части 2 статьи 62: Оставить в Действующая редакция Предложенная 86 5. ч.2, п.1 а) пункт 1 изложить в следующей редакции: «1) наименование владельца (держателя) регистрационного удостоверения, наименование производственных площадок, участвующих в процессе производства лекарственного препарата, с указанием этапа производства» редакции действующего 61ФЗ Статья 62, ч.2, новый п.8 г) дополнить пунктом 8 следующего содержания: «8) код лекарственного препарата по анатомотерапевтическо-химической классификации»; Исключить пункт Статья 62. Государственный реестр предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов 2. Государственный реестр предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, содержит в себе следующую информацию: 1) наименование производителя лекарственного препарата; - формулировка позволит снизить административные барьеры для производителей готовых лекарственных препаратов. Данное изменение позволит снизить административные барьеры для производителей готовых лекарственных препаратов. 87 Предложения ОАО «Фармстандарт» Начальная редакция 2) в статье 4: б) дополнить пунктами 61 и 62 следующего содержания: 62) биологические лекарственные средства – лекарственные средства, включая иммунобиологические лекарственные средства, лекарственные средства, полученные из крови и плазмы крови человека, лекарственные средства, произведенные путем биотехнологических процессов (технологий и методов), генотерапевтические и соматотерапевтические лекарственные средства, содержащие действующие вещества биологического происхождения;»; в) пункт 12 изложить в следующей редакции: «12) воспроизведенное лекарственное средство – лекарственное средство, имеющее такой же качественный и количественный состав действующих веществ в такой же лекарственной форме, что и оригинальное лекарственное средство, и поступившее в оборот с соблюдением интеллектуальных Предлагаемая редакция Комментарии б) дополнить пунктами 61 и 62 следующего содержания: 62) биологические лекарственные средства – группа лекарственных средств, включающая в себя: иммунобиологические лекарственные средства, лекарственные средства, полученные из крови и плазмы крови человека, лекарственные средства, произведенные путем биотехнологических процессов (технологий и методов), генотерапевтические и соматотерапевтические лекарственные средства; Предлагаем более четко ограничить группу лекарственных препаратов, называемых биологическими. По определению, предлагаемому законопроектом, к биологическим лекарственным препаратам ошибочно можно отнести галеновые лекарственные препараты, лекарственные препараты из растительного и животного сырья. в) пункт 12 изложить в следующей редакции: «12) воспроизведенное лекарственное средство – лекарственное средство, имеющее такой же качественный и количественный состав действующих веществ в такой же лекарственной форме, что и оригинальное лекарственное средство;»; Защита интеллектуальных прав осуществляется нормами Гражданского кодекса Российской Федерации и не требует дополнительного закрепления в других законодательных актах. Полномочиями федеральных государственных органов исполнительной власти, осуществляющих надзор в сфере 88 прав на оригинальное лекарственное средство;»; г) дополнить пунктами 121 – 123 следующего содержания: 122) биоподобное лекарственное средство (биоаналог) – биологическое лекарственное средство, схожее с оригинальным биологическим лекарственным средством по технологии производства, фармацевтической субстанции (комбинации фармацевтических субстанций), лекарственной форме, показаниям к применению и поступившее в оборот с соблюдением интеллектуальных прав на оригинальное лекарственное средство; г) дополнить пунктами 121 – 123 следующего содержания: 122) биоподобное лекарственное средство (биоаналог) – биологическое лекарственное средство, схожее с оригинальным биологическим лекарственным средством по технологии производства, фармацевтической субстанции (комбинации фармацевтических субстанций), лекарственной форме, показаниям к применению; д) дополнить пунктом 191 следующего содержания: «191) фармакопейные стандартные образцы – вещества, с которыми проводят сравнение испытуемых лекарственных средств при проведении анализа с использованием физико-химических и биологических методов при контроле качества лекарственных средств, подтверждении соответствия лекарственных средств требованиям, установленным при их государственной регистрации, нормативная документация д) дополнить пунктом 191 следующего содержания: «191) фармакопейные стандартные образцы – вещества, с которыми проводят сравнение испытуемых лекарственных средств при проведении анализа с использованием физико-химических и биологических методов при контроле качества лекарственных средств, подтверждении соответствия лекарственных средств требованиям, установленным при их государственной регистрации, требования к качеству которых определены фармакопеей;» обращения лекарственных средств, не предусмотрена функция по контролю за соблюдением интеллектуальных прав. Определение, предложенное в законопроекте, позволяет отнести к фармакопейным стандартным образцам только те, которые зарегистрированы в Российской Федерации. В настоящее время в России нет зарегистрированных фармакопейных стандартных образцов. Для контроля качества лекарственных средств широко используются стандартные 89 на которые утверждена в порядке, установленном уполномоченным федеральным органом исполнительной власти;» е) пункт 45 изложить в следующей редакции: «45) исследование биоэквивалентности лекарственного препарата - вид клинического исследования лекарственного препарата, проведение которого осуществляется для определения скорости всасывания и выведения фармацевтической субстанции, количества фармацевтической субстанции, достигающего системного кровотока, и результаты которого позволяют сделать вывод о биоэквивалентности воспроизведенного лекарственного препарата в определенных лекарственной форме и дозировке соответствующему оригинальному лекарственному препарату или препарату сравнения;»; е) пункт 45 изложить в следующей редакции: «45) исследование биоэквивалентности лекарственного препарата - вид клинического исследования лекарственного препарата, проведение которого осуществляется для определения скорости всасывания и выведения действующего вещества, обладающего фармакологической активностью, его количества, достигающего системного кровотока, и результаты которого позволяют сделать вывод о биоэквивалентности воспроизведенного лекарственного препарата в определенных лекарственной форме и дозировке соответствующему оригинальному лекарственному препарату или препарату сравнения;»; (з) дополнить пунктами 55-57 следующего содержания: 56) группировочное наименование лекарственного препарата - з) дополнить пунктами 55-57 следующего содержания: 56) группировочное наименование лекарственного препарата - наименование образцы, описанные в зарубежных фармакопеях. Предлагаем изменить редакцию определения с учетом возможности использования стандартных образцов, описанных в различных фармакопеях. Предлагаем в данном определении заменить термин «фармацевтическая субстанция» на «действующее вещество, обладающее фармакологической активностью». По определению фармацевтическая субстанция может содержать как одно, так и несколько действующих веществ, обладающих фармакологической активностью. Кроме того, она может включать вспомогательные вещества. Предложенная в законопроекте редакция определения имеет неоднозначное толкование. Предлагаем следующую 90 наименование лекарственного препарата, используемое с целью объединения под одним наименованием в группу согласно составу действующих веществ лекарственные средства, не имеющие рекомендованного международного непатентованного наименования; 2) в статье 5: б) дополнить пунктами 18-24 следующего содержания: «18) утверждение перечня взаимозаменяемых лекарственных препаратов, порядка его формирования и ведения; 19) ведение реестра инструкций по медицинскому применению взаимозаменяемых лекарственных препаратов; 20) утверждение правил рационального выбора наименований лекарственных препаратов для медицинского применения; 21) утверждение порядка оформления проектов макетов упаковок на лекарственные препараты для медицинского применения; 22) утверждение правил подготовки инструкций по применению лекарственных препаратов для медицинского применения; лекарственного препарата, не имеющего рекомендованного международного непатентованного наименования, состоящее из наименований действующих веществ, входящих в состав лекарственного препарата редакцию определения «группировочное наименование лекарственного препарата» б) дополнить пунктами 18-26 следующего содержания: «18) утверждение перечня взаимозаменяемых лекарственных препаратов, порядка его формирования и ведения; 19) ведение реестра инструкций по медицинскому применению взаимозаменяемых лекарственных препаратов; 20) утверждение правил рационального выбора наименований лекарственных препаратов для медицинского применения; 21) утверждение порядка оформления проектов макетов упаковок на лекарственные препараты для медицинского применения; 22) утверждение правил подготовки инструкций по применению лекарственных препаратов для медицинского применения; 23) утверждение правил подготовки и оформления нормативной документации на лекарственный препарат для медицинского Предлагаем добавить к полномочиям федеральных органов исполнительной власти: - утверждение правил подготовки и оформления нормативной документации на лекарственный препарат для медицинского применения для приведения в соответствие с предлагаемыми изменениями в часть 3 статьи 19, согласно которому основанием для отказа в проведении экспертиз является предоставление документов, не соответствующих требованиям к их содержанию и оформлению, утвержденным уполномоченным федеральным органом исполнительной власти, - утверждение правил разработки и утверждения фармакопейных статей на 91 23) утверждение перечня наименований лекарственных форм; 24) выдача разрешений на ввоз лекарственных средств в Российскую Федерацию;»; 5) в статье 9: а) часть 1 дополнить пунктом 3 следующего содержания: «3) федеральный государственный контроль качества лекарственных средств.»; применения; 24) утверждение перечня наименований лекарственных форм; 25) выдача разрешений на ввоз лекарственных средств в Российскую Федерацию;»; 26) утверждение правил разработки и утверждения фармакопейных статей на фармакопейные стандартные образцы. фармакопейные стандартные образцы для приведения в соответствие с частью 2 статьи 7. а) часть 1 дополнить пунктом 3 следующего содержания: «3) федеральный государственный контроль качества лекарственных средств.»; Федеральный государственный контроль качества лекарственных средств фактически определен пунктом 2 части 4 статьи 9 действующей редакции закона в составе федерального государственного надзора в сфере обращения лекарственных средств. Закон не должен содержать двойного толкования одних и тех же надзорных функций. Предлагаем исключить пункт 2 части 4. Термин «выпуск в оборот» не имеет точного нормативного определения, что может привести к неоднозначному толкованию нормы. Предлагаем заменить на «произведенных сериях (партиях) лекарственных средств, б) пункт 2 части 4 «2) организацию и проведение проверок соответствия лекарственных средств, находящихся в обращении, установленным обязательным требованиям к их качеству;» исключить б) дополнить пунктами 7-11 следующего содержания: б) дополнить пунктами 7-11 следующего содержания: 9. Субъекты обращения лекарственных средств обязаны предоставлять в уполномоченный федеральный орган исполнительной 9. Субъекты обращения лекарственных средств обязаны предоставлять в уполномоченный федеральный орган исполнительной власти по контролю 92 власти по контролю (надзору) в сфере здравоохранения в установленном им порядке сведения о сериях (партиях) лекарственных средств, выпущенных в оборот в Российской Федерации. (надзору) в сфере здравоохранения в установленном им порядке сведения о произведенных сериях (партиях) лекарственных средств, предназначенных для выпуска в оборот в Российской Федерации. 6) часть 2 статьи 14 изложить в следующей редакции: «2. Экспертиза лекарственных 2. Экспертиза лекарственных средств для средств для медицинского применения и медицинского применения и этическая этическая экспертиза проводятся экспертиза проводятся поэтапно: поэтапно: 1) на первом этапе: 1) на первом этапе: а) этическая экспертиза документов а) этическая экспертиза документов лекарственного препарата, представленного в лекарственного препарата, качестве орфанного лекарственного представленного в качестве орфанного препарата для определения возможности лекарственного препарата для рассматривать его при государственной определения возможности рассматривать регистрации в качестве орфанного его при государственной регистрации в лекарственного препарата; качестве орфанного лекарственного б) этическая экспертиза, экспертиза препарата; документов для получения разрешения на б) этическая экспертиза, экспертиза проведение клинического исследования документов и фармацевтическая лекарственного препарата, за исключением: экспертиза образцов биологических или - лекарственных препаратов, которые биоподобных лекарственных средств для разрешены для медицинского применения в получения разрешения на проведение Российской Федерации более двадцати лет клинического исследования (кроме биологических лекарственных средств лекарственного препарата, за и биоаналогов), и в отношении которых, в исключением: соответствии с правилами проведения - лекарственных препаратов, которые экспертизы лекарственных средств с учетом разрешены для медицинского применения особенностей отдельных групп в Российской Федерации более двадцати лекарственных препаратов, не проводится предназначенных для выпуска в оборот в Российской Федерации» Предлагаем вместо двух аналогичных экспертиз – фармацевтической и экспертизы качества - на разных этапах регистрации проводить одну полную экспертизу качества лекарственного препарата, включая экспертизу предложенных методов контроля качества, перед проведением клинических исследований для всех лекарственных препаратов. 93 лет (кроме биологических лекарственных средств и биоаналогов), и в отношении которых, в соответствии с правилами проведения экспертизы лекарственных средств с учетом особенностей отдельных групп лекарственных препаратов, не проводится исследование биоэквивалентности; - лекарственных препаратов для медицинского применения, в отношении которых проведены международные многоцентровые клинические исследования, часть из которых проведена в Российской Федерации; - лекарственных препаратов, в отношении которых в результате этической экспертизы признано возможным рассматривать их при государственной регистрации в качестве орфанных лекарственных препаратов и признаны результаты клинических исследований (кроме биоаналогов). 2) на втором этапе – экспертиза лекарственных средств, в части экспертизы предложенных методов контроля качества лекарственного средства и качества представленных образцов лекарственного средства с использованием этих методов (далее – экспертиза качества лекарственного средства) и экспертизы отношения исследование биоэквивалентности; - лекарственных препаратов для медицинского применения, в отношении которых проведены международные многоцентровые клинические исследования, часть из которых проведена в Российской Федерации; - лекарственных препаратов, в отношении которых в результате этической экспертизы признано возможным рассматривать их при государственной регистрации в качестве орфанных лекарственных препаратов и признаны результаты клинических исследований (кроме биоаналогов); в) экспертиза лекарственных средств, в части экспертизы предложенных методов контроля качества лекарственного средства и качества представленных образцов лекарственного средства с использованием этих методов (далее – экспертиза качества лекарственного средства). 2) на втором этапе – экспертиза отношения ожидаемой пользы к возможному риску применения лекарственного препарата. 94 ожидаемой пользы к возможному риску применения лекарственного препарата, осуществляемые после проведения его клинического исследования.»; 9) в статье 18: б) в части 2: дополнить пунктами 8 – 12 следующего содержания: «8) необходимость оформления разрешения на ввоз конкретной партии зарегистрированных и (или) незарегистрированных лекарственных средств, предназначенных для проведения экспертизы лекарственных средств для осуществления государственной регистрации; 9) необходимость проведения этической экспертизы документов лекарственного препарата, представленного в качестве орфанного лекарственного препарата, для определения возможности рассматривать его при государственной регистрации в качестве орфанного лекарственного препарата; 10) по собственной инициативе заявителя реквизиты документов об уплате: а) государственной пошлины за проведение этической экспертизы дополнить пунктами 8 – 12 следующего содержания: 10) по собственной инициативе заявителя реквизиты документов об уплате: а) государственной пошлины за проведение этической экспертизы документов лекарственного препарата, представленного в качестве орфанного лекарственного препарата, для определения возможности рассматривать его при государственной регистрации в качестве орфанного лекарственного препарата; б) государственной пошлины за проведение этической экспертизы, экспертизы документов и экспертизы качества лекарственного препарата для получения разрешения на проведение клинического исследования лекарственного препарата для медицинского применения при обращении за государственной регистрацией лекарственного препарата; в) государственной пошлины за проведение экспертизы качества Предлагаем внести соответствующие корректировки в данный пункт, исключив проведение фармацевтической экспертизы. 95 документов лекарственного препарата, представленного в качестве орфанного лекарственного препарата, для определения возможности рассматривать его при государственной регистрации в качестве орфанного лекарственного препарата; б) государственной пошлины за проведение этической экспертизы, экспертизы документов лекарственного препарата (кроме биологического и биоподобного лекарственного средства) для получения разрешения на проведение клинического исследования лекарственного препарата для медицинского применения при обращении за государственной регистрацией лекарственного препарата; в) государственной пошлины за проведение этической экспертизы, экспертизы документов и фармацевтической экспертизы образцов биологического или биоподобного лекарственного препарата для получения разрешения на проведение клинического исследования лекарственного препарата для медицинского применения при обращении за государственной регистрацией лекарственного препарата; г) государственной пошлины за проведение экспертизы качества лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата, разрешенного для медицинского применения в Российской Федерации более двадцати лет, при государственной регистрации лекарственного препарата; г) государственной пошлины за проведение экспертизы качества лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для медицинского применения, в отношении которого проведены международные многоцентровые клинические исследования, часть из которых проведена на территории Российской Федерации, при государственной регистрации лекарственного препарата; д) государственной пошлины за проведение экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для ветеринарного применения при его государственной регистрации.»; 96 лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата, разрешенного для медицинского применения в Российской Федерации более двадцати лет, при государственной регистрации лекарственного препарата; д) государственной пошлины за проведение экспертизы качества лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для медицинского применения, в отношении которого проведены международные многоцентровые клинические исследования, часть из которых проведена в Российской Федерации, при государственной регистрации лекарственного препарата; е) государственной пошлины за проведение экспертизы качества лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для ветеринарного применения при его государственной регистрации.»; в) часть 3 изложить в следующей редакции: 97 «3. Регистрационное досье формируется поэтапно из следующих документов: 11) документ, содержащий следующие сведения о фармацевтической субстанции, входящей в состав лекарственного препарата: а) наименование фармацевтической субстанции, ее структура, общие свойства; б) наименование и адрес производителя; в) описание производственного процесса и его контроля; г) информация о примесях; д) спецификация на фармацевтическую субстанцию и ее обоснование; е) описание аналитических методик; ж) результаты анализа серий фармацевтической субстанции; з) перечень стандартных образцов или веществ, используемых в процессе контроля качества; и) описание характеристик и свойств упаковочных и укупорочных материалов; к) данные о стабильности; л) срок годности; «3. Регистрационное досье формируется поэтапно из следующих документов: 11) документы, содержащий следующие сведения о фармацевтической субстанции, входящей в состав лекарственного препарата: - наименование фармацевтической субстанции, ее структура, общие свойства; - наименование и адрес производителя; - нормативная документация или проект нормативной документации, или номер фармакопейной статьи на фармацевтическую субстанцию, входящую в состав лекарственного препарата - описание производственного процесса и его контроля в случае, если фармацевтическая субстанция не включена в государственный реестр лекарственных средств, информация о примесях; - спецификация на фармацевтическую субстанцию и ее обоснование, если фармацевтическая субстанция не включена в государственный реестр лекарственных средств; - описание аналитических методик, в случае, если фармацевтическая субстанция не включена в государственный реестр лекарственных средств; - результаты анализа серий фармацевтической субстанции; - данные о стабильности Предлагаем уменьшить количество документов в случае, если данная субстанция включена в государственный реестр лекарственных средств и, следовательно, проведены все необходимые экспертизы документов. 98 12) документ, содержащий следующие сведения о фармацевтических свойствах лекарственного препарата: а) описание и состав лекарственного препарата; б) описание фармацевтической разработки; в) описание производственного процесса и контроля процесса; г) описание контроля критических этапов и промежуточной продукции; д) наименование и адреса производственных площадок; е) фармацевтическая совместимость; ж) микробиологические характеристики; з) материальный баланс для производства серии готового продукта; и) описание характеристик и свойств упаковочных и укупорочных материалов; к) валидация процесса и/или его оценка; л) спецификация на вспомогательные вещества и ее обоснование; м) аналитические методики, используемые при контроле качества фармацевтической субстанции, срок годности в случае, если субстанция не включена в государственный реестр лекарственных средств; - сведения об упаковке. 12) документы, содержащие следующие сведения о лекарственном препарате: а) описание и состав лекарственного препарата; б) описание фармацевтической разработки; в) описание производственного процесса и контрольных точек процесса; г) наименование и адреса производственных площадок; д) описание характеристик и свойств упаковочных и укупорочных материалов; е) валидация процесса и/или его оценка; ж) спецификация на вспомогательные вещества; н) валидация аналитических методик, используемых при контроле качества вспомогательных веществ, кроме фармакопейных методик, методик включенных в действующие государственные стандарты и методик, аттестованных в соответствии с Федеральным законом «Об обеспечении единства измерений»; и) информация об использовании вспомогательных веществ человеческого и животного происхождения; к) информация об использовании новых Сведения о лекарственном препарате описываются разными документами и без внесения изменений в ряд нормативных документов не могут быть представлены одним документом. Описание контроля критических этапов и промежуточной продукции входит в описание производственного процесса и контроля процесса. Выносить отдельно материальный баланс нет необходимости, так как он описывается в составе лекарственного препарата и в описании фармацевтической разработки. Валидация аналитических методик, используемых при контроле качества вспомогательных веществ, необходима для вспомогательных веществ, не описанных в фармакопее, государственных 99 вспомогательных веществ; н) валидация аналитических методик, используемых при контроле качества вспомогательных веществ; о) информация об использовании вспомогательных веществ человеческого и животного происхождения; п) информация об использовании новых вспомогательных веществ; р) спецификация на лекарственный препарат и ее обоснование; с) аналитические методики, используемые при контроле качества лекарственного препарата; т) валидация аналитических методик используемых при контроле качества лекарственного препарата; у) результаты анализов серий лекарственного препарата; ф) характеристика примесей; х) перечень стандартных образцов или веществ, используемых в процессе контроля качества лекарственного препарата; ц) данные о стабильности; 19) предложения по цене лекарственного препарата; вспомогательных веществ, о которых нет доступной информации об использовании в производстве лекарственных препаратов; л) спецификация на лекарственный препарат и ее обоснование; м) аналитические методики, используемые при контроле качества лекарственного препарата; н) валидация аналитических методик используемых при контроле качества лекарственного препарата; о) результаты анализов серий лекарственного препарата; п) характеристика идентифицированных примесей, определяемых в соответствии со спецификацией; р) перечень стандартных образцов или веществ, используемых в процессе контроля качества лекарственного препарата; с) данные о стабильности лекарственного препарата; Исключить. «5. С заявлением о государственной «5. С заявлением о государственной регистрации лекарственного препарата регистрации лекарственного препарата стандартах (ГОСТах) и не прошедших аттестацию в соответствии с Федеральным законом «Об обеспечении единства измерений». Данная информация не имеет отношения к регистрационному досье. Предлагаем внести соответствующие корректировки 100 заявитель вправе по собственной инициативе представить: 1) документ, подтверждающий уплату государственной пошлины за проведение этической экспертизы документов лекарственного препарата, представленного в качестве орфанного лекарственного препарата, для определения возможности рассматривать его при государственной регистрации в качестве орфанного лекарственного препарата; 2) документ, подтверждающий уплату государственной пошлины за проведение этической экспертизы, экспертизы документов лекарственного препарата (кроме биологического и биоподобного лекарственного средства) для получения разрешения на проведение клинического исследования лекарственного препарата для медицинского применения при обращении за государственной регистрацией лекарственного препарата; 3) документ, подтверждающий уплату государственной пошлины за проведение этической экспертизы, экспертизы документов и фармацевтической экспертизы образцов биологического или биоподобного лекарственного препарата для получения заявитель вправе по собственной инициативе представить: 1) государственной пошлины за проведение этической экспертизы документов лекарственного препарата, представленного в качестве орфанного лекарственного препарата, для определения возможности рассматривать его при государственной регистрации в качестве орфанного лекарственного препарата; 2) государственной пошлины за проведение этической экспертизы, экспертизы документов и экспертизы качества лекарственного препарата для получения разрешения на проведение клинического исследования лекарственного препарата для медицинского применения при обращении за государственной регистрацией лекарственного препарата; 3) государственной пошлины за проведение экспертизы качества лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата, разрешенного для медицинского применения в Российской Федерации более двадцати лет, при государственной регистрации лекарственного препарата; 4) государственной пошлины за проведение экспертизы качества лекарственного средства и экспертизы в данный пункт, исключив проведение фармацевтической экспертизы. 101 разрешения на проведение клинического исследования лекарственного препарата для медицинского применения при обращении за государственной регистрацией лекарственного препарата; 4) документ, подтверждающий уплату государственной пошлины за проведение экспертизы качества лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата, разрешенного для медицинского применения в Российской Федерации более двадцати лет, при государственной регистрации лекарственного препарата; 5) документ, подтверждающий уплату государственной пошлины за проведение экспертизы качества лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для медицинского применения, в отношении которого проведены международные многоцентровые клинические исследования, часть из которых проведена в Российской Федерации, при государственной регистрации лекарственного препарата; 6) документ, подтверждающий отношения ожидаемой пользы к возможному риску применения лекарственного препарата для медицинского применения, в отношении которого проведены международные многоцентровые клинические исследования, часть из которых проведена на территории Российской Федерации, при государственной регистрации лекарственного препарата; 5) государственной пошлины за проведение экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для ветеринарного применения при его государственной регистрации.»; В случае непредставления указанных документов уполномоченный федеральный орган исполнительной власти проверяет факт уплаты государственной пошлины с использованием информации об уплате государственной пошлины, содержащейся в Государственной информационной системе о государственных и муниципальных платежах.»; 102 уплату государственной пошлины за проведение экспертизы качества лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для ветеринарного применения при его государственной регистрации. В случае непредставления указанных документов уполномоченный федеральный орган исполнительной власти проверяет факт уплаты государственной пошлины с использованием информации об уплате государственной пошлины, содержащейся в Государственной информационной системе о государственных и муниципальных платежах.»; 12) в статье 19: а) части 1 и 2 изложить в следующей редакции: 1. В течение десяти рабочих дней со дня принятия заявления о государственной регистрации лекарственного препарата уполномоченный федеральный орган исполнительной власти проводит проверку полноты и достоверности сведений, содержащихся в представленных заявителем материалах, и а) части 1 и 2 изложить в следующей редакции: 1. В течение десяти рабочих дней со дня принятия заявления о государственной регистрации лекарственного препарата уполномоченный федеральный орган исполнительной власти проводит проверку полноты и достоверности сведений, содержащихся в представленных заявителем материалах, и принимает решение о выдаче задания на проведение: Предлагаем внести соответствующие корректировки в данный пункт, исключив проведение фармацевтической экспертизы. 103 принимает решение о выдаче задания на проведение: 1) этической экспертизы документов лекарственного препарата, представленного в качестве орфанного лекарственного препарата, для определения возможности рассматривать его при осуществлении государственной регистрации в качестве орфанного лекарственного препарата на основании документов, указанных в пунктах 8, 15, 16 части 3 и пункте 3 части 5 статьи 18 настоящего Федерального закона; 2) экспертизы лекарственных средств в части экспертизы документов лекарственного препарата для медицинского применения для получения разрешения на проведение клинического исследования лекарственного препарата в соответствии с целями, указанными в статье 38 настоящего Федерального закона, в отношении лекарственных препаратов, для которых не проводились клинические исследования в Российской Федерации, и этической экспертизы на основании документов, указанных в пунктах 1, 2, 4-8, 10-12 части 3 и пунктах 1 и 2 части 5 статьи 18 настоящего Федерального закона; 3) экспертизы лекарственных средств в части экспертизы документов и 1) этической экспертизы документов лекарственного препарата, представленного в качестве орфанного лекарственного препарата, для определения возможности рассматривать его при осуществлении государственной регистрации в качестве орфанного лекарственного препарата на основании документов, указанных в пунктах 8, 15, 16 части 3 и пункте 3 части 5 статьи 18 настоящего Федерального закона; 2) экспертизы лекарственных средств в части экспертизы документов лекарственного препарата для медицинского применения для получения разрешения на проведение клинического исследования лекарственного препарата в соответствии с целями, указанными в статье 38 настоящего Федерального закона, в отношении лекарственных препаратов, для которых не проводились клинические исследования в Российской Федерации, и этической экспертизы на основании документов, указанных в пунктах 1, 2, 4-8, 10-12 части 3 и пунктах 1 и 2 части 5 статьи 18 настоящего Федерального закона; 3) экспертизы лекарственных средств, в части экспертизы предложенных методов контроля качества лекарственного средства и качества представленных образцов лекарственного средства с использованием этих методов; 104 фармацевтической экспертизы образцов лекарственного препарата для получения разрешения на проведение клинического исследования биологического или биоподобного лекарственного препарата для медицинского применения в соответствии с целями, указанными в статье 38 настоящего Федерального закона, в отношении лекарственных препаратов, для которых не проводились клинические исследования в Российской Федерации, и этической экспертизы на основании документов, указанных в пунктах 1, 2, 4, 5, 8, 10-12 части 3 и пункте 4 части 5 статьи 18 настоящего Федерального закона, документов, указанных в части 4 статьи 18 настоящего Федерального закона и представленных по желанию заявителя; 4) экспертизы лекарственных средств в части экспертизы качества лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для медицинского применения, в отношении лекарственных препаратов, разрешенных для медицинского применения в Российской Федерации более двадцати лет (кроме биоаналогов), на основании документов, указанных в пунктах 1, 8-12 4) экспертизы лекарственных средств в части экспертизы качества лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для медицинского применения, в отношении лекарственных препаратов, разрешенных для медицинского применения в Российской Федерации более двадцати лет (кроме биоаналогов), на основании документов, указанных в пунктах 1, 8-12 части 3 и пункте 4 части 5 статьи 18 настоящего Федерального закона, а также лекарственных препаратов, в отношении которых проведены международные многоцентровые клинические исследования, часть из которых проведена в Российской Федерации, на основании документов, указанных в пунктах 1, 8, 9, 11, 12, 14, 15 части 3 и пункте 5 части 5 статьи 18 настоящего Федерального закона; 5) экспертизы лекарственного средства в отношении лекарственных препаратов для ветеринарного применения на основании документов указанных в пунктах 1, 3, подпунктах "а" - "и", "м" - "с", "у" - "э" пункта 8, в пунктах 9-12, пункте 15 части 3 и пункте 6 части 5 статьи 18 настоящего Федерального закона. 105 части 3 и пункте 4 части 5 статьи 18 настоящего Федерального закона, а также лекарственных препаратов, в отношении которых проведены международные многоцентровые клинические исследования, часть из которых проведена в Российской Федерации, на основании документов, указанных в пунктах 1, 8, 9, 11, 12, 14, 15 части 3 и пункте 5 части 5 статьи 18 настоящего Федерального закона; 5) экспертизы лекарственного средства в отношении лекарственных препаратов для ветеринарного применения на основании документов указанных в пунктах 1, 3, подпунктах "а" "и", "м" - "с", "у" - "э" пункта 8, в пунктах 9-12, пункте 15 части 3 и пункте 6 части 5 статьи 18 настоящего Федерального закона. 13) статью 20 изложить в следующей редакции: Статья 20. Этическая экспертиза Статья 20. Этическая экспертиза документов лекарственного препарата, документов лекарственного препарата, представленного в качестве орфанного представленного в качестве орфанного лекарственного препарата, для лекарственного препарата, для определения определения возможности рассматривать возможности рассматривать его при его при государственной регистрации в государственной регистрации в качестве качестве орфанного лекарственного орфанного лекарственного препарата, препарата, экспертиза документов, экспертиза документов, экспертиза качества фармацевтическая экспертиза, этическая лекарственного препарата, этическая Внести соответствующие изменения в статью 20, заменив фармацевтическую экспертизу на экспертизу качества лекарственного препарата, а также внести необходимые изменения в статью 23. 106 экспертиза лекарственного препарата для получения разрешения на проведение клинического исследования лекарственного препарата для медицинского применения. 21) в статье 28: 21) статью 28 дополнить частями 3 и 4 следующего содержания: экспертиза лекарственного препарата для получения разрешения на проведение клинического исследования лекарственного препарата для медицинского применения. 21) в статье 28: а) часть 1 дополнить предложением: 3. В случае подачи заявителем в установленном порядке до момента истечения срока действия регистрационного удостоверения заявления о подтверждении государственной регистрации лекарственного препарата, регистрационное удостоверение, выданное сроком действия на пять лет, считается действительным до момента вынесения уполномоченным федеральным органом решения о подтверждении или об отказе подтверждения государственной регистрации лекарственного препарата в соответствие со статьей 29 настоящего Федерального закона. Существует практика неоднозначного толкования налоговыми органами пункта 7 статьи 29 настоящего Федерального закона в части применения налоговой ставки НДС 10%. Согласно Письмо ФНС РФ от 10.08.2011 N АС-4-3/13016@, "О перечне документов, подтверждающих изготовление аптечными организациями лекарственных средств, и применения налоговой ставки налога на добавленную стоимость в размере 10 процентов при их реализации на территории б) дополнить частями 3 и 4 следующего Российской Федерации", содержания: основанием для применения налоговой ставки 10% при реализации аптечными организациями лекарственных средств, в том числе фармацевтических субстанций, 107 является наличие регистрационного удостоверения на конкретные наименования лекарственных средств, выданного в установленном порядке. В отношении реализации лекарственных средств, регистрационные удостоверения на которые находятся на подтверждении государственной регистрации, налоговые органы со ссылкой на указанное Письмо применяют, в противоречие пункту 2 статьи 164 Налогового кодекса Российской Федерации, ставку НДС 18%, что влечет увеличение стоимости лекарственных препаратов для конечных потребителей. 22) в статье 29: д) дополнить частью 8 следующего содержания: 8. В срок, не превышающий десяти рабочих дней со дня получения заключений комиссий экспертов по результатам указанных в части 6 настоящей статьи экспертиз, уполномоченный федеральный орган исполнительной власти: 1) принимает решение в случае В действующей редакции Федерального закона не описаны действия по принятию решения о внесении изменений при проведении процедуры подтверждения регистрации лекарственного препарата. 108 необходимости о внесении изменений в документы, содержащиеся в регистрационном досье на зарегистрированный лекарственный препарат для медицинского применения, или об отказе во внесении таких изменений; 2) вносит в случае необходимости в государственный реестр лекарственных средств на основании решения о внесении изменений в документы, содержащиеся в регистрационном досье на зарегистрированный лекарственный препарат для медицинского применения, необходимые изменения и возвращает их заявителю. 23) в статье 30: б) в части 2: слова «в подпунктах "г-п", "х" пункта 16» заменить словами «в подпунктах "б", "е-р", "т-ф", "ш" пункта 8»; второе предложение изложить в следующей редакции: «В случае необходимости внесения иных изменений в документы регистрационного досье на зарегистрированный лекарственный препарат экспертиза лекарственного препарата для медицинского применения не проводится.»; а) изложить часть 2 в следующей редакции: «2. В случае внесения изменений в инструкцию по применению лекарственного препарата в отношении сведений, указанных в подпунктах "ж-р", "т-у" пункта 8 части 3 статьи 18 настоящего Федерального закона, в состав лекарственного препарата для медицинского применения в части изменения количественного и качественного состава вспомогательных веществ или производителя фармацевтической субстанции, изменения места производства лекарственного препарата для медицинского применения, изменения показателей качества лекарственного препарата для медицинского применения и (или) методов контроля Считаем необходимым дополнить данную часть. Включение нового производителя субстанции не является качественным или количественным изменением состава. 109 качества лекарственного препарата для медицинского применения проводится экспертиза лекарственных средств в части экспертизы качества лекарственного средства и (или) экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для медицинского применения. В случае необходимости внесения иных изменений экспертиза лекарственного средства для внесения таких изменений в сведения о зарегистрированном лекарственном препарате не проводится.» в) часть 3 изложить в следующей редакции: «3. С заявлением о внесении изменений в документы, содержащиеся в регистрационном досье на зарегистрированный лекарственный препарат для медицинского применения, наряду с документами, указанными в части 1 настоящей статьи, заявитель вправе по собственной инициативе представить документы, подтверждающие уплату государственной пошлины за внесение в документы, содержащиеся в регистрационном досье на зарегистрированный лекарственный препарат для медицинского применения, изменений, требующих проведения экспертизы лекарственных средств для б) часть 3 изложить в следующей редакции: «3. С заявлением о внесении изменений в документы, содержащиеся в регистрационном досье на зарегистрированный лекарственный препарат для медицинского применения, наряду с документами, указанными в части 1 настоящей статьи, заявитель вправе по собственной инициативе представить документы, подтверждающие уплату государственной пошлины за внесение в документы, содержащиеся в регистрационном досье на зарегистрированный лекарственный препарат для медицинского применения, изменений, требующих проведения экспертизы лекарственных средств для медицинского Предлагаем представить возможность производителям лекарственных препаратов одновременно вносить изменения в состав лекарственного препарата в части изменения производителя фармацевтической субстанции и включение данной субстанции в государственный реестр лекарственных средств аналогично данной процедуре при регистрации лекарственного препарата. 110 медицинского применения в части экспертизы качества лекарственного средства и (или) экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для медицинского применения, государственной пошлины за внесение изменений в документы, содержащиеся в регистрационном досье на зарегистрированный лекарственный препарат для медицинского применения, не требующих проведения экспертизы лекарственных средств для медицинского применения. В случае непредставления указанных документов уполномоченный федеральный орган исполнительной власти проверяет факт уплаты государственной пошлины с использованием информации об уплате государственной пошлины, содержащейся в Государственной информационной системе о государственных и муниципальных платежах.»; применения в части экспертизы качества лекарственного средства и (или) экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для медицинского применения, государственной пошлины за внесение изменений в документы, содержащиеся в регистрационном досье на зарегистрированный лекарственный препарат для медицинского применения, не требующих проведения экспертизы лекарственных средств для медицинского применения. В случае непредставления указанных документов уполномоченный федеральный орган исполнительной власти проверяет факт уплаты государственной пошлины с использованием информации об уплате государственной пошлины, содержащейся в Государственной информационной системе о государственных и муниципальных платежах. В случае внесения изменений в состав лекарственного препарата для медицинского применения в части изменения производителя фармацевтической субстанции заявитель, при необходимости, может приложить заявление и документы согласно пункта 11 части 3 статьи 18 для внесения в государственный реестр лекарственных средств данной фармацевтической субстанции, если она до этого времени не 111 была в него внесена, а также документ, подтверждающий уплату государственной пошлины за включение фармацевтической субстанции, произведенной в целях реализации, в государственный реестр лекарственных средств. В случае непредставления указанного документа, уполномоченный федеральный орган исполнительной власти проверяет факт уплаты государственной пошлины с использованием информации об уплате государственной пошлины, содержащейся в Государственной информационной системе о государственных и муниципальных платежах. д) в абзаце первом части 7 слова «пяти» заменить словами «десяти»; д) часть 7 изложить в следующей редакции: 7. В срок, не превышающий десяти рабочих дней со дня получения заключений комиссий экспертов по результатам указанных в части 2 настоящей статьи экспертиз, уполномоченный федеральный орган исполнительной власти: 1) принимает решение о внесении изменений в документы, содержащиеся в регистрационном досье на зарегистрированный лекарственный препарат для медицинского применения, или об отказе во внесении таких изменений; принимает решение о включении фармацевтической Предлагаем следующую редакцию данной части. 112 субстанции, произведенной в целях реализации, в государственный реестр лекарственных средств, или об отказе в таком включении; 2) вносит в государственный реестр лекарственных средств на основании решения о внесении изменений в документы, содержащиеся в регистрационном досье на зарегистрированный лекарственный препарат для медицинского применения, необходимые изменения и возвращает их заявителю; вносит, при принятии решения о включении фармацевтической субстанции в государственный реестр лекарственных средств, предусмотренную пунктом 2 части 1 статьи 33 настоящего Федерального закона информацию и уведомляет об этом в электронном виде и (или)письменной форме заявителя. г) в части 5 слова «или отсутствие в представленных документах достаточных сведений, подтверждающих необходимость внесения изменений» заменить словами «и (или), предоставление документов, подтверждающих необходимость внесения изменений, не соответствующих требованиям к их содержанию и оформлению, утвержденным уполномоченным федеральным органом Исключить Содержание и оформление документов, подтверждающих необходимость внесения изменений, не регламентирована. В соответствии с вносимым изменением это могут быть самые разные документы от пояснительной записки до отчетов о проведении соответствующих исследований, для которых не может быть установлена единая 113 исполнительной власти»; 25) в статье 32: а) пункт 2 изложить в следующей редакции: «2) подачи владельцем (держателем) регистрационного удостоверения лекарственного препарата, разработчиком, производителем или уполномоченными ими другими юридическими лицами заявления об отмене государственной регистрации лекарственного препарата;»; 26) в статье 33: а) в пункте 1 части 1: форма. Предлагаем исключить данную часть из законопроекта. а) пункт 2 изложить в следующей редакции: «2) подачи владельцем (держателем) регистрационного удостоверения лекарственного препарата или уполномоченным им другим юридическим лицом заявления об отмене государственной регистрации лекарственного препарата;»; Регистрационное удостоверение выдается по заявлению одному лицу, которое в дальнейшем является владельцем (держателем) регистрационного удостоверения. Им оплачиваются все государственные пошлины за регистрационные процедуры, а также проведение доклинических, клинических, пострегистрационных исследований. Только владелец регистрационного удостоверения может подавать заявление об отмене регистрации лекарственного препарата. а) в пункте 1 части 1: подпункты «л» и «м» изложить в следующей редакции: «л) номер фармакопейной статьи или в случае ее отсутствия номер нормативной документации либо нормативного документа, а также даты утверждения внесенных изменений;» Предлагаем дополнить данный подпункт. 114 «м) дата государственной регистрации лекарственного препарата и его регистрационный номер, дата окончания действия регистрационного удостоверения (если применимо), дата аннулирования регистрационного удостоверения;» б) в пункте 2 части 1: дополнить подпунктами "е", "ж" следующего содержания: «е) качественный и количественный состав фармацевтической субстанции; ж) дата включения фармацевтической субстанции в государственный реестр лекарственных средств;»; б) в пункте 2 части 1: подпункт «д» изложить в следующей редакции: «д) номер фармакопейной статьи или в случае ее отсутствия номер нормативной документации либо нормативного документа, а также даты утверждения внесенных изменений;» Предлагаем дополнить данный пункт. В случае производства фармацевтической субстанции в соответствии со статьей Государственной фармакопеи виды упаковки будут указаны в государственном реестре лекарственных средств. дополнить подпунктом « з» следующего содержания: з) сведения о видах упаковки;»; 27) в статье 34: в) в части 2 цифры «4 – 7» заменить цифрами «1, 10-12»; в) в части 2 цифры «4 – 7» заменить цифрами «1, 11»; в пункте 3 цифры «4 – 7» заменить цифрами «1, 10-12»; в пункте 3 цифры «4 – 7» заменить цифрами «1, 11»; ж) дополнить частью 9 следующего содержания: «Внесение изменения в нормативную документацию или нормативный документ на Пункты 10 и 12 в части 3 статьи 18 относятся к лекарственным препаратам и не могут быть использованы при подготовке досье на фармацевтическую субстанцию. В действующей редакции Федерального закона не предусмотрено внесение изменения в нормативную 115 29) в статье 39: а) часть 1 после слов «экспертизы документов» дополнить словами «и фармацевтической экспертизы образцов лекарственного препарата в случае биологического и биоподобного лекарственного препарата»; фармацевтическую субстанцию, включенную в государственный реестр лекарственных средств, осуществляется в порядке, установленном в статье 30 настоящего Федерального закона.» документацию фармацевтических субстанций, включенных в государственный реестр лекарственных средств. а) часть 1 после слов «экспертизы документов» дополнить словами «и экспертизы качества лекарственного препарата»; Пострегистрационные клинические исследования проводятся для лекарственных препаратов, зарегистрированных в Российской Федерации, соответственно, прошедших все необходимые экспертизы при регистрации и находящихся в обращении в Российской Федерации. Для них не требуется дополнительная экспертиза качества образцов. б) в части 2: пункт 1 дополнить словами «, в котором б) в части 2: указывается на необходимость выдачи пункт 1 дополнить словами «, в разрешения на ввоз конкретной партии котором указывается на необходимость (серии) незарегистрированных или выдачи разрешения на ввоз конкретной зарегистрированных лекарственных партии (серии) незарегистрированных или препаратов для проведения экспертизы зарегистрированных лекарственных качества лекарственного средства для препаратов для проведения получения разрешения на проведение фармацевтической экспертизы образцов международного многоцентрового биологического и (или) биоподобного клинического исследования лекарственного лекарственного средства для получения препарата для медицинского применения»; разрешения на проведение международного многоцентрового в) в части 3: клинического исследования в абзаце первом слово «пяти» заменить лекарственного препарата для словом «десяти»; медицинского применения или пункт 2 после слов «экспертизы пострегистрационного клинического документов» дополнить словами «и исследования лекарственного препарата экспертизы качества лекарственного для медицинского применения»; препарата»; 116 в) в части 3: в абзаце первом слово «пяти» заменить словом «десяти»; пункт 2 после слов «экспертизы документов» дополнить словами «и фармацевтической экспертизы образцов лекарственного препарата в случае биологического или биоподобного лекарственного препарата»; пункт 3 после слов «уведомляет в» дополнить словами «электронном виде и (или) в»; пункт 3 после слов «уведомляет в» дополнить словами «электронном виде и (или) в»; г) в части 4: после слов «экспертизы документов» дополнить словами «и экспертизы качества лекарственного препарата»; после слов «экспертизы документов» дополнить словами «и экспертизы качества лекарственного препарата»; часть дополнить словами «, а также отсутствие информации, подтверждающей факт уплаты государственной пошлины за г) в части 4: после слов проведение этической экспертизы, «экспертизы документов» дополнить экспертизы документов лекарственного словами «и фармацевтической экспертизы препарата для получения разрешения на образцов лекарственного препарата в проведение международного случае биологического и биоподобного многоцентрового клинического исследования лекарственного препарата»; лекарственного препарата для медицинского после слов «экспертизы применения или отсутствие информации, документов» дополнить словами «и подтверждающей факт уплаты фармацевтической экспертизы образцов государственной пошлины за проведение лекарственного препарата в случае этической экспертизы, экспертизы биологического и биоподобного документов лекарственного препарата для лекарственного средства»; получения разрешения на проведение часть дополнить словами «, а также пострегистрационного клинического отсутствие информации, исследования лекарственного препарата для подтверждающей факт уплаты медицинского применения»; государственной пошлины за проведение этической экспертизы, экспертизы д) часть 5 после слов «экспертизы 117 документов лекарственного препарата для получения разрешения на проведение международного многоцентрового клинического исследования лекарственного препарата для медицинского применения или отсутствие информации, подтверждающей факт уплаты государственной пошлины за проведение этической экспертизы, экспертизы документов лекарственного препарата для получения разрешения на проведение пострегистрационного клинического исследования лекарственного препарата для медицинского применения»; д) часть 5 после слов «экспертизы документов» дополнить словами «и фармацевтической экспертизы образцов лекарственного препарата в случае биологического и биоподобного лекарственного препарата»; е) часть 6 после слов «экспертизы документов» дополнить словами «и фармацевтической экспертизы образцов лекарственного препарата в случае биологического и биоподобного лекарственного препарата»; 33) в статье 46: документов» дополнить словами «и экспертизы качества лекарственного препарата»; е) часть 6 после слов «экспертизы документов» дополнить словами «и экспертизы качества лекарственного препарата»; 118 а) пункты 1 и 2 после слов «международное непатентованное» дополнить словами «или группировочное,»; 35) в статье 47: 35) часть 8 статьи 47 изложить в следующей редакции: «8. Вывоз лекарственных средств из Российской Федерации осуществляется без применения ограничений, установленных таможенным законодательством Таможенного союза и (или) законодательством Российской Федерации о государственном регулировании внешнеторговой деятельности. Вывоз лекарственных препаратов, предназначенных для гуманитарной помощи (содействия) или помощи при чрезвычайных ситуациях, из Российской Федерации осуществляется в порядке, установленном Правительством Исключить 35) в статье 47: а) часть 3 изложить в следующей редакции: «3. Допускается ввоз в Российскую Федерацию конкретной партии зарегистрированных и (или) незарегистрированных лекарственных средств, предназначенных для проведения разработки лекарственных препаратов, доклинических и клинических исследований, проведения экспертизы лекарственных средств для осуществления государственной регистрации лекарственных препаратов или для оказания медицинской помощи по жизненным показаниям конкретного пациента на основании разрешения, Группировочные названия в зависимости от состава препарата могут быть очень объемными, например, для поливитаминных лекарственных препаратов или других многокомпонентных препаратов. Предлагаем группировочное название указывать в инструкции по медицинскому применению лекарственного препарата и не наносить на упаковку лекарственных препаратов. Российским производителям лекарственных препаратов требуется ввоз фармацевтических субстанций на стадии разработки лекарственных препаратов, для проведения доклинических исследований, для производства промышленной серии лекарственного препарата, образцы которой представляются на экспертизу качества при регистрации лекарственного препарата. Считаем необходимым дополнить данную статью. 119 Российской Федерации.»; выданного уполномоченным федеральным органом исполнительной власти по заявлениям лиц, указанных в статье 48 настоящего Федерального закона. Рассмотрение такого заявления и принятие решения о выдаче разрешения на ввоз конкретной партии зарегистрированных и (или) незарегистрированных лекарственных средств, предназначенных для проведения клинических исследований лекарственных препаратов, проведения экспертизы лекарственных средств для осуществления государственной регистрации лекарственных препаратов или для оказания медицинской помощи по жизненным показаниям конкретного пациента либо об отказе в выдаче указанного разрешения производятся в срок, не превышающий пяти рабочих дней. Плата за выдачу указанного разрешения не взимается.»; б) часть 8 изложить в следующей редакции: «8. Вывоз лекарственных средств из Российской Федерации осуществляется без применения ограничений, установленных таможенным законодательством Таможенного союза и (или) законодательством Российской Федерации о государственном регулировании внешнеторговой деятельности. Вывоз 120 лекарственных препаратов, предназначенных для гуманитарной помощи (содействия) или помощи при чрезвычайных ситуациях, из Российской Федерации осуществляется в порядке, установленном Правительством Российской Федерации.»; 35) в частях 1 и 2 статьи 59 слова «из гражданского оборота» заменить словами «из обращения»; 37) пункт 1 статьи 60 после слов «международное непатентованное» дополнить словами «, или группировочное,»; Исключить Исключить пункты 37,38, 39 Согласно определению, обращение лекарственных средств включает в себя разработку, доклинические исследования, клинические исследования, экспертизу, государственную регистрацию, производство, хранение, перевозку, отпуск, реализацию, передачу, применение, уничтожение. Таким образом, изъятие из обращения лекарственного средства делает не только невозможным его перевозку и уничтожение. Термин «гражданский оборот» остается в законе в соответствии с частью 3 статьи 45. Предлагаем оставить данную статью закона без изменения Изменения к статьям 60-62 Федерального закона вынесены в отдельный законопроект. При этом редакции изменений к 121 38) в статье 61: а) часть 2 изложить в следующей редакции: «2. Установленная производителем лекарственных препаратов предельная отпускная цена на лекарственный препарат, включенный в перечень жизненно необходимых и важнейших лекарственных препаратов, подлежит государственной регистрации в соответствии с утвержденной в порядке, установленном Правительством Российской Федерации, методикой установления производителями лекарственных препаратов предельных отпускных цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов. Перерегистрация зарегистрированных предельных отпускных цен на лекарственные препараты осуществляется на основании поданного до 1 октября каждого года заявления производителя лекарственных препаратов, включенных в перечень жизненно необходимых и важнейших лекарственных препаратов, в соответствии с утвержденной в порядке, установленном Правительством Российской Федерации, методикой перерегистрации производителями статьям 60-62 в законопроектах отличаются. Предлагаем данным законопроектом не вносить изменений к статьям 60-62. 122 лекарственных препаратов предельных отпускных цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов. Перерегистрация цен осуществляется не чаще 1 раза в календарном году.»; б) части 2.1. и 2.2. признать утратившими силу; 39) в части 2 статьи 62: а) пункт 1 изложить в следующей редакции: «1) наименование юридического лица, на имя которого выдано регистрационное удостоверение лекарственного препарата, производитель лекарственного препарата, первичный упаковщик, вторичный упаковщик, организация осуществляющая выпускающий контроль;»; б) пункт 2 после слов «международное непатентованное» дополнить словами «или группировочное,»; в) пункт 4 дополнить словами «, а также комплектность;»; г) пункт 6 изложить в следующей редакции: «6) дата и номер приказа о государственной регистрации предельной отпускной цены на лекарственный 123 препарат, включенный в перечень жизненно необходимых и важнейших лекарственных препаратов;»; д) дополнить пунктом 7 следующего содержания: «7) штрих-код.»; Статья 2 «Статья 333.32.1. Размеры государственной пошлины за совершение действий уполномоченным федеральным органом исполнительной власти при осуществлении государственной регистрации лекарственных препаратов. За совершение действий уполномоченным федеральным органом исполнительной власти, связанных с осуществлением государственной регистрации лекарственных препаратов в соответствии с Федеральным законом "Об обращении лекарственных средств", государственная пошлина уплачивается в следующих размерах (в зависимости от видов осуществляемых действий): «Статья 333.32.1. Размеры государственной пошлины за совершение действий уполномоченным федеральным органом исполнительной власти при осуществлении государственной регистрации лекарственных препаратов. За совершение действий уполномоченным федеральным органом исполнительной власти, связанных с осуществлением государственной регистрации лекарственных препаратов в соответствии с Федеральным законом "Об обращении лекарственных средств", государственная пошлина уплачивается в следующих размерах (в зависимости от видов осуществляемых действий): 1) за проведение этической экспертизы, экспертизы документов и фармацевтической экспертизы лекарственного препарата (кроме биологического и биоаналогового (биоподобного) лекарственного средства) 1) за проведение этической экспертизы, экспертизы документов и экспертизы качества лекарственного препарата для получения разрешения на проведение клинического исследования лекарственного препарата при обращении за государственной Предлагаем внести в проект соответствующие изменения, исключив проведение фармацевтической экспертизы. 124 для получения разрешения на проведение клинического исследования лекарственного препарата для медицинского применения при обращении за государственной регистрацией лекарственного препарата – 85 000 руб.; 2) за проведение этической экспертизы, экспертизы документов и фармацевтической экспертизы биологического или биоаналогового (биоподобного) лекарственного препарата для получения разрешения на проведение клинического исследования лекарственного препарата для медицинского применения при обращении за государственной регистрацией лекарственного препарата – 125 000 руб.; 3) за проведение этической экспертизы документов лекарственного препарата, представленного в качестве орфанного лекарственного препарата, для определения возможности рассматривать его при государственной регистрации в качестве орфанного лекарственного препарата – 10 000 рублей; 4) за проведение этической экспертизы, экспертизы документов и фармацевтической экспертизы лекарственного препарата для получения регистрацией лекарственного препарата – 225 000 руб.; 2) за проведение этической экспертизы, экспертизы документов и экспертизы качества лекарственного препарата для получения разрешения на проведение международного многоцентрового клинического исследования лекарственного препарата для медицинского применения 225 000 рублей; 3) за проведение этической экспертизы документов лекарственного препарата, представленного в качестве орфанного лекарственного препарата, для определения возможности рассматривать его при государственной регистрации в качестве орфанного лекарственного препарата – 10 000 рублей; 4) за проведение этической экспертизы, экспертизы документов для получения разрешения на проведение пострегистрационного клинического исследования лекарственного препарата для медицинского применения – 25 000 рублей; 5) за проведение экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для медицинского применения при его государственной регистрации - 25 000 рублей; 125 разрешения на проведение международного многоцентрового клинического исследования лекарственного препарата для медицинского применения - 225 000 рублей; 5) за проведение этической экспертизы, экспертизы документов и фармацевтической экспертизы лекарственного препарата для получения разрешения на проведение пострегистрационного клинического исследования лекарственного препарата для медицинского применения - 75 000 рублей; 6) за проведение экспертизы качества лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для медицинского применения при его государственной регистрации - 225 000 рублей;



