Урок – сказка по теме:
advertisement

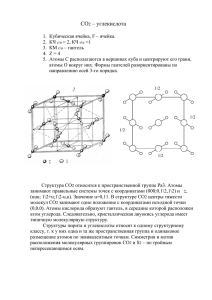
Урок – сказка по теме: «Оксид углерода (II), Оксид углерода (IV)». Цели урока: изучить физические и химические свойства, получение, применение и физические действия оксидов углерода (II, IV), развивая познавательную активность и самостоятельность учащихся в учебной работе. Оборудование: NаОН, СаО, Са(ОН)2 , Н2О, НСl, мрамор СаСО3, лакмус, пищевая сода NаНСО3, уксусная кислота СН3СООН, стеклорез, графит. План изучения темы: 1). Опрос: аллотропия С, адсорбиция, химические свойства С. 2). Оксид углерода (II). Физические и химические свойства; применение. 3). Оксид углерода (IV). Физические и химические свойства; применение. 4). Сообщения : «Экологические последствия антропогенного воздействия на природный круговорот углерода». Оформление доски: На левой доске написана тема, на средней доске таблица, которая заполняется в течении урока. Вопросы для сравнения 1. Получение 2. Физич. св – ва. 3. Химич. Св – ва. 4. Применение. Оксид углерода ( II ) Оксид углерода ( IV ) Правая доска для опроса. Сегодня, мы с вами проведем урок – сказку по теме: «Оксид углерода (II ). Оксид углерода (IV). Побывав в сказочном химическом царстве мы познакомимся с физическими и химическими свойствами данных оксидов, их получением и применением. Послушаем сообщение об экологической опасности, которую представляют углекислый и угарный газы. Итак, внимательно слушаем сказку и активно в ней участвуем. Ведущая: В сказочном царстве, химическом государстве жил – был граф Углерод. Он был очень важной персоной, так как находился в родстве со всеми живыми организмами. Граф был мягким и добродушным, но, когда случалось вспупать с кем то в спор, когда на него оказывали давление и доводили его до «белого каления», Углерод становился совсем другим, непохожим на самого себя: (демонстрирует стеклорез), бесцветным, прозрачным. В такой момент он необычайно хорош и привлекал внимание всех красавиц сказочного государства. Учитель: О каком химическом понятии идет речь? (аллотропия С: графит, алмаз).Чем отличаются структуры алмаза, графита, карбита и почему их можно назвать « родными братьями». Ведущий: Углерод очень любил принимать гостей, проявляя при этом свои окислительные способности. (звучит медленная музыка, поочереди входят Н2 , Са, Аl). 1. С водородом он образовывал углероды. С + 2Н2 = СН4 2. А с друзьями металлами- карбиды. 2С + Са = Са С 2 - карбид кальция. 3С + 4Аl = Аl4 С3 - карбид алюминия. ( на спинах у учащихся образовавшаяся формула). Учитель: ребята, кто желает записать на доске окислительные способности С -? Ведущий: Благодаря восстановительным свойствам было у углерода два сына: - угарный газ (Угарик), углекислый газ (Углекислик). (Граф обнимает своих детей). Учитель: Обратите внимание на таблицу, заметьте, что при неполном сгорании образуется угарный газ, а при полном СО2 , а также СО2 получить восстановление оксида меди ( II можно )углем.(в таблице записаны формулы). Получение: 2С + О2 = 2СО (неполное сгорание) С + О2 = СО2 +Q С + 2СuО = С О2 + 2Си (можно продемонстрировать). А как в природе образуются СО и СО2 ? ( дыхание живых организмов, фотосинтез, брожение, гниение, извержение вулканов, сжигание топлива). Учащиеся перечерчивают таблицу в тетрадь. Ведущий: Дети росли, а отец радовался глядя на них. Угарный газ был бесцветным, без запаха, немного легче воздуха, плохо растворим в воде, с очень низкой температурой кипения – 191,5 С (физич. свойства).(записывают свойства в таблицу). Он как и папа, восстановителем – восстанавливал металлы из их оксидов: СО + СиО = Си + СО2 С - 2е С восстановитель Си + 2е Си окислитель В кислороде он горел голубоватым пламенем. 2СО + О2 = 2СО + Q С + 2е С+4 восстановитель СО – активный О + 2е О -2 окислитель восстановитель Было у Угарного газа свойство, которое очень огорчало отца: Угарик прочно соединялся с гемоглобином крови. При этом кровь уже не могла переносить кислород, и это было смертельно опасно. СО – Яд! Углекислый газ был, как и брат бесцветен, но в 1,5 раза тяжелее воздуха. Было очень много друзей, с которыми он образовывал соли, основания и основные оксиды: СО 2 + 2 NаОН = Nа2СО3 + Н2О - карбонат натрия СО2 + NаОН = NаНСО3 - гидрокарбонат натрия (пищ. сода) СО 2 + СаО = СаСО 3 - карбонат кальция СО2 + 2М g С + 4е Мg - 2е 2М g О + С С окислитель Мg СО2 - окислитель восстановитель Только известковая вода не любила Углекислика. Завидев его, она начинала нервничать, и ее по ее помутнению все сразу узнавали о появлении Углекислого газа. СО2 + Са(ОН) 2 = СаСО3 + Н2 О (демонстрируется опыт) Углекислый газ помогал тушить пожары, производить сахар, соду, стекло, и многое друг СО 2 умел превращаться в «сухой лед»,чем очень гордился. Однажды старый граф Углерод поехал на бал в Водное царство. (музыка, танец). Их встретила принцесса Вода. Она была так прекрасна в своем ослепительноголубом наряде ,что Углекислый газ сразу влюбился в нее и весь вечер танцевал только с принцессой. Углекислый газ покорил сердце красавицы Воды. Вскоре они поженились и у них родилась дочь. Ей дали красивое имя – Кислота. От отца она унаследовала фамилию – Угольная. СО 2 + Н 2О = Н 2СО 3 (определяют лакмусом) СО и СО2 вместе: мы рассказали вам о нас немного,а что вы можете сказать нам о нашем применении? СО – используется в качестве газообразного топлива., в реакциях органического синтеза. Применение. (учащиеся) СО2 - получение сахара тушение пожаров производство фруктовых вод получение «сухого льда» получение соды ( Na2CO3, NаНСО3 ). Учитель: А теперь послушаем сообщения – какую же экологическую опасность представляют: углекислый и угарный газы. Заключение: Обратить внимание на таблицу, на вредное воздействие данных газов на живые организмы и на окружающую среду. Домашнее задание : 1. Какое §30, 31 . вещество называют «сухим льдом». Где оно применяется в сельском хозяйстве? (оксид углерода - один из основных источников минерального питания растений. В зеленых листьях из СО2 и Н 2 O синтезируются углеводы). 2. Как с помощью СО2 тушат пожары? Литература: 1. В.Г. Андросова. Внеклассная работа по химии. М.: Просвещение. 1983 2. М.В. Дряпина. Дайте возможность ребятам поиграть. Химия в школе. 1994 .№ 4. 3. В.В. Северюхина. Старые опыты с новым содержанием. Химия в школе. 1999 . №2. 4. Н.М. Кузьменок Экология на уроках химии. Минск. 1996 . Экологическая опасность представляемая СО. Угарный газ – очень ядовитый газ, без цвета и вкуса, с очень слабым запахом (обычно не ощущаемым), слегка напоминающим запах чеснока. Летальный исход может наступить для человека при 10 мин. вдыхании воздуха, содержащего 5, 7 г/м СО. Ядовитость СО обусловлена тем, что этот оксид соединяется гемоглобином крови, в результате чего кровь не способна с переносить достаточно кислорода из легких к тканям. В воздухе СО и СО2 находятся в отношении 1: 200, кровь поглощает оба газа в равных количествах. Поэтому достаточно самой ничтожной концентрации СО, чтобы значительно понизить способность крови воспринимать О 2 и тем самым вызвать удушие. Однако при вдыхании чистого воздуха или чистого О2 , СО постепенно удаляется из крови. СО – образуется в тех процессах, где существуют условия для полного сгорания веществ, содержащих С, а также при взаимодействии СО2 с раскаленным углем: 2С2 Н 4 + 5О2 = 2СО + 2СО + 4Н 2О (при недостатке О 2). С + СО2 = 2СО. В больших городах основным поставщиком СО в атмосферу является автомобильный транспорт.( В среднем каждый автомобиль сжигает 2т. бензина и 30 т. воздуха в год, выбрасывая 0,7 т. угарного газа, 40 кг. Оксидов азота, 2,5 т. твердых веществ, содержащих много свинца. Значительное снижение выбросов СО ( до 10 раз) и повышение экономичности двигателей происходит при применении газового топлива (метан, этан, пропан, а также смесей (бензина с метаном, водорода и бензина). В настоящее время каталитическая очистка выхлопных газов автотранспорта признана во всем мире. Она предполагает окисленные СО до СО2 . В качестве катализаторов используются различные композиции на основе оксидов металлов: алюминия Аl, платины Рt , палладия Рd , радия Rh . Особенности физиологического действия углекислого газа и его экологическая опасность. В результате каких природных процессов образуется СО2 ,поступающий в атмосферу? (дыхание растений, животных, в результате брожения, гниения, извержения вулканов, сжигания топлива). Небольшое содержание СО2 в воздухе полезно для живых организмов, так как стимулирует деятельность дыхательного центра, поэтому в небольшой концентрации СО2 не оказывает отравляющего действия на организм. Но если содержание СО2 повышается, то это губительно для человека и животных. При наличии в воздухе 3% СО2 наблюдается головокружение, шум в ушах, быстрая утомляемость, сонливость. При повышении концентрации СО2 в воздухе до 20% человек начинает задыхаться и возможен летальный исход. Увеличение содержания СО2 в атмосфере может привести к экологической катастрофе. На содержание СО2 в атмосфере существенное влияние оказывает деятельность человека, особенно все увеличивающиеся масштабы использования ископаемого топлива. Человечество за год сжигает около 3 млрд. тонн каменного угля, 2 млрд. тонн нефти, 800 млрд. м природного газа, при этом в атмосферу выбрасывается более 2 млрд. тонн СО2 .При сжигании топлива двигателя одного автомобиля в атмосферу попадает более 3000 кг. СО2 в год. Эти и ряд других факторов приводят к возрастанию содержания СО2 в атмосфере, за последние 100 лет концентрация СО2 в атмосфере увеличилась в 1,2 раза. Ученые считают, что это вызовет серьезные нарушения равновесия процессов в природе, в частности может привести к изменению климата на земле. Расчеты показывают, что удвоение содержания СО2 в атмосфере приведет к повышению средней температуры на планете на 2-3 градуса (парниковый эффект).Так, быстрое изменение климата может привести к исчезновению части лесов и других экосистем, что ослабит способность атмосферы поглощать СО 2 Более того, потепление может привести к быстрому высвобождению углерода, содержащегося в составе мертвой органической материи. Этот углерод, количество которого вдвое больше, чем в атмосфере постоянно превращается в СО2 и метан под действием почвенных бактерий. Также, потепление климата вызовет резкие животных и растений, в том числе и с/х экосистем. вспышки болезней среди культур в результате разрушения