06 Законы термодинамики
advertisement

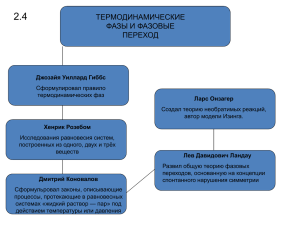
06 Законы термодинамики Термодинамика часто изучается как дедуктивный предмет без использования в качестве исходного понятия статистического определения энтропии как логарифма числа состояний. При таком построении вводится ряд постулатов, которые называются законами классической термодинамики. Нулевой закон. Если две системы находятся в тепловом равновесии с третьей системой, то они должны быть в тепловом равновесии друг с другом. Первый закон. Энергия сохраняется; тепло — это особая форма энергии. Второй закон. Если в некоторый момент времени замкнутая система находится в какой-либо макроскопической конфигурации, отличной от равновесной, то наиболее вероятным следствием этого будет монотонное возрастание энтропии системы в последующие моменты времени. Существует много форм второго закона. Мы сформулировали его в форме, наиболее близкой современному подходу. Одна из важных формулировок второго закона — постулат Кельвина, подчеркивающий ограниченность возможности превращения тепла в работу: невозможно построить такую циклически работающую машину, единственным результатом действия которой было бы извлечение тепла из резервуара и совершение равного ему количества механической работы. Третий закон. Если фундаментальная температура стремится к нулю, тоэнтропия системы стремится к постоянной, не зависящей от характера внешних воздействий на систему. Эти законы играют следующую роль в статистической термодинамике. а. Нулевой закон служит основой определения температуры. б. Первый закон утверждает сохранение энергии. в. Второй закон остается неким правдоподобным постулатом, но таким, который соответствует действительности и подтверждается всеми нашими повседневными наблюдениями. г. Третий закон не имеет существенного значения. Он указывает на характер вырождения основного состояния. Статистическая формулировка термодинамики покоится на следующих предположениях. а. Все допустимые состояния замкнутой системы реализуются с равной вероятностью. б. Средние физических величин по ансамблю равны равновесным значениям этих величин. б. Для достаточно большой системы среднее значение какой-либо величины можно заменить ее значением в системе с наиболее вероятной конфигурацией. Это предположение удобно, но несущественно: для небольших систем мы всегда можем вычислить сами средние. Резервуар (термостат, в который погружена система) всегда считается макроскопическим. г. Закон возрастания энтропии (второй закон).