Лабораторная работа № 155
advertisement

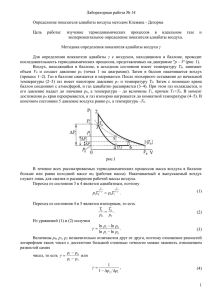
3 Лабораторная работа № 155 ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ ГАЗА CP CV ПО МЕТОДУ КЛЕМАНА-ДЕЗОРМА I. Цель и содержание работы Целью работы является изучение газовых законов. Содержание работы – определение отношения молярных теплоемкостей воздуха CP CV . II. Краткая теория работы Всякий газ может находиться в различных состояниях, отличающихся параметрами состояния (давлением P, температурой T , объемом V , плотностью и т.д.). Уравнение, устанавливающее связь между давлением, объемом и температурой, называют уравнением состояния. Для идеального газа уравнение состояния имеет вид: m PV RT , (1) M где m – масса газа, M – масса одного моля, R – универсальная газовая постоянная. Если при переходе некоторой массы газа из одного состояния в другое один из параметров остается постоянным, уравнение (1) имеет вид PV const ( T const – изотермический процесс), V const ( P const – изобарический процесс), T P const (V const – изохорический процесс). T При высоких давлениях (порядка десятков атмосфер) реальные газы не подчиняются уравнению (1), причины этого обусловлены наличием собственных размеров молекул и силами взаимодействия между ними, что и должно быть учтено в соответствующих уравнениях. 4 Из уравнений, предложенных для реальных газов, наиболее простым является уравнение Ван-дер-Ваальса. Для одного моля газа V m оно имеет вид: a P 2 Vm b RT , Vm (2) a – внутреннее Vm2 давление газа, появляющееся из-за сил притяжения между молекулами, b – поправка, учитывающая часть объема, занятого молекулами газа. При уменьшении плотности свойства всех реальных газов приближаются к свойствам идеального газа и уравнение (2) переходит в уравнение(1). Запишем закон сохранения энергии (первое начало термодинамики) dQ dU dA (3) где dQ – количество тепла, подводимого к газу. Это тепло затрачивается на работу газа dA PdV и на изменение его внутренней энергии dU . Количество тепла, которое нужно подвести к газу (веществу) или отнять от него для изменения его температуры на один градус, называется теплоемкостью газа (вещества). Теплоемкость, отнесенная к единице массы вещества, называется удельной теплоемкостью cуд . Теплоемкость, отнесенная к одному молю вещества, называется молярной теплоемкостью C . Удельная и молярная теплоемкости связаны выражением C cуд . (4) M Величина теплоемкости зависит от условий, при которых происходит нагревание тела. Пусть один моль газа нагревается при постоянном давлении ( P const , изобарический процесс). В этом случае получаемое газом тепло идет на увеличение его внутренней энергии и на совершение газом работы. dU dA dQ (5) CP dT dT dT P const где P – внешнее давление, оказываемое на газ, 5 Если один моль газа нагревается при постоянном объеме, то для нагревания его на один градус требуется меньшее количество тепла, так как работа газом не совершается, dA PdV 0 . dU dQ (6) CV dT V const dT Найдем связь между C P и CV . Для этого продифференцируем dA уравнение (1) и найдем для изобарического процесса. dT m PdV VdP RdT (7) M Учтем, что VdP 0 , тогда для одного моля газа PdV RdT dA . dA R (8) dT Подставив (6) и (8) в (5), получим для молярных теплоемкостей (9) CP CV R Отношение CP CV ( – показатель адиабаты) зависит только от числа степеней свободы i молекулы газа. Число степеней свободы определяется числом атомов в молекуле и характером связи между ними. Для одноатомного газа i 3 , для двухатомного газа с жесткой связью i 5 (с упругой связью i 7 ), для трех и более атомов (нелинейная молекула, жесткая связь) i 6 . На каждую степень свободы молекулы (согласно закону равнораспределения энергии по степеням свободы) приходится kT энергия, равная . (Здесь k – постоянная Больцмана.) 2 Внутреннюю энергию одного моля идеального газа можно найти по формуле iRT U , (10) 2 где R kN А , N А – число Авогадро. Продифференцируем выражение (10) по температуре и подставим в выражение (6). Тогда получим для молярной теплоемкости при изохорическом процессе iR CV (11) 2 6 iR R. 2 C Отсюда найдем отношение P CV C i 2 (12) P CV i Формула (12) справедлива и для отношения удельных теплоемкостей. Величина входит в уравнение Пуассона (13) PV const , описывающего адиабатический процесс в газах. Адиабатическим процессом называется процесс, протекающий без теплообмена с окружающей средой. Если процесс протекает достаточно быстро (например, при быстром расширении или сжатии газа), то его можно считать практически адиабатическим и при отсутствии тепловой изоляции. Закон Пуассона (13) может быть представлен также через параметры PT и TV . Для этого используют уравнение Менделеева – Клапейрона (1). Так, например, выразив V из (1), и, подставив в (13), получим (14) P1 T const . Выразив P из (1) и, подставив в (13), получим (15) TV 1 const . Первое начало термодинамики для адиабатического процесса ( dQ 0 ) принимает вид dA dU CV dT (16) Из выражения (16) видно, что адиабатическое расширение сопровождается понижением температуры, а адиабатическое сжатие – повышением температуры. Согласно (9) CP CV R III. Описание установки и метода выполнения работы Установка смонтирована в комплекс. Все элементы установки представлены на рис. 1. 7 Основной элемент установки – стеклянный баллон (объемом V 3,25 л ) расположен за передней панелью. В целях безопасности на баллон в рабочем состоянии надет мешок из плотной ткани. Часы-таймер В атмосферу Ш5 Верхний бачок К3 К насосу Ш1 Осушитель Ш2 К объему V2 К1 Баллон Ш3 К нижнему бачку К2 Ш4 Нижний бачок Рис. 1 Блок-схема установки Посредством крана К1 стеклянный баллон может быть соединен с насосом (в данной работе это груша-помпа, при помощи которой в баллон накачивается воздух) или, наоборот, отсоединен от него. Кран К2 соединяет (или перекрывает) стеклянный баллон с другим сосудом (известного или неизвестного объема). В нашей работе он должен быть закрыт. Стеклянный баллон снабжен краном К3, рукоятка которого выведена на переднюю панель прибора (внизу). Кран К3 соединяет баллон с атмосферой и позволяет быстро сбрасывать давление газа в нем. При повороте рукоятки из положения “открыт” в положение “закрыт” (или обратно) срабатывает микропереключатель, 8 подключенный к секундомеру. Результатом является измерение времени открытого или закрытого состояния крана. За передней панелью установлен осушитель (стеклянный баллончик с силикагелем). Дифференциальный водяной манометр состоит из нижнего и верхнего бачков, соединенных прозрачной трубкой. Вблизи трубки расположена линейка, по которой отсчитывается уровень жидкости. Необходимо учесть, что манометр измеряет давление в миллиметрах (мм) водяного столба. 1 мм водяного столба соответствует, примерно, 10 Па. Исследуемый газ подается в стеклянный баллон при помощи груши-помпы (насоса) через штуцер Ш1. При этом происходит удаление осушителем влаги из газа. Чтобы измерить давление в баллоне, штуцер Ш3 шлангом соединяют со штуцером Ш4. Если штуцер Ш5 открыт в атмосферу (как в данной работе), манометр измеряет превышение давления в резервуаре над атмосферным. (Если штуцер Ш5 соединен с другим резервуаром, то манометр измеряет разность давлений в них.) Штуцер Ш2 служит для подключения другого резервуара. (В данной работе не используется.) Жидкость (вода) заливается лаборантом в нижний бачок через штуцер Ш4 с помощью резиновой груши со шлангом так, чтобы начальный уровень жидкости находился напротив нулевого деления шкалы линейки. (В противном случае, надо обратиться к лаборанту.) Верхний бачок служит предохранителем: он принимает в себя воду при случайном превышении предельного значения давления в нижнем бачке. Часы-таймер предназначены для измерения времени с точностью 0,01с. Кнопка MODE – выбор режима работы. В режиме “секундомер” мигает надпись в верхней части дисплея. Кнопка DATE/UP в режиме “секундомер” поочередно запускает и останавливает отсчет времени. Кнопка ALT/SET, нажатая при остановленном отсчете времени, сбрасывает (обнуляет) отсчет и показания дисплея. Кнопка ALT/SET, нажатая в процессе отсчета времени, фиксирует показания дисплея, но не останавливает отсчета времени. 9 (Дроссели ДР 1 и ДР 2 предназначены для изучения видов течения газа в трубе и измерения вязкости воздуха. В данной работе не используются.) Упражнение. Определение отношения CP CV методом Клемана-Дезорма Пусть мы имеем баллон с газом, находящийся при атмосферном давлении P0 и комнатной температуре T0 . (Кран К3 открыт.) Закроем кран К3 и накачаем в баллон воздух до некоторого давления P1 . Через некоторое время (1-2 мин.) вследствие теплообмена с окружающей средой температура в баллоне станет комнатной T0 . По водяному манометру устанавливается разность давлений P1 P0 h1 , где h1 – высота столбика жидкости. Единица массы газа при этом занимает объем V1 . Это состояние соответствует точке 1 (см. рис.2). Параметры данного состояния P1 , T0 ,V1 . Откроем на короткое время (до 2 с) кран К3, соединяющий баллон с атмосферой. При этом воздух, находящийся в баллоне, быстро (адиабатически) расширится и вследствие этого охладится до температуры T1 , а давление будет равно атмосферному P0 . Единица массы газа займет объем V2 . Это состояние соответствует точке 2 (см.рис.2). Параметры данного состояния T1 , P0 ,V 2 . P 1 T0 P1 T0 P2 3 P0 T1 2 V V2 V1 Рис. 2. Графики процессов: 1 – 2 – адиабата, 2 – 3 – изохора. 1 * 10 Как только кран оказывается закрытым, температура (вследствие теплообмена) начинает повышаться до комнатной T0 и (так как процесс изохорический) давление также повышается до P2 . При этом по водяному манометру устанавливается разность давлений P2 P0 h2 , где h2 – высота столбика жидкости. Это состояние соответствует точке 3 (см.рис.2). Параметры данного состояния P2 , T0 ,V2 . Получим расчетную формулу для в нашей работе. Переход из состояния 1 в состояние 2 описывается уравнением Пуассона. Для состояний 1 и 2 запишем уравнение адиабатического процесса (см. 14). 1 1 P1 T0 P01 T1 или T0 T1 P1 P0 (18) Переход из состояния 2 в состояние 3 – изохорический. Поэтому параметры состояний 2 и 3 связаны следующим соотношением T0 T1 P2 P0 . (19) Возведем уравнение (19) в степень , получим: 1 T0 P2 T1 P0 Приравняем правую часть последнего уравнения к правой части уравнения (18): P2 P1 (20) P P 0 0 Подставим в (20) P1 P0 h1 , и P2 P0 h2 , где h1 – давление, превышающее атмосферное в состоянии 1, и h2 – давление, превышающее атмосферное в состоянии 2. 1 h2 h1 1 1 (21) P P 0 0 Так как h1 и h2 намного меньше P0 , то, разложив в ряд обе части уравнения (21), будем иметь: h h или h2 1h1 . 1 2 1 1 1 P0 P0 Откуда и получим расчетную формулу для : 11 h1 (h1 h2 ) (22) IV. Порядок выполнения работы 1. Убедитесь, что штуцеры Ш3 и Ш4 соединены шлангом (при этом стеклянный баллон соединен с манометром), а груша-помпа присоединена к крану К1. Убедитесь, что кран К1 открыт, а краны К2 и К3 закрыты (при этом стеклянный баллон не соединяется с атмосферой.) 2. Осторожно накачайте в баллон воздух до давления 180 – 200 мм водяного столба. Закройте кран К1.. Подождите 1 – 2 минуты до установления комнатной температуры T0 воздуха в баллоне. 3. Определите показание манометра h1 и запишите его значение в таблицу. 4. Включите часы в режим “секундомер”, обнулите их показания, нажав сначала DATE/UP, а затем ALT/SET. 5. На короткое время (до 1 – 2 с) откройте кран К3, повернув рукоятку крана по часовой стрелке до упора, а затем закройте, повернув назад. (Время открытого состояния крана автоматически покажет таймер.) В этом случае газ адиабатическим путем из состояния 1 переходит в состояние 2 (см. рис.2). Таблица № измерения. 1 2 3 4 5 6 7 8 9 10 h1 , мм h2 , мм h1 h2 , мм 12 6. Подождите 1 – 2 минуты, пока не установится комнатная температура (изохорный процесс). Определите по манометру избыточное давление h2 , установившееся в результате этого процесса, и запишите его значение в таблицу. 7. Чтобы привести газ в начальное состояние, откройте кран К3, соединяющий баллон с атмосферой, и подождите до опускания жидкости в начальное положение. 8. Откройте кран К1, закройте кран К3. Убедитесь, что кран К2 закрыт. 9. Повторите пункты 2 – 7 еще девять раз, записывая полученные данные в таблицу. V. Обработка результатов измерений 1. Исходя из полученных данных, подсчитайте по формуле (22) величину . Данные запишите в таблицу. 2. Оцените абсолютную погрешность величины . Вычисления случайной погрешности серии измерений проводить, как для i2 прямых измерений: t (n) , где t (n) – коэффициент n(n 1) Стьюдента, n – число измерений. Необходимо, также, учесть приборную погрешность = 0,02 , которую надо прибавить к случайной. 3. .Окончательный результат представьте в виде , где . VI. Контрольные вопросы 1. Напишите уравнение состояния для идеального газа. Каков физический смысл универсальной газовой постоянной R? 2. .Какой процесс называется изохорическим? изотермическим? изобарическим? адиабатическим? Нарисуйте в координатах PV графики этих процессов. 13 3. Сформулируйте первое начало термодинамики. Запишите его для всех изопроцессов. Как меняется температура газа при адиабатическом процессе? 4. Дайте определение удельной и молярной теплоемкостей газа. Получите соотношение между теплоемкостями при постоянном давлении и постоянном объеме. 5. Что называется числом степеней свободы молекулы? Получите формулу для через число степеней свободы молекулы. Каково численное значение для одно-, двух- и многоатомного газов? 6. Расскажите о методе определения в данной работе? 7. Напишите уравнение состояния для реального газа. Поясните физический смысл поправок в нем. 8. Как определяется погрешность серии измерений в данной работе? Литература 1. Савельев И.В. Курс общей физики Т.1 - М. Наука, 1977. 2. Кикоин И.К., Кикоин А.К. Молекулярная физика. М. Наука, 1978.