ВАРИАНТЫ ТЕСТОВЫХ ЗАДАНИЙ
advertisement
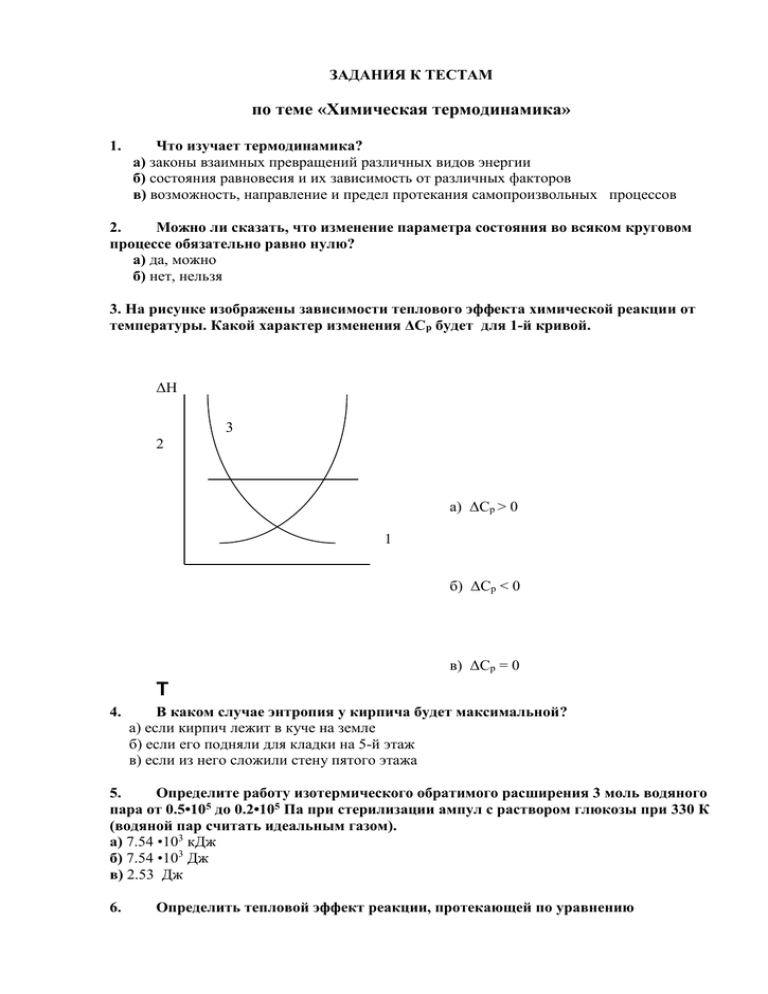
ЗАДАНИЯ К ТЕСТАМ по теме «Химическая термодинамика» 1. Что изучает термодинамика? а) законы взаимных превращений различных видов энергии б) состояния равновесия и их зависимость от различных факторов в) возможность, направление и предел протекания самопроизвольных процессов 2. Можно ли сказать, что изменение параметра состояния во всяком круговом процессе обязательно равно нулю? а) да, можно б) нет, нельзя 3. На рисунке изображены зависимости теплового эффекта химической реакции от температуры. Какой характер изменения ΔСр будет для 1-й кривой. ΔН 3 2 а) ΔСр > 0 1 б) ΔСр < 0 в) ΔСр = 0 Т 4. В каком случае энтропия у кирпича будет максимальной? а) если кирпич лежит в куче на земле б) если его подняли для кладки на 5-й этаж в) если из него сложили стену пятого этажа 5. Определите работу изотермического обратимого расширения 3 моль водяного пара от 0.5•105 до 0.2•105 Па при стерилизации ампул с раствором глюкозы при 330 К (водяной пар считать идеальным газом). а) 7.54 •103 кДж б) 7.54 •103 Дж в) 2.53 Дж 6. Определить тепловой эффект реакции, протекающей по уравнению CH3COOH(ж) + C2H5OH(ж) =CH3COOC2H5 (ж) + H2O(ж) в н.у. а) 13.51 кДж/моль б) – 13.51 кДж/моль в) –2254.21 кДж/моль 7. Внутренняя энергия является характеристической функцией при выборе в качестве независимых переменных ... а) давления и объема; б) давления и энтропии; в) температуры и энтропии; г) объема и энтропии; д) объема и температуры. 8. Разность между энергиями Гиббса и Гельмгольца равна произведению ... а) энтальпии и давления; б) объема и давления; в) объема и температуры; г) энтропии и температуры; д) давления и энтропии. 9. Химический потенциал – это производная от термодинамического потенциала по ... а) температуре; б) давлению; в) количеству моль данного вещества; г) объему; д) общему числу моль системы. по теме «Химическая кинетика» 1. Химическая кинетика – это раздел физической химии, изучающий: а) протекание химических реакций под действием электрического тока; б) скорость химических реакций; в) изменение концентраций реагирующих веществ во времени; г) возможность и направление протекания химической реакции. 2. Простыми называются реакции, для осуществления которых требуется преодоление: а) нескольких энергетических барьеров; б) одного или нескольких энергетических барьеров; в) только одного энергетического барьера. 3. Общим порядком химической реакции называется: а) сумма стехиометрических коэффициентов исходных реагентов в химическом уравнении; б) сумма показателей степеней у концентраций реагентов в уравнении константы скорости химической реакции; в) сумма показателей степеней у концентраций реагентов в кинетическом уравнении. 4. Какой из приведенных методов определения порядка реакции является дифференциальным? а) графический; б) по времени полупревращения; в) метод Вант-Гоффа; в) метод подбора (подстановки) уравнений. 5. Какому порядку реакции соответствует размерность константы скорости k [с-1] ? а) нулевому; б) первому; в) второму; г) третьему. 6. При повышении температуры скорость химической реакции: а) не изменяется; б) уменьшается; в) сначала увеличивается, потом уменьшается; г) увеличивается. 7. Реакция изомеризации 2-метилпентана является: а) мономолекулярной; б) бимолекулярной; в) тримолекулярной. 8. При повышении давления химическое равновесие: а) сместится в сторону увеличения числа молей реагирующих веществ; б) сместится в сторону уменьшения числа молей реагирующих веществ; в) останется без изменения. 9. В лабораторных условиях кислород часто получают разложением бертолетовой соли в присутствии оксида марганца (IV) в качестве катализатора. Какой это тип катализа? а) гомогенный; б) гетерогенный. 10. Энергия активации элементарной реакции – это: а) максимальный избыток энергии над средней внутренней энергией молекул, необходимый для того, чтобы произошло химическое взаимодействие; б) минимальный избыток энергии над средней внутренней энергией молекул, необходимый для того, чтобы произошло химическое взаимодействие. 11. Скорость химической реакции при охлаждении с 60 до 30 С уменьшилась в 8 раз? Чему равен температурный коэффициент данной реакции? а) 2 б) 4 в) 3.5 12. Вычислить значение константы скорости реакции каталитического разложения пероксида водорода и установить порядок реакции, если на титрование проб объемом 2 мл был израсходован последовательно объем перманганата калия (С=0,02 моль/л): Время взятия проб от начала опыта, мин 0 Объем пермантганата калия, мл 24,7 10 13,9 20 9,2 30 5,3 40 3,1 50 1,6 по теме «Получение и свойства дисперсных систем» 1. Данная дисперсная система относится к свободнодисперсным: а) эмульсия; б) крем; в) суспензия; г) туман; д) гель. 2. К аэрозолям относятся следующие дисперсные системы: а) эмульсия; б) дым; в) суспензия; г) облака; д) пена. 3. Характерными особенностями дисперсной системы являются: а) Большая площадь удельной поверхности частиц дисперсной фазы; б) Дисперсность; в) Однородность; г) Отсутствие границы раздела фаз; д) Гетерогенность; 4. Рассчитайте дисперсность системы, если известно, что дисперсная фаза состоит из 10000 частиц, радиусом 0,01 мм : а) 1000000 м-1 б) 1000 м-1 в) 100000 м-1 г) 100 м-1 5. Определите площадь удельной поверхности дисперсной фазы, если известно, что ее частицы кубической формы имеют основной размер а=3 10-6 м : а) 106 б) 2106 в) 2107 г) 108 д) 1,5106 6. Дисперсные системы разделяют на лиофобные и лиофильные по: а) взаимодействию частиц дисперсной фазы между собой; б) взаимодействию частиц дисперсной фазы с дисперсионной средой; в) агрегатному состоянию дисперсной фазы и дисперсионной среды; г) размерам частиц дисперсной фазы. 7. Укажите, какое соединение выступило в роли стабилизатора при образовании данной мицеллы золя: m BaSO4 n SO4- - 2(n-x) K+ 2x K+ а) KCl б) BaSO4 в) K2SO4 г) Na2SO4 8. Укажите верную формулу мицеллы золя, полученного по реакции: Al(NO3)3 + KOH = …………, при условии, что стабилизатором является Al (NO3)3 : а) m Al(OH)3 n Al+++ 3(n-x) NO3- 3x NO3б) m Al(OH)3 n Al+++ (3n-x) NO3- 3x NO3в) m Al(OH)3 n OH- (n-x) K+ x K+ г) m Al(OH)3 n Al+++ (3n-x) NO3- x NO39. Для проведения каких мембранных процессов необходимо использование внешнего давления: а) осмос; б) обратный осмос; в) диализ; г) фильтрация; д) ультрафильтрация. 10. Соединение, выступающее в роли стабилизатора нерастворимого осадка, должно: а) являться сильным электролитом; б) находиться в системе в недостатке; в) находиться в системе в избытке; г) иметь ионы, способные достраивать кристаллическую решетку ядра мицеллы; д) не иметь ионы, сходных по природе с ионами ядра мицеллы золя. 11. Для получения дисперсных систем Т/Г можно использовать следующие методы: а) распыливание; б) измельчение; в) барботаж; г) сублимация; д) кристаллизация. 12. Ядро данной мицеллы m ZnSO3 n SO3- - 2(n-x) K+ 2x K+ имеет заряд: а) положительный; б) отрицательный; в) нейтральный. по теме «Поверхностные явления в дисперсных системах» 1. Сорбцией называется процесс: а) слипание частиц дисперсной фазы; б) поглощение вещества из растворителя; в) слияние частиц дисперсной фазы; г) оседание частиц дисперсной фазы; д) концентрирование газа на поверхности твердой фазы. 2. Графическая зависимость, построенная в координатах Г=f(C) при T = const, является а) изотермой поверхностного натяжения; б) кривой седиментации; в)изобарой адсорбции; г) изотермой адсорбции. 3. Какое из веществ обладает большей поверхностной активностью? а) 1 б) 2 в) 3 г) одинаковой 4. Локализованной считается адсорбция, при которой: а) адсорбтив связан с адсорбентом химической связью; б) адсорбтив может перемещаться относительно поверхности сорбента; в) адсорбтив связан с адсорбентом силами молекулярного сцепления; г) адсорбтив не может перемещаться относительно поверхности сорбента; д) молекулы адсорбтива могут покинуть поверхность адсорбента. 5. Во сколько раз отличается адсорбционная способность уксусной и валериановой кислот? а) ≈ 3 б) ≈6 в) ≈ 9 г) ≈ 12 д) ≈27 6. Какие из перечисленных веществ относятся к поверхностно-инактивным: а) диэтиламин; б) бутадиен -2,4; в) анилин; г) хлорид аммония; д)гидроксид натрия. 7. Величина Г∞ характеризует: а) предельное значение гиббсовской адсорбции; б) взаимодействие молекул адсорбтива с поверхностью адсорбента; в) емкость монослоя молекул адсорбтива; г) избыток числа молей адсорбтива в поверхностном слое по сравнению с их числом в объемах фаз. 8. Правило Дюкло-Траубе будет действовать в случае адсорбции ПАВ из: а) этилового спирта; б) ацетона; в) воды; г) водного раствора щелочи; д) бензина. 9. Катион какого электролита будет обладать наибольшей адсорбционной способностью: а) оксида алюминия; б) фосфата калия; в) гидроксида натрия; г) бромида бария. 10. Для хроматографического анализа используют следующий тип адсорбции: а) физическую б) мономолекулярную; в) ионообменную; г) химическую; д) полимолекулярную. 11. Величина предельной адсорбции Гиббса графически определяется как: а)тангенс угла наклона прямой Г=f(C); б) отрезок, отсекаемый на оси ординат графиком, построенным в координатах Г=f(C); в) отрезок, отсекаемый на оси ординат графиком, построенным в координатах С/Г=f(C); г) котангенс угла наклона графической зависимости, построенной в координатах С/Г=f(C). 12. Определить константы уравнения Фрейндлиха по следующим экспериментальным данным адсорбции анилина на глине: Концентрация р-ра анилина, С% 0,12 0,24 0,44 0,65 8 Величина адсорбции, Г*10 , кг/кг 5 12 21 26 0,98 35 1,2 38













