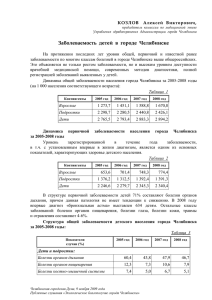
Y. Описание заболеваемости в группах населения, выделенных по
advertisement

СЕМИНАР № 1 ОСНОВНЫЕ СТАТИСТИЧЕСКИЕ ПОКАЗАТЕЛИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ИЗМЕРЕНИЯ ЗАБОЛЕВАЕМОСТИ. Исходные данные: Абсолютное число людей впервые заболевших определенной болезнью в какой-либо группе населения за определенный отрезок времени на данной территории. Как правило обозначается буквой А Абсолютное число всех случаев какого-либо заболевания в какой-либо группе населения за определенное время на данной территории, независимо от времени его возникновения. Как правило обозначается буквой А Численность группы населения. Как правило обозначается буквой N ИНТЕНСИВНЫЕ ПОКАЗАТЕЛИ ( I ) Отражают частоту встречаемости изучаемого явления. В общем виде могут быть представлены как отношение: ЯВЛЕНИЕ СРЕДА В нашем случае явление это абсолютное число заболевших (больных), среда – население. Общая формула расчета интенсивных показателей: I NA R , где А - абсолютное число заболевших (больных), N - численность группы населения, R – 10n . Размерность R указывает, на какую стандартную численность населения ( 1000 чел., 10000 чел. и т.д.) рассчитывается показатель. Чаще всего для измерения и описания заболеваемости используется два вида интенсивных показателей: 1. Показатель заболеваемости, синоним – показатель инцидентности (от англ. incidence rate). В качестве А принимается абсолютное число людей заболевших определенной болезнью в какой-либо группе населения за определенный отрезок времени на данной территории. Отражает частоту возникновения новых случаев изучаемой болезни в данной группе населения. 2. Показатель распространенности, синоним – показатель превалентности (от англ. prevalence rate). В качестве А принимается абсолютное число всех случаев какого-либо заболевания в какойлибо группе населения за определенное время на данной территории, независимо от времени его возникновения. Отражает, с какой частотой данная болезнь встречается в изучаемой группе населения. ЭКСТЕНСИВНЫЕ ПОКАЗАТЕЛИ. Показывают долю (удельный вес) части явления во всем явлении. Используются для изучения структуры явления. В общем виде могут быть представлены как отношение: ЧАСТЬ ЯВЛЕНИЯ ЯВЛЕНИЕ В нашем случае явление, это абсолютное число заболевших или больных (А), часть явления – количество больных, относящихся к какой либо группе населения (А части), например количество заболевших мужчин. Общая формула расчета экстенсивных показателей: Кафедра эпидемиологии ММА им. И.М.Сеченова 1 Р Ачасти А 100 Экстенсивные показатели рассчитываются из абсолютного числа заболевших (больных). Использование интенсивных показателей в качестве исходной информации для расчета экстенсивных возможно только в том случае, если они относятся к одной и той же группе населения. Значение отдельного интенсивного показателя, отражающего частоту заболеваний в отдельной группе населения, определяется только: риском заболеть (заразиться и заболеть) представителей исключительно данной группы; численностью данной группы населения. Следовательно, изменение интенсивного показателя одной группы населения никак не сказывается на величине интенсивных показателей в других группах. Значение отдельного экстенсивного показателя, отражающего долю заболевших отдельной группы населения в общей сумме больных, принятых за 100%, определяется: риском заболеть (заразиться и заболеть) характерным не только для данной группы, но и других групп населения; численностью каждой группы населения, входящей в данное распределение заболевших. Именно поэтому величина экстенсивных показателей и их изменение может зависеть с равной вероятностью, как от факторов присущих отдельной группе населения, так и факторов влияющих на число заболевших в других группах. Таким образом, по величине экстенсивных показателей заболеваемости не следует делать выводы о частоте и риске заболеваемости в разных группах населения. Исключением из этого правила являются такие распределения экстенсивных показателей, в которых оцениваются доли заболевших, относящихся к одной и той же группе населения Все задания выполняются в письменном виде в рабочей тетради Задание 1 1.1 По данным, представленным в табл..1, рассчитайте показатели распространенности (превалентности) и заболеваемости (инцидентности) ревматизмом населения Москвы в 1998 году. 1.2 Выявите и объясните причины различий между значениями показателей распространенности (превалентности) и заболеваемости (инцидентности) ревматизмом населения Москвы в 1998 году и в изучаемый период. 1.3 Раскройте эпидемиологический смысл показателей распространенности (превалентности) и заболеваемости (инцидентности) ревматизмом заболеваемости скарлатиной населения Москвы в 1998 г. Таблица 1. Заболеваемость ревматизмом населения Москвы в 1992-1998 г г. в показателях превалентности и инцидентности на 100 000 населения Годы Населен Число больных Превален Инцидент Всег ие тность ность о 1992 9044600 2689 40 29,7 0,4 025,9 0 1993 8837050 2290 45 /0000 /0,5 0000 1994 8792900 2161 48 24 6 0,5 1995 8792900 2045 39 23.3 0,4 1996 8755100 1999 45 22,8 0,5 1997 8690900 1942 46 22.3 0,5 1998 8690800 1832 55 ??????? ?????? Кафедра эпидемиологии ММА им. И.М.Сеченова 2 Задание 2 Таблица 2. Заболеваемость скарлатиной населения г. Москвы в 1992-1993 гг. на 100 000 населения Населени Выявлен Заболеваемость о (инцидентность е случаев ) 0/ 0000 1992 9044600 6653 73,6 1993 8337050 7700 87,1 1994 8/92900 7990 90,9 1995 3792900 6831 78,3 1996 8755100 7465 85,3 1997 8690900 5726 65,9 1998 8690800 9353 ?????? ________ 2.1. По данным, представленным в табл 2, рассчитайте показатель заболеваемости _| (инцидентности) скарлатиной населения Москвы в 1998 году. 2.2. Выскажите и аргументируйте Ваши соображения возможности расчета показателя превалентности периода по представленным данным. 2.3. Выскажите и аргументируйте Ваши соображения о целесообразности оценки заболеваемости скарлатиной с помощью показателя превалентности периода. 2.4. Раскройте эпидемиологический смысл показателя заболеваемости скарлатиной населения Москвы в 1998 г. Год Задание 3. Таблица 3. Заболеваемость острыми вирусными гепатитами в Российской Федерации в 2005 г. Всего Дети до 14 лет Абс.число На 100 000 населения Абс.число На 100 000 населения 64967 44,94 13307 57,65 3.1. По данным, представленным в табл. 3, рассчитайте долю детей до 14 лет среди заболевших острыми вирусными гепатитами в Российской Федерации в 2005 г. 3.2. Какие данные (абсолютные числа или интенсивные показатели) Вы выбрали для расчета? Объясните почему. 3.3. Можно ли по данным табл.3 рассчитать величину показателя заболеваемости (инцидентности) острыми вирусными гепатитами взрослых (старше 14 лет), их долю среди заболевших? Рассчитайте возможные показатели. Объясните свое решение. 3.4. Объясните, почему при более высокой заболеваемости детей до 14 лет, их удельный вес среди заболевших острыми вирусными гепатитами в Российской Федерации в 2005 г. меньше, чем удельный вес взрослых. Задание 4. Таблица 4. Заболеваемость острыми вирусными гепатитами в Российской Федерации в 2005 г. Всего Дети до 14 лет Абс.число На 100 000 Абс.число На 100 000 населения населения Острые вирусные 64967 44,94 64967 44,94 гепатиты В т.ч. гепатит А 43433 30,05 12246 53,05 Гепатит В 12379 8,56 438 1,90 Гепатит С 6455 4,47 179 0,78 4.1. По данным, представленным в табл. 4, рассчитайте доли заболевших гепатитами А, В и С среди заболевших острыми вирусными гепатитами в Российской Федерации в 2005 г. 4.2. Какие данные (абсолютные числа или интенсивные показатели) Вы выбрали для расчета? Объясните почему. Кафедра эпидемиологии ММА им. И.М.Сеченова 3 СЕМИНАР № 2 Описательные (дескрептивные) исследования относятся к наблюдательным (обсервационным) исследованиям являясь их важнейшей составной частью. Оно может быть самостоятельным законченным исследованием, в тоже время полученные в описательных исследованиях новые эпидемиологические данные побуждают исследователей к проведению аналитических исследований, конечным результатом которых является выяснение причины возникновения и распространения изучаемой болезни. В результате описательное исследование является чаще всего первым этапом полноценного эпидемиологического исследования включающего и аналитический раздел. «Перепрыгнуть» через описательные исследование невозможно, так как именно при описании выявляются различия заболеваемости отдельных групп населения, которые в аналитических исследованиях сравниваются с набором и активностью (в этих группах) биологических, социальных и природных факторов. Факторы риска рассматриваются как достаточные, необходимые и дополнительные причины возникновения и распространения болезней. Описать заболеваемость – значит дать характеристику особенностей ее распределения во времени в социально-возрастных группах населения и по территории. При этом описание ограничивается наблюдением за заболеваемостью (т.е. без вмешательства в изучаемое явление) и не предполагает проверку гипотез о причинах заболеваний. Помимо собственно болезней изучаются течение и исходы болезни: смертность, инвалидность, бесплодие и т.д., исходы воздействий например наркотиков, алкоголя. прекращение курения и т.д. Описание проводится на основе данных официальной (текущей) статистики и (или) выборочных исследований. База данных официальной статистики включает данные о заболеваемости выявленной: по обращаемости - данные характеризуются доступностью и простотой получения информации, являются основным источником информации об острых и хронических заболеваниях. Однако существуют и недостатки, связанные с особенностями учета и регистрации, неполнотой обращения. по данным медицинских осмотров - позволяют выявить начальные стадии или скрытые формы заболеваний. Возможности метода ограничены из-за недостаточной материально-технической базы, неполного финансирования осмотров декретированных групп населения, высокой стоимости и т.д. Виды медицинских осмотров: профессиональные (выявление болезней и нарушений здоровья. обусловленных профессией), целевые (выявление конкретной нозологической формы), предварительные (при устройстве на работу) и периодические профилактические (для определенных контингентов в течение года). Показатели заболеваемости полученные на основе выборочных исследований являются более точными, однако их получение и накопление сопряжены с определенными трудностями и (или) в ряде случаев значительными затратами. Структура описательных эпидемиологических исследований Дизайн, способы проведения исследований, способы организации исследований, research structures, study design – термины являются синонимами термина «структура». Единой общепринятой структуры описательных эпидемиологических исследований на сегодняшний день нет, как нет и единого названия данного исследования: описаниенаблюдение, описательно оценочные исследования, дескрептивные, описательные исследования. Существует много терминов характеризующих организацию исследований, которые применяются авторами произвольно. Наиболее удачная классификация с нашей точки зрения была предложена Палтышевым И.П., которая дает возможность использовать многообразие характеристик для обозначения различных особенностей организации и проведениялюбых эпидемиологических (в нашем случае Кафедра эпидемиологии ММА им. И.М.Сеченова 4 описательных) исследований (см. главу 4,стр…., схема….), в том числе и описательных. Согласно этой классификации (классификационный признак - термины определяющие дизайн) описательное исследование может быть: по цели -описательное по общенаучному методу – наблюдательное по объему изучаемого явления – сплошное и выборочное по наличию изучаемых - состоявшихся- случаев (болезни, смерти) – ретроспективное по времени проведения – одномоментное (поперечное и динамическое (продольное) по месту проведения - полевое. В ряде случаев один из терминов может быть использован как имя собственное, например «одномоментное исследование» используется для характеристики чаще всего выборочных описательных исследований. Одномоментное описательное исследование (поперечное, prevalence study, crosssectional) - это исследование в равной степени может относиться как к описательным, так и аналитическим. Критерий - проводится или нет проверка гипотезы о факторах риска. Более того термин»одномоментное» трактуется как исследование проведенное на результатах полученных один раз (кратность проведения) или чаще всего – проведенных в одно и тоже время (время проведения). В ряде случаев термин «одномоментное исследование» заменяется термином «скрининг». Все эти термины используются для обозначения описательных эпидемиологических исследований. Большинство авторов этот тип исследований относят к аналитическим исследованиям. В дескрептивной эпидемиологии этот метод используется для: выявления истинной распространенности болезни выявления признаков болезни уточнения симптомов болезни и их связи с диагнозом т.д. В выборочных описательных исследованиях величина показателей заболеваемости будет превышать данные официальной статистики и более достоверно отражать распространенность явления. В тоже время на точность результатов исследования отрицательно могут повлиять выбранные методы, критерии диагностики, корректность вопросов анкеты, манифестность болезни и т.д. Согласно классификации Палтышева И.П. одномоментное исследование является описательным, наблюдательным, выборочным, редко сплошным, научным или рутинным, полевым. Наиболее широко методы декрептивной эпидемиологии в нашей стране используются санитарно-эпидемиологической службой. Описательные эпидемиологические исследования являются одним из инструментов в практической работе эпидемиолога по выявлению особенностей распределения болезней. Эти исследования являются повседневными, рутинными, проводятся в рамках одной из основных (эпидемиолого-диагностической, аналитической) функций управленческой деятельности. Только правильно поставив эпидемиологический диагноз заболеваемости можно успешно осуществлять профилактику. Основными разделами эпидемиологической диагностики являются ретроспективный эпидемиологический анализ и оперативный эпидемиологический анализ заболеваемости, первым этапом в которых являются описательные эпидемиологические исследования. Схема проведения описательного ретроспективного эпидемиологического анализа (РЭА) заболеваемости состоит из ряда последовательных, взаимосвязанных действий. Однако прежде чем приступить к его выполнению необходимо освоить некоторые основополагающие специальные приемы работы с величинами заболеваемости. Все специальные методы, используемые в эпидемиологических исследованиях, являются статистическими и включают методы сбора и методы обработки эпидемиологических данных. К универсальным методам, используемым на всех этапах анализа, относятся: группировка и сводка эпидемиологических данных; методы измерения заболеваемости (представлены в главе 4); Кафедра эпидемиологии ММА им. И.М.Сеченова 5 способы графического отображения эпидемиологических величин; оценка статистической достоверности и эпидемиологической значимости различий показателей заболеваемости. Знание особенностей формирования и оценки показателей заболеваемости, сводки и группировки данных, правил построения и прочтения диаграмм, оценки достоверности различий показателей заболеваемости дает возможность правильно организовать, провести и оценить результаты описательного ретроспективного анализа. Ретроспективный эпидемиологический анализ –это анализ уровня, структуры и динамики заболеваемости с целью обоснования перспективного планирования мероприятий. Описательный этап ретроспективного анализа заболеваемости, является обязательным его элементом. В практике здравоохранения целью РЭА является выявление и обоснование приоритетных проблем профилактики заболеваний по группам и нозологическим формам болезни, выявление и обоснование приоритетных проблем профилактики отдельных инфекций и формулирование гипотез о факторах риска. В отношении актуальных групп и нозологических форм болезней - выявление особенностей динамики и структуры заболеваемости с учетом времени, места возникновения заболевания и индивидуальных характеристик заболевших, т. е. установить время риска, территории риска и группы риска. Выявление проблем профилактики 1. На основе анализа уровня и структуры заболеваемости по группам и нозологическим формам болезней При выявлении проблем профилактики оценке подвергаются показатели характеризующие состояние здоровья населения. Прежде всего это показатели описывающие частоту (инцидентность- новые случаи, болезненность – новые и выявленные ранее случаи) заболеваемости и долю заболевших. Инцидентность характеризует уровни заболеваемости по группам и нозологическим формам болезни и оценивает риск заболеть. Для большей наглядности и возможности использовать данные обобщенной характеристики риска заболеть и долевого участия группы болезней проводят ранжирование показателей. Сравниваемые показатели распределяют в убывающем порядке. Болезненность (пораженность) характеризует актуальность болезней с хроническим течением. Оценка этого показателя дает представление не только о распространенности болезни и риске быть больным на данный момент (период), но и косвенно указывает на продолжительность болезни, эффективность лечения и т.д. Его изменение может напрямую зависеть от показателя инцидентности. При оценке показателей заболеваемости прежде всего необходимо исключить субъективные факторы способные повлиять на их величину (качество выявления, диагностики и учета больных), что может избавить от ошибочных выводов. Сравнивая показатели заболеваемости отчетного периода с предшествующими данными (в динамике) выявляют тенденцию и прогнозируют развитие заболеваемости в дальнейшем. Часто сравнение проводят по среднемноголетним показателям. Незнание особенностей средних величин, неверный их выбор может привести к ошибочным выводам. В первую очередь это касается анализа болезней, для которых характерно неравномерное (упорядоченное или беспорядочное) распределение заболеваемости. Даже при относительно равномерном распределении заболеваемости, но разнонаправленных тенденциях, среднемноголетние величины могут исказить значимость сравниваемых групп болезней, уравнивая их шансы при выборе приоритетных проблем профилактики. При равных средних, тенденция к росту заболеваемости указывает на увеличение активности факторов риска, изменение их набора или (и) появление новых факторов. Значит большее внимание следует уделить именно этой группе болезней. Таким образом сравнение по среднемноголетним показателям заболеваемости правомерно использовать в случаях стабилизации заболеваемости (т.е. отсутствие и колебаний заболеваемости, и отсутствие тенденции). Кафедра эпидемиологии ММА им. И.М.Сеченова 6 Структура заболеваемости (заболевших) это - особенности строения, внутреннее устройство общей или групповой заболеваемости. Структура заболеваемости по группам и нозологическим формам болезней оценивается в долях от общего числа больных, с последующим ранжированием. Ранги интенсивных и экстенсивных показателей суммируются. Суммарные ранги по представленным показателям определяют эпидемиологическую значимость болезней. Термин «эпидемиологическая значимость болезней» правомерно использовать не только в отношении инфекционной патологии, а всего спектра болезней исходя из определения данного Беляковым В.Д. (Эпидемиология, Беляков В.Д. Яфаев Р.Х., М., Медицина, 1989). «Эпидемиология как общемедицинская наука – наука, изучающая причины, условия и механизмы формирования заболеваемости населения путем анализа особенностей её распределения по территории, среди различных групп населения и во времени и использующая эти данные для разработки способов профилактики заболеваемости». Описание показателей характеризующих социальную значимость болезни проводится анологично показателям заболеваемости. Систематизация статистических показателей используемых при изучении структуры заболеваемости групп и нозологических форм болезней позволила выделить критерии оценки эпидемиологической, социальной и экономической значимости болезней. Эпидемиологическая значимость. Используются интенсивные показатели заболеваемости (инцидентности, болезненности) и экстенсивные в виде фактических, среднемноголетних и прогностических величин и показателей тенденции. По результатам исследований проводят оценку эпидемиологической обстановки (эпидемиологического благополучия территорий), составляют отчеты о состоянии здоровья населения (ежегодный Государственный доклад о состоянии здоровья населения) Социальная значимость. Используются показатели общей смертности и смертности среди различных возрастных групп, инвалидности, которые характеризуют исходы болезни и связанные с ними показатель потерянных (недожитых) лет жизни и трудопотери. Социальная значимость оценивается также на основе совокупного ущерба наносимого здоровью населения (тяжесть и продолжительность болезни, исходы болезни), учитывает и дезорганизацию жизни и деятельности населения (например при проведении режимно-ограничительных мероприятий). Поскольку используемые критерии разнообразны и выражены в разных единицах измерения, а ряд из них не имеет количественных характеристик, социальный ущерб оценивают в относительных величинах. Экономическая значимость. Определяется ущербом, который наносят болезни народному хозяйству, ограничивая трудовые ресурсы. Оценивают прямой и косвенный ущерб. Прямой ущерб – затраты на обследование и лечение заболевших, выплаты по временной нетрудоспособности и инвалидности, пенсии и пособия в случае утери кормильца, затраты на профилактические и противоэпидемические мероприятия, научную разработку средств и методов борьбы с заболеваниями. Косвенный ущерб – стоимость недополученной обществом продукции в результате нетрудоспособности по болезни и уходу за больным, инвалидности (исходя из средней длительности предстоящего нетрудоспособного периода), смерти. Для оценки экономической и социальной значимости болезней разработан экспресс-метод, в основе которого лежит использование «стандартных» величин социального и экономического ущерба наносимого одним случаем заболевания. Показатели периодически пересматриваются. 2. На основе анализа динамики и структуры заболеваемости конкретными группами и нозологическими формами болезни Описать заболеваемость населения какой-либо болезнью означает не просто, как часто отмечают ответить на вопросы «когда болеют», «где болеют», «кто болеет». Описание должно содержать сравнительную характеристику величин заболеваемости, Кафедра эпидемиологии ММА им. И.М.Сеченова 7 т.е. ответы на вопросы «когда болеют чаще, а когда реже»; какие группы (коллективы) населения болеют чаще, а какие реже», на какой территории (в каком месте) болеют чаще, а на какой реже». (Именно поэтому более правильно называть эти исследования описательно-оценочными). В ходе проведения описательных эпидемиологических исследований должны быть описаны как устойчивые (закономерные, типичные) особенности динамики и структуры, так и необычные (нетипичные) характеристики заболеваемости. Словосочетание «особенности динамики и структуры заболеваемости» в советской и российской эпидемиологической литературе обычно по аналогии с проявлениями болезни обозначают термином «проявления заболеваемости». Проявление заболеваемости - это распределение заболеваемости в социальновозрастных группах населения в конкретных условиях места и времени. Эти данные нужны для решения вопросов – где, когда и среди кого необходимо проводить мероприятия. Описать заболеваемость – значит дать характеристику ее распределения во времени в социально-возрастных группах населения и по территории. При этом описание ограничивается наблюдением за заболеваемостью (т.е. без вмешательства в изучаемое явление) и не предполагает проверку гипотез о причинах заболеваний Описание представляется в виде таблиц, диаграмм и текста, в которых отражены выявленные проявления заболеваемости. Основание для проведения исследований высокая эпидемиологическая значимость болезни высокая социально-экономическая значимость болезни наличие (появление) возможностей для предупреждения заболеваний или снижения заболеваемости. Цель определение приоритетных проблем профилактики в практике здравоохранения определение приоритетных проблем медицинской науки Задачи выявление особенностей в структуре заболеваемости по группам и нозологическим формам болезней характеристика эпидемиологической ситуации среди наблюдаемого населения в целом, в определенных группах населения, в конкретных условиях места и времени Действия определение эпидемиологической, социальной и экономической значимости болезней выявление и описание структуры заболевших и особенностей проявления заболеваемости конкретными нозологическими формами болезни во времени, в группах населения и по территории. В результате 1. выявляется распространенность болезни время наибольшего риска заболевания и время проведения профилактических и противоэпидемических мероприятий территории риска и степень риска заболевания группы и (или) коллективы наибольшего риска заболевания 2. Формулируется гипотеза о факторах риска обеспечивающих данное распределение заболеваемости Использование полученных результатов описательные данные используются в дальнейших аналитических исследованиях для корректировки существующих на данный момент времени программ (планов) профилактики болезней Описательное эпидемиологическое исследование может быть сплошное или выборочное научное или рутинное Кафедра эпидемиологии ММА им. И.М.Сеченова 8 одномоментное или динамическое ретроспективное полевое всегда наблюдательное Описание многолетней динамики заболеваемости (распределения годовых показателей заболеваемости) Описание распределения заболеваемости следует начинать с полного названия диаграммы I.Тенденция или направление движения показателей заболеваемости Для выявления и оценки тенденции используют различные методы, которые дают ориентировочные (визуальная оценка графика или "мысленное" выравнивание, метод выравнивания "от руки") и точные (метод наименьших квадратов) выводы. Выявление тенденции означает выравнивание фактической кривой и построение линии, которую называют линией тренда (трендом или линией тенденции). Линия тренда показывает, какими теоретически могли бы быть годовые показатели, если бы заболеваемость зависела только от факторов, формирующих тенденцию Критерием правильности нанесения (или расчета) линии тренда является приблизительно равные значения сумм() отклонений ( - дельта) фактических показателей заболеваемости вверх и вниз от линии тенденции (+=¯) (рис.1-условные данные). I0 /0000 Кривая фактических показателей 300 Линия тенденции 250 Отклонения фактических поазателей вверх от линии тренда - -дельта (∆+). 200 150 Отклонения фактических показателей вниз от линии тренда -дельта (∆−) 100 50 2002 2001 2000 1999 1998 1997 1996 1995 1994 1993 1992 0 Рис. 1. Пример правильного нанесения линии тенденции (+=¯) Кривая фактических показателей I0 /0000 300 Линия тенденции 250 Отклонения фактических показателей вверх от линии тренда дельта (∆+) Отклонения фактических показателей вниз от линии тренда дельта (∆−) 200 150 Кафедра эпидемиологии ММА им. И.М.Сеченова 2002 2001 2000 1999 1998 1997 1996 1995 1994 0 Линия тенденции проведена неправильно - сумма отклонений вверх от линии тенденции явно меньше суммы отклонений вниз от линии тенденции. 1993 50 1992 100 9 Рис.2.Пример неправильного нанесения линии тенденции (+¯)(условные данные). В ряде случаев кривые нельзя описать одной прямой линией в силу того, что меняется активность или набор факторов риска, тогда выравнивание проводится несколькими прямыми (рис.3). I0/0000 I0/ 0000 правильно неправильно 180 160 140 120 100 80 60 40 20 0 1 2 3 4 5 6 7 8 правильно неправильно 180 160 140 120 100 80 60 40 20 0 1 9 10 11 12 13 14 15 16 17 годы условно 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 годы условно Рис.3. Примеры выравнивания кривых динамки годовых показателей. Наличие «выскакивающего» показателя изменяет характер тенденции, что, в свою очередь, приведет к некорректным выводам о динамике риска заболеть, к завышению прогностических показателей заболеваемости и, возможно, к планированию и проведению неадекватных мероприятий по профилактике данной болезни. «Выскакивающими» считаются величины нехарактерные для данного ряда, – то есть необычно высокие или необычно низкие показатели. Учитывая, что причины появления «выскакивающего» показателя нетипичны для изучаемого периода, его при расчетах тенденции следует исключить или заменить (рис.4 и рис.5). I0 / 0000 500 450 400 350 300 250 200 150 ------ тренд с "выскакивающим" показателем ___ тренд без "выскакивающего" показателя 2003 2002 2001 2000 1999 1998 1997 1996 1995 1994 1993 1992 1991 1990 1989 1988 100 50 0 Рис. 4. Заболеваемость скарлатиной населения г. В в 1988 – 2003 г. (I0/0000).Один из трендов построен без «выскакивающего» показателя 2001 г. (433,7/0000), при этом значение «выскакивающего» показателя заменено при расчете тенденции на медианный показатель из лет подъема заболеваемости (211,2/0000). Кафедра эпидемиологии ММА им. И.М.Сеченова 10 I0/ 0000 49 тренд с "выскакивающим" показателем 42 тренд без "выскакивающего" показателя 35 28 21 14 7 1989 1988 1987 1986 1985 1984 1983 1982 1981 1980 1979 1978 0 Рис. 5 Заболеваемость ГЛПС населения области С. в 1978 – 1989 г. (I0/0000). Один из трендов на рис 5 построен без «выскакивающего» показателя 1986 г. (45,70/0000) При этом значение «выскакивающего» показателя заменено при расчете тенденции на прогнозируемый на 1986 г. показатель (1,20/0000). Выводы тенденция отсутствует, т.е. линия тренда располагается практически параллельно оси Х, а показатель заболеваемости первого года линии тенденции достоверно не отличается от уровня заболеваемости последнего года линии тенденции, тенденция к росту или тенденция к снижению. Если показатель заболеваемости первого года линии тенденции достоверно отличается от уровня заболеваемости последнего года линии тенденции, тогда делается вывод о наличии тенденции. Дополнительно различными статистическими методами может быть оценена выраженность тенденции. Например, ежегодный темп прироста (снижения) заболеваемости, выраженный в процентах, оценивается следующим образом: до 1% отсутствует, от 1% до 5% - умеренный, выше 5% - выраженный. если отсутствует тенденция и цикличность можно сделать вывод о стабилизации заболеваемости. II. Колебания годовых показателей заболеваемости Изучение колебаний относится к анализу многолетней динамики показателей. Такими показателями могут быть: итоговые годовые показатели всего населения, групповые годовые показатели, годовые уровни фоновой и сезонной заболеваемости, месячные (например, многолетняя динамика заболеваемости в мае), недельные и др. показатели. Для обозначения особенностей колебаний годовых показателей заболеваемости используют ряд терминов отражающих различные параметры колебаний: относительно равномерное и неравномерное распределение показателей, годы подъема и годы спада заболеваемости, эпидемический цикл, амплитуды циклов, фаза подъема и фаза спада, цикличность, периодичность, волнообразность, ритмичность, хаотичность колебаний. К сожалению, многие из них не имеют однозначных определений. I.1.Равномерное или неравномерное распределение показателей заболеваемости Абсолютно равномерного распределения показателей заболеваемости как правило в природе не наблюдается, всегда существуют некоторые колебания величин. Однако статистической достоверности в разности этих показателей не отмечается, что дает основание говорить об относительно равномерном распределении заболеваемости. Такое распределение характерно для неинфекционных и ряда инфекционных болезней. Кафедра эпидемиологии ММА им. И.М.Сеченова 11 Неравномерное распределение заболеваемости, когда показатели заболеваемости статистически достоверно отличаются в годы подъемы и спады заболеваемости. Достоверность различия показателей рассчитывается различными статистическими методами и отражается на графике в виде доверительных границ. Если таких знаков на графике не нанесено, тогда вывод о неравномерности распределения будет носить предварительный характер, который в дальнейшем подтвердится или будет опровергнут. Заболеваемость многими инфекционными болезнями отличается наличием статистически достоверных (р0,05) колебаний годовых показателей, что, соответственно, расценивается как неравномерное их распределение за изучаемый период времени. (рис. 6). Пример неравномерного распределения заболеваемости 0 I /0000 120 100 80 60 40 20 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 Годы условно Рис 6. Заболеваемость болезнью Х (условные данные, доверительные границы I 2m). населения г. Н за 29 лет При описании целесообразно указать годы подъема и годы спада и соответствующие им уровни заболеваемости или назвать диапазон колебания заболеваемости от минимального до максимального уровня в конкретные годы. Годы спада заболеваемости – один год или несколько лет с относительно низкими показателями заболеваемости, расположеными на диаграмме ниже линии тенденции и не отличающиеся друг от друга, но отличающиеся от ближайших соседей - предшествующего и последующего показателя. На рис. 9.16А группа лет спада - это 8, 9, 10, и 11 год -, один год спада - 26 год. Годы подъема заболеваемости - один или несколько лет, показатели заболеваемости которых, достоверно выше предшествующего и последующего показателя лет, отнесенных к годам спада заболеваемости. Например:3, 4, 5, 6 и 7 годы. I.2.Неравномерное распределение годовых показателей может быть упорядоченным (циклическим, ритмичным) или хаотичным. Динамика годовых показателей заболеваемости большинства инфекционных болезней отличается закономерным формированием циклов, нередко повторяющихся с относительно одинаковым интервалом. Для характеристики таких закономерных явлений используют термины цикличность и периодичность (большинство авторов считают их синонимами) и редко – ритмичность. (Ритм – чередование, каких либо элементов, происходящее с определенной последовательностью, частотой). Эпидемический цикл – проявление заболеваемости, при котором в течение определенного числа лет (но не менее трех) происходит статистически значимое увеличение и уменьшение частоты заболеваемости (т.е. циклические изменения заболеваемости). Цикл легко выявляется на Кафедра эпидемиологии ММА им. И.М.Сеченова 12 графике многолетней динамики как участок кривой расположенный между двумя годами с минимальной (для данного цикла) заболеваемостью. Их условно делят на малые- с периодом 3-5 лет, средние – 6-15 лет и большие – более 15 лет. Упорядоченность во времени – приблизительно одинаковый промежуток времени между двумя максимально выраженными подъемами (спадами) заболеваемости (обычно допускается расхождение в 1-3 года) (см. рис.5.11). Ориентировочное представление об упорядоченном или хаотическом распределении заболеваемости достигается при обычной визуальной оценке графиков или гистограмм. Беспорядочное (хаотичное, нерегулярные или эпизодические подъемы) распределение заболеваемости, когда количество циклов меньше 3-х, отсутствует закономерность в повторяемости циклов и т.д. Упорядоченное (цикличность, периодичность, ритмичность) распределение заболеваемости. Если интервалы между циклами оказываются приблизительно одинаковыми, а их число составляет не менее 4, можно с большой долей уверенности сделать вывод о циклических колебаниях заболеваемости как характерной особенности динамики годовых показателей в изучаемом периоде. При выявлении 3 циклов, повторяющихся с равными интервалами, можно сделать тот же, но только ориентировочный вывод. III. Прогноз заболеваемости на следующий год Прогностические оценки основаны лишь на выявленных, характерных для изучаемого периода, проявлениях многолетней динамики заболеваемости и не учитывают возможные будущие нетипичные изменения активности факторов риска. Поэтому любой метод вычисления прогностических показателей заболеваемости, дает лишь ориентировочный (с разной степенью точности) прогноз. Определяют средний прогностический показатель и его возможные максимальные и минимальные значения ( пороговые показатели), в которых может находиться показатель заболеваемости следующего года при условии если не произойдет существенных (непредвиденных или ожидаемых) изменений активности причин возникновения и распространения какой-либо болезни, или (и) существенных изменений в полноте выявления, качестве диагностики и учета больных. Если такие изменения произойдут, это приведет к нетипичным (по отношению к изученному периоду) проявлениям заболеваемости и показатель заболеваемости следующего года не будет соответствовать прогнозу. Кафедра эпидемиологии ММА им. И.М.Сеченова 13 Самым простым способом определения прогноза заболеваемости является продолжение нанесенной на график линии тенденции до метки следующего года, что даст возможность определить средний прогностический показатель. IY. Возможные причины обеспечивающие данное распределение заболеваемости Особенности распределения заболеваемости во времени зависят от набора факторов и активности комплекса разнообразных причин и условий, которые условно можно разделить на три группы: 1. факторы (причины и условия), активность которых на протяжении многих лет практически не меняется или изменяется в одном направлении. Например: на неблагоустроенной территории (отсутствие канализации, колодезное водоснабжение), строится водопровод и канализация с поэтапным вводом отдельных районов в течение нескольких лет. В результате улучшения качества питьевой воды и очистке территории от загрязнения бытовыми стоками отмечается тенденция к снижению заболеваемости. Такой характер изменения активности причин влияет на интенсивность заболеваемости и связан в первую очередь с социальными факторами 2. причины и условия, активность которых меняется периодически, ритмично, достигая максимума и минимума через приблизительно одинаковое число лет. Например: величина иммунной прослойки общества, являющаяся главной составляющей биологических факторов и определяющая циклические (периодические, ритмичные) колебания заболеваемости. Если не происходит существенных и необычных изменений иммунной прослойки то, в большинстве случаев, на одной территории периоды разных циклов одинаковы, также одинаковы и интервалы между циклами. 3. причины и условия, активность которых беспорядочно меняется во времени (природно-климатические факторы) или факторы проявляющиеся случайно (аварии за счет природно-климатических или социальных факторов) Таким образом распределение заболеваемости зависит от сочетанного действия биологических, социальных и природно-климатических факторов. Кафедра эпидемиологии ММА им. И.М.Сеченова 14 Описание внутригодовой (месячной) динамики заболеваемости Описание следует начинать с полного названия графика I. Колебания внутригодовых (месячных) показателей заболеваемости I.1. Равномерное или неравномерное распределение показателей заболеваемости Внутригодовая структура и динамика месячных показателей заболеваемости неинфекционными болезнями, как правило не имеет достоверных изменений в пределах одного года. Для инфекционных болезней наоборот часто характерны достоверные колебания месячных показателей заболеваемости, поэтому внутри года можно выявить несколько вариантов их распределения. Относительно равномерное распределение заболеваемости: когда все месячные показатели достоверно не превышают фонового уровня заболеваемости (т.е. уровня выше которого фоновая заболеваемость подняться не может). Фоновая заболеваемость – это проявления внутригодовой динамики и структуры заболеваемости присущие данной территории с характерными для нее постоянно действующими факторами с минимальной их активностью. При расчетах фоновой заболеваемости учитываются только спорадические случаи. Терминами близкими по смыслу фоновой заболеваемости являются «межсезонная» и «межэпидемическая» заболеваемость (или заболеваемость в «межсезонный» и «межэпидемический» периоды). Эти термины отражают заболеваемость только в те месяцы, когда фактические показатели не превышают фоновый уровень. Неравномерное распределение заболеваемости: когда отмечаются достоверные подъёмы заболеваемости выше предельной фоновой заболеваемости. Внутригодовые подъёмы заболеваемости – объективное явление, отражающее активизацию и (или) изменение набора факторов риска внутри года. Внутригодовые подъемы могут быть представлены разным набором случаев, например, только спорадическими случаями, или только случаями, относящимися к вспышкам, или их сочетанием I.2. Неравномерное распределение показателей заболеваемости: сезонные или хаотические подъемы заболеваемости сезонные - подъёмы регулярно (ежегодно) повторяются в одно и то же время (сезон). - сезонные подъёмы при одних болезнях начинаются и заканчиваются в одном и том же году, а при других – начинаются осенью (зимой) и заканчиваются уже в следующем году. - подъемы заболеваемости могут захватывать один, два или три природных сезона, отсюда сезонность может быть зимней, осенней, летне-осенней, весенне-летне-осенней и т.д.. - сезонность можно выявить по табличным и графическим данным, но при условии, что данные о заболеваемости представлены за весь изучаемый период и распределены по месяцам года в таблице, на ленточной диаграмме ) или типовой кривой. - если табличные или графические данные о заболеваемости представлены за один год, делается вывод о наличии подъема, но является ли он сезонным неизвестно. хаотические (эпизодические) – подъёмы возникают относительно редко, только в отдельные годы и в разные месяцы. Данное распределение заболеваемости может быть связано со вспышечной заболеваемостью, которая формируется за счет случайных факторов. Из описания внутригодовой заболеваемости она исключается и анализируется отдельно, как правило в оперативном эпидемиологическом анализе. Ориентировочные выводы о наличии (отсутствии) этих проявлений возможны уже при обычной визуальной оценке таблиц и графиков динамики месячных показателей заболеваемости. Графики могут быть представлены в виде: - линейной диаграммы месячных показателей заболеваемости отдельного года, при построении соблюдается правило «золотого сечения». - ленточной диаграммы месячных показателей заболеваемости – непрерывная кривая отражающая внутригодовую динамику заболеваемости за ряд лет с единой ценой деления (длина масштабного отрезка чаще всего равна 0,5 см, что позволяет «одним взглядом» охватить Кафедра эпидемиологии ММА им. И.М.Сеченова 15 особенности распределения месячных показателей внутри года сразу за несколько лет), правило «золотого сечения» при построении не соблюдается. - типовая кривая месячных показателей заболеваемости - это кривая построенная по средним (чаще медианным) значениям заболеваемости каждого месяца за изучаемый период, при построении соблюдается правило «золотого сечения». Примеры диаграмм 0 12 I /0000 10 8 Верхний предел "фона" 6 4 2 0 1 2 3 4 5 6 7 8 9 10 11 12 Месяцы Рис. 7. Заболеваемость бактериологически подтвержденной дизентерией населения г. В. в 1997 г. Как следует из рисунка подъём заболеваемости дизентерией населения г.В. в 1997г. продолжался 6 месяцев – с июня (начало подъема заболеваемости) по ноябрь(окончание подъема заболеваемости) включительно, при этом максимальная заболеваемость была зарегистрирована в августе. Межэпидемический период соответственно продолжался тоже 6 месяцев. Если «типовой» сезонный подъём начинается и заканчивается в одном году, то график строят как обычно, начиная с января и заканчивая декабрём. Если «типовой» сезонный подъём начинается в одном году, а заканчивается в следующем, то при построении диаграммы обозначения на оси Х следует начать не с января, а с одного из месяцев минимальной заболеваемости. I0 / 0000 0 I /0000 А 10 10 9 9 8 8 7 7 6 6 5 5 4 4 3 3 2 2 Б 1 1 0 0 1 2 3 4 5 6 7 8 9 10 Месяцы 11 12 5 6 7 8 9 10 11 12 1 2 3 Месяцы 4 . Рис. 8 (А, Б) Медиана («типовая» кривая) заболеваемости гепатитом А населения г.В в 1992 – 2000 г.г. (I0/0000). Рис. А – обычное построение графика, т.е. начиная с января, более пригодно для изучения межэпидемического периода. Рис. Б – график начинается с одного из месяцев минимальной заболеваемости. Рис.Б более наглядно, чем рис. А, отражает типовые сроки начала и окончания сезонных подъемов заболеваемости гепатитом А. населения г.В. за последние 9 лет. II. Характеристика (параметры) внутригодового подъёма заболеваемости позволяет оценить его: начало, окончание, месяц максимальной заболеваемости и продолжительность этого подъема. Оставшиеся (от 12) месяцы года составят длительность межэпидемического (межсезонного) периода. Сопоставление сроков начала и регулярности подъёмов в различные годы позволяет их Кафедра эпидемиологии ММА им. И.М.Сеченова 16 расценить как сезонные или как хаотические. При этом в описании следует отметить не только типичные временные параметры, но и необычные отклонения от них. срок начала подъема заболеваемости можно определять несколькими способами. Один из них: опустить перпендикуляр на ось Х из точки пересечения месячной Iпред.фон (предельно фоновой) заболеваемости и кривой заболеваемости. Начало подъема определяется только месяцем года, но не днем месяца т.к. не известно распределение заболеваний по дням внутри месяцев (т.е. неизвестно с какого дня месяца заболеваемость будет стабильно и достоверно превышать Iпред.фон). срок окончания подъема заболеваемости определяется последним месяцем, когда заболеваемость была выше уровня предельно фоновой заболеваемости. Определение даты спада заболеваемости полностью противоречит кумулятивной природе показателей и приводит к абсурдным выводам. продолжительность подъёма - время (количество месяцев) от начала подъема заболеваемости до его окончания месяц максимальной заболеваемости продолжительность межэпидемического (межсезонного) периода III. Возможные причины обеспечивающие данное распределение заболеваемости Внутригодовые подъемы заболеваемости отражают изменение (повышение активности и(или) набора факторов риска, которые можно объединить в три группы. 1. факторы, определяющие различные формы «перемешивания» людей К ним относятся: а) горизонтальной перемешивание: формирование новых коллективов, например: групп детского сада, первых классов школы, воинских коллективов (пополнение), массовая «закладка» больных в стационары с летним перерывом и т.д. миграционные процессы, особенно активные в годы социальных катаклизмов б) вертикальное перемешивание естественная убыль населения и рождение новых Эта группа факторов связана с социальными условиями, в которых развивается заболеваемость, наиболее отчетливо проявляется при аэрозольных антропонозах. 2. факторы, снижающие иммунитет и резистентность 3. факторы, определяющие активизацию механизма передачи возбудителя, наиболее значимы при кишечных антропонозах 1. природные (климато-географические, природно-климатические факторы), могут действовать - прямо (переохлаждение, «простудные» заболевания, открытие купального сезона, появление свежих овощей и фруктов, сроки выплода мух и т.д.) - опосредовано, через социальные факторы (при плохих погодных условиях организованные дети большую часть времени проводят в закрытых помещениях, отсюда скученность, что «облегчает» и ускоряет передачу возбудителя и т.д.) В конечном итоге все эти факторы влияют на уровень популяционного иммунитета увеличивая прослойку восприимчивых, чем она больше и чем больше численность коллектива, тем выше показатели заболеваемости. Кафедра эпидемиологии ММА им. И.М.Сеченова 17 Описание проявлений заболеваемости в группах населения выделенных по индивидуальным признакам I. Многолетняя и внутригодовая динамика заболеваемости в группах населения Описание проявлений динамики годовых и месячных показателей заболеваемости каждой группы аналогичны описанию заболеваемости всего населения (см. соответствующий информационный материал). В многолетней и годовой динамике дополнительно описывается синхронность (асинхронность) колебаний показателей заболеваемости в разных группах и в совокупном населении и этапность вовлечения различных групп население в сезонный подъем. II.Распределение групп по степени риска заболеть Следует выявить различающиеся “альтернативные” по заболеваемости группы населения путем сопоставления проявлений заболеваемости в разных группах. При условии сопоставимого качества выявления, диагностики и учета больных в разных группах, распределить группы по степени риска заболеть изучаемой болезнью. Группа, имеющая самые высокие показатели, рассматривается как группа наибольшего риска, а группа с самыми низкими показателями считается группой наименьшего риска возникновения данной болезни на данной территории в данное время. Степень риска заболеть оценивается по табличным и графическим данным в динамике или по среднемноголетним величинам заболеваемости. Если отсутствуют результаты статистической оценки достоверности различий групповых показателей, выводы должны считаться ориентировочными. II.1. Оценка степени риска заболеть в динамике Проводиться по арифметическим и (или) полулогарифмическим графикам многолетней динамики заболеваемости. Примеры В данном примере для выявления степени риска заболеть дизентерией представленных групп населения в г.Н может быть использован любой из рисунков, т.к. различия в частоте заболеваний хорошо демонстрирует как арифметический так и полулогарифмический график. 0 I /0000 2510 2010 ДДУ 1-2 ДДУ 3-6 1510 Н/О до 6 школьники в зрослые 1010 Итого 510 Кафедра эпидемиологии ММА им. И.М.Сеченова 1999 1998 1997 1996 1995 1994 1993 1992 1991 1990 1989 10 Рис.А 18 0 I /0000 10000 ДДУ 1-2 ДДУ 3-6 1000 Н/О до 6 школьники взрослые 100 Итого 1999 1998 1997 1996 1995 1994 1993 1992 1991 1990 1989 10 Рис.Б. Рис.9. Заболеваемость дизентерией различных групп населения г. Н. в 1989 – 1999 г.г. (I0/0000,).Рис.9А – арифметический график, рис.9Б – полулогарифмический график Пример описания: Изучение данных позволяет сделать следующие ориентировочные выводы. В течение всех лет наблюдения самые низкие показатели заболеваемости отмечены в группе взрослых. Частота заболеваний школьников была в течение всего периода выше частоты заболеваний взрослых, но ниже трех других групп, поэтому, школьники по риску заболеть находятся на 4 месте. В отношении трех других групп детей не представляется возможным высказать общую (за весь период) оценку распределения групповых показателей заболеваемости, так как ”структура риска” изменялась в течение всего периода. Так, вплоть до 1994 года по риску заболеть дизентерией лидировали «организованные» дети 1-2 лет, на втором месте находились «организованные» дети 36 лет, а на третьем - «неорганизованные» дети до 6 лет. В последующие годы, произошло перераспределение занимаемых мест, причиной этого явления явилась разная скорость тенденции снижения заболеваемости в указанных группах населения (табл. 7, что также хорошо видно на рис. 24, по разному наклону мысленно проведенных линий тенденции). В итоге, к 1999 году группой наибольшего риска стали «неорганизованные» дети до 6 лет (т.е. группа, в которой тенденция заболеваемости практически отсутствовала), а «организованные» дети 1-2 и 3-6 лет стали занимать второе и третье место соответственно. II.2. Оценка степени риска заболеть по среднемноголетним и прогностическим групповым показателям заболеваемости Такой способ сравнительной оценки групповой заболеваемости следует использовать только в случаях, когда тенденции отсутствуют или, когда тенденции однонаправлены и совпадают. В других случаях, особенно при оценке групп риска на перспективу и планировании мероприятий использование среднемноголетних показателей заболеваемости чаще всего приводит к ошибочным описательным выводам и, как следствие этого, к ошибочным заключениям об активности (наборе) факторов риска и даже к принятию ошибочных управленческих решений. Чтобы избежать подобных ошибок следует дополнительно описывать тенденцию или использовать прогностические показатели, так как они определяются тенденциями заболеваемости каждой группы населения. Пример Кафедра эпидемиологии ММА им. И.М.Сеченова 19 I0/0000 А Б Б В условные годы 1 6 11 Iср.мн. Iпрог. Рис.10 Примеры формирования среднемноголетнего показателя заболеваемости А,Б,В возрастные группы населения. При равной величине среднемноголетнего показателя заболеваемости можно сделать вывод об одинаковом риске заболеть в трех представленных группах, а значит и одинаковой активности (наборе) факторов риска. Что в свою очередь может служить основанием считать, что и мероприятия в этих группах проводятся одинаково активно. Однако данный вывод некорректен, т.к. среднемноголетний показатель сформирован при разнонаправленных тенденциях и в худшем положении оказывается группа Б. Риск заболеть в этой группе будет расти, а значит и активизировать проведение мероприятий в первую очередь надо именно в этой группе. При сравнении прогностических групповых показателей, как правило, достаточно использовать средние значения прогностических групповых показателей. Расчет среднего прогностического группового показателя проводят точно так же, как и аналогичного показателя всего населения: продление линии тенденции до пересечения с меткой следующего года. Разница в риске заболеть по среднеарифметическим и прогностическим показателям при наличии тенденций наиболее наглядно представлена на рисунке 11. I 0 /0000 1800 Сред. арифмет. показ. заболеваемости 1600 Прогностический показ. заболеваемости 1400 1200 1000 800 600 400 200 0 ДДУ 1-2 года ДДУ 3-6 лет Н/О до 6 лет Школьники Взрослые Рис. 11. Среднеарифметические и прогностические показатели заболеваемости дизентерией различных контингентов населения г. Н (I0/0000) II.3. Оценка степени риска заболеть с помощью присвоения группам определенных рангов Кафедра эпидемиологии ММА им. И.М.Сеченова 20 Чтобы провести ранжирование необходимо: 1. Расставить ранги: 1, 2, 3, 4, 5 и т.д. по количеству групп, присваивая 1 наибольшему показателю 2. Если показатели достоверно отличаются друг от друга, то присвоенные ранги остаются. Если есть показатели, которые достоверно друг от друга не отличаются, то тогда: ранговые величины этих показателей складываются и делятся на число показателей составивших эту сумму, т.е. находится средняя величина полученный ранг присваивается всем показателям взятым в расчет последующим показателям будут присваиваться ранги соответствующие следующему за последним взятым в расчет. Например показатели получили ранги 1,2, 3, 4 и 5, достоверно между собой не отличаются показатели с рангами 1, 2. 3. Рассчитываем среднее значение ранга (1+2+3): 3= 2. Меняем ранги 1, 2, 3 на ранг 2 для всех трех показателей. Следующие показатели сохраняют свои ранги 4 и 5. рассчитанные ранги вносим в таблицу Достоверность различий показателей более наглядно отображается на графике Ошибка показателя (m) Ранг Показатель наглядности Показатель отношения 1 ДДУ 1-2 года ДДУ 3-6 лет Н/Одо 6 лет Школьники Взрослые Все население Интенсивные показатели и результаты их сравнения Групповой показатель (I0/0000) Контингенты Пр огнос тич е с кие в е л ич ины 2 502,4 242,7 859,7 100,0 50,2 100,6 3 200,0 65,1 129,1 22,1 7,0 8,6 4 2,5 2,5 1 4 5 #### 5 58,4 28,2 100,0 11,6 5,8 ### 6 1,7 3,5 1,0 8,6 17,1 ### Табл. 8. Прогностические (на 2000 г.) величины заболеваемости дизентерией различных контингентов населения г. Н и результаты их сравнения III. Распределение групп по удельному весу заболевших (структура заболевших) Анализ групповой структуры заболевших можно проводить по годовым, среднемноголетним и прогностическим показателям. Оценка структуры заболевших дает представление о вкладе каждой группы в общий показатель заболеваемости в динамике, в среднем за многолетний период или (и) на перспективу. Результаты могут быть представлены в таблицах или графически, в виде столбиковых (с нанесением доверительных границ - более точные выводы) или круговых диаграмм. Примеры Кафедра эпидемиологии ММА им. И.М.Сеченова 21 Групповой экстенсивный показатель (Р %) Ошибка показателя (m) Ранг по Р 1 ДДУ 1-2 года 2 6 3 4,4 4 1,8 5 5 ДДУ 3-6 лет 14 10,2 2,6 3,5 Н/Одо 6 лет 44 32,1 4,0 1,5 Школьники 21 15,3 3,1 3,5 Взрослые 52 38 4,1 1,5 Все население 137 100 ##### ### Контингенты Абсолютное число заболевших Прогностические величины Табл. 1.Прогностическая структура заболевших на 2000 год в абсолютных и относительных величинах ( по данным табл.1) P% 50 40 30 20 10 0 в зрослые Н/О до 6 школьн. ДДУ 3-6 ДДУ 1-2 Рис. 12. Экстенсивные прогностические показатели заболеваемости дизентерией различных групп населения г. Н. в 2000 году (Р%2m) Рисунок 12 и данные табл. 1 показывают, что первые два места по вкладу групп в общее число заболевших дизентерией в г. Н. в 2000 году будут занимать взрослые и “неорганизованные” дети до 6 лет, поэтому ранг каждой из этих групп равен 1,5. Третье и четвертое место разделят школьники и “организованные” дети 3-6 лет, следовательно, доля заболевших каждой из этих групп будет выражаться рангом 3.5. Последнее пятое место единолично принадлежит “организованным” детям 1 - 2 лет, поэтому их прогностический вклад в общее число больных дизентерией в г. Н. оценивается рангом 5. IY. Оценка эпидемиологической значимости групп населения Проводится по сумме ранговых значений риска заболеть и доли заболевших Группы населения ДДУ 1-2 года ДДУ 3-6 ет Н/о до 6 лет Школьники Взрослые Интенсивные показатели в группах 502,4±200,0 242,7±65,1 859,7±129,1 100,0±22,1 50,2±7,0 Ранговые значения 2,5 2,5 1 4 5 Экстенсивные показатели в группах 4,4 ±1,8 10,2±2,6 32,1±4,0 15,3±3,1 38,0±4,1 Ранговые значения Сумма рангов 5 3,5 1,5 3,5 1,5 7,5 6 2,5 7,5 6,5 Наибольшая эпидемиологическая значимость у группы неорганизованных детей до 6 лет, на втором месте дети , посещающие детские дошкольные учреждения, за ними следуют взрослые – 3 место и на 4 месте –группы школьников и детей, «организованных» в возрасте 1-2 года с одинаковой эпидемиологической значимостью. Кафедра эпидемиологии ММА им. И.М.Сеченова 22 Y. Описание заболеваемости в группах населения, выделенных по признаку «места». В научной и практической работе этот раздел анализа чаще называют «анализом заболеваемости по территории» Признаки «места» весьма многочисленны и ими могут быть любые признаки, позволяющие определить территориальную «привязанность» отдельного случая. Сравнение уровней заболеваемости населения разных территорий позволяет распределить их по степени риска заболеть какой-либо болезнью. Так же как и при группировке по признакам времени, наибольшей эпидемиологической информативностью обладают данные, полученные при территориальной группировке, учитывающей место действия факторов риска. Содержание и методы изучения заболеваемости групп, выделенных по признаку «места» не отличаются от содержания и методов, применявшихся при анализе заболеваемости групп, выделенных по индивидуальным признакам. При необходимости выявляются и сравниваются различные особенности распределений годовых и месячных показателей заболеваемости, как всего населения изучаемых территорий, так и разных групп на тех же территориях. Различия состоят в том, что применяются: дополнительная статистическая обработка (метод стандартизации) общих показателей заболеваемости населения сравниваемых территорий, связанная с тем, что нередко приходится сравнивать показатели заболеваемости населения территорий с различной демографической структурой. дополнительные способы графического отображения данных: построение картограмм и картодиаграмм. Кафедра эпидемиологии ММА им. И.М.Сеченова 23 СЕМИНАР № 3 Тема занятия: НАБЛЮДАТЕЛЬНЫЕ АНАЛИТИЧЕСКИЕ ЭПИДЕМИОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ (выявление и оценка факторов риска). Цель занятия: Изучить основные способы выявления и оценки причин (факторов риска) заболеваний различной этиологии. В результате изучения темы студенты должны знать: классификацию наблюдательных аналитических эпидемиологических исследований; принцип аналитических эпидемиологических исследований; классификацию причин и возможные следствия болезней; общенаучные методы познания, отличие наблюдения от эксперимента, область приложения гипотез исследователя; принцип проведения ретроспективных и «проспективных» эпидемиологических исследований; принцип сплошных и выборочных эпидемиологических исследований; этапы проведения когортного исследования, четыре схемы; достоинства и недостатки когортного исследования; этапы проведения исследований случай-контроль; достоинства и недостатки исследования случай-контроль; принцип проведения экологических исследований; принцип проведение ретроспективного эпидемиологического анализа; принцип проведения одномоментные исследование В результате изучения темы студенты должны уметь: оценивать правильность организации и проведения наблюдательных аналитических исследований; проводить логическую и статистическую обработку данных, полученных в результате когортных и случай-контроль исследованиях; Перечень вопросов для изучения темы: 1. Какие цели в эпидемиологии реализуются благодаря эпидемиологическим исследованиям? 2. Что является результатом проведенного аналитического исследования? 3. Сравнительная характеристика исследования случай-контроль и когортного исследования. 4. Организация когортных исследований: o определение популяции, из которой будет формироваться когорта и процесс ее формирования; o выявление факта воздействия каждого из изучаемых факторов риска на каждое лицо когорты и заполнение первичных учетных документов; o o определение периода наблюдения за когортой; формирование основных и контрольных групп; o динамическая оценка и учет состояния здоровья лиц, включенных в когорту; o статистический и логический анализ полученных данных. 5. Источники случайных и систематических ошибок в когортных исследованиях; 6. Эпидемиологический смысл абсолютного риска, атрибутивного риска, относительного риска, этиологической доли, добавочного популяционного риска. Кафедра эпидемиологии ММА им. И.М.Сеченова 24 7. Организация исследований случай-контроль: o определение генеральной совокупности (популяции); o формирование основной и контрольной групп; o выявление в основной и контрольной группах лиц, подвергавшихся и не подвергавшихся воздействию предполагаемых факторов риска; o статистический и логический анализ полученных данных и формулирование выводов; 8. Эпидемиологический смысл вероятности воздействия изучаемого фактора, шансов и показателя отношения шансов. 9. Источники случайных и систематических ошибок в исследовании случай-контроль. 10. Отличие экологического (корреляционного) исследования от исследований случай-контроль и когортного. 11. Место ретроспективного эпидемиологического анализа в работе врача-эпидемиолога санитарной службы. 12. Цель одномоментных эпидемиологических исследований. I Классификация эпидемиологических исследований по целям исследования и общенаучным методам: Эпидемиологические исследования Описательные Аналитические Наблюдательные Экспериментальные Исследования случай-контроль Когортное исследование Экологическое (корреляционное) исследование Ретроспективный эпидемиологический анализ Одномоментное исследование II Принцип аналитического исследования. Поиск ответов на вопросы: Почему кто-то болеет чаще, а кто-то реже? Почему где-то болеют чаще, а где-то реже? Почему когда-то болеют чаще, а когда-то реже? Вопрос «Почему?..» подразумевает поиск причины при известном следствии, или определение следствия от известной причины – в любом случае ставится задача установить причинно-следственную связь между причиной (П) и следствием (С). П ? С Цель данного процесса – предотвратить следствие, т.е. ликвидировать причину. Окончательный Кафедра эпидемиологии ММА им. И.М.Сеченова 25 «продукт» аналитического эпидемиологического исследования является определение причины или вероятности существования данной причины при известном следствии. 1) Что подразумевается под следствием? Что является предметом изучения эпидемиологии? Заболеваемость. Явления, отражающие исходы болезни (смертность, летальность, инвалидизация, ВрУТ, выздоровление). 2) Что подразумевается под причиной? НП1 НП1 С1 С1 НПn С1 ДП1 ДПn ДП1 С1 С1 С1 НП1 -определенная необходимая причина НПn -любая другая необходимая причина ДП1 -определенная дополнительная причина ДПn -любая другая необходимая причина С1 -определенное следствие Согласно основному общенаучному правилу, каждое полноценное аналитическое исследование – наблюдательное или экспериментальное должно иметь, как минимум, 2 сравниваемые группы – основную и контрольную. III Наблюдение, Метод гипотез и Эксперимент – общенаучные методы познания. Френсис Бэкон заложил основу индуктивизма – направление философии, объясняющего процесс познания наблюдением за природой, формулированием гипотез и последующей их проверкой. Эта проверка подтверждает истинность знания или отвергает гипотезу (В.В. Власов, Эпидемиология, М. «ГЭОТАР-МЕД»,2004). Наблюдение – это метод изучения явления без вмешательства в его естественное течение. Метод гипотез – это метод основан на мыслительных способностях человека, позволяющих высказывать суждения, умозаключения, формулировать гипотезы и теории. Кафедра эпидемиологии ММА им. И.М.Сеченова 26 Эксперимент – метод, который предусматривает вмешательство в изучаемое явление. Вмешательство должно быть точно фиксируемым, контролируемым и воссоздаваемым. Ни одно исследование не может начаться без идеи, мысленного предвосхищения результатов, без гипотезы, и тем более, без использования метода гипотез невозможно сформулировать выводы исследования. IV Ретроспективные и Проспективные эпидемиологические исследования. Ретроспективные ЭИ - это исследование, которое основано на изучении информации о возникших случаях болезни за какой-либо период времени в прошлом, например, существующая система регистрации и учета больных, архивные истории болезни и т.д. Проспективные ЭИ – это исследования, которые предусматривают изучение информации по мере появления новых случаев болезни, не существовавших к началу исследования. V Наблюдательные аналитические (обсервационные) эпидемиологические исследования. Наблюдательные аналитические исследования проводятся в естественных условиях возникновения и распространения болезни, т.е. без вмешательства в этот процесс или когда какое-то вмешательство, стало обычным “естественным” мероприятием. Примером может быть изучение заболеваемости населения инфекцией, в отношении которой десятки лет проводится иммунизация. Главное достоинство таких исследований простота их проведения, что связано с тем, что в них обычно используют официальные данные регистрации заболеваний и их исходов и официальную информацию о вероятных факторах риска. Например, данные о состоянии внешней среды, об экономическом состоянии различных групп населения индивидуальных особенностях. В наблюдательных исследованиях наиболее ярко проявляется общее правило – любые аналитические исследования начинаются с описательного этапа. Выявление значимых различий в проявлениях заболеваемости различных групп населения, является основой для выработки рабочих гипотез о факторах риска возникновения и распространения болезни. И только после формирования «созревания» рабочей гипотезы приступают к ее проверке в аналитических исследованиях. По особенностям организации выделяют два основных типа наблюдательных аналитических исследований: исследование случай контроль («контрольные случаи»), когортное исследование, Дополнительными вариантами аналитических исследований являются: экологические (корреляционные) исследования ретроспективный эпидемиологический анализ (этот термин и, определяемые им действия – особенность отечественной эпидемиологии). одномоментные исследования (могут проводиться и как описательные исследования, или как аналитические). В дополнительных вариантах выделение групп сравнения, чаще всего носит формальный характер, поэтому их нельзя в полной мере считать полноценными аналитическими исследованиями, хотя результаты таких исследований позволяют сделать предварительные выводы о причинах возникновения и распространения изучаемой болезни. 1. Когортные эпидемиологические исследования (КЭИ). Цель КЭИ: выявление причин возникновения и распространения болезней. Это наиболее прямой путь к выявлению этиологии болезней и количественной оценке риска воздействия причинных факторов. Когорта – а) войсковое подразделение, десятая часть легиона в Древнем Риме численным составом 360-600 человек, включало 3 манипулы. б) в переносном смысле – сплоченная группа людей, соратников. в) в медицине – выборка людей, объединенных общими признаками состояния здоровья, в которой ожидается возникновение случаев болезни. Кафедра эпидемиологии ММА им. И.М.Сеченова 27 В любом когортном исследовании поиск причин различных следствий происходит в направлении: от предполагаемой причины к следствию. Когортное ЭИ П С Когортное исследование может быть основано на трех видах информации: Ретроспективные (архивные) данные – ретроспективные (исторические) КЭИ; «Проспективные» данные – проспективные (параллельные) КЭИ; Смешанные данные – комбинированные КЭИ. Четыре схемы КЭИ: Условные обозначения: «Группа F+» - экспонированная группа; «Группа F-» - неэкспонированная группа. F – фактор риска. А) Схема организации когортного исследования по выявлению одного фактора риска одной изучаемой болезни: группа F+ а заболевание + b заболевание - F популяция когорта случаи заболевания, выявленные до конца периода наблюдения с заболевание + группа F- d статистическая и логическая обработка результатов случаи заболевания, выявленные до конца периода наблюдения заболевание - конец расчётного периода наблюдения Пример: В 1949 году в Нью-Йорке началось «проспективное» когортное исследование, целью которого было выявление причинно-следственной связи между краснухой беременных и последующими врожденными заболеваниями, уродствами и гибелью плода. Б) Данная схема исследования предназначена для выявления одного фактора риска у несколько нозологических единиц. Отличие от варианта А заключается в том, что разделение группы F+ и F- после окончания расчетного периода наблюдения происходит по каждой нозологии отдельно. Пример: Выявление причинно-следственной связи между курением и заболеваниями, связанными с данным фактором риска (стоматиты, хронические бронхиты, коронарные тромбозы, рак легких и т.д.). Подобное исследование проводилось на когорте английских врачей. Кафедра эпидемиологии ММА им. И.М.Сеченова 28 а заболевание + группа F+ 1 b заболевание - популяция когорта с заболевание + F1 F2 F3 группа F1 конец расчётного периода наблюдения d заболевание - статистическая и логическая обработка результатов В) Схема организации когортного исследования по выявлению нескольких факторов риска одной изучаемой болезни: данные этапы КЭИ проводятс я по каждому фактору риска, т.е. для F1 ,F2 и F3 . Пример: В Москве и Ленинграде в 1975-1982 гг. было проведено масштабное когортное исследование. Изучение когорты численностью 13,5 тыс. мужчин и женщин позволило подтвердить этиологическую роль в возникновении ИБС факторов, которые называют «большой тройкой» артериальная гипертензия, курение и гиперхолестеринемия. Г) Схема организации когортного исследования по выявлению нескольких факторов риска для нескольких нозологий. Пример: Фраменгемское исследование, начатое в 1949 году для выявления факторов риска сердечно-сосудистых заболеваний. Этапы проведения когортного исследования (на примере варианта В): 1) определение популяции, из которой будет формироваться когорта и процесс ее формирования, внимание на возможные смещения; 2) выявление факта воздействия каждого из изучаемых факторов риска на каждое лицо когорты и заполнение первичных учетных документов; 3) определение периода наблюдения за когортой; 4) динамическая оценка и учет состояния здоровья лиц, включенных в когорту; 5) формирование основных и контрольных групп (4); 6) статистический и логический анализ полученных данных. ИСТОЧНИКИ СИСТЕМАТИЧЕСКИХ ОШИБОК В КОГОРТНОМ ИССЛЕДОВАНИИ 1. При формировании когорты возможны следующие смещения подбора: А) Центростремительное смещение (концентрация хронических и серьезных больных и максимальные возможности диагностики и лечения в специализированных центрах); Б) Смещение популярности (присутствие нетипичных больных); В) Смещение фильтрации («движение» пациентов от звена первичной медицинской помощи до специализированных центров приводит к их частичному отсеиванию по разным причинам: особенности течения заболевания, социальным причинам, географическим, финансовым, особенностям раннее примененного лечения и т.д.); Г) Смещение доступности диагностики – вариант смещения фильтрации. 2. Во время отслеживания результатов в когортном исследовании источником смещения может быть потеря пациентов: - потеря более 10% пациентов может привести к заметным неопределенностям в оценках; - потеря более 20% сделает оценки малопригодными для использования. 3. Во время оценки исхода возможны смещения, связанные: - с отсутствием четких критериев оценки исходов; - со слабыми диагностическими возможностями; - со смещением подозрения (более внимательное отношение врача во время обследования пациентов, подвергающихся воздействию фактора риска); Кафедра эпидемиологии ММА им. И.М.Сеченова 29 - со смещением ожидания (врач-лаборант, патологоанатом, зная клиническую картину пациента, его анамнез, могут находиться под сильным влиянием знаний о прошлых событиях и прижизненном диагнозе). Статистическая обработка полученных в КЭИ данных. С л уч аи бол езн и есть н ет Группы В сего О сн овн ая гр уп п а (э к сп о н и р о в а н н ы е) a b a+b К он тр ол ьн ая группа (н еэк сп о н и р о в а н н ы е ) c d c+d В сего a+c b+d a+b+c+d= N Такая таблица заполняется только абсолютными величинами, что позволяет рассчитать следующие показатели: 1. ИНЦИДЕНТНОСТЬ В ГРУППАХ НАБЛЮДЕНИЯ (I) (риск при наличии/отсутствия фактора риска) (incident, risk factor group- RF) а) Инцидентность в основной группе (RF+ или Ie): RF a 10 n ab б) Инцидентность в контрольной группы (RF-или Io): RF c 10 n cd (в этих и других формулах: 10n – размерность показателя) 2. ОТНОСИТЕЛЬНЫЙ РИСК (OP) (relative risk - RR) RR или RR a /(a b ) c /(c d ) , RF RF Значение относительного риска (RR): используется для ориентировочной оценки причинно-следственной связи между фактором риска и возникновением болезни. При этом: значение RR равное 1 рассматривается как отсутствие связи между фактором и болезнью; если величина RR больше 1 считается, что чем больше RR, тем выше риск заболеть тех лиц, которые подвергались воздействию фактора, т.е. изучаемый фактор является фактором риска; если величина RR меньше 1, значит, риск заболеть экспонированных лиц ниже, чем у тех на кого изучаемый фактор не воздействовал и, следовательно, данный фактор, вероятно, оказывает благоприятное воздействие на здоровье – протективный фактор. Кафедра эпидемиологии ММА им. И.М.Сеченова 30 3. АБСОЛЮТНЫЙ РИСК (AR) (разница рисков, абсолютная разность рисков, добавочный риск, атрибутивный риск) (absolute risk, risk difference) AR ( a c ), ab cd или AR= RF+ - RF- 70 Инцидентность 60 50 40 Атрибутивный риск 30 20 10 0 группа F+ группа F- 4. ЭТИОЛОГИЧЕСКАЯ ДОЛЯ (доля добавочного риска) (attributable fraction - AF, etiological fraction - EF) 1) EF абсолютный риск (AR) 100 инцидентность в основной группе F 2) EF RR - 1 100 RR 5. ДОБАВОЧНЫЙ ПОПУЛЯЦИОННЫЙ РИСК (attributable population risk – ARP) PAR AR 100% , где Ip AR – абсолютный риск Ip – инцидентность изучаемого населения В случае проведения различных профилактических программ в отношении населения, мы можем предположить с учетом добавочного популяционного риска, на сколько устранение изучаемого фактора приведет к снижению заболеваемости конкретной болезнью среди населения. 6. ОТНОШЕНИЕ ШАНСОВ (ОШ) (odds ratio – OR) Алгоритм расчета №1: Расчет вероятности развития болезни при наличии фактора риска. a/(a+b) Расчет вероятности развития болезни при отсутствии фактора риска. c/(c+d) Кафедра эпидемиологии ММА им. И.М.Сеченова 31 Расчет шансов на развитие болезни при наличии фактора риска. Шанс F+ =вероятность при F+/1-вероятность при F+ Расчет шансов на развитие болезни при отсутствии фактора риска. Шанс F- = вероятность при F-/1-вероятность при F- Расчет отношения шансов (ОШ). ОШ = Шанс F+ / Шанс F- Алгоритм расчета №2: o Расчет шансов на развитие болезни при наличии фактора риска. Шанс F+ = a/b o Расчет шансов на развитие болезни при отсутствии фактора риска. Шанс F- = c/d o Расчет отношения шансов (ОШ). ОШ = Шанс F+ / Шанс F- Алгоритм расчета №3: Расчет отношения шансов (ОШ). ОШ (a d ) (b c) Оценивается значение отношение шансов, так же как и относительный риск. Величина OR < 1 указывает на отсутствие причинно-следственной связи изучаемого фактора и болезни. Величина OR > 1 указывает на возможную этиологическую роль изучаемого фактора, т.е. на повышенный риск возникновения болезни из-за воздействия данного фактора. 7. 2 (хи-квадрат), (критерий Пирсона, коэффициент согласия, критерий соответствия), необходимый для статистической оценки гипотезы причинно-следственной связи. Критерий 2, так же как и другие статистические методы оценки различия переменных позволяет принять, или отвергнуть нулевую гипотезу, которая в данном случае утверждает, что выявленные различия в частоте заболеваний в сравниваемых группах определяются исключительно случайной ошибкой. Величина критерия 2 позволяет: оценить достоверность различий заболеваемости в опытной и контрольной группе; высказать гипотезу о наличие связи между заболеваемостью и изучаемым фактором. (ad - bc)2 N (a b )(c d )(a c)(b d ) , 2 Кафедра эпидемиологии ММА им. И.М.Сеченова 32 Эта формула применяется, если N больше 40. Однако при этом если одно из значений (a, b, c или d ) в таблице «два на два» будет меньше 5, но больше 0, следует использовать другую формулу (с поправкой Йетса): (ad - bc) - 0,5N 2 N (a b)(c d)(a c)( b d) 2 В других случаях вместо 2-рекомендуется использовать точный критерий Фишера. Уровень ошибки и, соответственно, уровень достоверности различий заболеваемости в сравниваемых группах, а, следовательно, и уровень достоверности суждения о наличии связи между фактором и заболеваемостью зависит от значения 2и определяется по таблице 2-распределения (она есть в любом статистическом справочнике). Для таблицы «два на два»: 2= 3,841 соответствует уровню ошибки – р=0,05 2= 6,635 соответствует уровню ошибки - р=0,01 Таким образом, значение 2, позволяющее отвергнуть нулевую гипотезу, должно быть (для таблицы «два на два») не менее 3,841. Достоинства и недостатки когортных исследований. Достоинства. Главное достоинство когортных исследований – возможность (и нередко единственная) получения достоверной информации об этиологии болезней, особенно в тех случаях, когда эксперимент невозможен. Единственный способ оценки показателей абсолютного, атрибутивного, относительного риска возникновения заболевания и оценки этиологической доли случаев, связанных с предполагаемым фактором риска. Позволяют выявлять редко встречающиеся причины. Позволяют одновременно выявлять несколько факторов риска одного или нескольких заболеваний. Достаточно высокая достоверность выводов связанная с тем, что в когортных исследованиях гораздо легче избежать ошибок при формировании основных и контрольных групп, так как они создаются после выявления изучаемых эффектов (заболеваний, смертей и др.). Главные недостатки. Необходимость формирования когорты большой численности, особенно при относительно редко встречающихся болезнях. Чем реже встречается заболевание, тем больше возрастает физическая невозможность создать необходимую когорту. Большая продолжительность исследования. Высокая стоимость. 4. Исследования случай-контроль. Цель исследования случай-контроль: выявление причин возникновения и распространения болезней. В исследованиях случай-контроль вероятность существования причинно-следственной связи обосновывается не разной частотой заболеваемости, а различной распространенностью Кафедра эпидемиологии ММА им. И.М.Сеченова 33 (встречаемостью) предполагаемого фактора риска в основной и контрольной группах. В любом исследовании случай-контроль поиск причин различных следствий происходит в направлении: от следствия к предполагаемой причине. С П Исследование случай-контроль Исследование случай-контроль может быть только ретроспективным. F+ популяция основная группа выявление в а намнезе факторо в риска подбор метчированных пар F? контрольная группа FF+ F- а b с d статистическая и логическая обработка результатов Схема проведения выборочного исследования случай-контроль: окончание работ по изучению архивных данных Этап деления основной и контрольной группы на подгруппы (a F+, b F-, c F+ и d F-) может повторяться столько раз, сколько факторов риска было выявлено в результате изучения архивных данных. Этапы проведения исследования случай контроль: определение генеральной совокупности (популяции); формирование основной и контрольной групп (в идеале: с использованием способа «подбора-пар»); выявление в основной и контрольной группах лиц, подвергавшихся и не подвергавшихся воздействию предполагаемых факторов риска; статистический и логический анализ полученных данных и формулирование выводов. ИСТОЧНИКИ СИСТЕМАТИЧЕСКИХ ОШИБОК В ИССЛЕДОВАНИИ СЛУЧАЙ-КОНТРОЛЬ 1. Искаженный сбор данных (специалист, зная, с кем он беседует или на кого делает выписки из истории болезни – на пациента основной или контрольной группы, за счет более настойчивого и детального опроса или предвзятой оценки документов может исказить результаты своей работы в угоду изучаемой гипотезе); 2. Смещение памяти (систематическая ошибка, связанная с ошибками воспоминания у пациентов); 3. Смещения выявления (отличие в диагностике членов основной и контрольной группы: в большинстве ИСК лица, включенные в группу сравнения, не проходят такого диагностического обследования, как больные). Статистическая обработка полученных данных в исследованиях случай-контроль. Кафедра эпидемиологии ММА им. И.М.Сеченова 34 Фактор риска в анамнезе есть нет Группы Всего Больные изучаемой бользнью (основная группа - случаи) a b a+b Здоровые или больные, но другой болезнью (контрольная группа) c d c+d Всего a+c b+d a+b+c+ d= N Поскольку в исследованиях случай–контроль невозможно рассчитать показатели абсолютного риска в сравниваемых группах, выраженность причинной ассоциации в исследованиях случай – контроль определяется различиями частоты воздействия (частоты встречаемости) факторов риска в группах сравнения, а не различиями в частоте заболеваний в сравниваемых группах. Частоту воздействия (встречаемости) факторов риска в этих группах рассчитывают по той же формуле, что и абсолютный риск в когортных исследованиях, т.е. a/(a+b) для основной группы (случаи), и c/(c+d) для контрольной группы. Рассчитанная частота воздействия отражает значение вероятности воздействия изучаемого фактора в сравниваемых группах. Значения вероятностей воздействия фактора риска в группах сравнения позволяет рассчитать шансы (odds) воздействия изучаемого фактора в основной и контрольной группах. Шансы – в общем случае, это отношение вероятности того, что событие произойдет, к вероятности того, что событие не произойдет. При расчетах шансов вероятность лучше всего выражать в долях единицы: шансы вероятность 1 вероятность Шансы и вероятности содержат одну и ту же информацию, но по-разному, выражают ее. Например, если вероятность воздействия изучаемого фактора риска в основной группе 0,67 (67,0%) то шансы воздействия равны 0,67/(1–0,67)= 2. Часто шансы чего-либо, например наличия воздействия фактора риска в основной группе, выражают как соотношение шансов к 1, в данном примере, как 2:1. Зная величину шансов при необходимости легко рассчитать вероятность: вероятность шансы 1 шансы Так, в предыдущем примере: вероятность = 2/(1+2)=0,67 или 67,0% В некоторых случаях шансы удобнее использовать, чем вероятности. В исследованиях случай-контроль различия в частоте встречаемости факторов риска в сравниваемых группах, определяет отношение шансов двух групп, а рассчитываемый показатель называется отношением шансов (коэффициентом асимметрии, odds ratio, OR). По данным таблицы «два на два» можно не вычислять шансы каждой группы, а отношение шансов рассчитать как: ОШ ad bc Оценивается значение отношение шансов, так же как и относительный риск. Величина OR 1 указывает на отсутствие причинно-следственной связи изучаемого фактора и болезни. Кафедра эпидемиологии ММА им. И.М.Сеченова 35 Величина OR >1 указывает на возможную этиологическую роль изучаемого фактора, т.е. на повышенный риск возникновения болезни из-за воздействия данного фактора. Оценка достоверности результатов исследования помощью тех же критериев, что и в когортном исследовании. случай-контроль проводится с Достоинства и недостатки исследований случай–контроль. Достоинства. Возможность их проведения не зависит от распространенности изучаемой болезни. Сравнительно небольшие затраты времени, сил и средств необходимы для того чтобы создать основную группу больных, даже редко встречающимися заболеваниями, подобрать к ним контроли, опросить и сделать хотя бы ориентировочные выводы. При изучении таких болезней в когортном исследовании, пришлось бы подобрать когорту из сотен тысяч людей, наблюдать их длительное время, что повлекло бы значительные временные, материальные и моральные затраты. Относительно короткая длительность. Для получения выводов не нужно, как в когортном исследовании, проводить наблюдение в течение периода превышающего латентный период развития болезни. Возможность одновременно выявлять несколько факторов риска одного заболевания. Сравнительно небольшие экономические затраты. Недостатки. Низкая достоверность выводов из-за высокой подверженности систематическим ошибкам. Невозможность выявления редко встречающихся причин болезни. В таких случаях, скудные данные не позволяют оценить достоверность различий частоты встречаемости фактора риска в группах сравнения и, следовательно, сделать выводы о наличии/отсутствии причинно следственной связи. невозможность количественно оценить риск возникновения болезни (смерти) от предполагаемой причины. В исследовании количественно определяется лишь показатель «отношение шансов». 5. Экологические (корреляционные) исследования 6. Ретроспективный эпидемиологический анализ. 7. Одномоментные исследования. Скрининг. Кафедра эпидемиологии ММА им. И.М.Сеченова 36 VI Выборочные эпидемиологические исследования. Когда заключения относительно популяции делаются на основании наблюдений в выборке, возникают два фундаментальных вопроса: Справедливы ли полученные выводы для всех элементов выборки? – Внутренняя достоверность результатов выборочных ЭИ. Отражает ли выборка интересующую нас популяцию? – Внешняя достоверность результатов выборочных ЭИ. VII Задания. Задача 1. Табл. Число новых случаев артериальной гипертонии (АГ) в Москве среди женщин 20-69 лет, в зависимости от наличия или отсутствия гиперхолестеринемии (ГХС). Источник: Эпидемиология неинфекционных заболеваний под редакцией А.М. Вихерта, А.В. Чаклина. Москва «Медицина», 1990 Новые случаи АГ есть нет Группы Основная группа - ГХС есть Контрольная группа ГХС нет Всего Всего 64 79 143 219 815 1034 283 894 1177 Примечание: различие в частоте новых случаев АГ в опытной и контрольной группе достоверно (p 0,05) Задание. 1. Укажите возможные недостатки (упущения) в названии таблицы. Назовите тип представленной таблицы. Укажите, какими терминами следует обозначить дизайн данного исследования. 2. Определите цель этого исследования. 3. Укажите, какие показатели (величины, коэффициенты) позволяют рассчитать данные этой таблицы и расшифруйте их эпидемиологический смысл. 4. Объясните, что означают термины внутренняя и внешняя достоверность данных эпидемиологического исследования и можно ли результаты этого исследования экстраполировать на всех женщин 20 - 69 лет. Задача 2. Табл. Встречаемость частых ангин в анамнезе больных ревматоидным артритом и в анамнезе здоровых лиц. Источник. Эпидемиология ревматических болезней. Л.И. Беневоленская, М.М. Бржезовский. Москва «Медицина»,1988. (с небольшими изменениями). Группы Больные ревматоидным артритом Здоровые лица Всего Частые ангины (2 и более раз в год) Всего есть нет 54 30 84 1314 1368 5904 5934 7218 7302 Примечание: различие в частоте встречаемости частых ангин у больных ревматоидным артритом и здоровых лиц достоверно (p 0,05) Задание. 1. Укажите возможные недостатки (упущения) в названии таблицы. Назовите тип представленной таблицы. Кафедра эпидемиологии ММА им. И.М.Сеченова 37 Укажите, какими терминами следует обозначить дизайн данного исследования, и объясните основные его этапы. 2. Определите цель этого исследования. 3. Укажите, какие показатели (величины, коэффициенты) позволяют рассчитать данные этой таблицы и расшифруйте их эпидемиологический смысл. 4. Объясните, что означают термины внутренняя и внешняя достоверность данных эпидемиологического исследования и можно ли результаты этого исследования экстраполировать на всех больных ревматоидным артритом. Задача 3. Из 600 пациентов, которым было сделано переливание крови, в течение 2,5 лет 60 лиц заболели гепатитом В, а из 700 пациентов без переливания крови гепатитом в те же сроки заболели только 15. ( Источник: А.Альбом, С Норелл. «Введение в современную эпидемиологию» 1996 г., с незначительными изменениями) Задание. 1. Оформите представленные данные в виде таблицы « два на два» 2.Укажите какими терминами следует обозначить дизайн данного исследования, и объясните, какими должны быть основные этапы такого исследования . 2. Определите цель этого исследования. 3. Укажите, какой или какие показатели (величины, коэффициенты) рассчитываются при такой организации исследования, рассчитайте некоторые из них и расшифруйте их эпидемиологический смысл. 4. Объясните, что означают термины внутренняя и внешняя достоверность данных эпидемиологического исследования и можно ли результаты этого исследования считать абсолютным доказательством того, что переливание крови является фактором риска Задача 4. Ситуация: Во время беременности (особенно первой) многие женщины страдают от приступов гипертензии. Обобщенная статистическая информация, собранная в Англии в период с 1938 по 1960 года позволила сделать вывод о том, что среди рожавших женщин (в отличие от нерожавших) наблюдалась высокая смертность от сердечно-сосудистых заболеваний, в частности гипертонической болезни и ишемической болезни сердца. Задание: 1. Представьте дизайн эпидемиологического исследования для выявления причинноследственных связей между беременностью и сердечно-сосудистыми заболеваниями у рожавших женщин. 2. Прокомментируйте каждый этап данного исследования. 3. Какие показатели (величины, коэффициенты) можно рассчитать по результатам данного исследования? Задача 5. Табл. Число смертельных исходов в группе некурящих женщин в возрасте 40-70 лет, проживающих в семи районах Шанхая в зависимости от курения табака их мужьями. Источник: BMJ, doi:10.1136/ bmj.38834.522894.2F, 12 July 2006. Группы мужья курят Количество смертей среди женщин да нет 662 39 133 Всего 39 795 мужья не курят 490 24 895 25 385 Всего 1 152 64 028 65 180 Примечание: различие в частоте новых случаев АГ в опытной и контрольной группе достоверно (p=0,009) Задание. 1. Представьте дизайн данного исследования. 2. Определите цель этого исследования. 3. Укажите, какие показатели (величины, коэффициенты) позволяют рассчитать данные этой таблицы и расшифруйте их эпидемиологический смысл. 4. Объясните, что означают термины внутренняя и внешняя достоверность данных эпидемиологического исследования и можно ли результаты этого исследования экстраполировать на всех женщин 40-70 лет. Кафедра эпидемиологии ММА им. И.М.Сеченова 38 Задача 6. Вопрос в исследовании случай-контроль: увеличивает ли прием нестероидных противовоспалительных препаратов риск развития заболевания почек? Задание: 1. Представьте дизайн эпидемиологического исследования. 2. Прокомментируйте каждый этап эпидемиологического исследования. 3. Какие показатели (величины, коэффициенты) можно рассчитать по результатам данного исследования? Задача 7. Ситуация: Располагая доступом к информационной системе неотложной медицинской помощи города Сиэтла, штата Вашингтон, задаемся вопросом: предупреждает ли регулярная интенсивная физическая активность риск остановки сердца у лиц без явного заболевания сердечно-сосудистой системы? Больные были отобраны 163 пациента из 1250 жителей Сиэтла, которые в течение определенного периода времени перенесли вне стационара остановку сердца. Контрольная группа (163 участника) была сформирована по случайно выбранным телефонным номерам того же города (большинство жителей имели домашние телефоны). Обе группы, основная и контрольная должны были удовлетворять единым критериям включения: возраст 25-75 лет, отсутствие клинически распознаваемого диагноза сердца, отсутствие предшествующего заболевания, ограничивающего физическую активность, наличие супруги/супруга, которые могли сообщить информацию о привычной физической нагрузке. Участники контрольной группы соответствовали участникам основной группы по возрасту, полу, семейному положению и месту жительства. Супруги участников обеих групп опрашивались о способе проведения досуга. В результате опроса супругов и участников исследования выяснилось, что регулярной физической нагрузкой занимались 59 человек из основной группы и 95 человек из контрольной группы. Задание: 1. Представьте дизайн эпидемиологического исследования. 2. Прокомментируйте каждый этап эпидемиологического исследования. 3. Заполните таблицу «два-на-два» и рассчитайте показатели (величины, коэффициенты) по результатам данного исследования? Задача 8. Табл. Встречаемость приема эстрогена в анамнезе больных женщин раком эндометрия и здоровых женщин. Прием эстрогенов да нет Всего 985 1129 Группы Рак эндометрия Здоровые женщины Всего 24 895 64 028 2258 Задание. 1. Заполните представленную таблицу. 2. Укажите возможные недостатки (упущения) в названии таблицы. Назовите тип представленной таблицы. Укажите, какими терминами следует обозначить дизайн данного исследования, и объясните основные его этапы. 3. Определите цель этого исследования. 4. Укажите, какие показатели (величины, коэффициенты) позволяют рассчитать данные этой таблицы и расшифруйте их эпидемиологический смысл. Кафедра эпидемиологии ММА им. И.М.Сеченова 39 СЕМИНАР № 4 Тема занятия: ЭКСПЕРИМЕНТАЛЬНЫЕ АНАЛИТИЧЕСКИЕ ЭПИДЕМИОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ (оценка эффективности и безопасности лекарственных и профилактических препаратов). Цель занятия: Освоение основных подходов к оценке эффективности и безопасности лекарственных и профилактических препаратов. В результате изучения темы студенты должны знать: определение экспериментальных аналитических эпидемиологических исследований, их предназначение; определение рандомизированных клинических испытаний (РКИ) цели, фазы, организация РКИ; случайные и систематические ошибки РКИ; основные показатели оценки эффективности и безопасности лекарственных и профилактических препаратов; основные стандарты проведения РКИ. В результате изучения темы студенты должны уметь: оценивать правильность организации РКИ; проводить оценку статистической и клинической значимости результатов РКИ; Перечень вопросов для изучения темы: 1. РКИ (рандомизированные клинические испытания). РКИ - «золотой» стандарт экспериментальных исследований по оценке потенциальной эффективности лечебных и профилактических препаратов. 2. Цели РКИ. Оценка безопасности и эффективности (действенность и собственно эффективность). Внутренняя и внешняя достоверность РКИ. 3. Фазы РКИ. 4. Случайные и систематические ошибки. 5. Организация РКИ. Планирование числа участников. Критерии включения/исключения. Согласие участников. Комплайенс. Формирование выборки. Кафедра эпидемиологии ММА им. И.М.Сеченова 40 Рандомизация: цели, методы, ошибки. Псевдорандомизация. Распределение и применение вмешательств. Испытания в параллельных группах (независимые и связанные выборки), перекрестное испытание, факторная структура эксперимента, исторический и внешний контроль. Дозиметрия применяемого вмешательства (характеристики, методы измерения и стандартизации) Плацебо: цели применения плацебо. Ослепление (маскирование) исследования: слепое, двойное тройное и четверное слепые испытания. Исходы исследования: методы оценки. Клинически важные исходы, промежуточные, косвенные, суррогатные исходы. Качество жизни. Прекращение испытания: планирование длительности. 6. Статистическая и клиническая значимость результатов. Показатели величины эффекта. Оценка клинической значимости. 7. Изучение побочных эффектов вмешательства. 8. Стандарт отрасли ОСТ 42-511-99 "Правила проведения качественных клинических испытаний в Российской Федерации". Область применения. 9. Принципы качественных клинических испытаний (GCP – Good Clinical Practice). 10. Основные документы, необходимые для проведения РКИ. 11. Этические аспекты проведения РКИ. ЦЕЛЬ И КЛАССИФИКАЦИЯ КЛИНИЧЕСКИХ ИСПЫТАНИЙ В оценке эффективности вмешательства в широком смысле выделяют оценку действенности и эффективности. Под действенностью понимают способность вмешательства предотвращать нежелательные исходы в условиях контролируемого эксперимента. Целью испытания вмешательства на действенность является установить, действительно ли вмешательство приводит к тем последствиям, которые ожидаются. Для этого допустимо создавать специальные условия, которые позволят в максимальной степени проявиться ожидаемому эффекту и в которых влияние обычных сложностей клинической практики будет минимальным. Например, подбирают пациентов только с выраженной патологией, исключают широкий круг сопутствующих болезней, проверяют потенциальных участников испытания на способность к выполнению условий испытания и исключают неспособных, в т.ч. лиц с поведенческими проблемами. Под собственно эффективностью понимают способность вмешательства достигать тех же целей в условиях обычной практики. Соответственно эффективность вмешательства устанавливается в испытаниях, в которых ограничения для участников минимальны, с тем, чтобы результаты испытания можно было уверенно обобщить для условий широкой практики. Для принятия вмешательства в широкую медицинскую практику важна его комплексная оценка, включающая в себя, помимо эффективности, экономические достоинства и недостатки метода, широкий круг эффектов, возникающих помимо основного эффекта. Кафедра эпидемиологии ММА им. И.М.Сеченова 41 Фазы клинических испытаний. Применительно к лекарственным средствам (ЛС) и вакцинам клинические испытания классифицируют на 4 фазы. Фазы клинических испытаний (КИ). Особенности проведения КИ вакцин и других иммунобиологических препаратов (сыворотки, интерфероны, иммуноглобулины), а также лекарственных средств. Фазы КИ вакцин. Фаза I. Лабораторные испытания вакцин-кандидатов - исследование физических свойств, химического состава, доклиническое изучение токсичности и безопасности на лабораторных животных. Фаза II. Ограниченные исследования на иммуногенность и безопасность. Исследование осуществляется только после положительного заключения национального органа контроля медико-биологических препаратов на сотнях добровольцев. Определение правильной концентрации антигена, количества компонентов вакцины, техники изготовления, эффекта последующих доз и основных побочных реакций. Окончательный выбор типа вакцины для проведения третьей фазы. Фаза III. Широкомасштабные испытания вакцин-кандидатов на здоровых пациентах (тысячи добровольцев). Определение эффективности вакцины и побочных реакций. Определение длительности наблюдения (обычно 1-2 года, но не менее 6 месяцев). Измерение эффективности, а также частоты и типов побочных реакций Фаза IV. Постлицензионный контроль качества вакцин. Продолжение исследования частоты и силы побочных реакций, реальной эффективности. Фазы КИ лекарственных средств (ЛС) и иммунобиологических препаратов. Фаза I. Выявление токсичности ЛС и его ожидаемого фармакологического действия на небольшом числе добровольцев, как правило, здоровых. Фаза II. Выявление ожидаемого терапевтического эффекта, уточнение данных о безопасности и уточнение дозировки ЛС на небольшом числе испытуемых с состоянием, которое должно быть объектом применения ЛС. Фаза III. Выяснение размера терапевтического эффекта, уточнение данных о безопасности на большом числе испытуемых. Получение разрешения к применению ЛС. Фаза IV. Пострегистрационные, постмаркетинговые исследования, уточнение размера эффекта от вмешательства в условиях реальной практики, уточнение данных о безопасности. ОРГАНИЗАЦИЯ РКИ. Планирование числа участников Число включаемых в эксперимент пациентов (размер выборки) должно быть обосновано. Обоснование числа лиц, подвергаемых экспериментальному лечению, исходит из: 1) предполагаемой величины эффекта (например, снижения частоты обострений или увеличения выживания при применении нового лечения); 2) структуры исследования; 3) установленного заранее порога статистической значимости обнаружения эффекта. Исследование должно планироваться так, чтобы число пациентов было достаточным для обнаружения предполагаемого эффекта. Методики выбора числа обследуемых (пациентов) разработаны для многих видов структуры исследования, а не только для исследований с экспериментальным вмешательством. Вычисления относительно сложны и их следует выполнять с помощью статистических программ. Кафедра эпидемиологии ММА им. И.М.Сеченова 42 Критерии включения и исключения Ясные критерии включения пациентов (обследуемых) необходимы для описания популяции (генеральной совокупности), которой соответствуют включенные в исследование субъекты. Ясные критерии исключения необходимо сформировать, чтобы создать изучаемую группу пациентов достаточно однородной. Например, из числа участников терапевтического эксперимента исключают лиц с тяжелыми сопутствующими болезнями, с состояниями, мешающими выполнить условия эксперимента (например, с деменцией), тех, кому вмешательство может быть вредно. Исключением нетипичных случаев обеспечивается однородность группы пациентов, т.е. меньшая вариабельность переменных в исходном состоянии и в оценке величины эффекта вмешательства. Таким образом увеличивается статистическая чувствительность эксперимента. Например, в результате организации образовательных программ для врачей будет легче выявить изменения, если из числа экспериментальных поликлиник исключить поликлиники медицинского университета Согласие участников В идеале все пациенты, подходящие под критерии включения, должны быть включены в испытание. Теоретически для этого нет препятствий, поскольку испытание должно проводиться только в ситуации, когда нет достаточных оснований предпочесть одно из сравниваемых вмешательств. Практически же люди имеют разные ценности и по-разному представляют ценность вмешательств. Поэтому не все пациенты дают согласие на участие в испытании. Одни могут предпочитать один из испытываемых методов лечения и не хотят оставлять его выбор случаю. Другие в принципе не хотят быть объектом исследования или избирают иной способ лечения. Соответственно таких пациентов в исследование не включают, и они получают то лечение, которое им показано и которое они избрали (дали согласие). Необходимо, чтобы отклик, т.е. доля людей, откликнувшихся на просьбу включиться в исследование, от всех соответствующих критериям включения, был достаточно высок – не менее 80%. В противном случае сформированная группа, возможно, не будет соответствовать сформулированным критериям включения и исключения. Результат испытания, от участия в котором отказалось много пациентов, может быть неприложим ко всем людям (например, к тем, кто отказывается). Так, испытывать методы лечения поясничных болей трудно, поскольку немало людей уверены в том, что им поможет только мануальная терапия. Результаты лечения у таких людей лучше независимо от лечения: пациенты, активно выбирающие некоторый метод лечения, лечатся старательнее, правильнее выполняют назначения. Это свойство людей называют аккуратностью или исполнительностью пациентов, но чаще – комплайенс. Рандомизация Случайное распределение пациентов по группам – классическая процедура достижения неразличимости групп в КИ. Рандомизация впервые была применена в клиническом испытании только после Второй мировой войны. Распределяют пациентов по группам случайным образом для того, чтобы различия между группами были как можно меньше. Еще важнее, чтобы различия носили случайный, а не преднамеренный характер по всем признакам, даже по тем, о которых исследователь ничего не знает. Из принципа случайного комплектования групп исходит методология статистического анализа данных — различия групп по определению являются случайными. Рандомизация выполнима разными средствами — от подбрасывания монеты и использования таблиц случайных чисел до компьютерных программ. Несмотря на простоту этих средств, иногда рандомизацию подменяют негодными методами. Примерами псевдорандомизации является распределение в группы по первой букве имени (возникают неравенства групп из-за этнических различий, связанных с именами), дате рождения, номеру медицинской карты, дню недели поступления в клинику и т.д. Применение псевдорандомизации чревато тем, что метод узнают третьи лица и смогут влиять на подбор пациентов. Например, сестра в приемном Кафедра эпидемиологии ММА им. И.М.Сеченова 43 отделении сможет присваивать четные номера медицинским картам симпатичных ей женщинпациенток. Главное неблагоприятное следствие псевдорандомизации - становится известным, кто из пациентов какое лечение получает. Таким образом, не выполняется главное условие рандомизации — сокрытие ее результатов, и рандомизация не может выполнить своей важнейшей функции — обеспечения слепого характера исследования. В исследованиях, где меры к сокрытию результатов рандомизации не принимались или сокрытие было недостаточным, оценка эффективности вмешательства завышалась примерно на 25%. Для обеспечения сокрытия принимаются надежные технические меры. Например, после регистрации в испытании пациента, давшего согласие, его данные сообщаются в территориально удаленный центр, откуда в ответ сообщается результат рандомизации. Распределение и применение вмешательств Испытание в параллельных группах Наиболее ярким достижением клинической эпидемиологии является разработка методологии испытания медицинских вмешательств — клинических испытаний. Простейшим случаем КИ является сравнение результатов вмешательства в двух группах – контрольной и опытной. Опытная получает изучаемое вмешательство, а контрольная — нет. Такую методику обозначают как проспективное исследование с вмешательством и с параллельным контролем. Независимые выборки. В КИ контрольная группа должна подвергаться всем тем воздействиям, что и опытная, с одним лишь отличием — контрольная получает другое лечение. Пациентов подбирают одинаково и разделяют на опытную и контрольную группы случайным образом. Численность групп может быть любой, не обязательно одинаковой. Поскольку пациенты включаются в группы независимо друг от друга, такие группы называют независимыми. Выборка пациентов Применение критериев включения и исключения Получение согласия Рандомизация Вмешательство Контроль Оценка исходов Связанные выборки (подобранные пары) -это случай, когда каждому пациенту в одной группе соответствует парный ему пациент в другой. Парой может быть пациент, подобранный, например, по полу и равному возрасту. Когда подобрана пара, проводится рандомизация. Она определит, какое вмешательство получит один из членов пары; второй получит другое. Выборка пациентов Применение критериев Кафедра эпидемиологии ММА им. И.М.Сеченова 44 включения и исключения Получение согласия Подбор пары Рандомизация Вмешательство Контроль Оценка исходов Перекрестное испытание Чтобы максимально устранить неизбежную межиндивидуальную вариабельность, иногда применяется перекрестная организация. При этом между основной и контрольной группами почти нет отличий: обе группы получают по очереди лекарство и плацебо. Иными словами, каждый пациент является и опытным, и контрольным. Например, в первом периоде одной группе пациентов дают контрольное лечение, а второй — изучаемое новое. Во втором периоде лечение в двух группах менялся. Сопоставляется эффект от лечения в каждой группе в каждом периоде. Такая структура испытания подходит для сравнения, например, противовоспалительных средств в терапии хронических болезней. Выборка пациентов Применение критериев включения и исключения Получение согласия Рандомизация Период 1 Вмешательство А Вмешательство В Период 2 Вмешательство В Вмешательство А Поскольку эффект может зависеть от последовательности лечения и может сохраняться какое-то время после лечения, между этапами эксперимента делается перерыв и применяются две очередности: лечение А, затем В и лечение В, затем А. Главным достоинством такой схемы является экономичность - статистически значимый результат можно получить при числе пациентов в 2 раза меньшем, чем при параллельном контроле. Это важно, поскольку информированное согласие на экспериментальное лечение дает не каждый пациент, и больных исследуемой болезнью может быть немного. Перекрестная схема позволяет лучше провести испытание в одной клинике и выявить более тонкие различия. Последнее возможно, поскольку точно одни и те же пациенты обследуются при новом и контрольном лечении. Перекрестные КИ не должны применяться в случае, когда эффект одного из видов лечения очень длителен или предполагается «потеря» испытуемых, или пациенты выпадают из исследования по причине полного выздоровления (как это имеет место при острых заболеваниях, завершающихся обычно излечением). Перекрестные КИ ненадежны в случаях, когда сравниваемые методы лечения дают внешне различающиеся фармакологические эффекты, если не удается вернуть пациентов к исходному состоянию после предыдущего этапа лечения, если изменения состояния Кафедра эпидемиологии ММА им. И.М.Сеченова 45 пациентов во времени неоднородны или эффект накапливается постепенно. Во всех этих случаях нужны не перекрестные КИ, а испытания с параллельным контролем. Факторная структура эксперимента В одном эксперименте можно сравнить более чем 2 вмешательства на одной группе пациентов. Для этого надо сначала рандомизировать пациентов для первого лечения и плацебо, а затем — для второго лечения и плацебо Вмешательство 2 Вмешательство 1 Да Нет (плацебо) Да 36 38 Нет (плацебо) 37 40 В результате будут пациенты, которые получат вмешательство 1 и 2 (в примере их 36), которые получат вмешательство 2 (38 пациентов), которые получат вмешательство 1 и которые получат только плацебо. Конечно, получающие плацебо получают в действительности 2 плацебо, а получающие одно вмешательство получают вместо второго плацебо. Факторная структура неприемлема, если существует взаимодействие между изучаемыми вмешательствами. Факторная структура исследования экономически очень эффективна в сравнении с проведением двух отдельных испытаний для оценки двух вмешательств. На одной группе испытуемых изучается 2 вопроса без потери статистической чувствительности эксперимента. Обычно факторную структуру применяют, когда запланировано испытание некоторого вмешательства, но появляется интерес и достаточные основания для проверки действенности еще одного вмешательства. Дозиметрия и применение вмешательства Применительно к некоторым вмешательствам дозировка не представляет проблемы: инъекция в установленное время обеспечивает введение в организм запланированного количества активного вещества. Применение пероральных форм введения уже приводит к трудностям в дозировке. Пациенты могут не полностью принимать суточную дозу, в случае ясно выраженных побочных эффектов могут уменьшать дозу для того, чтобы уменьшить побочные эффекты. Крайний вариант - вмешательства, которые трудно дозировать. К таким вмешательствам относится большинство хирургических. Обычно хирурги с трудом могут стандартизовать степень, в которой, например, затрудняется пассаж содержимого желудка после пластики. Манипуляции руками на позвоночнике практически не дозируются, так же как и воздействия игл при иглоукалывании. В ситуации, когда дозирование невозможно или затруднено, могут применяться вмешательства, стандартизованные, например, по времени манипуляций, глубине проникновения, месту и методике внедрения иглы. В ходе КИ обычно прекращают лечение, назначенное пациенту ранее. Срок, проходящий после прекращения прошлого лечения до начала КИ, устанавливают таким образом, чтобы действие принимавшихся ранее препаратов закончилось. В процессе КИ собирают информацию о том, как часто пациенты опытной и контрольной групп используют побочное, не назначенное в ходе испытания лечение. Если пациенты опытной группы используют дополнительные средства для лечения своего состояния (коинтервенция), то это может увеличить оценку действенности вмешательства. Если пациенты контрольной группы используют то же вмешательство, что предоставляется в экспериментальной группе (контаминация, загрязнение), то разница между группами уменьшается, и оценка действенности вмешательства будет занижена. В испытании принимают меры к предотвращению приема непредписанных средств и к повышению исполнительности пациентов и персонала в выполнении предписанных протоколом действий. Одним из способов достижения комплайенса является проведение до испытания вводного этапа. На этом этапе выявляют пациентов, не соблюдающих режим, например путем определения в моче веществ, введенных в препарат в качестве метки. Затем в испытание включают только исполнительных пациентов. Коинтервенция и контаминация почти неизбежны и должны учитываться при анализе данных. Кафедра эпидемиологии ММА им. И.М.Сеченова 46 Плацебо Первым вопросом относительно полезности нового вмешательства является вопрос о его действенности, т.е. способности уменьшить вероятность неблагоприятных исходов по сравнению с отсутствием вмешательства. Отсутствие вмешательства в контрольной группе может быть психологически неприемлемо для пациентов и может приводить к неисполнению ими режима испытания. Больные, которых не лечат, сами начинают лечиться. Поэтому пациенты контрольной группы дают вещество (проводят процедуры), которое неотличимо от активного вмешательства. Обычно плацебо — это лекарственная форма, лишенная активного компонента, например таблетка, идентичная активной, но содержащая только наполнитель (обычно каолин, крахмал, изотонический раствор хлорида натрия). Для полноты «ослепления» плацебо придают вид, максимально сходный с активным препаратом, и используют тот же путь введения. Даже если полезность «обычного» лечения не доказана, врачи и пациенты могут с трудом воспринимать возможность замены его на плацебо. Тогда в качестве контроля применяют «обычное» лечение, стандартное в текущий момент. Считается неприемлемым применять плацебо и в некоторых специфических случаях, таких как исследования эффективности противозачаточных средств. Плацебо нельзя применять при болезнях, для которых есть эффективное лечение. Фармацевтические компании предпочитают проводить плацебо-контролируемые КИ, поскольку для государственной регистрации действенность нового Л С легче показать в сравнении с плацебо, чем в сравнении со стандартным лечением, даже минимально действенным. При сравнении с существующим ЛС надо или показать, что новое ЛС дает больший эффект, или показать, что его эффект идентичен (не меньше) эффекту существующего ЛС. И то и другое требует резкого увеличения числа пациентов в КИ. Интерес к плацебо-контролируемым испытаниям — законный коммерческий интерес, но это объяснение не меняет негативного отношения врачей к оставлению пациентов в контрольной группе без лечения. В соответствии с вековой традицией нередко полагают, что применение плацебо дает полезный эффект — «эффект плацебо». В действительности в систематическом обзоре тысяч РКИ показано, что плацебо – по сравнению с отсутствием вмешательства — оказывает незначительное влияние и то лишь на исходы, которые отражают эмоции, субъективную картину болезни человека (качество сна, интенсивность боли). На клинически важные исходы прием плацебо не влияет (продолжительность жизни, длительность ремиссии, функциональный дефект и т.д.). Важно, что «эффект плацебо» присущ и активному ЛС, но не является специфическим эффектом ЛС, а в испытаниях изучают именно специфические) эффекты вмешательств. Впоследствии, в клинической практике врачи применяют ЛС в надежде на получение специфического эффекта, например антибактериального. Слепой метод Главным условием эффективного испытания медицинского вмешательства является «ослепление» участников, т.е. сокрытие от них, к какой группе в исследовании они принадлежат. Иногда вместо термина «ослепление» применяют термин «маскирование» (тазкшё, англ.). Слово «ослепление», по понятным причинам, не применяют офтальмологи. Если лечение известно исследователю, но не участнику, то такая организация КИ называется «слепое испытание». Если не замаскировать, к какой группе принадлежит пациент, он будет относиться к своему лечению по-особенному. Например, получающий «старое» лечение чаще будет им пренебрегать. Получающий новое вмешательство будет относиться к нему с энтузиазмом. Возможно, наоборот, получающие «проверенное временем» лекарство будут его ценить выше. Наконец, высока вероятность, что пациенты, которые знают, что получают неактивное или «старое» лечение, прервут свое участие в исследовании. Точно предсказать отношение участников к вмешательству нельзя, но обычно новые вмешательства рассматриваются как обещающие больший эффект. Врачи тоже могут вносить систематическую ошибку. Например, выздоровление при новом вмешательстве может переоцениваться (рентгенолог найдет снижение плотности тени более быстрым при новом лечении). При возникновении у пациента неожиданных симптомов Кафедра эпидемиологии ММА им. И.М.Сеченова 47 (головокружения, диспепсии) врач может прервать испытание у пациента, получающего новое лекарственное средство, но может игнорировать эти симптомы у получающего плацебо. Поэтому желательно, чтобы все работающие с пациентами не знали, кто какое лечение получает. Это называется «двойным слепым испытанием». Отсутствие двойного ослепления в РКИ приводит к смещению оценки эффективности вмешательства — в среднем к завышению на 19%. «Тройными слепыми испытаниями» называют такие РКИ, в которых результат рандомизации скрыт не только от пациента и исследователя, но и от статистика, проводящего анализ данных. В таком случае статистик сравнивает результаты в двух группах, но их лечение открывается только по завершении анализа. В случае, если хотят подчеркнуть, что исследователь не оценивал исходы лечения, а это делали другие специалисты и что они тоже были «ослеплены», иногда говорят о «четверном ослеплении». Испытания, результат рандомизации в которых не скрывают, называют открытыми РКИ. Исходы Исходами («целевыми» признаками) называют события, по которым судят о прогрессировании болезни, эффективности лечения или других вмешательств. В медицине обычно на 1-м месте стоят такие исходы, как летальность (продолжительность жизни), длительность периода между обострениями (частота обострений), возникновение инвалидности (сохранение работоспособности), сохранение (возникновение) боли, уменьшение объективных проявлений болезни (отеки, ограничения подвижности, непроходимость), функциональные возможности (самообслуживание), удовлетворенность жизнью, видом своего тела. Первые исходы более традиционны для медицины, последние — привлекли больше внимания в последние десятилетия как показатели «качества жизни». Оценка исходов Выбор исходов болезни определяется целью и задачами исследования. Обычно в исследовании избирают самые важные исходы, характерные для данной болезни. Например, при сердечной недостаточности это летальность и степень снижения функциональных возможностей (класс NYHA). Выявить изменения в таких исходах может быть затруднительно, поскольку в исследуемый интервал времени летальных исходов наблюдается мало. Традиционным решением является замена клинически важных исходов на доступные (промежуточные, косвенные, суррогатные). При сердечной недостаточности можно оценивать фракцию изгнания левого желудочка, поскольку увеличение фракции изгнания отражает увеличение функциональных возможностей пациентов. При лечении судорожных расстройств в качестве меры эффективности лечения можно использовать не частоту припадков, а изменения на ЭЭГ, которые развиваются уже в ближайшие часы после начала приема препарата; при профилактике ИБС — вместо частоты инфаркта, стенокардии, внезапной смерти — концентрацию холестерина ЛПНП в плазме. Использование таких «суррогатных» исходов может приводить к неверным результатам. Например, противоаритмические средства при инфаркте миокарда помогают нормализовать ритм, и это было основанием рекомендовать их профилактическое применение. Контролируемые испытания показали, что смертность у пациентов, получающих профилактически антиаритмические средства, даже повышена по сравнению со смертностью получающих плацебо. Только в США, где это лечение применялось наиболее активно, ежегодно погибало от этого лечения, по приблизительной оценке 50 000 человек — больше, чем погибло американцев во вьетнамской войне. Другой пример. При лечении остеопороза основным оцениваемым исходом является частота переломов, а суррогатным — минеральная плотность костей. Одни средства ожидаемым образом увеличивают минерализацию костей и снижают частоту переломов (эстрогены, этидронат). Другие лишь увеличивают минеральную плотность, но увеличивают частоту переломов (фтор). Суррогатные оценки, например минерализация костей, приемлемы только в случае, когда клинически важные исходы (частоту переломов) нельзя оценить или до тех пор, пока клинически важные исходы еще не изучены. Суррогатные оценки могут быть воспроизводимыми, но они могут неполно и даже неверно отражать основные клинически важные исходы. Обычно исследователи стремятся к использованию «надежных» исходов, таких как смерть, смерть от определенной причины, возникновение болезни, инвалидность. Такие исходы, как Кафедра эпидемиологии ММА им. И.М.Сеченова 48 качество сна, выраженность дизурии, труднее использовать, поскольку по таким признакам люди оценивают себя сами и оцениваются другими неточно, с низкой воспроизводимостью. Точность и воспроизводимость «надежных» исходов значительно выше, но ее также не следует переоценивать. При установлении диагноза или определении причины смерти всегда существует неопределенность, на которую могут повлиять привходящие факторы. Поэтому оценка исходов всегда должна проводиться вслепую. Данные диагностических исследований должны оцениваться специалистами, не знающими, к какой группе относится обследуемый, из архивных материалов данные должны выписываться вслепую, опрашиваться участники исследований также должны вслепую. Оценка изображений (рентгенограмм), гистологических препаратов должна проводиться двумя специалистами независимо и с привлечением третьего для согласования в случае расхождения оценок. Качество жизни Несмотря на традиционное внимание к исходам, отражающим клинически важные события, в медицине никогда не игнорировали субъективные страдания больного и побочные эффекты лечения. Вместе с тем всегда существовало стремление достичь клинически важных исходов, несмотря на причиняемые пациенту страдания в ходе лечения. Это стремление было наиболее выражено у врачей, применяющих агрессивные, травматичные виды лечения — у хирургов, онкологов. Именно в этих областях медицины острее всего была осознана необходимость наряду с клинически важными исходами оценивать и качество жизни, продлеваемой в результате лечения. Оценка качества жизни в соответствии с исходной идеей должна к оценке количества (продолжительности жизни) добавить ее качество. В экстремальном примере агрессивной противораковой химиотерапии небольшое увеличение продолжительности жизни может достигаться неприемлемыми страданиями в процессе лечения. Это — не гипотетическая возможность, а реалии современной медицины. В 1990-е годы испытывался метод высокодозной химиотерапии рака молочной железы, который обещал увеличение продолжительности жизни больных. В результате испытаний выяснилось, что применение испытываемого протокола сопровождается тяжелыми побочными эффектами и увеличение продолжительности жизни, даже если оно возникает, покрывается увеличением летальности от побочных эффектов лечения. Для того чтобы измерить, как болезни и медицинские вмешательства влияют на качество жизни пациентов, применяются специальные методы (шкалы): функциональные классы сердечной недостаточности NYHA, 5Р-36, шкала функциональных возможностей Карновского. Одни шкалы неспецифичны, и их можно применять к любому пациенту, другие приспособлены к особым дефектам, особенностям, возникающим, например, при астме, раке. Одни шкалы более нацелены на то, как пациент справляется с задачами повседневной жизни, в быту, другие более ориентированы на оценку самочувствия, удовлетворенности. Инструменты для оценки качества жизни обычно представляют собой сложные шкалы, итоговая оценка на которых получается в результате суммирования разнообразных сведений — об интенсивности боли, настроении, состоянии дыхания, способности помыться самостоятельно и так далее. Несмотря на то, что многие шкалы на первый взгляд выглядят очень простыми, их разработка представляет собой достаточно сложный процесс. Поэтому исследователи используют стандартизованные шкалы качества жизни, специализированные для изучаемого вида патологии. Эти шкалы являются по происхождению ординальными переменными. Вместе с тем число градаций на шкале обычно достаточно велико, и к оценкам качества жизни применяют те же статистические методы, что и к количественным признакам в надежде на робастность этих критериев. Прекращение испытания Длительность КИ планируется исходя из числа участников и ожидаемой частоты исходов, ожидаемого различия между вмешательствами (размера эффекта) и планируемой статистической Кафедра эпидемиологии ММА им. И.М.Сеченова 49 значимости результата. Можно провести относительно короткое испытание, если включить много участников. Если не запланировать длительности испытания, а просто ожидать, когда различие между сравниваемыми группами станет статистически значимым, то это будет ошибкой. Повторное применение статистических критериев для проверки значимости различий приводит к увеличению вероятности ложноположительных выводов — вероятности обнаружения значимого различия там, где его нет. Это один из вариантов ошибки, возникающей при множественных сравнениях. Проведение испытания до момента, когда его результат станет статистически значимым, будет ошибкой, которую в обыденной жизни люди не допускают: никто не согласится играть на деньги до момента, когда выигрыш у противника будет больше 1000 рублей. Поэтому длительность КИ устанавливается заранее. В длительных испытаниях правила прекращения КИ устанавливают, поскольку это может быть необходимым для обеспечения безопасности участников и при получении убедительных результатов в пользу одного из изучаемых вмешательств. Принято думать, что после того, как преимущества одного из сравниваемых вмешательств установлены, изменяется ситуация: для участников КИ вмешательства становятся неравными, какими они были в момент начала испытания. Испытание должно быть прекращено и всем участникам предоставлена информация о результатах и доступ к найденному более эффективному вмешательству. Статистическая оценка результатов испытания. Плацебо Препарат Неблагоприятный исход Наблюдался Отсутствовал А B С D Всего A+B C+D Риск при лечении плацебо Pпл=А/(А+В) Риск при лечении изучаемым препаратом Рлр=С/(С+D) Абсолютное снижение риска АСР=А/(А+В)-С/(С+D) Число пациентов, подвергаемых лечению, на один предотвращенный неблагоприятный исход ЧПЛП=1/АСР Относительный риск ОР=[C/(C+D)]/[A/(A+B)] Снижение относительного риска СОР=1-ОР Изучение побочных эффектов вмешательств. Плацебо Препарат Неблагоприятный исход Наблюдался Отсутствовал А B С D Абсолютное повышение риска Число пациентов, подвергаемых лечению, на один вредный исход Всего A+B C+D АПР= С/(С+D)-А/(А+В) ЧПЛВ=1/АПР Стандарт отрасли ОСТ 42-511-99 "Правила проведения качественных клинических испытаний в Российской Федерации" Для оценки эффективности лекарственного средства используется стандарт отрасли ОСТ 42-511-99 "Правила проведения качественных клинических испытаний в Российской Федерации" (утв. Минздравом РФ от 29 декабря 1998 г.) Дата введения 1999.01.01 Область применения Кафедра эпидемиологии ММА им. И.М.Сеченова 50 Настоящий стандарт устанавливает требования к проведению клинических испытаний лекарственных средств. Правила проведения качественных клинических испытаний в Российской Федерации (Good Clinical Practice -GCP) представляют собой этический и научный стандарт качества планирования и проведения исследований на человеке, а также документального оформления и представления их результатов. Соблюдение этих правил служит гарантией достоверности результатов клинических испытаний, безопасности, охраны прав и здоровья испытуемых в соответствии с основополагающими принципами Хельсинкской декларации. Требования данных Правил должны соблюдаться при проведении клинических испытаний лекарственных средств, результаты которых планируется представить в разрешительные инстанции. Принципы качественных клинических испытаний (GCP) Клинические испытания должны проводиться в соответствии с основополагающими этическими принципами Хельсинкской Декларации, Правилами GCP и действующими нормативными требованиями. До начала клинического испытания должна быть проведена оценка соотношения предвидимого риска с ожидаемой пользой для испытуемого и общества. Клиническое испытание может быть начато и продолжено только в случае преобладания ожидаемой пользы над риском. Права, безопасность и здоровье испытуемого важнее интересов науки и общества. Обоснованием планируемого клинического испытания должны служить данные доклинического и клинического изучения исследуемого препарата. Клиническое испытание должно быть научно обосновано, подробно и ясно описано в протоколе исследования. Клиническое испытание проводится в соответствии с протоколом, заблаговременно утвержденным/одобренным Экспертным Советом/Комитетом по этике. Ответственность за оказание медицинской помощи испытуемому может взять на себя только квалифицированный врач. Все лица, участвующие в проведении клинического испытания, должны иметь профессиональное образование и опыт, соответствующий поставленным задачам. Испытуемый может быть включен в испытание только на основании добровольного информированного согласия, полученного после детального ознакомления с материалами исследования. Сбор, обработка и хранение информации, полученной в ходе клинического испытания, должны обеспечивать точное и правильное представление, объяснение и подтверждение данных. Документы, позволяющие установить личность испытуемого, должны сохраняться в тайне от неуполномоченных лиц. Производство и хранение исследуемого препарата, а также обращение с ним осуществляется в соответствии с Правилами организации производства и контроля качества лекарственных средств (Good Manufacturing Practice -GMP). Препарат должен использоваться в соответствии с утвержденным протоколом исследования. Основные документы необходимые для проведения РКИ: - протокол исследования и поправки к нему; - форма письменного информированного согласия и ее последующие редакции; - материалы для привлечения испытуемых к участию в исследовании (например, рекламные объявления); - Брошюра исследователя; - имеющаяся информацию по безопасности исследуемого препарата; - информация о выплатах и компенсациях испытуемым; Кафедра эпидемиологии ММА им. И.М.Сеченова 51 - curriculum vitae исследователя на настоящий момент и/или другие материалы, подтверждающие его квалификацию; - любые другие документы, которые могут потребоваться Экспертному совету/Комитету по этике для исполнения своих обязанностей. Этические аспекты проведения РКИ: Согласно Указанию Минздрава РФ от 19 августа 1999 г. N 891-У функции Комитета по этике при Федеральном органе контроля качества, эффективности и безопасности лекарственных средств возложены на Национальный этический комитет. Основная задача Экспертного совета/Комитета по этике – защита прав и здоровья испытуемых, а также гарантия их безопасности. Особое внимание уделяется тем исследованиям, участниками которых могут быть уязвимые испытуемые. Задача 1. Пациенты с тяжелым хроническим зудом участвовали в испытании лекарственных препаратов, купирующих зуд. В течение каждой из трех недель в случайной последовательности 48 пациентов получали либо ципрогептадина хлорид, либо тримепразидина тартрат, либо плацебо. Кроме того, в график приема препаратов и плацебо был введен (также в случайном порядке) однонедельный перерыв. Результаты оценивались в отсутствие сведений о принимаемом препарате и представлялись в баллах выраженности зуда: чем выше балл, тем сильнее зуд. Полученные средние значения были следующими: ципрогептадина хлорид – 28 баллов, тримепразидина тартрат – 35 баллов, плацебо – 30 баллов, отсутствие лечения – 50 баллов. Задание: 1. Сделайте предварительный вывод об эффективности каждого вмешательства. 2. Укажите причины повлиявшие на результат. Кафедра эпидемиологии ММА им. И.М.Сеченова 52 Задача 2. 1 – преимущественно специфическое действие; 2 – смешанное действие; 3 – преимущественно неспецифическое действие А – наркотические средства, антидепрессанты; Б – средства против зуда, инъекции в триггерные точки; В – антимикробные средства, антиметаболиты. Задание: Установите соответствие. Задача 3. При проведении клинического испытания нового антибиотика была произведена выборка больных пневмонией легкой формы течения. Случайным образом были сформированы четыре группы пациентов. В первой группе вмешательство не проводилось, за пациентами второй группы было установлено наблюдение, в третьей группе пациенты получали плацебо, в четвертой – исследуемый препарат. Через неделю была проведена оценка эффективности лечения. Критерием эффективности считалось клиническое улучшение состояния. В первой группе улучшение состояния наблюдалось у 15 % пациентов, во второй – у 23%, в третьей – у 35 %, в четвертой – у 85 %. Задание: 1. Оцените полученные результаты. 2. Укажите причины, повлиявшие на полученные результаты. Задача 4. эффект Лечебный Вклад различных причин в суммарный лечебный эффект Кафедра эпидемиологии ММА им. И.М.Сеченова Гру ппа отсу тств ия 53 Гру ппа наблюдения без Гру ппа плацебо Гру ппа лекарств енного Задание: Оцените вклад различных причин в суммарный лечебный эффект и дайте объяснение полученных результатов. Задача 5. При проведении клинического испытания двух лекарственных препаратов пациенты делились на группы разными способами. В первом случае пациентов делили по четности номера карты (четные номера – основная группа, нечетные – контрольная), во втором случае по дню недели поступления в стационар (понедельник, среда, пятница, воскресенье – основная, вторник, четверг, суббота – контрольная). Задание: 1. Оцените правильность организации первого и второго исследования. 2. Дайте рекомендации по проведению рандомизации. Задача 6. В крупном исследовании влияния нескольких гиполипидемических препаратов на развитие стенокардии 1103 мужчинам был назначен клофибрат и 2789 мужчинам - плацебо. Летальность за последние 5 лет составляла в среднем 20,0% в группе принимавших клофибрат и 20,9% в группе принимавших плацебо, что указывает на неэффективность препарата. В то же время было обнаружено, что не все пациенты принимали лекарство. Был ли клофибрат эффективен у тех, кто действительно принимал препарат? Ответ оказался утвердительным. В экспериментальной группе летальность за последние 5 лет среди пациентов, действительно принимавших клофибрат, составила 11,0% по сравнению с 26,4% у пациентов, не соблюдавших схему лечения (р< 10-5). Летальность среди больных, которые строго выполняли назначения и принимали плацебо также снизилась. В данном случае летальность за последние 5 лет у пациентов действительно принимавших препарат составила 19,3% против 25,3% среди тех, кто не принимал его (р<10-15). Кафедра эпидемиологии ММА им. И.М.Сеченова 54 Задание: 1. Оцените полученные результаты. 2. Укажите причины, повлиявшие на результаты. 3. Сделайте предварительный вывод об эффективности препарата. Задача 7. Лечение больных СПИДом связано с эмоциями, в частности потому, что болезнь поражает молодых людей и неизбежно заканчивается смертью в течение нескольких лет после появления симптомов. Изучению эффективности методов лечения препятствует нарушение обычных процедур рандомизированных испытаний, поскольку пациенты пытаются увеличить свои шансы на выживание. В ходе рандомизированных испытаний пациенты иногда обмениваются препаратами или получают через "лекарственные клубы" препараты, не используемые в испытании. О таких поступках они не сообщают исследователям, так что эти факторы невозможно учесть при подведении итогов испытания. Задание: Определите каким образом такое вмешательство в исследование оказывает влияние на получаемые результаты. Задача 8. Оцените правильность организации исследований в следующих случаях. Укажите, каким образом такая организация исследования могла повлиять на полученные результаты. 1. В клиническом испытании нового препарата для снижения уровня триглицеридов крови пациенты были поделены на две группы. Пациенты первой группы получали препарат, во второй группе – плацебо. Пациенты знали свою принадлежность к группе. 2. В клиническом испытании антибиотика у пациентов с пневмонией результат оценивался по изменению рентгенологической картины. Врач, проводивший испытание знал принадлежность пациентов к контрольной или основной группе. При этом улучшение рентгенологической картины врач выявлял раньше у пациентов экспериментальной группы. 3. Было проведено клиническое испытание нового дорогостоящего препарата класса статинов. Статистик, оценивающий результаты знал принадлежность пациентов к контрольной или основной группе. По совместительству статистик работал в фармацевтической компании, заказавшей это исследование. Кафедра эпидемиологии ММА им. И.М.Сеченова 55 Задача 9. В исследовании первичной профилактики сердечнососудистых заболеваний было использовано практически идеальное плацебо. Одни участники получали холестирамин (экспериментальная группа), другие - порошок такого же вида, вкуса и запаха - плацебо (контрольная группа). Однако побочные эффекты встречались существенно чаще в экспериментальной группе. В конце первого года испытания у пациентов экспериментальной группы чаще, чем в контрольной, отмечались запоры (39% против 10%), изжога (27% против 10%), отрыжка и метеоризм (27% против 16%), а также тошнота (16% против 8%). Задание: Оцените, каким образом данная ситуация может повлиять на полученные результаты. Задача 10. Было проведено двойное слепое рандомизированное испытание, чтобы выяснить, предотвращает ли прием пропранолола повторный инфаркт миокарда. После окончания исследования, но до раскрытия кодов, пациентов и медицинский персонал попросили отгадать, какой препарат принимал пациент. Среди пациентов 79,9% правильно отгадали пропранолол и 57,2% - плацебо. Врачи и медицинские сестры показали такой же результат. Задание: Оцените, каким образом данная ситуация может повлиять на полученные результаты Задача 11. 1) Внутривенные инъекции. 2) Пероральная форма лекарственного средства. 3) Мануальная терапия. 4) Иглорефлексотерапия. 5) Оперативное вмешательство. Задание: Определите возможные трудности стандартизации и дозиметрии указанных методов. Дайте обоснование принятого решения. Задача 12. При проведении рандомизированного клинического испытания эффективности препарата Кафедра эпидемиологии ММА им. И.М.Сеченова 56 Арбидол среди детей в возрасте от 2 до 6 лет было сформировано две группы: основная (экспериментальная) группа численностью 143 пациента и контрольная – 151 пациент. Пациенты основной группы получали Арбидол в дозе 0,05 в течение 6 дней, пациенты контрольной группы получали плацебо. Исследование продолжалось в течение 3-х месяцев, после чего проводилась оценка результатов по количеству заболевших гриппом и ОРВИ, а также количество осложненных гриппа и ОРВИ. В опытной группе заболели 66 пациентов, при этом осложнения наблюдались у 7 пациентов, в контрольной группе заболели 95 пациентов, осложнения были у 20 пациентов. Задание: Оцените по представленным данным эффективность препарата Арбидол по показателям (см. Приложение) на предотвращение развития заболевания грипп и ОРВИ и на предотвращение развития осложнений. Задача13 Популяция из которой проводился отбор участников исследования Соответствуют условиям включения/исключения 1037 детей Критерии включения: дети от 2 до 16, проживающие в местечке Кирьяс Джоел коммуны Монроу, штат Нью-Йорк, согласие родителей или опекунов, возможность последующего наблюдения. Критерии исключения: сероположительная реакция на антитела гепатита А, иммунная недостаточность, известная аллергия на любой компонент вакцины, получившие иммунный глобулин за 6 мес до начала исследования, получившие любую другую вакцину против гепатита А, получившие любую вакцину в предшествующие 15 дней и другие показания, которые по мнению исследователей могли повлиять на объективность исследования Рандомизация и введение препаратов 519 детей получивших вакцину 518 детей получивших плацебо Наблюдение в течение 137 дней Оставшиеся до конца опыта . Выявление больных соответствующих определению случая гепатита А. Исключение из опыта трех детей из опытной и одного из котрольной группы, как получивших иммунный глобулин по просьбе их родителей. Исключение из опыта детей заболевших раньше, чем через 50 дней от начала вакцинации 495 детей получивших вакцину 469 детей получивших плацебо Нет заболевших гепатитом 25 детей заболели гепатитом после 50 дней от момента введения плацебо Схема составлена на основании данных, изложенных в публикации «Формалин-инактивированная вакцина гепатита А, Приложение 1. А. Верзбергер и др.Nеw England Jornal of Medicine. 327 (7), 1992) Задание: 1. Изучите представленную схему и составьте ее заголовок. 2. Укажите, какими терминами следует обозначить дизайн данного исследования и объясните основные его этапы. Кафедра эпидемиологии ММА им. И.М.Сеченова 57 3. Определите цель этого исследования. 4. Укажите, какой или какие показатели (величины, коэффициенты) рассчитываются при такой организации исследования и расшифруйте их эпидемиологический смысл. 5. Объясните, что означают термины внутренняя и внешняя достоверность данных эпидемиологического исследования и можно ли результаты этого исследования считать абсолютно истинными Приложение к задаче №12. Плацебо Препарат Неблагоприятный исход Наблюдался Отсутствовал А B С D Всего A+B C+D Риск при лечении плацебо Pпл=А/(А+В) Риск при лечении изучаемым препаратом Рлр=С/(С+D) Абсолютное снижение риска АСР=А/(А+В)-С/(С+D) Число пациентов, подвергаемых лечению, на один предотвращенный неблагоприятный исход ЧПЛП=1/АСР Относительный риск ОР=[C/(C+D)]/[A/(A+B)] Снижение относительного СЕМИНАР № 5 ДИАГНОСТИЧЕСКИЕ И СКРИНИНГОВЫЕ ТЕСТЫ В результате изучения темы студент должен Уметь: • Рассчитывать - чувствительность и специфичность измерения - ложноположительные и ложноотрицательные показатели - прогностическую значимость положительного и отрицательного тестов - претестовую вероятность и шансы - посттестовую вероятность и шансы - отношение правдоподобия (likehood ratio) Сравнить значения чувствительности и специфичности для определения диагностического теста. В результате изучения темы студент должен: Знать: Понятия диагностического и скринингового теста. - основную схему испытания диагностического теста. -понятие и критерии оценки валидности и воспроизводимости теста. полезности - влияние чувствительности и специфичность влияет на оценку распространенности болезни - зависимость прогностической значимости теста от распространенности болезни - разницу между дифференцированной и недифференцированной ошибочной классификацией - влияние недифференцированной и дифференцированной ошибочной классификация одной или Кафедра эпидемиологии ММА им. И.М.Сеченова 58 обеих переменных на оценку показателей заболеваемости в сравниваемых группах -факторы и показатели валидности для определения полезности скринингового теста - значения показателей валидности для определения полезности диагностического теста Работа на занятии Понятия диагностического и скринингового теста. Основная схема испытания диагностического теста. Понятие и критерии оценки валидности и воспроизводимости диагностических скрининговых тестов. - чувствительность и специфичность измерения - ложноположительные и ложноотрицательные показатели - прогностическая значимость положительного и отрицательного результата тестов - претестовая и посттестовая вероятность и шансы - отношение правдоподобия (likehood ratio) Выполнение заданий: 1 2 3 1. Расчет показателей чувствительности и специфичности, ложноположительных и ложноотрицательных показателей. Влияние чувствительности и специфичности диагностических тестов на оценку распространенности болезни. (Задание 1) 2. Влияние тестов с разной валидностью на оценку показателей заболеваемости на в сравниваемых группах . (Задания 2 и 3). 3. Оценка критериев валидности для определения полезности скринингового теста. Факторы, влияющие на выбор скринингового теста (Задания 4 и 5). 4 Оценка критериев валидности для определения полезности диагностического теста (задание 6). Информационный материал Методы оценки состояния здоровья людей подразделяют на: диагностические (клинические) тесты; скрининговые тесты. При этом еще раз подчеркнем, что термин тест, во всех случаях рассматривается не только как отдельное лабораторное исследование, но и как данные опроса, физикального обследования, и как комплекс критериев, полученных разными методами. Таким образом, тест это любой способ, метод получения данных и сами данные, используемые для оценки состояния здоровья обследуемого лица. Диагностические тесты Диагностические (клинические) тесты предназначены для постановки клинического диагноза уже больным (обратившимся к врачу) людям. В отличие от диагностических тестов, скрининговые тесты, и применяют их для обследования лиц, считающих себя здоровыми с целью объективной оценки состояния их здоровья и с целью вторичной профилактическии Главное требование, предъявляемое диагностическим тестам – точность, а для этого они должны быть: достоверны (валидны). воспроизводимы; Оценка результатов применения тестов. Чувствительность и специфичность Кафедра эпидемиологии ММА им. И.М.Сеченова 59 Определение чувствительности и специфичности теста предполагает наличие какого-то метода (комплекса методов), результаты которых считаются надежными, т.е. истинными. Такие методы называют эталонными или «золотым стандартом». Так, выделение у больного какого-либо облигатного патогенного паразита человека, является «золотым стандартом» установления соответствующего диагноза инфекционного заболевания. В тоже время, только на основании выделения условно-патогенных микроорганизмов далеко не во всех случаях можно поставить необходимый диагноз. Для длительно протекающих заболеваний (например, онкологических) специфические симптомы которых появляются по истечении нескольких лет, подобрать «золотой стандарт» на ранних стадиях заболевания невозможно. Фактически «золотым стандартом» в таких случаях становятся данные, накопленные в течение длительного наблюдения Основная схема испытания диагностического теста может быть представлена следующими этапами: • Выбор референтного теста. «Золотой стандарт» - наиболее точный диагностический метод из существующих. • Критерии включения и исключения. Согласие. • Формирование выборки. • Обследование выборки при помощи испытуемого теста. • Обследование выборки при помощи референтного теста. • Использование «ослепления» • Сравнение результатов испытания. Оценка безопасности теста. Оценка экономической эффективности теста. Чувствительность теста Чувствительность (sensitivity) теста – это его способность давать достоверную оценку наличия данной болезни у обследуемого лица. Тесты, обладающие высокой чувствительностью, должны редко ошибаться в оценке здоровья лиц, действительно имеющих какую-либо патологию (болезнь). Другими словами, чувствительные тесты не должны пропускать больных, хотя при этом, почти неизбежно, в ряде случаев, болезнь может быть ошибочно «приписана» здоровым лицам. Чувствительность теста измеряется по удельному весу (доле) правильных (достоверных) диагностических оценок среди лиц, заведомо больных данной болезнью. Долю правильных диагнозов называют истинно положительными результатами. Оставшаяся нераспознанной часть заведомо больных лиц, называется – ложноотрицательными результатами. Специфичность теста. Специфичность (specificity) теста – это его способность давать достоверную оценку отсутствия данной болезни у индивидуума. Обычно в этом случае, говорят, – человек здоров, понимая под этим отсутствие определенной болезни. Высокоспецифичные тесты, как правило, не относят здоровых к больным, но могут пропустить часть случаев с легким, атипичным течением болезни. Специфичность теста измеряется долей достоверных оценок отсутствия данной болезни среди заведомо здоровых лиц. Эту долю оценок называют истинно отрицательными результатами, а долю здоровых, которых ошибочно расценили, как больных обозначают, как ложноположительные результаты. Ошибки при классификации (разделения на больных и здоровых Оценка чувствительности и специфичности. Кафедра эпидемиологии ММА им. И.М.Сеченова 60 Оценка достоверности (валидности) диагностического теста проводится с помощью таблицы «два на два» Табл. Оценка валидности диагностического теста Скрининговый тест Наличие болезни Всего Есть Нет Положительный a b a+b Отрицательный c d c+d Всего a+c b+d a+b+c+d Условные обозначения и рассчитываемые характеристики теста: a – число истинно положительных результатов; b – число ложноположительных результатов; c – число ложноотрицательных результатов; d - число истинно отрицательных результатов; Чувствительность = a/(a+c); Специфичность = d/(b+d); Ложноотрицательный показатель =c/(а+c) Ложноположительный показатель = b/(b+d). Эти величины обычно умножают на 100 и выражают в процентах. Положительное прогностическое значение – вероятность обнаружения болезни у лиц с положительным результатом теста = a/(a+b); Отрицательное прогностическое значение – вероятность отсутствия болезни у лиц с отрицательным результатом теста = d /(c+b). Количество положительных результатов на выявленный случай = (a+b) / a; Общее количество тестов на выявленный случай = (a+b+c+b) /a;. Отношения правдоподобия. Для интерпретации диагностических тестов является полезным еще один тип показателей. Эти показатели обычно называются отношениями правдоподобия (likelihood ratios (LR)). Отношения правдоподобия равняется вероятности наличия определенного результата некоего теста для человека с заболеванием, деленное на вероятность этого же результата теста для человека без заболевания. Для таких тестов, как тест с тонкоигольчатой биопсией, которые могут быть классифицированы как дихотомические, отношения правдоподобия определяются как для положительных, так и для отрицательных результатов теста. Отношение правдоподобия для положительных результатов теста (LR+) равняется вероятности положительного результата теста для человека с заболеванием, деленное на вероятность положительного результата теста для человека без заболевания. Математически отношение правдоподобия можно рассчитать следующим образом: Кафедра эпидемиологии ММА им. И.М.Сеченова 61 В этой формуле чувствительность и специфичность опять таки выражается в пропорциях, а не в процентах Возможное наименьшее значение отношения правдоподобия возникает тогда, когда числитель является минимальным (чувствительность равняется нулю), в этом случае значение LR+ становится нулевым. Максимальное значение LR+ возникает тогда, когда знаменатель является минимальным. Специфичность равняется 1, поэтому 1 – специфичность = 0, в результате этого LR+ начинает стремиться к положительной бесконечности. LR+ = 1 указывает на абсолютно бесполезный тест, поскольку он не помогает разделить лиц с/ и без интересующего нас заболевания, в связи с тем, что вероятность положительного результата теста одинаково равна у больных и у здоровых людей. Значения LR+ больше 1 соответствует ситуации, когда человек, пораженный заболеванием, с большей вероятностью будет иметь положительный результат теста, по сравнению со здоровым человеком. Чем больше значение LR+ , тем сильнее связь между положительным результатом теста и заболеванием. Отношение правдоподобия для отрицательного результата теста (LR- ) – это вероятность отрицательного результата теста для больного человека, деленная на вероятность отрицательного результата теста для здорового человека. Математически LR- рассчитывается следующим образом: Влияние валидности теста на оценку показателей заболеваемости в популяции Только тест обладающий 100% чувствительность и специфичностью может без ошибочно определить показатели заболеваемости (инцидентности, превалентности). На практике когда тесты используются для оценки заболеваемости определенной болезнью, их низкая валидность означает, что часть лиц будет неправильно классифицирована на больных и здоровых. Низкая чувствительность означает, что люди с данной болезнью будут ошибочно отнесены к разряду лиц, ее не имеющих. Это приведет к недооценке превалентности или инцидентности. Низкая специфичность, с другой стороны, означает, что некоторые люди будут ошибочно отнесены к разряду лиц, имеющих эту болезнь. Это приведет к переоценке превалентности или инцидентности. В обоих случаях возникнет ошибка классификации (разновидность информационной (или связанной с измерением) систематической ошибки). Направление ошибки зависит от того, чего больше: ложноположительных или ложноотрицательных результатов. Количество этих ложных результатов определяется и чувствительностью, и специфичностью, а также количеством людей с заболеванием и без него в популяции. Количество ложноположительных результатов – это ложноположительный показатель, умноженный на количество людей, не имеющих заболевания, а количество ложноотрицательных результатов – это ложноотрицательный показатель, умноженный на количество лиц с заболеванием. Если метод измерения обладает одинаковой чувствительностью и специфичностью в обеих группах – т.е. если его достоверность(валидность) не различается – то такая ошибочная классификация называется недифференцированной. То есть при этом ошибка классификации будет одинаковой (не различаться, не дифференцироваться) в сравниваемых группах. При сравнении двух групп с помощью метода, специфичность и чувствительность которого одинаковы в обеих группах, ошибочная классификация всегда уменьшит разницу между этими группами. Под дифференцированной ошибочной классификацией – понимают последствия применения в сравниваемых группах тестов с разной валидностью (чувствительностью, специфичностью или и тем, и другим). Если чувствительность и специфичность теста различны в сравниваемых группах, то смещение может быть любой направленности. При этом истинное различие между группами обследуемых может быть искусственно занижено, завуалировано или увеличено, или может изменяться его направление; может быть выявлено различие, которого нет Кафедра эпидемиологии ММА им. И.М.Сеченова 62 на самом деле. Ошибочная классификация может также проявляться по-разному при использовании одного и того же теста, если, по какой-либо причине, его валидность различна в сравниваемых группах. Воспроизводимость теста. Воспроизводимость (repeatability) теста – это его способность одинаково измерять какие-либо явления, процессы, состояния в серии повторных измерений. Абсолютно одинаковые оценки, каких-либо параметров здоровья, при повторных обследованиях встречаются относительно редко. Причины (различий вариабельности) показателей связаны с истинной (объективной, биологической) и с субъективной вариабельностью. Истинная вариабельность результатов связана с особенностями процесса жизнедеятельности организма обследуемого. Известно, что даже у здоровых лиц, многие показатели варьируют в течение небольшого промежутка времени между исследованиями. Субъективная вариабельность объясняется погрешностями персонала или погрешностями теста (техники). Как сильно могут влиять погрешности персонала на вариабельность результатов, наглядно показывает проверка умения измерять АД на специальных тренажерах, задающих определенные и постоянные параметры АД. Практически всегда, лица, не прошедшие специальную тренировку, по-разному измеряли заданные параметры АД. Даже у одного врача в серии измерений получались существенные варьирующие результаты. Еще больший разброс результатов измерения одного признака, наблюдается при применении разных технических средств, например разных аппаратов измерения АД. Субъективная вариабельность порождает случайные и систематические ошибки измерений. Для оценки степени воспроизводимости теста проводят серию испытаний с изучением вариабельности полученных результатов. Чтобы свести к минимуму субъективную вариабельность, соответствующий персонал, участвующий в проведении эпидемиологического исследования, должен быть тщательно подготовлен. Подготовка персонала, прежде всего, предусматривает его обучение особенностям использования соответствующих стандартизованных методов. Обучение должны проводить высококвалифицированные специалисты. Окончательная проверка и закрепление полученных навыков происходит при применении выбранного метода обследования в отношении специально подобранной группы лиц. «Специально подобранные» в данном случае означает, что они по набору индивидуальных характеристик будут сходны с теми, кого предстоит обследовать в планируемом эпидемиологическом исследовании. Кроме обучения технике метода, персонал должен быть, если это необходимо, подготовлен относительно стандартных условий применения метода, например, температуры помещения, положения тела обследуемого, его физической активности и т.д. Субъективная вариабельность бывает особенно велика, когда погрешности персонала соединяются с погрешностями метода (теста). Кафедра эпидемиологии ММА им. И.М.Сеченова 63 Креатинин ммоль/л 120 110 100 90 80 70 Эталлонный результат 60 1 2 3 4 5 6 № лаборатории 7 8 9 10 Рис. 5.4. Концентрация креатинина в одной порции крови по результатам 10 шведских лабораторий, проанализировавших одну и ту же пробу 16 раз. Источник: А.Альбом, С Норелл. «Введение в современную эпидемиологию» 1996. На рис. 5.4. продемонстрированы результаты биохимического анализа на концентрацию креатинина в крови. Как следует из представленных данных, большинство лабораторий завышают результаты по сравнению с эталоном. При этом в лабораториях № 8 и 9 отмечается большой разброс полученных результатов. Результаты проведенного исследования показывают, как важно стандартизировать методики теста и условия его проведения. Поскольку от результатов теста зависит постановка диагноза, валидность тестов может существенно повлиять на результаты эпидемиологического исследования. Валидность теста. Чувствительность, специфичность и воспроизводимость теста определяют его достоверность или валидность (validity). Достоверность или валидность отдельного теста означает: способность теста дать истинную оценку тех параметров организма индивидуума или окружающей среды, которые необходимо измерить; То есть достоверный (валидный) тест должен измерить то, что требуется измерить и ничего более. Это относиться не только к лабораторным исследованиям, а в равной мере касается и методов опроса, которые должны содержать только необходимые для диагностики вопросы; соответствие данных отдельного теста объективным симптомам болезни и данным анамнеза; согласованность данных одного теста с данными традиционных лабораторных тестов. К сожалению, точная оценка составляющих валидности и ее самой в целом, чаще всего, представляет значительные трудности или невозможна. При проведении эпидемиологических исследований следует твердо придерживаться правила не изменять валидность применяемых методов. В противном случае, уменьшение или увеличение валидности приведет к значительной вариабельности результатов и, как следствие, к ошибочным выводам. Кафедра эпидемиологии ММА им. И.М.Сеченова 64 В заключение отметим, что неполная и недостоверная информация, независимо от объективных или субъективных обстоятельств ее получения, не может служить оправданием низкого качества выводов данного исследования. Скрининг Скрининг (просеивание, screening), - обследование (чаще всего - массовое) лиц, считающих себя здоровыми, с целью выявления у них не распознанного ранее заболевания. Скрининг также применяют для выявления у здоровых лиц факторов риска, (в основном факторов риска хозяина) например, курения, вредных пищевых привычек, пограничных результатов лабораторного обследования и т.д . Скрининг осуществляется помощью скрининговых тестов, которые, как и любые тесты могут проводиться: в виде опроса, физикального обследования (например, осмотра кожных покровов, пальпации отдельных органов и т.д.), лабораторного исследования и других методов. Несмотря на общность цели необходимо различать: скрининг как профилактическое мероприятие, и в этом случае он не имеет отношения к проведению эпидемиологических исследований скрининг как метод, применяемый в эпидемиологических исследованиях. Чаще всего скрининг используется как профилактическая мера и в этом случае после выявления лиц подозрительных на заболевание, назначается их дальнейшее тщательное обследование и при необходимости лечение. В противном случае применение скрининговых тестов как профилактической меры не имеет смысла. Во многих странах скрининг как мера профилактики предусматривает периодическое обследование людей, которое проводится преимущественно в медицинских учреждениях по возрастным показаниям, с учетом наиболее частой патологии в соответствующем возрасте и принадлежности обследуемого к определенной группе риска. Ценность скрининга, проводимого в профилактических целях определяется его влиянием на показатели заболеваемости, временной потери трудоспособности, инвалидности, смертности и соотношением экономических затрат и экономической выгоды. В эпидемиологических исследованиях скрининг является не профилактической мерой, а используется как элемент организации исследований, а именно: в проспективных когортных исследованиях при формировании когорты и в процессе наблюдения за ней; в исследованиях случай- контроль при формировании контрольной группы из здоровых лиц, или при формировании контрольной группы из больных другой - не изучаемой в данном исследовании болезни; в одномоментных исследованиях скрининг обеспечивает оценку распространенности какой-либо болезни. В зависимости от численности обследуемых лиц, от их профессиональной или иной индивидуальной характеристики, в зависимости от набора используемых скрининговых тестов, различают: массовый скрининг – например скрининг всего населения населенных пунктов, или скрининг выборок большой численности; целенаправленный скрининг – оценку состояния здоровья отдельных контингентов, выделенных по индивидуальным признакам, таким как пол, возраст, раса, профессия, социальное положение и т.д., или населения, выделенного по признаку состоявшегося воздействия фактора риска среды; многопрофильный скрининг – оценку состояния здоровья с использованием набора скрининговых тестов, для выявления нескольких заболеваний; Кафедра эпидемиологии ММА им. И.М.Сеченова 65 поисковый скрининг,– обследование скрининговыми тестами лиц уже имеющих известную патологию, на предмет выявления другой болезни. Поскольку, обследуются уже больные лица, такой скрининг называют оппортунистическим. К любым скрининговым тестам предъявляются определенные требования, в частности: чувствительность, специфичность и воспроизводимость; валидность; простота исполнения и низкая стоимость; безопасность; приемлимость для обследуемого лица; эффективность (как профилактического мероприятия). Понятия чувствительности, специфичности и валидности скрининговых тестов, аналогичны этим же понятиям, относящимся к диагностическим тестам, уже описанным в этой главе. При проведении скрининга необходимо учитывать низкую распространенность большинства болезней. При этом, после выявления больных, среди обратившихся к врачу, распространенность данной болезни среди оставшихся здоровых лиц, становится еще меньше. Именно поэтому скрининговые тесты должны, прежде всего, иметь высокую чувствительность, чтобы не пропустить оставшиеся редкие случаи болезни. Но эти тесты должны быть и высокоспецифичны, чтобы не получить большое число ложноположительных результатов. При повторных скринингах, особенно если они проводятся с небольшим интервалом, число выявленных больных будет снижаться, поскольку в последующих скринингах, будут, в основном, выявляться новые (свежие) случаи болезни. Оценка достоверности (валидности) скринигового теста проводится с помощью все той же таблицы «два на два» Хотя формулы чувствительности, специфичности и других характеристик скринингового и диагностического теста одинаковы, оценка этих параметров для скринингового теста отличается, поскольку нет другого скринингового теста, принимаемого за «золотой стандарт». Ориентировочная оценка скринингового теста проводится по результатам (наличие/отсутствие болезни), полученным с помощью клинического обследования, проведенного сразу же после обследования скрининговым тестом. Окончательная оценка проводится двумя способами: путем наблюдения за обследованными лицами в течение определенного периода времени (например, один год). Затем при заполнении таблицы «два на два» к числу больных, выявленных во время скрининга, прибавляются случаи болезни, выявленные в течение года, у лиц с отрицательными результатами теста. Такая оценка предполагает, что эти больные были не выявлены во время скрининга, поскольку тест дал ложнопололожительные результаты; путем сравнения результатов скрининга с заболеваемостью среди населения, не подвергавшегося скринингу. Идеальный скрининговый тест должен быть валидным, прост в исполнении и относительно дешев – как, например, целенаправленный опрос, или измерение артериального Задача 1 Адаптировано из книги Дж. Х. Абрамсон, З.Х. Абрамсон «Осмысление эпидемиологических данных» Кафедра эпидемиологии ММА им. И.М.Сеченова 66 Болезнь Д – распространенное заболевание, вызываемое действием фактора Т. Оно характеризуется продолжительным бессимптомным периодом, после чего наступает прогрессирующее расстройство функции центральной нервной системы, которое приводит к неспособности без посторонней помощи заниматься повседневной деятельностью. Диагноз можно поставить как, до так и после манифестации симптомов, с помощью точных, но дорогостоящих и трудоемких тестов. В исследовании, где использовался более простой новый тест, произвольно названный тест А, показатель распространенности этого заболевания в популяции составил 18.4 на 100. Валидность теста А оценивали, применяя его у 100 пациентов с болезнью Д и у 400 людей, у которых, как было известно, эта патология отсутствовала; при этом было получено 80 положительных результатов в 1-ой группе и 8-во 2-ой. 1 2 3 4 5 6 Представьте результаты оценки теста А в виде таблицы 2 на 2. Рассчитайте чувствительность и специфичность, ложноположительные и ложноотрицательные показатели этого теста. (см. приложение) Какая еще информация о тесте А Вам необходима, прежде чем пользоваться этими данными? Если тест, используемый для определения распространенности болезни, обладает низкой чувствительностью, как это повлияет на показатель распространенности? Если тест имеет низкую специфичность, как это повлияет на показатель распространенности? Предложите как рассчитать показатели распространенности, которые будут получены при применении теста А в городах П. и г К. с населением 10000 в каждом, где истинные показатели распространенности равны 21% и 7%, соответственно. В соответствии с истинными показателями распространенности в П и К, отношение показателей распространенности равно 3. Если для расчета этого отношения будут использованы показатели распространенности, полученные в результате применения теста А, то каким будет это отношение: таким же, ниже или выше? Задача 2 Доктор В., будучи неудовлетворенным результатами теста А, предложил новый тест для выявления болезни Д. Этот тест, названный в честь разработчика тестом В, обладает чувствительностью 99% и специфичностью 86%. Теперь для определения распространенности болезни в городе К. используется тест В, и его результаты сравниваются с результатами теста (при использовании теста А) в городе П.; последний показатель, равен 18.4%, а показатель истинной распространенности в г. П в 3 раза больше, чем в г. К. Задание 1 Оцените ожидаемые результаты сравнения болезни распространенности болезни Д. в городе. П. (тест А) и в городе К. (тест В). Сделайте предположение о величине отношения показателя распространенности в городе П. к показателю распространенности болезни Д. в городе К. 2 Рассчитайте ожидаемые результаты оценки распространенности болезни Д. в городе К. (истинная распространенность болезни Д. в г. К. 7%, население 10000). Рассчитайте отношение показателей болезни Д. в городе П. (тест А) и К. (тест В). Задача 3 Оцените достоверность диагностических тестов в следующих исследованиях: 1 Сравнение инцидентности шизофрении в двух странах на основе диагнозов, выставленных психиатрами в историях болезни. 2 Исследование связи патологии сетчатки и диабета, на основании клинических исследований пациентов с диабетом и без такового. Кафедра эпидемиологии ММА им. И.М.Сеченова 67 Исследование эффективности вакцинации от определенного заболевания на основании сравнения частоты новых случаев болезни среди вакцинированных добровольцев и невакцинированных людей. 4 Исследование эффективности нового лечения болей во время менструаций, в котором сторонники этого лечения опрашивали пациенток о постоянстве симптомов после случайного их разделения на две группы – одну, где женщин лечили новым методом (о чем пациентки не знали), и другую, где пациенток продолжали лечить обычным методом. 5 Исследование связи между воздействием препаратов для ингаляционного наркоза и специфическим заболеванием с иммунодефицитом, с помощью теста на наличие этого заболевания со специфичностью 100%, но чувствительностью только 60%. 6 Исследование связи между заболеванием старческой деменцией и уровнем образования путем определения этого заболевания при помощи простых тестов для изучения познавательной функции (общие знания и интеллектуальные способности) 7 Исследование связи между лихорадкой в начальном периоде беременности и врожденными аномалиями, в котором матерей детей, родившихся с дефектами и матерей здоровых детей опрашивали о болезнях в период беременности. 8 Исследование влияния курения на физическое состояние, в котором курящих сравнивали с людьми, бросившими курить. 9 Исследование эффективности интенсивной образовательной программы по гигиене, в которой ответы школьников, охваченных программой, на вопросы, моют ли они руки перед едой, сравнивали с ответами таких же детей, но не охваченных данной программой. 10 Исследование, в котором для изучения того, является ли ревматоидный артрит семейным заболеванием, пациентов с этим заболеванием и контрольную группу спрашивали о том, был ли артрит у их родителей. 11 Исследование, в котором изучали связь между острыми респираторными заболеваниями и патологией опорно-двигательного аппарата на основе анализа диагнозов, поставленных пациентам в стационаре. 12 Исследование различий между странами в распространенности желчнокаменной болезни, на основе грубых данных всех аутопсийных исследований, опубликованных с начиная с 1890 г. (Brett и Barker, 1976). 3 Кафедра эпидемиологии ММА им. И.М.Сеченова 68 Задача 4 Для выявления болезни Д предлогается два теста –тест А (чувствительность 80%, специфичность 98%) и тест В (чувствительность –99%, специфичность – 86%). Задание 1. Определите тест, который лучше подходит для проведения скрининга. 2. Какая дополнительная информация (кроме чувствительности и специфичности) необходима при выборе скринингового теста? Задача 5 В таблице представлены ожидаемые применения результаты теста А для выявления болезни Д. в городе г. П. Ожидаемые результаты Теста А(чувствительность 80%, специфичность 98%) при его применении для выявления болезни Д в городе П. (истинная распространенность 21%) Наличие болезни Результат теста Есть Нет Всего Положительный 1680 158 1838 Отрицательный 420 7742 8162 Всего 2100 7900 10000 Задание 1. Используя эти данные, рассчитайте прогностическую значимость положительного теста, прогностическую значимость отрицательного теста, количество положительных тестов на выявленный случай и общее количество тестов на выявленный случай. (См приложение) 2. Рассчитайте эти же показатели для теста А, но используя его ожидаемые результаты в г. М, где распространенность болезни Д– только 1%, а не 21% как в г. А. Вам следует построить таблицу, основываясь на знании того, что показатель распространенности равен 1%, чувствительности - 80%, а специфичности – 98%. Оцените полученные результаты. Задача 6 Ожидаемые результаты Теста А(чувствительность 80%, специфичность 98%) при его применении для выявления болезни Д в городе П.(истинная распространенность 21%) Наличие болезни Результат теста Есть Нет Всего Положительный 1680 158 1838 Отрицательный 420 7742 8162 Всего 2100 7900 10000 Задание Оцените: 1 Вероятность того, что у представителя данной популяции (до тестирования) болезнь Д. ? Оцените шансы в пользу этой болезни (предтестовые шансы)? 2 Вероятность наличия у обследуемого этой болезни, если результат тест А, положителен? Вероятность наличия у обследуемого этой болезни, если результат тест А отрицателен (посттестовые вероятности)? Оцените соответствующие шансы (посттестовые шансами)? 3 Насколько целесообразно использование теста А в клинической практике в г. П? Кафедра эпидемиологии ММА им. И.М.Сеченова 69 Формулы перевода вероятности в шансы и наоборот Шансы = вероятность/ (1-вероятность ); Вероятность = это шансы/(1+шансы). Задача 7. Сведения о тесте А (чувствительность 80%, специфичность 98%) представлены в другом виде следующей таблице: Вероятность положительных и отрицательных результатов у лиц с Болезнью Д и при ее отсутствии при использовании Теста А * отношение вероятности определенного результата среди лиц с заболеванием к соответствующей вероятности у лиц без заболевания Задание Объясните представленные данные (См. приложение) Используя результаты оценки теста А для выявления болезни Д в г. П. полученные в задании 6. Умножьте предтестовые шансы на отношения правдоподобия для положительного и на отношения правдоподобие для отрицательного результата и сравните ответы с посттестовыми шансами. Оцените полученные результаты Кафедра эпидемиологии ММА им. И.М.Сеченова 70 СЕМИНАР № 6 Систематические обзоры. Метаанализ. Вопросы для обсуждения 1. Определение, характеристика и назначение систематических обзоров Зачем они нужны? Как их делают? Где их найти? Кто их использует? Что их результаты означают для врача и пациента? 2. Аспекты практического применения принципов доказательной медицины. 3. Отличие систематических обзоров от обзоров литературы 4. Принципы отбора исследований для систематических обзоров 5. Источники исследовательских данных (доказательств) 6. Примеры систематического подхода 7. Этапы составления систематического обзора 8. Понятие мета-анализ 9. Определение показателей результатов исследований, используемых в практике метаанализа 10. Представление результатов мета-анализа Доказательная медицина (evidence-based medicine) — это раздел медицины, основанный на доказательствах, предполагающий поиск, сравнение, обобщение и широкое распространение полученных доказательств для использования в интересах больных (Evidence Based Medicine Working Group, 1993). Термин «evidence-based medicine» впервые был предложен в 1990 г. группой канадских ученых из Университета Мак Мастера в Торонто. В буквальном переводе «медицина, основанная на фактах» либо, что более точно отражает значение термина, «научнообоснованная медицинская практика», или «научно-доказательная медицина». Доказательная медицина — это новый подход, направление или технология сбора, анализа, обобщения и интерпретации научной информации. Предусматривает добросовестное, объяснимое и основанное на здравом смысле использование наилучших современных достижений для лечения каждого пациента. Основная цель внедрения принципов доказательной медицины в практику здравоохранения — оптимизация качества оказания медицинской помощи с точки зрения безопасности, эффективности, стоимости и др. значимых факторов. В научно обоснованной медицине принятие решений опирается только на достоверные факты. Достоверный факт - это надежное и объективное подтверждение принципа или процедуры. При рассмотрении результатов исследования как достоверного факта особое внимание необходимо обращать на качество исследования, которое во многом зависит от заранее определенного плана, схемы исследования. Корректная схема (структура) исследования позволяет свести к минимуму предвзятость и получить объективные результаты. Основной акцент при этом делается не на интуицию или на общепринятую практику, а на беспристрастную, объективную оценку научного факта. В связи с этим огромное значение приобретают стандарты качества информации и критическая ее оценка. Многие врачи полагают, что они в своей практике ориентируется на реальные научные факты. В действительности, большинство клиницистов при принятии решений полагается на интуицию или Кафедра эпидемиологии ММА им. И.М.Сеченова 71 на общепринятую практику. Не зная принципов отбора и не имея некоторых основных навыков, качественную информацию отобрать трудно. Вместе с тем в практической деятельности желательно использовать только полезные вмешательства, а из полезных те, которые дают наибольшую пользу, причем наибольшую пользу на единицу затрат. От того, насколько убедительны научные данные в отношении клинической и стоимостной эффективности, зависит правильность размещения финанансовых средств. Естественно, что наиболее эффективно направлять эти ресурсы на развитие методов профилактики, диагностики и лечения, практическая польза которых подтверждена исследованиями, удовлетворяющими критерия научнообоснованной медицинской практики. Именно доказательная медицина способствует решению проблемы сравнения, стандарта в оценке результатов лечения, профилактики, диагностики, принятия клинических и управленческих решений. КОМУ И ЗАЧЕМ ЭТО НУЖНО? Ни один практический врач не обладает достаточным опытом, позволяющим свободно ориентироваться во всем многообразии клинических ситуаций. Можно полагаться на мнения экспертов, авторитетные руководства и справочники, однако это не всегда надежно из-за так называемого эффекта запаздывания — перспективные терапевтические методы внедряются в практику спустя значительное время после получения доказательств их эффективности. С другой стороны, информация в учебниках, руководствах и справочниках зачастую устаревает еще до их публикации, а возраст проводящего лечение опытного врача отрицательно коррелирует с эффективностью лечения. Эти заключения были получены с помощью основного статистического инструмента доказательной медицины — метаанализа. Основные тенденции развития биомедицинских наук определяют следующие факторы: глобализация информационных процессов; большое количество проводимых биомедицинских исследований; широкий спектр лекарственных средств (ЛС) на фармацевтических рынках; увеличение потока медицинской информации (издается около 40 000 биомедицинских журналов, публикующих примерно 2 млн статей ежегодно) остро стоит проблема рационального расходования средств в системе здравоохранения. Эти основные тенденции определяют следующие потребности практической медицины: необходимость критической оценки информации, предназначенной для практических врачей и руководителей здравоохранения; выбор системных подходов для принятия решений в медицине (лечебных, диагностических, управленческих и др.). Следовательно, существует необходимость обобщения биомедицинских знаний и широкого информирования медицинской общественности о результатах новейших исследований. ОБЛАСТЬ ПРИМЕНЕНИЯ Потенциальные возможности применения принципов доказательной медицины в практике здравоохранения — значительны. В первую очередь, их применение позволяет использовать объективные критерии ко всем аспектам фармакотерапии. Принципы доказательной медицины дают возможность с учетом новейшей и достоверной информации оптимизировать влияние на принятие решения таких во многом субъективных факторов, как интуиция и квалификация врача, мнения авторитетных экспертов, рекомендации популярных руководств и справочников. Таким образом, доказательная медицина предполагает объединение индивидуального клинического опыта врача с наилучшими доступными независимыми клиническими доказательствами из Кафедра эпидемиологии ММА им. И.М.Сеченова 72 систематизированных исследований. При этом принципы доказательной медицины позволяют разрабатывать наиболее эффективные, безопасные и экономичные современные терапевтические стратегии, которые могут быть реализованы на государственном, региональном, популяционном, субпопуляционном и индивидуальном уровнях, способствуя выбору оптимального варианта в каждом конкретном клиническом случае. Остановимся на некоторых аспектах практического применения принципов доказательной медицины. Прежде всего они применимы для повышения качества оказания медицинской помощи: это разработка клинических рекомендаций для практических врачей и внедрение систем стандартизации в здравоохранение. Клинические рекомендации для практических врачей позволяют усовершенствовать работу врача в отношении следующих аспектов: определение задач, стоящих перед врачом; описание заболевания (этиология, распространенность, клиническая картина и т.д.); алгоритмы диагностических процедур (программа обследования, показания и противопоказания к назначению диагностических манипуляций); лечение (тактика, описание конкретных ЛС и лечебных мероприятий, критерии эффективности и прекращения лечения); осложнения, прогноз, показания к госпитализации, диспансерное наблюдение и др. Внедрение систем стандартизации в здравоохранении: сфера обращения ЛС; разработка и применение медицинской техники; разработка формулярной системы (протоколы ведения и лечения больных); разработка и использование протоколов в страховой медицине; определение относительной ценности различных источников информации применительно к поиску ответа на клинические вопросы. ДОСТОВЕРНО ИЛИ НЕТ? Важным аспектом доказательной медицины является определение степени достоверности информации: результатов исследований, которые берут за основу при составлении систематических обзоров. Центр доказательной медицины в Оксфорде разработал следующие определения степени достоверности представляемой информации: A. Высокая достоверность — информация основана на результатах нескольких независимых клинических испытаний (КИ) с совпадением результатов, обобщенных в систематических обзорах. B. Умеренная достоверность — информация основана на результатах по меньшей мере нескольких независимых, близких по целям КИ. C. Ограниченная достоверность — информация основана на результатах одного КИ. D. Строгие научные доказательства отсутствуют (КИ не проводились) — некое утверждение основано на мнении экспертов. Согласно мнению Шведского совета по методологии оценки в здравоохранении, достоверность доказательств из разных источников не одинакова и убывает в следующем порядке: 1) рандомизированное контролируемое КИ; 2) нерандомизированное КИ с одновременным контролем; 3) нерандомизированное КИ с историческим контролем; Кафедра эпидемиологии ММА им. И.М.Сеченова 73 4) когортное исследование; 5) исследование типа «случай—контроль»; 6) перекрестное КИ; 7) результаты наблюдений; 8) описание отдельных случаев. СИСТЕМАТИЧЕСКИЙ ОБЗОР Персональный клинический опыт важен для формирования гипотез, но из-за фактора пристрастности и высокой подверженности к смещению оценок он не очень полезен для количественных оценок, хотя до введения контролируемых клинических испытаний основой фармакотерапии были именно персональные рекомендации. Сопоставление доказательств. Главный недостаток описательных обзоров – их подверженность к смещению оценок. Для минимизации смещения необходимо приблизить обзор к доступным доказательствам с помощью научно-систематического подхода, получившего название метаанализа и мощное развитие в работах Ассоциации Кохрана. Выполненный таким образом обзор Кафедра эпидемиологии ММА им. И.М.Сеченова 74 рассматривается как систематический и включает 6 основных этапов: Определение основной цели обзора. Определение способов оценки результатов. Систематический информационный поиск. Суммирование количественной информации. Суммирование доказательств с использованием подходящих статистических методов. Интерпретация результатов. Как и в любом научном исследовании, эти этапы фиксируются в протоколе. Систематический обзор - это разновидность научного исследования с заранее спланированными методами, где объектом изучения служат результаты ряда оригинальных исследований. Систематический обзор синтезирует результаты этих исследований, используя подходы, уменьшающие возможность систематических и случайных ошибок. В большинстве систематических обзоров используют статистические методы обобщения данных - мета-анализ. По мере поступления новых данных их выводы могут меняться. Систематический обзор – это структурированный процесс, включающий: – Правильно сформулированный вопрос – Полноценный и профессиональный поиск информации – Несмещенный (безошибочный) процесс отбора публикаций фактических данных из них – Критическая оценка данных – Синтез данных и извлечения Правильно сформулированный клинический вопрос- основа высококачественного систематического обзора. При плохо сформулированном вопросе обзор вряд ли будет достаточно информативным. Кроме того, четко сформулированный вопрос позволяет врачу быстро понять, применимы ли результаты обзора в его клинической практике. На основе такого обзора делаются соответствующие выводы: - вмешательство, несомненно, эффективно и его необходимо применять; - вмешательство неэффективно и его не следует применять; - вмешательство наносит вред и его следует запретить; - польза или вред не доказаны, требуются дальнейшие исследования. Систематические обзоры рассматривают результаты только хорошо спланированных научных исследований, которые проходят экспертизу на достоверность. Это в основном контролируемые проспективные (участников делят на группы, которые будут или не будут подвергнуты изучаемому вмешательству, до того как наступили исходы) исследования, с разделением больных на опытную (применяется новое лечение) и контрольную группы (применяется стандартное лечение). Слово "контролируемые" означает, что при организации испытаний действие посторонних факторов, способных повлиять на результат сравнения испытуемых методов, учтено (находится под контролем). Для того, чтобы средние показатели в обеих группах различались как можно меньше проводится рандомизация (англ. random - случайный). По этой причине научно-доказательная медицина не рассматривает обычные литературные обзоры в качестве надежных источников информации. Систематические обзоры проводят для того, чтобы найти ответы на определенные, часто довольно узкие клинические вопросы, в точной формулировке которых должны быть отражены следующие параметры: - определенная популяция и клиническая база (например, дети, амбулаторные больные); - изучаемое заболевание (например, бронхиальная астма); - используемый метод исследования или лечения (например, определенная лекарственная терапия); - один или более определенный клинический исход (например, частота присту- пов, качество жизни). Количественный систематический обзор литературы, или количественный синтез Кафедра эпидемиологии ММА им. И.М.Сеченова 75 первичных данных с целью получения суммарных статистических показателей называется метаанализом. Систематический обзор (systematic review, systematic overview) — особый вид научного исследования, выполненный по специально разработанной методике, объектом которого являются результаты других, оригинальных научных исследований. Анализ и обобщение результатов исследований, включенных в обзор, можно проводить с применением статистических методов и без них. Систематические обзоры позволяют провести адекватное обобщение результатов научных исследований. Целью систематического обзора является взвешенное и беспристрастное изучение результатов ранее проведенных исследований. Часто в систематическом обзоре проводится количественная оценка суммарного эффекта, установленного на основании результатов всех изученных исследований (метаанализ). Примечательна история одного из первых систематических обзоров. Результаты первого КИ, посвященного эффективности недорогого короткого курса кортикостероидов, который назначали беременным с высоким риском преждевременных родов, были опубликованы в 1972 г. Было установлено, что кортикостероиды снижают вероятность смерти новорожденных от осложнений, обусловленных недоношенностью. К 1991 г. были опубликованы сообщения еще о 7 КИ, посвященных той же теме, подтвердивших и уточнивших результаты первого КИ. Было доказано, что риск смерти у таких детей можно снизить на 30–50%. Схематическое изображение результатов этого исследования стало эмблемой Кокрановского Сотрудничества. Поскольку до 1989 г. не было опубликовано ни одного систематического обзора данных КИ, большинство врачей считали такую терапию неэффективной. Таким образом, прошло около 20 лет со времени публикации первых результатов исследования до широкого их внедрения в практику. По приблизительной оценке десятки тысяч детей пострадали и умерли от отсутствия необходимой терапии. Это впечатляющая иллюстрация необходимости внедрения принципов доказательной медицины в практику (The Cochrane Collaboration, 2001). Систематические обзоры — главный результат деятельности Кокрановского Сотрудничества — регулярно публикуются в электронном виде под названием «The Cochrane Database of Systematic Reviews» (Кокрановская база данных систематических обзоров). Основные характеристики систематического обзора приведены в таблице 1. Таблица 1. Цель Характеристики Ясность цели обзора Протокол, содержащий задачи исследования, описание объектов и методов исследования Избежать невключения в Исчерпывающие, чувствительные и обзор релевантных документированные стратегии исследования с исследований использованием библиографических баз данных, ключевых слов, возможно ручного поичка, возможно попытки включения неопубликованных исследований1, не ограниченных страной или языком. Избежать случайного Подробные и верифицированные критерии выбора выбора/исключения и исключения, разработанные для оценки исследований результатов исследования Тщательное Использование таблиц отбора данных с проверкой резюмирование данных их полноты исследований Оценить валидность Разработать и использовать критерии качества для результатов исследования оценки валидности исследований с помощью 1 депонированные рукописи, тексты диссертаций и т.п. Кафедра эпидемиологии ММА им. И.М.Сеченова 76 Оценить размер ассоциаций и источника разнообразия данныъ исследования Оценить качество2 результатов обзора Критическая оценка или повторение обзора Помочь читателю оценить применение обзора для нужд организаторов здравоохранения, практикующих врачей, исследователей оценки дизайна, проведения и анализа исследований с оценкой размера ошибки, смещений и шансов Обзор оснований почему результаты исследования могут ипсользовать различные соответствующие количественные модели для оценки роли таких факторов, как состояние пациента, дозы, продолжительности и природы вмешательства. Там где это возможно, иссследования объединяют для получения общего эффекта. Проверка чувствительности результатов выборов и предположений сделанных в обзоре, таких как критерии включения и валидности, которые влияют на исследование на метод, использованный для объединения данных Отчет о ключевых аспектах создания обзора, методах, анализе и результатах. Он должен включать резюме протокола , стратегию поиска, таблицу основных элементов каждого включенного исследования. Отчет может дополняться графическим описанием. Обсуждение методологических ограничений как в отношении первичных исследований так и обзора. Обеспечить использование доказательств исследования, в том числе путем разработки рекомендаций по применению результатов исследования. Преимущества систематических обзоров и синтетического подхода к анализу результатов исследований заключаются в следующем: помогают демократизировать научные исследования и сипользование их результатов, способсвуют большей открытости базы знаний, в том числе для общественности. Это может уменьшить значение «экспертов» как сосредоточения знаний, что в прошлом приводило к увеличению числа ошибок. предоставляет научной общественности бесценный источник информации, который позволяет обобщать накопленный в прошлом материал, упорядочивать новые материалы и разработать методологию определения тем и ключевых направлений научных исследований. Это позволяет обеспечить применение результатов исследований и проведение оценки теорий во всем мире. предоставляет возможность для исследователей определить основные пробелы в исследованиях, предлагать новые решения в рамках накопленных знаний и избежать ненужного дублирования исследований. предоставляет базу знаний для практикующих врачей и организаторов здравоохранения которые могут использовать обзоры для оценки эффективности различных форм и видов оказания медицинской помощи. содействуют кумулятивному развитию науки. Крайне редко исследование проводится на совершенно новой почве, мы стоим на плечах предыдущих исследований. помогают более ясно определить то, чего мы не знаем и степень неясности. Использование систематических обзоров не только позволяет получить лучшие результаты, но и повысить их качество и степень доверия к ним. 2 в оригинале robustness – здравость суждений Кафедра эпидемиологии ММА им. И.М.Сеченова 77 Наиболее авторитетными в области доказательной медицины считаются систематические обзоры Кокрановской библиотеки (Российское отделение http://www.cochrane.ru/cochrane/rus_otd.htm). К сожалению, подавляющее большинство статей и докладов из области практической медицины, которые публикуются у нас в стране, к доказательной медицине имеют очень слабое отношение. Часто группу больных подвергшихся новому методу лечения сравнивают с исторической контрольной группой или вообще отсутствует контрольная группа, неправильно проводится рандомизация или вообще не проводится, неадекватно применяются статистические методы, иногда исследователи (и докладчики) бывают экономически заинтересованы в определенных результатах. Различия между систематическими обзорами и обзорами литературы Все обзоры относятся к ретроспективным наблюдательным исследованиям и поэтому подвержены систематическим и случайным ошибкам. Соответственно качество обзора и, следовательно, его ценность зависят от использования при его проведении научных методов, снижающих до минимума эти ошибки. Это основное, что отличает традиционные обзоры литературы от систематических обзоров (табл. 2). Если обзор проведен согласно принципам, изложенным в правой колонке таблицы, более вероятно, что он будет систематическим и обеспечит наиболее объективные выводы. Если методы проведения обзора соответствуют приведенным в средней колонке, это скорее обзор литературы; вероятность того, что его выводы основаны на безошибочном объединении всех относящихся к данному вопросу данных, гораздо ниже. Таблица 2. Различия между обзорами литературы и систематическими обзорами Характеристика Освещаемые вопросы Источники данных и стратегия поиска Принцип отбора данных Обзор литературы Часто рассматривается широкий спектр вопросов Источники не всегда указаны, стратегия может быть ошибочной Не всегда указан, может быть ошибочным Методы оценки данных Различные Обобщение данных Часто качественное Выводы Иногда научно обоснованные Систематический обзор Часто посвящен определенному клиническому вопросу Источники обычно всеобъемлющи, а стратегия поиска точно изложена Отбор основан на определенных критериях, применяемых одинаковым образом Строгие, критические методы оценки Количественное (мета-анализ) Как правило, научно обоснованные Систематические обзоры проводят, чтобы найти ответы на определенные, часто довольно узкие клинические вопросы. В точной формулировке этих вопросов должны быть отражены 4 параметра: определенная популяция и клиническая база (например, пожилые амбулаторные больные), изучаемое заболевание (например, артериальная гипертония), используемый метод исследования или лечения (например, определенная лекарственная терапия), один или более определенный клинический исход (например, сердечно-сосудистая и цереброваскулярная заболеваемость и смертность). Пример хорошо сформулированного клинического вопроса — предотвращает ли лекарственное лечение артериальной гипертонии у пожилых больных инсульты и инфаркты миокарда и увеличивает ли оно продолжительность жизни? Если вопрос, на который обзор должен ответить, не ясен из названия, резюме и введения, или если не включен раздел с Кафедра эпидемиологии ММА им. И.М.Сеченова 78 описанием методов проведения обзора, статья, скорее всего, окажется обзором литературы, а не систематическим обзором. Большинство обзоров литературы чаще посвящены широкому диапазону проблем, связанных с данной темой, а не глубокому анализу конкретного вопроса. Например, обзор литературы по диабету (напоминающий главу из учебника) может содержать разделы по физиологии и патофизиологии обмена углеводов, жиров и белков; эпидемиологии диабета и прогнозу при нем; диагностическим и скрининговым методам; профилактическим, лечебным, реабилитационным и паллиативным вмешательствам. Таким образом, обзоры литературы наиболее полезны для получения широкого представления по теме; они гораздо менее полезны при поиске конкретного ответа на определенный клинический вопрос. Обзоры литературы хороши для описания истории развития вопроса и его решения, они могут лучше представить новейшие достижения, если проведенные исследования были немногочисленными, предварительными или не очень достоверными из-за недостатков в их организации или исполнении. Они могут быть особенно полезны для обсуждения данных в свете основной теории. В обзорах литературы допустимы аналогии, умозрительное объединение исследований в двух независимых областях (например, посвященных раку и синдрому приобретенного иммунодефицита) . Однако в таких обзорах связь между клиническими рекомендациями и фактами часто слабая, неполная, или — что еще хуже — основана на предвзятом цитировании определенных оригинальных исследований. В результате рекомендации в обзорах литературы, публикуемых в журналах или руководствах, часто отличаются от рекомендаций систематических обзоров. Например, обзоры литературы могут с опозданием на десятилетие рекомендовать методы лечения, эффективность которых доказана, или приводить доводы в защиту методов лечения, о которых уже давно известно, что они бесполезны или вредны. Кроме того, систематические обзоры, использующие количественные методы, скорее, чем обзоры литературы, позволят обнаружить небольшие, но клинически значимые эффекты лечения. Возможности и ограничения систематических обзоров Значение хорошо проведенного систематического обзора для практического врача трудно переоценить. Многие из нас перегружены объемом выпускаемой медицинской литературы и в результате часто предпочитают просматривать обзорные сообщения, а не публикации оригинальных исследований. Обзорные статьи позволяют нам оставаться на уровне современных знаний. Высококачественные систематические обзоры помогают определить границы известного и узнавать обо всех научно доказанных фактах. Отдельные исследования редко дают точные ответы на определенные клинические вопросы, а систематические обзоры могут помочь практическим врачам решать их. Критически анализируя первичные исследования, систематические обзоры помогают также выявить противоречия между результатами различных исследований. Количественно объединяя результаты нескольких небольших исследований, метаанализ позволяет делать более точные, разносторонние и убедительные выводы. Примером тому служит недавно опубликованный обзор, подчеркнувший благоприятное влияние ограничения белков в пище на прогрессирование заболеваний почек диабетической и иной этиологии. Кроме того, систематический обзор нескольких исследований помогает лучше определить, для каких подгрупп больных применимы полученные результаты. Систематические обзоры нужны и исследователям, так как позволяют суммировать существующие данные, усовершенствовать гипотезы, определять необходимые размеры выборки для исследования, помогают выработать план будущих исследований. Без этих обзоров исследователи могут пройти мимо многообещающих направлений или изучать уже решенные вопросы. Организаторам здравоохранения обзоры и другие обобщающие публикации необходимы для выработки политики оказания медицинских услуг, обеспечивающей оптимальные результаты при имеющихся ресурсах. Кафедра эпидемиологии ММА им. И.М.Сеченова 79 Систематические обзоры могут помочь в решении клинических проблем, но никогда не заменят клинического опыта. Врачи дают рекомендации конкретным больным, основываясь на аналогиях, опыте, логических построениях и теории, равно как и на научно обоснованных результатах исследований. Осведомленность об эффективности какой-либо терапии не заменит знания о том, как использовать ее для лечения конкретных больных. Научно обоснованные рекомендации могут привести к плохим практическим результатам, если применяются некритически или неосознанно. Структура принятия решений в медицине сложна; для этого требуется объединять воедино знания, навыки, морально-этические ценности и научно обоснованные факты при каждой встрече больного с врачом. Прошлое, настоящее и будущее систематических обзоров Распространенность обзорных статей быстро изменяется; число ежегодно издаваемых систематических обзоров увеличилось в прошлом десятилетии по крайней мере в 500 раз. Теперь часто можно встретить несколько систематических обзоров по одним и тем же или близким клиническим вопросам. Например, оценке влияния кальция на артериальное давление были посвящены недавно два мета-анализа, опубликованные в течение одного месяца. Хотя дублирующие друг друга независимые обзоры, в которых получены аналогичные результаты, позволяют относиться к ним с большим доверием, за это приходится расплачиваться сужением возможностей — они могут отвлекать исследователей от проведения необходимых систематических обзоров в других областях. Ситуация может стать еще более сложной, если в нескольких обзорах результаты похожи, а клинические рекомендации различаются; такое случилось с пятью мета-анализами по ведению больных в отделениях интенсивной терапии, изданными в течение 5 лет (причем два из них были опубликованы в одном выпуске одного и того же журнала). Разрешить разногласия между мета-анализами можно, проведя на высоком методологическом уровне новый систематический обзор, в котором будут синтезированы все существующие данные. За прошедшие 10 лет были разработаны методические рекомендации, помогающие критически оценивать и применять обзорные статьи. Схема интерпретации данных оригинальных исследований и создания систематических обзоров с использованием уровней доказательности и степени обоснованности рекомендаций была с успехом использована несколькими группами исследователей. На согласительных конференциях Американской коллегии пульмонологов по предотвращению тромбозов лечебные рекомендации обычно классифицируются согласно степени их научной доказательности — в зависимости от того, основаны ли они на результатах крупных, строгих, рандомизированных исследований, метаанализов, наблюдательных исследований или на мнении экспертов. Международное содружество ученых, названное Cochrane Collaboration, создано именно для того, чтобы помочь в подготовке, постоянном обновлении и распространении результатов систематических обзоров по лечебным вмешательствам. Библиотека Cochrane — первый крупномасштабный многодисциплинарный продукт этого сотрудничества. Она обновляется ежеквартально, и в январе 1997г. содержала 159 законченных систематических обзоров, подготовленных в рамках Cochrane Collaboration (еще 199 систематических обзоров готовятся к выпуску в настоящее время), более чем 1600 резюме других систематических обзоров, список более чем 110 000 контролируемых исследований и библиографию из 400 статей по методике подготовки систематических обзоров. Каковы перспективы систематических обзоров? Охват ими различных направлений медицины хотя и быстро расширяется, но все еще ограничен. Cochrane Collaboration работает в этом направлении, но оно нуждается в более активном участии и поддержке, чтобы действовать успешно. Исследования, посвященные науке синтеза данных, позволят повысить качество и ценность результатов, получаемых в систематических обзорах. Будут выработаны более эффективные методы проведения этих обзоров. Увеличится доступ к обзорам больных и руководителей здравоохранения, что будет побуждать врачей более активно искать, анализировать и применять результаты систематических обзоров в своей работе. Развитие информационных Кафедра эпидемиологии ММА им. И.М.Сеченова 80 технологий сможет обеспечить доступность информации прямо на месте оказания медицинской помощи, но практические врачи должны будут приобрести навыки использования такой технологии. Форматы представления данных станут более удобными и для медиков, и для больных. Будут созданы и повсеместно распространены практические методы включения информации из систематических обзоров в процесс выработки клинического решения. В ожидании этого прогресса врачи уже сейчас могут и должны пользоваться преимуществами систематических обзоров (табл. 2). Серия статей, публикуемая нашим журналом, поможет им в этом, демонстрируя, как находить, оценивать, использовать и проводить систематические обзоры в клинических, образовательных и исследовательских целях. Таблица3. Основные особенности систематических обзоров В систематических обзорах собираются, критически оцениваются и обобщаются результаты первичных исследований по определенной теме или проблеме. При подготовке систематических обзоров используются подходы, уменьшающие возможность систематических и случайных ошибок Систематические обзоры — аналитико-синтетические статьи; к ним относятся также экономические анализы, клинические рекомендации, анализы алгоритмов принятия клинических решений. Систематические обзоры помогают врачам быть в курсе современной информации, несмотря на огромное количество медицинских публикаций. Систематические обзоры могут помочь обосновать клинические решения результатами исследований, хотя сами по себе они не позволяют принимать решения и не заменяют клинического опыта. ПОИСК И АНАЛИЗ ДОКАЗАТЕЛЬНОЙ ИНФОРМАЦИИ Информационный поиск в области доказательной медицины требует от исследователя соответствующего опыта и использования системного подхода. Для успешного поиска необходимой информации по вопросам доказательной медицины большое значение имеют выбор доступных баз клинических данных (MedLine, Cochrane Library, Adonis и др.) и разработка адекватной методологии поиска (по ключевым словам или словосочетаниям, именам авторов и т.д.). Но даже при самом тщательном и квалифицированном поиске не всегда удается найти необходимую информацию о проведенных КИ (например, из-за некачественного индексирования или нежелания фирм-спонсоров публиковать отрицательные результаты КИ). Таким образом, данные некоторых необходимых КИ могут быть не охвачены. По этой причине при поиске доказательной информации компьютерный отбор необходимо дополнять другими методами поиска: «ручным» поиском информации о КИ, описание которых отсутствует в электронных базах данных; изучением списков литературы в найденных статьях; запросами исследователям и производителям ЛС. Для анализа доказательной информации используют такие специальные методы работы с информацией, как систематический обзор и метаанализ. МЕТААНАЛИЗ Метаанализ (meta-analysis) — применение статистических методов при создании систематического обзора (см. ниже) в целях обобщения результатов, включенных в обзор Кафедра эпидемиологии ММА им. И.М.Сеченова 81 исследований. Систематические обзоры иногда называют метаанализом, если этот метод применялся в обзоре. Метаанализ проводят для того, чтобы обобщить имеющуюся информацию и распространить ее в понятном для читателей виде. Он включает определение основной цели анализа, выбор способов оценки результатов, систематизированный поиск информации, обобщение количественной информации, анализ ее с помощью статистических методов, интерпретацию результатов. Метаанализ — это статистический метод, позволяющий объединить результаты независимых исследований. Чаще всего его используют для оценки клинической эффективности терапевтических вмешательств; для этого объединяют результаты двух и более рандомизированных контролируемых исследований. Информативность метаанализа зависит от качества систематического обзора, на основании которого он проводится. Качественный метаанализ предполагает изучение всех исследований, посвященных соответствующей проблеме, оценку неоднородности и определение информативности основных результатов путем анализа чувствительности. Существует несколько разновидностей метаанализа. Кумулятивный метаанализ позволяет построить кумулятивную кривую накопления оценок при появлении новых данных. Проспективный метаанализ — попытка разработки метаанализа планируемых испытаний. Такой подход может оказаться приемлемым в областях медицины, где уже существует сложившаяся сеть обмена информацией и совместных программ. На практике вместо проспективного метаанализа часто применяют проспективно-ретроспективный метаанализ, объединяя новые результаты с ранее опубликованными. Метаанализ индивидуальных данных основан на изучении результатов лечения отдельных больных. В ближайшем будущем метаанализ индивидуальных данных, вероятнее всего, будет ограничиваться изучением основных заболеваний, лечение которых требует крупномасштабных централизованных капиталовложений. Преимущества: получение достоверных результатов; устранение возможных ошибок; точность оценок; прозрачность. Сложности: выявление и отбор исследований; неоднородность представленной информации; вероятность потери важной информации; неадекватный анализ сравниваемых подгрупп; неадекватный анализ чувствительности метода. Главным требованием к информативному метаанализу является наличие адекватного систематического обзора. Результаты метаанализа обычно представляют в виде графика и отношения шансов (оdds ratio), суммарного показателя, отражающего выраженность эффекта. Почему мета-анализ? Если систематические обзоры предоставляют научные доказательства для внедрения результатов исследований в практику и принятия решений, в то время как мета-анализ является аналитической частью систематических обзоров. Ниже приведены основные черты, характерные для мета-анализа. (1) уточнение в протоколе исследования задач исследования, оцениваемых гипотез (как в области медицины, так и в области биологии), обзора материала и методов систематических обзоров, прежде чем исследования будут предприняты. (2) объединение всех доступных первичных исследований, включая информационный поиск, с четким описанием стратегии поиска и источников информации. Выбор исследований должен быть Кафедра эпидемиологии ММА им. И.М.Сеченова 82 основан на четких критериях, обоснованных протоколом исследования. (3) оценка методологического качества отобранных исследований (применение методов, снижающих ошибку). Оценка воспроизводимости исследований. (4) определение искомых результатов исследований, объяснение отличий, которые по возможности проводятся по каждому из первичных исследований. (5) Выбор и метод оценки результатов исследований, предмет исследований характеризуются в стандартизованной форме по первичной документации исследования с проверкой ошибки выборки. Процедура должна быть ясной, воспроизводимой и с минимальной статистической ошибкой. (6) Там где обзор и характеристики данных выполнены, мета-анализ (количественный синтез результатов первичных исследований) использует соответствующие методы и модели (ясно обоснованные) для того чтобы учесть при расчетах все возможные причины изменчивости признаков (например, различия качества исследований, участников, дозы, продолжительности и характера вмешательства, определения и измерений результатов). (7) Когда данные имеют значительный разброс, слишком низкое качество или высокую неоднородность, проведение мета-анализа представляет значительную сложность. (8) Обеспечение ясности результатов систематического обзора в отношении выборов и предположений проводится на всех стадиях анализа. В частности, в мета-анализе должны найти отражение: (a)влияние качества исследования/критерии включения (b) правдоподобие и возможное влияние статистических ошибок, (c) влияние различных моделей стратегии выбора и обеспечение реконструкции значений пропущенных данных в исследованиях с неполными результатами. (9) Ясное представление ключевых аспектов всех этапов анализа в отчете исследования, проведение критической оценки и обеспечение воспроизводимости. Эти данные могут быть представлены в виде специальной таблицы, включающей ключевые элементы каждого первичного исследования. Графическое представление результатов также может помочь в интерпретации и должно включаться там где это необходимо. (10) методологические ограничения как первичных исследований так и систематических обзоров должны быть оценены. Любые клинические или организационные рекомендаций должны быть практическими и исчерпывающими, и обеспечивать ясность доказательств на основании которых они сделаны. Предложения необходимых исследований должны включать клинические и методологические требования к этим исследованиям. Проблемы мета-анализа. Смещённые оценки. Существует несколько типов смещения оценок в мета-анализе. К первому типу относятся смещения из-за пристрастности к публикации положительных результатов в противовес отрицательным и был предложен статистический метод, позволяющий выявить смещение и устранить его из оценок. Более того, при анализе чувствительности суммарной оценки общепринято оценивать число испытаний с отрицательным результатом (индекс надёжности), которые потребовались бы для предотвращения любого наблюдаемого положительного результата. Другие типы потенциального смещения обусловлены: 1. незаконченностью информационного поиска; 2. неудачными критериями включения/исключения источников; 3. небрежностями изложения в оригинальных сообщениях. Можно показать, что этих проблем в систематических обзорах существенно меньше по сравнению с традиционными повествовательными аналогами. Объединение разнородных исследований. Критика мета-анализа исходит из того, что в нём “яблоки смешиваются с апельсинами ”, что даёт неинтерпретируемые результаты. Однако Кафедра эпидемиологии ММА им. И.М.Сеченова 83 грамотно выполненный в рамках систематического обзора мета-анализ должен преодолеть этот критицизм, поскольку его существенными этапами являются строгие критерии включения и тщательная интерпретация наблюдаемой разнородности. В самом деле, смешивание “слегка различающихся сортов цитрусовых” может существенно улучшить однородность выборки с помощью различных статистических методов. Включение неопубликованных данных. В мета-анализе основные усилия направлены на идентификацию всего набора испытаний в определённой области - опубликованных или неопубликованных. И хотя последние могут быть методологически слабыми, тщательная оценка качества обеих групп перед включением в мета-анализ устраняет этот недостаток. Действительно, в недавнем обзоре предположили, что подобный подход даст наиболее ценный синтез данных. “Золотой стандарт”. В качестве такого стандарта обычно рассматривается хорошо проведённое клиническое испытание соответствующего дизайна и размера выборки, организованное с целью оценки эффективности лекарственного средства. Когда результаты нескольких таких испытаний эффективности данного лекарства доступны для анализа, следующее из их анализа факты будут неоспоримыми, поскольку при таких условиях мета-анализ даёт наиболее точные оценки. Проблемы возникают при расхождении результатов между одним большим и группой более ранних и малочисленных исследований. Причины расхождения необходимо детально выяснить, не поддаваясь стремлению подытожить результаты в пользу большого исследования. КОКРАНОВСКОЕ СОТРУДНИЧЕСТВО Основой современной доказательной медицины является так называемое Кокрановское Сотрудничество — международная организация, целью которой является поиск и обобщение достоверной информации о результатах медицинских вмешательств. Составление систематических обзоров — весьма трудоемкая работа, требующая совместных усилий исследователей. Кокрановское Сотрудничество — наиболее активная организация, созданная с этой целью в 1992 г. Дж. Чалмерсом, в настоящее время насчитывающая около 3000 организацийучастников. Кокрановское Сотрудничество действует в виде сети сообщающихся центров в различных странах. Цель Кокрановского Сотрудничества — создать исчерпывающий регистр всех рандомизированных КИ, необходимых для составления систематических обзоров. 1973 г. — английский эпидемиолог Арчи Кокран (Cochrane A.L.) составил первый систематический обзор. 1992 г. — открыт первый Кокрановский центр в Оксфорде. ПРИНЦИПЫ КОКРАНОВСКОГО СОТРУДНИЧЕСТВА За годы, прошедшие с момента образования, Кокрановское Сотрудничество претерпело значительные изменения, не отступив при этом от провозглашенных задач и принципов. Основная задача этой международной организации — создание, обновление и распространение систематических обзоров результатов медицинских вмешательств, которые должны облегчить заинтересованным лицам принятие решений в различных областях медицины. Кокрановское Сотрудничество основано на 8 принципах: дух сотрудничества; энтузиазм участников; отсутствие дублирования в работе; минимизация предвзятости и систематических ошибок; Кафедра эпидемиологии ММА им. И.М.Сеченова 84 постоянное обновление данных; актуальность обзоров; доступность обзоров; постоянное повышение качества работы. КОКРАНОВСКИЕ ЦЕНТРЫ Кокрановские центры поддерживают деятельность подразделений Кокрановского Сотрудничества. Профиль каждого центра определяется с учетом интересов его участников и уровнем финансирования, но все они должны координировать свои действия и оказывать поддержку Кокрановскому Сотрудничеству. Кокрановские центры облегчают работу всех, кто намерен составлять систематические обзоры по отдельным областям клинической медицины и системы здравоохранения в целом. Условием такого сотрудничества является публикация в Кокрановской базе данных систематических обзоров, распространяемых также на компакт-дисках (The Cochrane database of systematic reviews, 1995) и в сети Интернет. Получить такую информацию можно, например, воспользовавшись услугами сервера Московского центра доказательной медицины и фармакотерапии: http://evbmed.fbm.msu.ru/index-r.html и официальным сайтом Российского отделения Кокрановского Сотрудничества: http://www.cochrane.ru МЕЖДУНАРОДНЫЕ ПРОБЛЕМНЫЕ ГРУППЫ ПО СОСТАВЛЕНИЮ СИСТЕМАТИЧЕСКИХ ОБЗОРОВ Международные проблемные группы по составлению систематических обзоров занимаются составлением и обновлением Кокрановских обзоров. В помощь членам проблемных групп Кокрановское Сотрудничество подготавливает обучающие материалы, а Кокрановские центры и в отдельных случаях сами проблемные группы проводят семинары. При обучении лиц, участвующих в проведении Кокрановских обзоров, по возможности используются примеры реально проведенных исследований. В работе групп участвуют исследователи, врачи, представители организаций потребителей — все, кто заинтересован в получении надежной, современной и актуальной информации в области профилактики, лечения и реабилитации при различных заболеваниях. МУЛЬТИДИСЦИПЛИНАРНЫЕ ГРУППЫ Отдельные мультидисциплинарные группы организованы для анализа и обобщения данных, относящихся к различным клиническим разделам медицины и областям медицинской деятелности. КОКРАНОВСКИЕ РАБОЧИЕ ГРУППЫ ПО МЕТОДОЛОГИИ ОБЗОРОВ При составлении обзоров применяют специальные методы компиляции, оценки и обобщения результатов испытаний. Эти методы разрабатывают члены Кокрановских рабочих групп по методологии обзоров, призванных поддерживать на должном уровне доказательность и точность систематических обзоров. Например, в одной из методологических групп была разработана высокоэффективная унифицированная стратегия ручного поиска публикаций в журналах, которую используют проблемные группы по составлению обзоров. Усилиями методологов из разных рабочих групп создана и постоянно совершенствуется компьютерная программа Review Manager (RevMan) для планирования, подготовки, анализа и представления результатов систематических обзоров. ГРУППЫ ПО ОБЛАСТЯМ ИНТЕРЕСОВ Кафедра эпидемиологии ММА им. И.М.Сеченова 85 Группы по областям интересов — это Кокрановские подразделения, объединенные не по нозологическим формам, а по таким аспектам медицины, как условия оказания медицинской помощи (например, догоспитальной), оказание помощи определенным группам больных (например, старческого возраста), различные уровни медицинской помощи (например, сестринский уход) или по определенному типу вмешательств (например, по физиотерапии). Работает отдел координации различных обзорных групп по интересам и сетям (например, потребительская сеть). КОКРАНОВСКАЯ ЭЛЕКТРОННАЯ БИБЛИОТЕКА Чтобы обеспечить единую методологическую основу и единый электронный формат для Кокрановских обзоров, создана Кокрановская электронная библиотека. Для этого разработано специальное программное обеспечение — программа RevMan. Завершенные обзоры и протоколы обзоров, а также информация, полученная от подразделений Кокрановского Сотрудничества (центров, групп по областям интересов, рабочих групп по методологии обзоров, Кокрановской сети потребителей и др.), регулярно пересылаются в главную базу данных Кокрановского Сотрудничества. Именно из этой, непрерывно обновляемой базы данных отбираются Кокрановские обзоры и информация о деятельности Кокрановской Ассоциации для публикации в Кокрановской электронной библиотеке. Кокрановская электронная библиотека состоит из четырех отдельных баз данных. Кокрановская база данных систематических обзоров содержит завершенные обзоры и протоколы готовящихся обзоров. Кокрановский регистр контролируемых испытаний представляет собой библиографическую базу данных всех выявленных публикаций контролируемых испытаний. Реферативная база данных обзоров по эффективности медицинских вмешательств содержит структурированные рефераты тех систематических обзоров, которые прошли критическую оценку сотрудниками Йоркского Центра по составлению и распространению обзоров (Великобритания) либо сотрудниками журналов «American College of Physicians’ Journal Club» и «Evidence-Based Medicine». Кокрановская база данных по методологии обзоров представляет собой библиографию статей, посвященных методам синтеза и анализа результатов клинических исследований. В Кокрановскую электронную библиотеку также включены: учебное пособие по методологии составления систематических обзоров, словарь методологических и специфических терминов, принятых в организации, адреса проблемных групп и других подразделений Кокрановского Сотрудничества. Кокрановский подход является основой развития идей доказательной медицины. В настоящее время органы управления здравоохранением и страховые организации промышленно развитых стран, принимая большинство своих решений, руководствуются заключениями и рекомендациями Кокрановского Сотрудничества. АЛГОРИТМ ОЦЕНКИ НАУЧНОЙ ПУБЛИКАЦИИ Определите тип исследования Укажите способ формирования опытной и контрольной групп (вид выборки) По разделам статьи НАЗВАНИЕ Информативно ли название? Отражает ли оно тему статьи (не больше и не меньше)? Является ли оно терминологически точным? Ясны ли отношения между компонентами названия? Является ли название достаточно кратким? Кафедра эпидемиологии ММА им. И.М.Сеченова 86 Есть ли в названии «балласт» (слова, которые ничего не добавляют)? Нет ли ненужного многословия? Элегантно ли название? Стоят ли определения рядом с определяемым словом? Нет ли в названии грамматических ошибок? АБСТРАКТ Укажите вид абстракта (индикативный или информативный, структурированный или неструктурированный) Присутствуют ли следующие части: Вопрос, для ответа на который проводилось исследование Что проделано Что установлено Какие выводы сделаны Даны ли в абстракте цифры (там, где это необходимо)? Можно ли понять абстракт, не обращаясь к полному тексту статьи? Нет ли в абстракте лишней информации (то есть информации, которая необязательна в абстракте, или информации, не относящейся к исследованию)? Отвечает ли абстракт требованиям по объему? ВВЕДЕНИЕ Устроено ли введение по принципу воронки? Начинается ли введение на уровне, соответствующем уровню гипотетического читателя (не слишком общо и не слишком конкретно)? Является ли фоновая информация относящейся к делу? Конкретно ли сформулирована гипотеза или основной вопрос исследования? Создает ли введение адекватные ожидания, соответствующие теме исследования? Преподнесена ли общая проблема (пробел в знаниях) во введении и достаточно ли близко к его началу? Что является основной отличительной чертой (чертами) исследования по сравнению с другими, более ранними исследованиями? Способно ли введение привлечь и удержать внимание гипотетического читателя? МАТЕРИАЛЫ И МЕТОДЫ Описывает ли этот раздел, что было проделано? Ясно ли построение исследования? Четко ли описаны материалы/испытуемые/выборка? Все ли методы описаны точно и правильно? Понятна ли последовательность этапов работы (например, схема лечения, процесс измерения)? Все ли описания выстроены в логичном порядке, а именно: Построение исследования Материалы/испытуемые/выборка (тип выборки) Процедуры (действия) Методы анализа и статистической обработки Кафедра эпидемиологии ММА им. И.М.Сеченова 87 Удобен ли формат читателю? Используются ли подзаголовки? Если да, соответствуют ли они тексту? Если нет, не стоит ли их добавить? Используются ли рисунки или таблицы? Если да, достаточно ли они информативны? Если нет, не стоит ли их добавить? Понимаете ли вы, почему исследование проводилось так, как описано? РЕЗУЛЬТАТЫ Представлены ли результаты в последовательности, логически отвечающей на вопрос исследования? Представлены ли данные в таблицах, схемах, на фотографиях или рисунках? Если нет, не стоит ли их таким образом представить? Если да, выбраны ли оптимальные средства представления данных? Адекватно ли используется текст при графических средствах презентации (для интерпретации и прояснения данных, а не для их повтора)? Согласуются ли между собой цифровые значения, несколько раз повторяющиеся в этом разделе (в виде текста и в графическом виде) и повторяющиеся в других местах текста (например, в разделе «Обсуждение»)? Сообщаются ли в этом разделе результаты только данного исследования? Упоминается ли метод при каждом результате и результат при каждом методе? ОБСУЖДЕНИЕ Обсуждается ли в этом разделе исследование? Отвечает ли этот раздел на вопрос исследования? Описывает ли этот раздел, как это исследование помогает решить общую проблему, описанную во «Введении»? Какой вывод (выводы) представлен в этом разделе? Обоснованы ли выводы всей организации и структурой данной работы? Достаточно ли близко к началу раздела дается ответ на вопрос исследования? Каков порядок подачи доказательств: преподносятся ли самые сильные доказательства в первую очередь? Имеется ли четкая связь между вопросами обсуждения и изысканиями работы? Достаточно ли умело интегрирована новая и ранее имевшаяся информация (включая исторические материалы)? Возникает ли к концу ощущение завершенности? Создает ли способ подачи информации правильную перспективу? Какие темы вводятся в начале и в конце этого раздела? Уделено ли обсуждению более важных проблем больше места, чем обсуждению менее важных? Если в тексте обсуждаются второстепенные вопросы, делается ли это в середине раздела и с достаточной краткостью? Объективно ли представлены данные, вступающие в противоречие друг с другом (или данными более ранних исследований), и ограничения данного исследования? Четко ли проведена грань между фактами и мнениями авторов? Кафедра эпидемиологии ММА им. И.М.Сеченова 88 Абстракты (рефераты) Как правило, автор пишет абстракт в последнюю очередь, уже после написания самой работы, когда все, что ему хочется – это закончить с данной темой и заняться чем-то другим. Автора можно понять, но можно понять и запросы читателя – ведь во многих случаях абстракт оказывается единственной версией статьи, с которой он когда – либо ознакомится. Существует две основные категории абстрактов: индикативный (указательный) и информативный (описательный). Индикативные абстракты «указывают» и «перечисляют» цель, масштаб и методологию работы. Они могут быть эквивалентны содержанию. Их может написать человек, не имеющий никакого отношения к самой работе. Индикативные абстракты называют еще критическим абстрактом, поскольку как правило он содержит комментарии относительно масштаба работы и оценку ее качества, т.е. они указывают на то, что именно достигнуто авторами рукописи. В отличие от него, информативный (описательный) абстракт содержит информацию о том, что было проделано и каким образом, но они также включают ключевые результаты, выводы и рекомендации, которые следуют из проделанной работы, отчетом о которой является статья. В свою очередь информативные абстракты могут быть структурированными и неструктурированными. Структурированные абстракты включают в очень сжатом виде все основные разделы статьи (введение, цель, материалы и методы, результаты и обсуждение). В эпоху информационного взрыва, когда наблюдается резкое увеличение потока медицинской информации (издается около 40 000 биомедицинских журналов, публикующих примерно 2 млн статей ежегодно) востребованы именно информативные абстракты. При этом предпочтение отдается структурированным абстрактам. МОДУЛЯРНЫЙ (СТРУКТУРИРОВАННЫЙ) ВИД ИНФОРМАТИВНОГО АБСТРАКТА (из программы конференции EIS) Введение: В июне 1997 года FETP проинформировали об увеличении числа лиц с подозрением на брюшной тиф в районах Багонг Байан, Даснарикас, Кевит. Багонг Байан - район поселения возвратившихся беженцев. Источник питьевой воды - скважина глубокого залегания, вода из которой поступает в цистерну. Вода из цистерны подается в некоторые дома. В большинстве домов индивидуальное водоснабжение; однако, некоторые семьи покупают воду у соседей. Методы: От местного центра здравоохранения получен линейный список случаев заболевания брюшным тифом. Проведено исследование на группе больных и контрольной группе. Случаем подозрения на брюшной тиф считался больной с нормальным самочувствием накануне повышения температуры в течение минимум 5-ти дней и по крайней мере одним из следующих симптомов: головная боль, общее недомогание, запор, дискомфорт в брюшной области и диаррея. Подтвержденным случаем брюшного тифа считался больной с подозрением на заболевание и с положительным анализом крови или мазка из прямой кишки на Salmonella typhi. В контрольную группу вошли лица аналогичного возраста с нормальным самочувствием из домов, не подвергшихся заражению. Больные и контрольная группа проинтервьюированы по единому опроснику. И больные, и контрольная группа сдавали анализ культуры из прямой кишки, анализ крови сдавали только больные с повышенной температурой. Проделано экологическое исследование. Взяты образцы воды из нескольких кранов и из цистерны, проведен бактериологический анализ образцов. Результаты: Всего было 239 случаев подозрения на брюшной тиф. Возраст больных - от 1 до 81 года (средний возраст 12 лет). Был один летальных исход (CFR 0.4%). Salmonella typhi. высеяна в 34 анализах крови и в 8-ми анализах культуры из прямой кишки. В исследование вошли 123 больных и 123 человека в контрольной группе. Было обнаружено, что покупка воды (СР 5, 95%ИУ Кафедра эпидемиологии ММА им. И.М.Сеченова 89 2-14, р<.01) и хранение воды (СР 8, 95%ИУ 2-39, р<01) являлись фактором риска для заболевания брюшным тифом. Кипячение воды (СР 0.09, 95% ИУ 0.02-0.40, р<01) и использование льда домашнего изготовления (СР 0.4, 95% ИУ 0.2-0.8, р<01) явились адекватными мерами защиты от заражения. Пищевые продукты фактором заражения не являлись. Экологическое исследование показало несоответствие с санитарно-гигиеническими нормами. Обнаружены повреждения водопроводных труб, проходящих в канале для сброса отходов. При анализе образцов воды на среде РНС 18 образцов из 23 (78%) оказались содержащими колиформные бактерии. Обсуждение: Вспышка брюшного тифа в Багонге Байане вызвана заражением питьевой воды. Недостаточная обработка сточных вод и неудовлетворительное состояние подводящих труб водопровода привело к загрязнению питьевой воды. Определенную роль сыграли плохие санитарные условия хранения и транспортировки воды. В районе проведена кампания IEC по усилению санитарно-гигиенического контроля. Кампания IEC и немедленная починка протекающих труб водопровода в сочетании с хлорированием воды привели к тому, что вспышка была приостановлена на ранних стадиях. С этого времени хлорирование воды производится постоянно. (Несколько меньше 500 слов) ИНФОРМАТИВНЫЙ (ОПИСАТЕЛЬНЫЙ) АБСТРАКТ (из журнала "Анналс ов Интернал Медисин") Неспецифическая лимфома (в отличие от болезни Ходжкина) встречается редко в качестве позднего осложнения невыясненного происхождения после лечения болезни Ходжкина. В настоящем исследовании изучена возможная роль вируса Эпштейна-Барра в патогенезе таких вторичных злокачественных образований по линии В-клеток. У двух больных в возрасте 25 и 43 лет развилась лимфома высокой степени через 12 и 8 лет, соответственно, после радиотерапии, назначенной для лечения болезни Ходжкина. Серологические анализы больных свидетельствуют о наличии острого (в первом случае) и ранее перенесенного (во втором) инфицирования вирусом Эпштейна-Барра. Анализ молекулярной гибридизации в опухолевых тканях больных показал наличие множественных клеточных эквивалентов генома вируса. Эти результаты позволяют предположить, что вирус Эпштейна-Барра может являться неотъемлемой частью патогенеза неспецифической лимфомы по линии В-клеток, которая возникает у больных после лечения болезни Ходжкина. (Около 125 слов) ИНФОРМАТИВНЫЙ (ОПИСАТЕЛЬНЫЙ) АБСТРАКТ (из программы конференции EIS) У 33-х из 187 новорожденных, поступивших в отделение интенсивной терапии новорожденных (ОИТН) 3-го уровня на 47 мест за период с 1-го января по 15 июня 1989 года, во время пребывания в ОИТН возник некротический энтероколит (НЭК). У двадцати из 33-х (61%) симптомы наступили между 1 апреля и 15 июня, на основании чего можно предположить о наличии кластера заболеваний в этот период. Исследование с группой больных и контрольной группой (аналогичных по весу при рождении, примерной дате поступления в ОИТН и примерному сроку пребывания в ОИТН) показало, что возникновение НЭК никак не связано ни с энтерическим кормлением, ни с гипоксией в перинатальный период по количеству баллов по шкале Апгара и по протеканию родов, ни с наличием отдельных микроорганизмов. Существенная корреляция была установлена между возникновением НЭК и переливанием компактных красных клеток (соотношение риска [СР] = 15.5, с 95%-ным интервалом уверенности [ИУ] = 2.59-92.51). Кроме того, некоторая умеренная, но достаточно значимая корреляция была установлена между возникновением НЭК и терапией кафеином (СР = 5.67, 95%-ный ИУ = 0.98-32.65), теофиллином (СР = 4.50, 95%-ный ИУ = 0.48-62.76) и фуросемидом (СР = 4.50, 95%-ный ИУ = 0.37-54.4). Эти Кафедра эпидемиологии ММА им. И.М.Сеченова 90 изыскания позволяют предположить, что затруднение гемостаза по объему -возникающее в результате переливания компактных клеток, использования мочегонных средств или потребности в мочегонных средствах - может оказаться важным фактором для возникновения НЭК. (Около 175 слов) АБСТРАКТ (не принят в программу конференции EIS) Сообщения о случаях неблагоприятной реакции на медицинские препараты (НРМП) служат сигналом для потенциально представляющих большую важность и ранее неизвестных факторов риска, сопряженных с употреблением фармацевтических препаратов. В последние годы изменились правила проведения санэпиднадзора в FDA, что обеспечивает возможности комплексного анализа и оперативных действий. В 1985 году получено около 30 000 спонтанных сообщений о НРМП; из них 90% посредством фармацевтических компаний-изготовителей. Около 25% этих сообщений включали информацию о госпитализации или смерти. Почти в 20% случаев речь шла о новых химических соединениях. Будет представлен анализ по классам препаратов. Будет проделан обзор работы по обработке и использованию этих сообщений о НРМП. (меньше 100 слов) ПРИМЕЧАНИЕ: ВЫ ПОМНИТЕ ЗОЛОТОЕ ПРАВИЛО НАПИСАНИЯ АБСТРАКТОВ ИСКЛЮЧИТЬ НЕПРАВИЛЬНОЕ ПОНИМАНИЕ. ВОЗЬМИТЕ ТАКЖЕ НА ВООРУЖЕНИЕ ЭТОТ АБСТРАКТ, КАК ПЛОХОЙ ПРИМЕР - "ПЛАСТМАССОВЫЙ СТАНДАРТ" НАПИСАНИЯ АБСТРАКТОВ. ИНДИКАТИВНЫЙ АБСТРАКТ (из журнала "Анналс ов Интернал Медисин") Коллагены, основной компонент межклеточной матрицы, являются близкородственными, но генетически различающимися между собой протеинами, благодаря которым ткани обладают физиологическим свойством эластичности. Последние достижения в области изучения нормальной биохимии и биологии коллагенов позволяют выделить различные уровни, на которых в структуру и метаболизм этого протеина может вкрасться ошибка. Теперь уже известно, что ряд приобретенных и врожденных заболеваний сопровождается выраженными аномалиями в функционировании коллагена. На конференции рассматривается ряд современеных открытий в области биохимии коллагена и освещаются некоторые комплексы заболеваний, для которых получена достоверная информация о молекулярных изменениях коллагена. (Около 100 слов) ТРЕБОВАНИЯ К АБСТРАКТАМ, ПРЕДЪЯВЛЯЕМЫЕ НАУЧНЫМИ ЖУРНАЛАМИ 1. Am J Dis Child не более 135-ти слов 2. AJPH 280 слов, 4 подзаголовка: "Задачи", "Методы", "Результаты", "Выводы" 3. Ann Intern Med 250 слов: (Оригинальное исследование: задача, построение, условия проведения, больные, вмешательства, измерения, результаты, выводы). Отдельный подзаголовок "Рецензии". 4. Can Med Assoc J 250 слов: (Оригинальное исследование: задача, построение, условия проведения, больные, Кафедра эпидемиологии ММА им. И.М.Сеченова 91 вмешательства, основные единицы измерения итогов, результаты, выводы). Отдельный подзаголовок "Рецензии". 5. JAMA To же, что в №4 — но с более подробными инструкциями. 6. J Infect Dis He более 150 слов. Указать цель, методы, результаты и выводы. "Авторам напоминается, что абстракты являются ключевым источником информации для пользователей компьютерных систем (например, ... "МЕДЛАЙН" ...)". 7. The Lancet Абстракт не оговаривается. Но "Исходите из того, что читатель практически ничего не знает о проблеме." 8. N Engl J Med He более 250 слов. 4 абзаца, озаглавленные "Базовые сведения", "Методы", "Результаты" и "Выводы". He больше одной страницы через два интервала. Подзаголовки: "Базовые сведения", "Методы", "Результаты", "Выводы". 9. EIS Conference Program (публикация CDC) Кафедра эпидемиологии ММА им. И.М.Сеченова 92