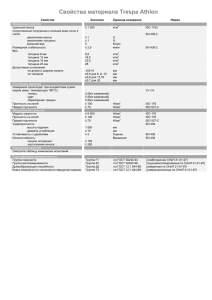
Сравнительный анализ требований стандартов ISO, GMP, НАССР
advertisement
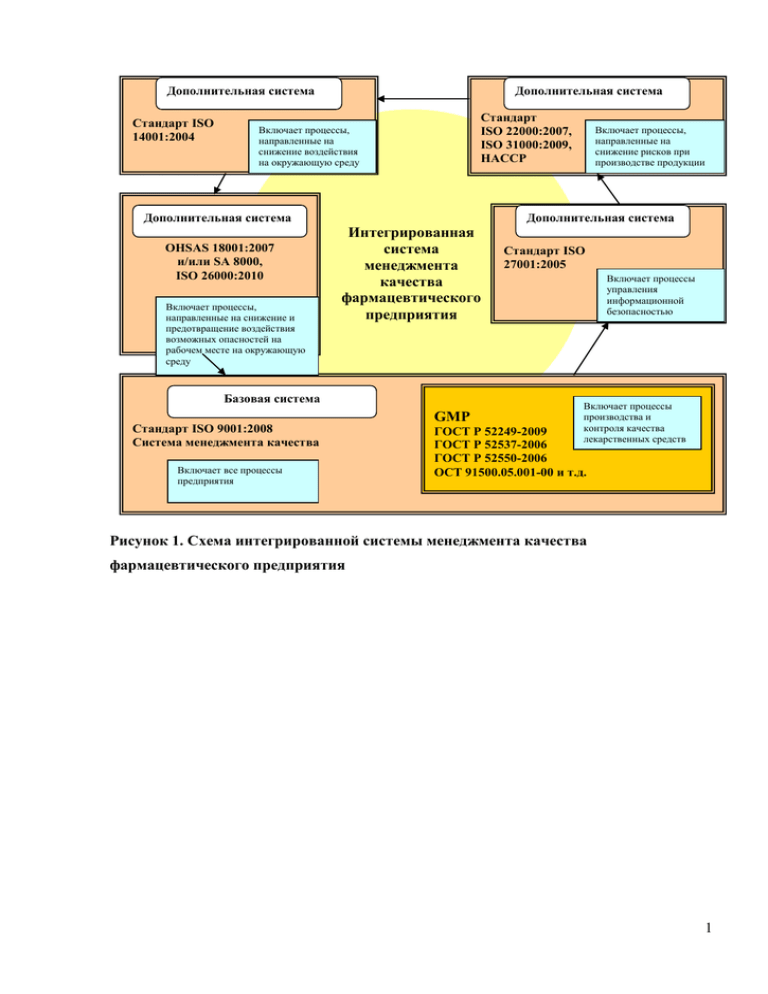
Дополнительная система Стандарт ISO 14001:2004 Дополнительная система Стандарт ISO 22000:2007, ISO 31000:2009, HACCP Включает процессы, направленные на снижение воздействия на окружающую среду Дополнительная система OHSAS 18001:2007 и/или SA 8000, ISO 26000:2010 Включает процессы, направленные на снижение и предотвращение воздействия возможных опасностей на рабочем месте на окружающую среду Включает процессы, направленные на снижение рисков при производстве продукции Дополнительная система Интегрированная система менеджмента качества фармацевтического предприятия Базовая система Стандарт ISO 9001:2008 Система менеджмента качества Включает все процессы предприятия GMP Стандарт ISO 27001:2005 Включает процессы управления информационной безопасностью Включает процессы производства и контроля качества лекарственных средств ГОСТ Р 52249-2009 ГОСТ Р 52537-2006 ГОСТ Р 52550-2006 ОСТ 91500.05.001-00 и т.д. Рисунок 1. Схема интегрированной системы менеджмента качества фармацевтического предприятия 1 Таблица 2. Сравнительный анализ данных стандартов, использующихся при разработке систем качества фармацевтического предприятия Сведения о стандарте Принципы Стандарты ISO 9000 В последней редакции документ содержит 4 тома: 1) Основные положения и словарь. 2) Требования. 3) Менеджмент для достижения устойчивого успеха организации. Подход на основе менеджмента качества Изложено в основных положениях в виде 8 принципов управления качеством: ориентация на потребителя; лидерство руководителя; вовлечение работников; процессный подход; системный подход; постоянное улучшение качества; принятие решений, основанных на фактах; взаимовыгодные отношения с поставщиками. ГОСТ Р 52249-2009 1 том. Настоящий стандарт идентичен Правилам производства лекарственных средств для человека и животных Европейского союза (ЕС Guide to Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use) по состоянию на 31.01.2009, за исключением приложения 20 Заложены 10 основных принципов в системе обеспечения качества: 1) все производственные процессы должны быть четко регламентированы и пересматриваться, должно быть показано, что они обеспечивают производство лекарственных средств в соответствии со спецификацией; 2) следует провести валидацию всех производственных процессов и их значительных изменений; 3) все средства выполнения требований GMP должны быть обеспечены: обученный персонал соответствующей квалификации; подходящие помещения и площади, соответствующее оборудование и системы обслуживания, необходимые исходные и упаковочные материалы, утвержденные инструкции и правила, соответствующие условия хранения и транспортировки; 4) все инструкции и правила должны быть наглядными, четкими и целенаправленными; 5) операторы должны быть обучены правильному выполнению инструкций; 6) протоколы удостоверяют соблюдение всех шагов процедуры и предполагаемое качество и количество продукции, отклонения протоколируются и расследуются; 7) все производственные протоколы, ИСО 22000-2007 1 том. В него входит разработка плана HACCP, валидация верификация и улучшение системы менеджмента безопасности пищевой продукции ГОСТ Р 51705.1-2001 1 том. Исходная информация для разработки системы НАССР, критические контрольные точки, критические пределы Система менеджмента безопасности пищевой продукции включает следующие общепризнанные ключевые элементы, позволяющие обеспечить безопасность пищевой продукции во всей цепи ее создания вплоть до стадии конечного употребления пищевой продукции в пищу: интерактивный обмен информацией; системный менеджмент; программы предварительных обязательных мероприятий; принципы НАССР (анализ рисков и критические контрольные точки Система НАССР должна разрабатываться с учетом 7 основных принципов: 1. Идентификация потенциального риска или рисков (опасных факторов), которые сопряжены с производством продуктов питания, начиная с получения сырья (разведения или выращивания), конечного потребления, включая все стадии жизненного цикла продукции (обработку, переработку, хранение и реализацию). 2. Выявление критических контрольных точек (ККТ) в производстве для устранения (минимизации) риска или возможности его появления. 3. В документах системы НАССР или технологических инструкциях следует установить и соблюдать предельные значения параметров для подтверждения того, что критическая контрольная точка находится под контролем. 4. Разработка системы мониторинга, позволяющая обеспечить контроль критических контрольных точек на основе планируемых мер или наблюдений. 5. Разработка корректирующих и предупреждающих действий и применение их в случае отрицательных результатов мониторинга. 6. Разработка процедур проверки, которые должны регулярно проводиться для обеспечения эффективности функционировании системы 2 включая документацию по реализации продукции, позволяют проследить историю каждой серии продукции, составленной в доступной и понятной форме; 8) порядок реализации лекарственных средств должен минимизировать любой риск для ее качества; 9) создана система отзывов любой партии продукции из торговой сети; 10) рекламации продукции тщательно расследуются, выясняются причины ухудшения качества и принимаются меры по предотвращению их повторения НАССР. 7. Документирование всех процедур системы, форм и способов регистрации данных, относящихся к системе НАССР 3 Таблица 3. История создания и внедрения правил GMP Эволюция GMP 1906 г. Закон о доброкачественности пищевых продуктов и медицинских препаратов. (США). Запрещение производства, продажи или транспортировки фальсифицированных или неправильно маркированных продуктов или лекарств в рамках межштатной торговли. Закон способствовал созданию одного из первых государственных контрольных органов в области производства пищевых продуктов и лекарственных средств, сейчас известного как FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов) и также разрешал конфискацию нелегальных (фальсифицированных) пищевых продуктов и лекарственных средств. Принятию этого закона способствовало выявление шокирующих фактов использования ядовитых консервантов и красителей при производстве пищевых продуктов; данные факты были освещены в прессе и представлены в романе Эптона Синклера «Джунгли» 1938 г. Закон Уилера – Ли. Закон о пищевых продуктах, медикаментах и косметике. Запрещение недобросовестных и обманных действий и приемов независимо от того, наносится ли при этом ущерб конкуренции; учреждение юрисдикции Федеральной торговой комиссии над рекламой пищевых продуктов и медикаментов. Впервые от компаний-производителей стали требовать подтверждения безопасности их продукции до ее появления в продаже. Данный закон существенно расширил полномочия FDA по надзору за косметическими препаратами и терапевтическим оборудованием, ввел инспектирование производств, порядок привлечения к судебной ответственности. Закон ужесточил стандарты на пищевую продукцию и разрешил в случае нарушения правил осуществлять принудительную остановку производства в качестве дополнительной карательной меры в дополнение к уже действующим конфискации продукции и уголовному преследованию 1944 г. Закон «О здравоохранении» решал большое количество проблем управления отраслью, в т.ч. в сфере регулирования биологических продуктов и контроля над инфекционными заболеваниями. Кроме того, в годы Второй мировой войны стала обязательной пакетная (групповая) сертификация отдельных видов препаратов. Данная сертификация обязывала компании предоставлять в FDA пробы из каждой выпускаемой партии продукции. После проведения анализа проб FDA выдавала разрешение на реализацию данной партии. Подобная практика началась в 1941 г. для инсулина и в 1945 г. для пенициллина, а затем распространилась на все антибиотики 1962 г. Поправка Кефаувера – Харриса к закону Уилера – Ли от 1938 г. (Закон о пищевых продуктах, медикаментах и косметике), предусматривающая проведение предварительных испытаний безопасности и эффективности медицинских препаратов и обязательное указание родовых названий медикаментов на ярлыках и этикетках. Данная поправка обязывала компании проводить клинические испытания на животных, прежде чем апробировать новые препараты на людях. Ответственность за эффективность препаратов, проходящих испытания, ложилась на исследователей. Производителям было предписано в обязательном порядке уведомлять людей, принимающих участие в исследовании, о факте его проведения и получать их официальное согласие перед употреблением тестируемого препарата. Теперь лекарства должны были подтверждать свою эффективность, прежде чем попасть на рынок. Производители были обязаны сообщать о 4 случаях выявления негативного побочного эффекта. Кроме того, с этого момента FDA получило полномочия регулировать рекламу рецептурных препаратов 1978 г. Утвержден окончательный вариант правил GMP для медицинских препаратов и медицинских аппаратов. Целью введения данных правил было обеспечение безопасности и эффективности всех видов продукции. «Правила… содержат минимум требований GMP к помещениям, методам производства и способам контроля над производством, обработкой и упаковкой препаратов с целью соответствия их требованиям безопасности, а также наличию у них заявленных характеристик эффективности и чистоты». 1979 г. Появление GLP (Правила организации и контроля качества лабораторных исследований). Данные правила «предназначены для проведения неклинических лабораторных исследований с целью получения в Управлении по санитарному надзору за качеством пищевых продуктов и медикаментов разрешений на продажу лекарств для людей и животных, пищевых добавок и красителей, медицинского оборудования и биопрепаратов, а также электронных устройств». Правила обеспечивают качество и достоверность полученных в ходе исследований данных 1983 г. Принятие конгрессом США Закона против отравителей-злоумышленников, превратившего вскрытие готовой продукции в уголовно наказуемое деяние. Ацетаминофеновая трагедия 1 оказала огромное влияние на всю индустрию. С этого времени во всем мире проводятся семинары и тренинги, чтобы убедиться, что сотрудники компаний-производителей осознают свою ответственность за выполнение своей работы. Сегодняшние реалии заставляют компании думать о том, как защитить свою продукцию от действий злоумышленников 1990 г. Опубликованы Предложения по внесению изменений в правила GMP лекарственных средств. В соответствии с окончательными правилами электронного учета необходимы механизмы контроля для обеспечения безопасности и точности всех используемых компьютерных систем 1992 г. Принятие конгрессом США Закона о дженериковых препаратах. Целью данного закона являлось внедрение практики отстранения и других наказаний за незаконные действия, касающиеся воспроизведенных препаратов (дженериков). Закон 1992 г. ставил перед собой цель пресечь взяточничество и мошенничество со стороны руководителей компаний – производителей дженериков, подкупающих сотрудников FDA 1991 г. В СССР была сделана попытка приведения российских правил в соответствие с международной практикой, введен стандарт РД 64-125-91 «Правила организации производства и контроля качества лекарственных средств (GMP)», утвержденный министром медицинской промышленности СССР 14 мая 1991 г. 1998 г. В России вступил в силу совместный приказ Министерства здравоохранения и Министерства экономического развития о введении в действие стандарта отрасли ОСТ 42-510-98 «Правила организации производства и контроля качества лекарственных средств», который устанавливал, что с 1 июля 2000 г. приемка в эксплуатацию вновь созданных и реконструированных предприятий – производителей лекарственных средств и фармацевтических субстанций, выдача этим предприятиям лицензий на производство, хранение и распространение продукции осуществляются лишь в случае соответствия стандарту GMP в его российском варианте 2004 г. Постановлением Госстандарта России от 10 марта 2004 г. №160-ст был утвержден ГОСТ Р 522492004 «Правила производства и контроля качества лекарственных средств». Российский стандарт GMP был подготовлен Ассоциацией инженеров по контролю микро загрязнений (АСИНКОМ) и гармонизирован 5 с правилами GMP (Good Manufacturing Practice for medicinal products) Европейского союза 2009 г. Приказом Федерального агентства по техническому регулированию и метрологии №159-ст утвержден ГОСТ Р 52249-2009 «Правила производства и контроль качества лекарственных средств». Он идентичен правилам GMP ЕС, кроме приложения 20 по анализу рисков Политика в области качества п. 5.3 ISO 9001:2008, Приложение В ГОСТ Р 52537-2006 п. 5.2 ISO 22000:2005 Ответственность руководства п. 5.5.1 ISO 9001:2008 п. 2.3-2.7 ГОСТ Р 52249-2009 п. 5.4 ISO 22000:2005 Персонал п. 6.2 ISO 9001:2008 п. 2 ГОСТ Р 52249-2009 п. 9 ГОСТ Р 52537-2006 п. 6.2 ISO 22000:2005 Оценка поставщиков, закупка п. 7.4 ISO 9001:2008 п. 5 ГОСТ Р 52537-2006 п. 5.25-5.34 ГОСТ Р 52249-2009 п. 7.3.3 ISO 22000:2005 Разработка и внедрение п. 7.3 ISO 9001:2008 п. 7 ISO 22000:2005 Производство п. 7.5 ISO 9001:2008 п. 5 ГОСТ Р 52249-2009 п. 6 ГОСТ Р 52537-2006 п. 7.3.5 ISO 22000:2005 Система качества фармацевтического предприятия Документация п. 4.2 ISO 9001:2008 п. 4 ГОСТ Р 52249-2009 ГОСТ Р 52550-2006 п. 4.2 ISO 22000:2005 Анализ рисков п. 11 ГОСТ Р 52537-2006 п. 1.5-1.6 ГОСТ Р 52249-2009 п. 7.6, п.7.4 ISO 22000:2005 Мониторинг и контроль п. 7.6,п.8.2 ISO 9001:2008 п. 1.3, п.6 ГОСТ Р 52249-2009, п. 7, п.10 ГОСТ Р 52537-2006 п. 8.3 ISO 22000:2005 Помещения и оборудование п. 6.3 ISO 9001:2008, п. 3 ГОСТ Р 52249-2009 п. 6.3 ISO 22000:2005 Самоинспекция п. 8.2.2 ISO 9001:2008, п. 9 ГОСТ Р 52249-2009, п. 13 ГОСТ Р 52537-2006 Работа по контрактам на производство продукции и проведение анализов п. 7 ГОСТ Р 52249-2009 Рекламации и отзыв продукции п. 8.3 ISO 9001:2008 п. 8 ГОСТ Р 52249-2009 п. 7.4.10 ISO 22000:2005 Измерение, анализ и улучшение п. 5.6, п. 8 ISO 9001:2008 п. 5.8, п. 8.4.3 ISO 22000:2005 Рисунок 2. Ключевые элементы системы менеджмента качества фармацевтического предприятия 6