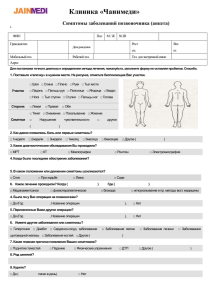
методические разработки, инфекционные болезни
advertisement

Вирусные зоонозы. Лихорадка Ласса. Ящур. Этиология. Эпидемиология. Патогенез. Клиническая картина. Осложнения. Дифференциальная диагностика. Лабораторная диагностика. Принципы лечения. Эпидемиологический надзор. Профилактические мероприятия 1. ЛИХОРАДКА ЛАССА (FEBRIS LASSA) Лихорадка Ласса—острая вирусная болезнь из группы зоонозов с природной очаговостью. Характеризуется тяжелым течением, высокой летальностью, тромбогеморрагическим синдромом, язвенным стоматитом, поражением органов дыхания, почек, центральной нервной системы, миокардитом. Этиология. Возбудитель относится к аренавирусам, семейство Arenaviridae, род Аrепаvirus, Имеет антигенное родство с другими аренавирусами (вирусом лимфоцитарного хориоменингита, возбудителями геморрагических лихорадок Южной Америки — вирусами Такарибе, Хунин, Мачупо и др.). Вирион сферической формы, диаметр 70-150 нм, имеет липидную оболочку, на которой расположены ворсинки нередко булавовидной формы длиной около 10 нм, содержит РНК. Вирус хорошо размножается в перевиваемой культуре клеток почки зеленой мартышки, на которых через 4-5 дней выявляется цитопатический эффект. Патогенен для белых мышей, морских свинок, некоторых видов обезьян. При внутримозговом заражении 25-30-дневных мышей отмечается гибель их на 5-6-е сутки. Возбудитель лихорадки Ласса относится к числу наиболее опасных для человека вирусов, работа с ним требует соблюдения строжайших мер предосторожности. Вирус длительно устойчив во внешней среде. Эпидемиология. В 1969 г. в городе Ласса (Нигерия) среди миссионеров возникло высококонтагиозное вирусное заболевание. В дальнейшем вспышки этой болезни наблюдались в Сьерра-Леоне, и Либерии. Существование очагов инфекции серологически доказано и в других странах Африки (Берег Слоновой Кости, Гвинея, Мали, Мозамбик, Сенегал и др.). Летальность достигала 36-67%. Резервуар инфекции —многососковая крыса (Mastomys natalensis), широко распространенная в Западной Африке. Характерна длительная персистенция вируса у инфицированных животных; он выделяется с мочой, слюной, обнаружен в секрете респираторного трактата. Сохраняется в высохших выделениях. Заражение человека может происходить алиментарным и воздушно-пылевым путем. Больной человек представляет большую опасность для окружающих. Вирус обнаружен в крови, в выделениях (кал, рвотные массы, моча), а также в капельках слюны. Заражение может происходить воздушно-капельным путем, а также при попадании на кожу крови или выделений больного; вирус проникает через микротравмы кожи. Так инфицируются медицинские работники, ухаживающие за больными, и работники лабораторий при исследовании материалов от больных. Выделение вируса больными может продолжаться до месяца и более. Не исключается возможность трансмиссивной передачи. Сезонность отсутствует. Возможны завоз лихорадки Ласса в другие страны (при переезде из очага инфекции во время инкубационного периода) и развитие там вспышки за счет контактной передачи инфекции. Патогенез. Ареновирусы лихорадки Ласса могут проникать в организм различными путями: через слизистые оболочки респираторного тракта и органов пищеварения, через микротравмы кожи при контакте с инфицированным материалом. Отчетливых изменений в области ворот инфекции не отмечается. Однако наличие выраженных поражений органов пищеварения (тошнота, рвота, понос) у одних больных и органов дыхания (пневмонии, отек легкого) у других, возможно, связано с местом внедрения возбудителя. " Характерная особенность лихорадки Ласса — генерализация инфекции с гематогенной диссеминацией вируса и поражением многих органов и систем. Прежде всего страдает сосудистая стенка, повышается ломкость сосудов, возникают глубокие расстройства гемостаза и развивается синдром диссеминированного 1 внутрисосудистого свертывания, как наиболее выраженное проявление тромбогеморрагического синдрома. Преобладание его в клинической картине и послужило основанием для отнесения лихорадки Ласса к группе геморрагических лихорадок. Кровоизлияния (чаще диффузного характера) наиболее выражены в кишечнике, печени, миокарде, легких и головном мозге. В результате обильной рвоты и диареи может развиться дегидратация с уменьшением объема циркулирующей крови, падением АД, нарушением функции почек и другими симптомами гиповолемического шока. Возможна острая печеночная недостаточность. Иногда развивается картина инфекционно-токсического шока. У переболевших лихорадкой Ласса в сыворотке крови определяются специфические антитела. В эндемичных местностях антитела обнаруживаются у 5-10% населения, тогда как только у 0,2% населения отмечались клинические признаки болезни. Это свидетельствует о возможности бессимптомного или легкого течения болезни, которые остаются невыявленными. Повторных заболеваний лихорадкой Ласса не наблюдается. Данных о длительности иммунитета нет. Симптомы и течение. Инкубационный период продолжается 3-17 дней. Продромальных симптомов нет. Заболевание начинается относительно постепенно. С каждым днем нарастает выраженность лихорадки и симптомов общей интоксикации. В первые дни больные отмечают общую слабость, разбитость, общее недомогание, умеренные мышечные и головные боли. Температура тела нарастает и через 3-5 дней достигает 39-40°С. Лихорадка может продолжаться 2-3 нед. Температура тела не снижается при назначении антибиотиков. Вечером температура тела существенно выше, чем утром, появление лихорадки постоянного типа прогностически неблагоприятно. Одновременно с лихорадкой нарастают и симптомы интоксикации (разбитость, астенизация, мышечные боли, расстройства сознания). Лицо и шея гиперемированы, иногда пастозны, сосуды склер инъецированы. В начальный период у большинства больных (80%) появляется характерное поражение зева. Обычно на 3-й день болезни на дужках миндалин и мягком нёбе отмечаются очаги некротически-язвенных изменений желтоватосероватой окраски, окруженные зоной яркой гиперемии. В дальнейшем число этих язвенно-некротических элементов увеличивается, они могут сливаться, налеты на язвах иногда напоминают фибринозные (дифтеритические) пленки. Выражены симптомы тонзиллита, задняя стенка глотки изменена меньше, язык сухой, обложен. На 5-й день болезни могут появиться боли в подложечной области, тошнота, рвота, обильный, жидкий, водянистый стул. Иногда развивается дегидратация (сухость кожи и слизистых оболочек, снижение тургора кожи, цианоз, понижение АД, олигу-рия, судороги). При тяжелых формах болезни на 2-й неделе резко усиливаются симптомы интоксикации, присоединяются пневмония, отек легкого, миокардит, расстройство кровообращения, отек лица и шеи, резко выраженный геморрагический синдром, в этот период возможен летальный исход. При объективном обследовании больного рано выявляется генерализованная лимфаденопатия, более выражено увеличение шейных лимфатических узлов. В конце 1-й недели появляется экзантема. Наряду с кровоизлияниями в кожу различных размеров отмечаются и другие элементы (розеолы, папулы, пятна), иногда сыпь напоминает коревую экзантему. Отмечается относительная брадикардия, а иногда и дикротия пульса, в дальнейшем при развитии миокардита брадикардия сменяется тахикардией. Границы сердца расширены, тоны сердца приглушены, АД понижено. Отмечаются одышка, кашель, колющие боли в боку, укорочение перкуторного звука, сухие и влажные хрипы, иногда шум трения плевры; рентгенологически выявляются инфильтративные изменения, нередко плевральный выпот. Выражены изменения органов пищеварения. Помимо рано появляющегося некротического фарингита, отмечаются боли в подложечной области, тошнота, рвота, урчание и боли в околопупочной области, водянистый обильный стул. Печень увеличена, болезненная при пальпации. Иногда развивается асцит. Со стороны нервной системы: сильная головная боль, менингеальные симптомы (при нормальном 2 составе спинномозговой жидкости), расстройства сознания, головокружение, шум в ушах; может наступить полная потеря слуха. В периоде реконвалесценции длительно сохраняется астенизация, наблюдается выпадение волос. При исследовании периферической крови лейкоцитоз со сдвигом лейкоцитарной формулы влево, тромбоцитопения, снижение содержания протромбина, повышается активность аминотрансфераз; положительная тимоловая проба, при почечной недостаточности повышается содержание мочевины в крови. При исследовании мочи характерна протеинурия (часто свыше 2 г/л), цилиндрурия. Осложнения: пневмонии, миокардиты, психозы. Диагноз и дифференциальный диагноз. Опасный характер болезни и необходимость организации и проведения строгих профилактических мероприятий делают особенно важной раннюю клиническую диагностику, так как результаты специфических методов исследований можно получить лишь в более поздние сроки. В начальном периоде болезни лихорадку Ласса необходимо дифференцировать от многих инфекционных болезней — брюшного тифа, стрептококковой ангины, дифтерии зева, пневмоний, вызванных пневмококками, легионеллами, хламидиями, риккетсиями, малярии, желтой лихорадки, геморрагической лихорадки Крым-Конго, кори, герпангины. Большое значение имеют эпидемиологические предпосылки (пребывание в эндемичной местности не более чем за 17 дней до развития болезни) и характерная клиническая симптоматика, в частности тяжелое течение, сочетание лихорадки, язвенно-некротических изменений глотки, рвоты, поноса, геморрагического синдрома, почечной недостаточности. Имеет значение отсутствие эффекта от антибиотиков, противомалярийных и других химотерапевтических препаратов, а также отрицательные результаты обычных бактериологических и паразитологических исследований. Диагноз подтверждается серологически при нарастании титров антител к вирусу Ласса в 4 раза и более. Используется метод непрямой флюоресценции антител или выявляются специфические антитела к вирусу Ласса (IgM). Диагноз лихорадки Ласса маловероятен, если к 14-му дню болезни антитела класса IgM отсутствуют. Выделение вируса лихорадки Ласса допустимо лишь в лабораториях, имеющих специальное защитное оборудование. Необходимо строго соблюдать меры защиты при работе с вирусо-содержащими материалами (кровь, моча и др.). Вирус можно выделить из патологоанатомического материала (печень, селезенка, почки, сердце). Лечение. Все больные подлежат госпитачизации и строгой изоляции. Для специфической терапии можно ввести 250-500 мл сыворотки или плазмы переболевших лихорадкой Ласса, взятой не ранее 2 мес после выздоровления. Эффективность серотерапии умеренная, а возможность получения подобной сыворотки может представиться очень редко. Перспективным является применение рибавирина (виразола). Из 20 больных лихорадкой Лаоса, которые получали рибавирин, выжили 19, из 16 больных, которым вводили иммунную плазму, выжили только 6, а из 18 больных, не получавших этиотропной терапии, выжили 7 человек. Виразол назначали по следующей схеме: вначале внутривенно вводили 2 г препарата, затем по 1 г через 6 часов в течение 4 дней, в последующие 6 дней — по 0,5 г через каждые 8 ч. В основном используются методы патогенетической терапии. Прежде всего необходимо добиться регидратации и устранения ацидоза. Для этого используют различные растворы (см. Холера). При развитии инфекционно-токсического шока проводят комплекс соответствующих терапевтических мероприятий. Назначают витамины (особенно аскорбиновая кислота и Р-витаминные препараты), под контролем свертывания крови назначают гепарин внутривенно 1000050000 ЕД в сутки. Прогноз для жизни серьезный. Болезнь протекает очень тяжело, летальность 3667%. Если больной не погибает в острый период, все проявления болезни постепенно стихают, наступает полное выздоровление без резидуальных явлений. 3 Профилактика и мероприятия в очаге. Лихорадка Ласса относится к особо опасным вирусным болезням. Необходимо строгое проведение профилактических мероприятий с учетом воздушно-капельного и контактного путей передачи. Больного изолируют в бокс, а при возможности в специальные пластиковые или стекляннометаллические кабины с автономным жизнеобеспечением. Персонал должен работать в защитной одежде. Для больного выделяют индивидуальные инструменты и посуду. Изоляция продолжается не менее 30 дней с начала заболевания, за контактировавшими наблюдение продолжается 17дней. Проводится заключительнаядезинфекция. ЯЩУР Ящур (aphtae epizooticae; синонимы: афтозная лихорадка, рыльно-копытная болезнь) — острая инфекционная болезнь из группы вирусных зоонозов, иногда передающаяся человеку при контакте с больными животными; характеризуется лихорадкой, интоксикацией, слюнотечением, появлением болезненных пузырьков и язв на слизистой оболочке рта и на коже пальцев рук. Этиология. Вирус ящура относится к семейству Picornavirinae, роду Picor-navirus типовому виду Picornavirus aphtae. По антигенным свойствам подразделяется на ряд серологических различных типов (А, О, С, CAT-I, САТ-2, САТ-3, «Азия-Ь). Каждый серологический тип имеет варианты (подтипы), всего их более 60. Частицы вируса ящура имеют сферическую форму диаметром 20-30 нм. Вирус ящура обладает высокой изменчивостью как в лабораторных, так и в естественных условиях, однако проявления болезни, обусловленные различными типами и вариантами, существенно не различаются. Вирус ящура культивируется на развивающихся куриных эмбрионах и различных культурах ткани. Вирус устойчив во внешней среде. В масле он сохраняется до 2 мес., в отрубях от 2 до 5 мес., в высохшей слюне (на шерсти животных, на одежде) от 1 до 3 мес. В замороженных тушах вирус сохраняется до 687 дней. Эпидемиология. Источником и резервуаром инфекции являются больные животные, особенно крупный рогатый скот, свиньи, овцы, козы, реже другие виды. Восприимчивы к ящуру и дикие животные (лоси, косули, северные олени, сайгаки и др.). Человек заражается ящуром чаще при потреблении сырого молока (свыше 60%) и при контакте с больными животными (около 30%). Заболевания от человека к человеку не передаются. Возможен механический перенос вируса ящура обслуживающим и ветеринарно-техническим персоналом (на обуви, одежде, на руках) и инфицирование здоровых животных. Патогенез. Воротами инфекции являются слизистые оболочки полости рта и желудочно-кишечного тракта, а также трещины и царапины кожного покрова. Нельзя исключить возможность инфицирования человека воздушно-капельным путем (при работе с вирусом в лабораторных условиях). В месте внедрения развивается первичная афта, или первичный аффект, затем вирус проникает в кровь и гематогенно распространяется по всему организму, фиксируясь в эпителии слизистых оболочек полости рта, языка, носа, уретры) и кожи кистей, особенно около ногтей в межпальцевых складках. Образуются вторичные афты и везикулезные элементы на коже. Массивное размножение вируса и его диссеминация сопровождаются резким повышением температуры тела (до 39—40° С) и симптомами общей интоксикации. При гистологическом исследовании биоптатов кожи и слизистых отмечалось скопление клеток в остистом слое, резко выраженная ацидофилия протоплазмы, клетки эпителия образуют вакуоли, в содержимом везикул обнаруживается огромное скопление вируса ящура. Симптомы и течение. Инкубационный период длится от 2 до 12 сут. (чаще 3—8 дней). Заболевание начинается остро без продромальных явлений. Появляется сильный озноб, боли в мышцах, температура тела повышается и достигает 38—40° С и сохраняется в течение 5—6 дней. Спустя 1—2 дня после появления первых клинических симптомов болезни отмечаются воспалительные изменения слизистой оболочки ротовой полости: 4 стоматит, жжение во рту, изменения слизистых оболочек губ, десен, гортани, щек, отек языка. В это же время выявляется конъюнктивит (иногда односторонний), рези при мочеиспускании. Через 1—2 дня после этого происходит высыпание везикул величиной от просяного зерна до крупной горошины по краю языка, на деснах, на небе и на губах. Через 2—3 дня везикулы вскрываются, образуя эрозии или язвочки. Речь и глотание затруднены, саливация резко повышена, губы и язык покрываются налетом и корками. Афты располагаются на языке, деснах, небе, иногда на слизистых оболочках носа, влагалища, уретры, на конъюнктивах. У детей ящур может сопровождаться развитием острого гастроэнтерита. У некоторых больных высыпания появляются на коже, особенно на кистях, стопах, голенях, вокруг рта. Характерно поражение кожи в межпальцевых складках и около ногтей. Период высыпания длится около недели. Могут быть новые высыпания, затягивающие заболевание до нескольких месяцев (затяжные и хронические формы). Помимо клинически выраженных форм ящура наблюдаются стертые и инаппарантные формы инфекции. Стертые формы проявлялись легким недомоганием, умеренной головной болью и проявлением в межпальцевых складках характерных везикул, которые через 1—2 дня вскрывались и быстро эпителизи-ровались. Инаппарантные формы протекают без каких-либо клинических проявлений. Вирусоносительство при ящуре может продолжаться до 120—150 дней. Осложнения. При ящуре осложнений обычно не наблюдается. Диагноз и дифференциальный диагноз. Диагноз ящура основывается на эпидемиологических данных, характерной клинической симптоматике и данных лабораторных исследований. Эпидемиологический анамнез имеет целью выявление контакта больного или с больными ящуром животными, или с продуктами животноводства (молоко, сметана, сливки, творог, масло), приготовленными из нестерилизованного молока неблагополучных по ящуру животных. Основными клиническими критериями диагноза ящура являются характерные изменения слизистой оболочки ротовой полости, которым предшествует выраженная лихорадка. Дополнительными критериями служат изменения кожи в межпальцевых складках, которые наблюдаются у части больных. Дифференциальный диагноз ящура следует проводить с везикулезным стоматитом, ветряной оспой, опоясывающим лишаем, энтеровирусной везикулярной болезнью, геморрагической лихорадкой Ласса, болезнью Бехчета. Энтеровирусное заболевание, описанное как своеобразная болезнь Hand-Fuss-Mund Krankheit, или, сокращенно, HFMK, обусловлено вирусом Коксаки А16. При этой болезни на фоне умеренной интоксикации и небольшого повышения температуры тела у больных на пальцах кистей и стоп появляется экзантема в виде небольших везикул диаметром 1—3 мм, слегка выступающих над уровнем кожи и окруженных венчиком гиперемии. Одновременно на языке и слизистой оболочке щек обнаруживаются единичные афтозные элементы. Через несколько дней экзантема и энантема бесследно исчезают. В отличие от ящура не бывает ощущения жжения, повышенной саливации, поражений кожи в межпальцевых складках. Для лабораторного подтверждения диагноза ящура используются вирусологические и серологические методы. Для вирусологических исследований от больного берут содержимое невскрывшихся везикул и их стенки, помещают в стерильную пробирку или пенициллиновый флакон. Для выделения вируса используются культуры клеток ткани почек телят, поросят или сирийского хомячка (ВНК-21). Используется также биопроба: морских свинок заражают методом скарификации или путем внутрикожного введения исследуемого материала в подошвенную поверхность задних лапок. При наличии вируса через 24—36 ч на месте заражения образуются первичные везикулы, которые вскрываются и превращаются в эрозии. Спустя еще 1—3 дня развиваются вторичные везикулы на языке и на подошвах передних лапок. Для выявления антител ис5 пользуются серологические реакции (РСК, РТГА). Диагностическое значение имеет нарастание титра антител. Лечение. Антибиотики неэффективны. Их можно назначать лишь при наслоении вторичной бактериальной инфекции. Рекомендуют препараты интер-феронов и индукторов интерферона, однако эффективность их еще недостаточно изучена. Большое значение имеет уход за больным и организация питания. При выраженных поражениях слизистой оболочки ротовой полости пища должна быть в жидком или полужидком виде (молоко, сливки, кефир, жидкие каши, слизистые супы и др.). Кормить больного нужно малыми дозами 6—7 раз в сутки. Если больной не может активно принимать пищу, приходится прибегать к зондовому питанию (тонкий зонд). Перед приемом пищи за 20— 30 мин можно давать по 0,1 г анестезина в порошке. Для утоления болей используют также мази, содержащие анестезин и новокаин. При поражении глаз применяют 30% раствор альбуцида. Больные ящуром, независимо от тяжести заболевания, должны лечиться в условиях стационара, где они должны находиться до полного клинического выздоровления. Прогноз благоприятный. Правила выписки. Больные выписываются из стационара после полного клинического выздоровления (эпителизация язв на слизистых оболочках и кожных поражений). Диспансеризация и реабилитационные мероприятия не проводятся. Профилактика и мероприятия в очаге. Борьба с ящуром домашних животных. В очаге ящура устанавливаются строгие карантинные мероприятия (ограждение, дезинфекция транспорта, выезжающего за пределы очага и др.). Проводится вакцинация животных, дератизация, дезинфекция и дезинсекция в очагах. Оборудуется помещение для обеззараживания молока, переработки и временного хранения его. Закрепляется круг лиц для работы в очагах ящура. Запрещается употребление сырых молочных продуктов. Соблюдаются меры предосторожности при уходе за больными животными (работа в санитарно-за-щитной одежде, запрещение пить воду, принимать пищу и курить в очаге ящура и др.). Не допускаются к работе в неблагополучных по ящуру хозяйствах беременные женщины, подростки и лица с микротравмами рук. Иерсиниозы (кишечный иерсиниоз и псевдотуберкулез). Этиология. Эпидемиология. Патогенез. Классификация. Клиническая картина. Осложнения. Дифференциальная диагностика. Лабораторная диагностика. Принципы лечения. Мероприятия в эпидемическом очаге. Эпидемиологический надзор. Профилактические мероприятия. Особенности внутрибольничного распространения. 2. КИШЕЧНЫЙ ИЕРСИНИОЗ Иерсиниоз (Yersiniosis, кишечный иерсиниоз) — острое инфекционное заболевание, характеризующееся преимущественным поражением желудочно-кишечного тракта с тенденцией к генерализованному течению с вовлечением в процесс различных органов и систем. Этиология. Возбудитель иерсиниоза относится к семейству кишечных бактерий Enterobacteriaceae, роду Yersinia, виду Yersinia enterocolitica. Грамотри-цательные палочки размером 1,8—2,7 х 0,7—0,9 мкм. Растут как на обычных, так и на обедненных питательных средах. Возбудитель иерсиниоза содержит О- и Н-антигены, по 0-антигену насчитывается более 50 сероваров иерсинии. Наибольшее значение в патологии человека имеют серовары 01, 05, 08 и 09, хотя от больных людей выделяются и другие. При температуре +4... +8° С микробы способны длительно сохраняться и размножаться на 6 различных пищевых продуктах. По биохимическим и культуральным свойствам Y. enterocolitica близка к Y. pseudotuberculosis. Эпидемиология. Механизмы и пути передачи возбудителя иерсиниоза и псевдотуберкулеза очень близки. Патогенез и патологическая анатомия. Принадлежность возбудителей иерсиниоза и псевдотуберкулеза к одному роду Yersinia обусловливают сходство механизмов патогенеза и патоморфологических изменений. Симптомы и течение. Инкубационный период продолжается от 1 до 6 дней. Иерсиниоз характеризуется полиморфизмом клинических проявлений. Заболевание начинается остро без продромы. Появляются озноб, головная боль, недомогание, слабость, боли в мышцах и суставах, бессонница, першение в горле, снижение аппетита. Температура тела субфебрильная, иногда до 38— 40° С. Наряду с симптомами общей интоксикации часто на первый план выступают признаки поражения желудочнокишечного тракта (боли в животе, тошнота, рвота, понос). Кожа сухая, иногда появляется сыпь мелкопятнистая и точечная с последующим шелушением. Нередко отмечается относительная тахикардия, наклонность к гипотонии. На протяжении болезни могут появляться новые симптомы, указывающие на поражение тех или других органов. Жалобы на боли и тяжесть в правом подреберье, темный цвет мочи. Появляется желтушное окрашивание кожи и склер. Увеличиваются размеры печени. В динамике может усилиться головная боль, выявляются оболочечные и очаговые симптомы поражения центральной нервной системы. Боли при мочеиспускании, снижение суточного диуреза вплоть до анурии. Усиливаются боли в животе, выявляются симптомы раздражения брюшины. На второй неделе могут появиться признаки острого артрита с преимущественным поражением крупных суставов, элементы узловатой сыпи или крапивницы, отек кожи лица (Квинке), рези в глазах, гиперемия и отек конъюнктив. Клиническая классификация иерсиниоза не разработана. По ведущему синдрому можно выделить несколько клинических форм. Из них: локализованную (гастроэнтероколитическую), клиническая картина которой ограничивается преимущественным поражением желудочно-кишечного тракта, и генерализованные (желтушную, экзантемную, артралгическую, септическую) формы. Гастроэнтероколиттеская форма встречается чаще, чем другие. На ее долю приходится около 70% заболеваний. Начинается остро, повышается температура тела до 38—39° С. Появляются головная боль, недомогание, бессонница, анорексия, озноб. Одновременно с синдромом интоксикации возникают боль в животе, понос, иногда рвота. Стул жидкий с резким неприятным запахом, изредка с примесью слизи, крови. Частота стула варьирует от 2 до 15 раз за сутки. Тяжелое течение встречается редко. Чаще температура тела субфебрильная или нормальная, синдром общей интоксикации выражен слабо, стул 2—3 раза за сутки, боли в животе незначительные. Такие больные активно выявляются при групповых заболеваниях. Эта форма может протекать в виде энтерита, энтероколита и гастроэнтероколита. Продолжительность болезни от двух дней до двух недель. Желтушная форма развивается либо одновременно с гастроэнтероколитической, либо спустя 2—3 дня после дисфункции кишечника. При этой форме на первый план выступают симптомы поражения печени, развивается токсический гепатит. Жалобы на тяжесть и боли в правом подреберье, иногда зуд кожи. Появляется желтушность кожи и склер. Печень увеличена, болезненна при пальпации. Отмечается потемнение мочи, обесцвечивается кал. Определяется гипербилирубинемия и гипертрансаминаземия. Экзантемная форма характеризуется синдромом интоксикации и экзантемой. Сыпь появляется на 1—6-й день болезни. Она может быть точечной, мелко- или крупнопятнистой без зуда кожи. Сыпь обычно исчезает бесследно через 2—5 дней, на месте бывшей сыпи бывает отрубевидное шелушение. 7 Артралгигеская форма протекает с лихорадкой, интоксикацией и сильными болями в суставах. Основная жалоба на боли в суставах. Артралгии иногда вызывают обездвиживание больных и бессонницу. Суставы внешне не изменены. Эти формы выделены по доминирующему синдрому, при них могут быть и другие симптомы, характерные для иерсиниоза, но они слабо выражены. Септигеская форма встречается редко. Для нее характерны высокая лихорадка с суточными размахами до 2° С, озноб, увеличение печени, селезенки и поражение различных органов. Могут развиться эндокардит, пневмония, нефрит с острой почечной недостаточностью, менингит, менингоэнцефалит, гепатит. Осложнения возникают чаще на 2—3-й неделе. К ним относятся аллергическая экзантема (крапивница, узловатая эритема), отек Квинке, артрит (преимущественно крупных суставов), миокардит, уретрит, конъюнктивит, аппендицит. Диагноз и дифференциальный диагноз. Иерсиниоз можно клинически диагностировать на основании острого начала, интоксикации, лихорадки, симптомов острого гастроэнтероколита в сочетании с экзантемой, желтухой, арт-ралгиями и эпидемиологических предпосылок. Для лабораторного подтверждения диагноза производятся посевы на питательные среды крови, кала, лик-вора, воспаленных мезентериальных лимфоузлов и аппендикулярных отростков. Методика посева материалов такая же, как при псевдотуберкулезе. Из серологических методик используются реакция агглютинации, реакция непрямой гемагглютинации с эритроцитарными диагностикумами, латекс-агглютинация, иммуноферментный анализ. Дифференциальный диагноз проводится с острыми желудочно-кишечными инфекционными заболеваниями (острой дизентерией, эшерихиозом, сальмонеллезом, псевдотуберкулезом, вирусным гепатитом, скарлатиной, краснухой, токсикоаллергической эритемой). Лечение. Из этиотропных средств применяется один из антибиотиков. Внутрь — тетрациклин (Tetracyclini hydrochloridum) no 0,5 г 4 раза в день, левомицетин (Chloramphenicol) по 0,5 г 4 раза в день. Внутримышечно — стрептомицин (Streptomycini sulfas) no 0,5 г 2 раза в день, ко-тримоксазол (co-trimoxazo-k) no 0,96 г 2 раза в день. При септической форме парентерально назначаются цефалоспорины и фторхинолоны в тех же дозах, что и при псевдотуберкулезе. Курс лечения зависит от формы и тяжести болезни. При легком течении 5—7 дней, при среднетяжелом и тяжелом — до 14 дней. Прогноз в большинстве случаев благоприятный, за исключением септической формы. Правила выписки и диспансерного наблюдения аналогичны таковым при псевдотуберкулезе. Профилактика иерсиниоза проводится так же, как при острых кишечных инфекциях и псевдотуберкулезе. Специфическая профилактика иерсиниоза не разработана. Врачебная экспертиза. После гастроэнтероколитических форм не проводится. В случаях генерализованных форм срок временной нетрудоспособности определяется решением клинико-экспертной комиссии. Реконвалесцентны-военнослужащие выписываются без изменения категории годности. После тяжелого, затяжного течения и септической формы решением ВВК предоставляется отпуск по болезни (для военнослужащих). ПСЕВДОТУБЕРКУЛЕЗ Псевдотуберкулез (Pseudotuberculosis, дальневосточная скарлатиноподобная лихорадка) — острое инфекционное заболевание, характеризующееся лихорадкой, симптомами общей интоксикации, поражением печени, суставов и часто протекающее с экзантемой. 8 Этиология. Возбудитель псевдотуберкулеза относится к семейству Enterobacteriaceae, роду Yersinia, виду Yersinia pseudotuberculosis. Грамотрицательная палочка размером 0,8—2 х 0,4—0,6 мкм не требовательна к питательным веществам. Растет на обычных и обедненных средах, лишенных азотосодержащих веществ и органических соединений углерода. Содержит соматический О- и жгутиковый Н-антигены. По 0антигену выделяют 8 серологических вариантов возбудителя псевдотуберкулеза. Заболевание у человека чаще всего вызывают I и III, реже II, IV, V и другие серовары. При разрушении микробных клеток выделяется эндотоксин, у некоторых штаммов обнаружена способность к продукции экзотоксинов. Важным свойством возбудителя является способность расти на питательных средах при низких температурах. Так, Yersinia pseudotuberculosis способна размножаться при температуре +4 ... +8° С. Она устойчива к повторному замораживанию, способна длительно существовать в почве, воде, на различных пищевых продуктах, а в условиях низкой температуры и повышенной влажности — размножаться и накапливаться. Возбудитель псевдотуберкулеза быстро погибает при высыхании, воздействии прямого солнечного света, высокой температуры, при кипячении погибает через 10—30 секунд. Дезинфицирующие вещества (3% раствор хлорамина, 3—5% раствор карболовой кислоты и лизола, раствор сулемы 1:1000 и др.) убивают псевдотуберкулезный микроб в течение 1—2 ч. Эпидемиология. Возбудитель псевдотуберкулеза распространен в природе чрезвычайно широко. Он выделен из органов и фекалий многих видов млекопитающих, птиц, земноводных, членистоногих, а также из смывов с овощей, корнеплодов, из фуража, почвы, пыли, воды. Однако основным резервуаром возбудителя и источником заболеваний человека являются синантропные и другие грызуны. Они высоко восприимчивы к псевдотуберкулезному микробу, распространены практически повсеместно, всегда имеют возможность инфицировать своими выделениями продукты питания, воду и почву, где возбудитель не только сохраняется длительное время, но при определенных условиях и размножается. Другим резервуаром псевдотуберкулезных бактерий является почва. Частое обнаружение в ней возбудителя связано не только с загрязнением испражнениями животных, но и с наличием у псевдотуберкулезного микроба сапрофитических способностей. Человек, как правило, источником заражения псевдотуберкулезом не является. Механизм передачи возбудителя фекально-оральный. Ведущий путь передачи инфекции — пищевой. К основным факторам передачи относятся овощные блюда (салаты из овощей) и молочные продукты, употребляемые в пищу без предварительной термической обработки. Накоплению возбудителя в продуктах способствует хранение их в овощехранилищах и холодильниках. Второе место занимает водный путь передачи. Он обычно реализуется при употреблении воды из открытых водоемов. Возможны и другие пути передачи, но они существенного значения в эпидемиологии псевдотуберкулеза не имеют. Спорадическая заболеваемость псевдотуберкулезом человека наблюдается на протяжении всего года, хотя имеется четко выраженный сезонный подъем в зимневесенний период, когда суточная температура воздуха колеблется от -5 до +10° С. Групповые заболевания встречаются в организованных коллективах и связаны с питанием из общего пищеблока (детские учреждения, учебные заведения, воинские части, другие учреждения). Патогенез и патологическая анатомия. Возбудитель псевдотуберкулеза попадает в желудочно-кишечный тракт с инфицированной пищей или водой. Преодолев защитный барьер желудка, микробы фиксируются в клетках лимфоидного аппарата кишечника, оттуда проникают в регионарные мезентериальные лимфатические узлы, вызывая их воспаление. На этой стадии, как правило, клинических проявлений болезни нет, заболевание протекает в латентной форме, а в случае несостоятельности барьера регионарных лимфатических узлов микробы попадают в кровяное русло и различные 9 органы, происходит их массовая гибель, сопровождающаяся высвобождением большого количества эндотоксина, появляются клинические симптомы болезни (лихорадка, интоксикация, поражение органов). Возбудитель фиксируется в клетках системы мононуклеарных фагоцитов. Эти патогенетические факторы обусловливают возможность развития генерализованной формы заболевания и объясняют полиморфизм клинической картины псевдотуберкулеза. Патологоанатомическая картина при тяжелом течении болезни свидетельствует о поражении всех органов и систем. В органах, богатых макрофагальными элементами, определяются псевдотуберкулезные очаги — «гранулемы», а иногда и микроабсцессы, в других органах отмечаются неспецифические изменения дистрофического характера. При длительном воздействии псевдотуберкулезных микробов и их токсинов у больных происходит сенсибилизация организма, что вызывает ряд аллергических симптомов. Иммунитет при псевдотуберкулезе развивается медленно, сохраняется короткий период, иногда не формируется вовсе, в связи с чем возможны обострения, рецидивы и повторные заболевания. Заключительным звеном патогенеза псевдотуберкулеза служит освобождение организма от возбудителя и выздоровление. Симптомы и течение. Инкубационный период от 3 до 18 дней, в среднем 10 дней. Заболевание начинается остро без выраженной продромы. Появляется озноб, головная боль, недомогание, боль в мышцах и суставах, бессонница, першение в горле, кашель. Температура тела повышается до 38—40° С. Наряду с симптомами общей интоксикации у части больных на первый план выступают признаки поражения желудочно-кишечного тракта (боли в животе различной локализации, тошнота, рвота, понос). Кожа сухая и горячая, нередко наблюдаются одутловатость и гиперемия лица и шеи — симптом «капюшона», бледный носогубный треугольник, ограниченная гиперемия и отечность кистей и стоп — симптомы «перчаток» и «носков», инъекция сосудов конъюнктив век и глазных яблок, диффузная гиперемия слизистой оболочки ротоглотки, иногда с точечной или мелкопятнистой энантемой. На языке — белый налет. Пульс соответствует температуре. Артериальное давление понижается, отмечается сосудистая лабильность. На 1—6-й, чаще на 2—4-й день болезни появляется ярко-красная точечная сыпь на нормальном или субиктеричном фоне кожи (см. цв. вклейку, рис. 11). Наряду с точечной, скарлатиноподобной, наблюдается и мелкопятнистая сыпь, в ряде случаев вся она имеет макулезный характер. Отдельные элементы или вся сыпь может быть геморрагического характера. Иногда сыпь появляется лишь на ограниченных участках кожи. Независимо от характера сыпи и ее количества она располагается на симметричных участках. Определяются положительные симптомы Пастиа, Мозера, Кончаловского—Румпель— Лееда. Сыпь сохраняется от нескольких часов до 8 дней и исчезает бесследно, иногда оставляя за собой кратковременное шелушение. В период разгара болезни артралгии наблюдаются у 50—70% больных. В ряде случаев артралгии столь выражены, что приводят к обездвиживанию больных. Язык очищается от налета, приобретая ярко-малиновую окраску. Боли в животе локализуются в илеоцекальной области, интенсивность их бывает различной, иногда боли в животе являются доминирующим симптомом. При пальпации живота в илеоцекальной области наблюдаются болезненность и урчание. Кроме того, в ряде случаев в правой подвздошной области при перкуссии укорочен перкуторный звук, наблюдаются напряжение мышц передней брюшной стенки и симптомы раздражения брюшины. Этот симптомокомплекс обусловлен развитием мезаденита, терминального илеита или аппендицита. Нередко больные жалуются на тяжесть и боли в правом подреберье. Определяется увеличенная болезненная печень, желтушное окрашивание кожи и склер, фиксируется потемнение мочи, выявляется уробилинемия, гипербилирубинемия, повышенная активность трансфераз. Селезенка увеличивается у 10—18% больных. В остром периоде может быть токсическое поражение почек, которое характеризуется скоропреходящей альбуминурией, микрогематурией и цилиндрурией. 10 Гемограмма свидетельствует о токсическом поражении кроветворных органов, определяется нейтрофильный лейкоцитоз (10—26 х 109/л), увеличение процента незрелых палочкоядерных нейтрофилов, эозинофилия (5—26%), тромбоцитопения (60—130 х 109/л). Скорость оседания эритроцитов 20— 40 мм/ч, реже до 60 мм/ч. Псевдотуберкулез может протекать с обострениями и рецидивами. Обострение характеризуется ухудшением общего состояния, повышением температуры тела, появлением новых органных поражений или усилением угасающих симптомов. Рецидив возникает после периода кажущегося выздоровления. Через 1— 3 нед. вновь появляются типичные признаки болезни. Рецидивов бывает 1—2, реже 3 и более. Известно несколько клинических классификаций псевдотуберкулеза. В практике остается классификация, отражающая основные клинические проявления, тяжесть и течение болезни (табл. 6). Таблица 6 Клиническая классификация псевдотуберкулеза (В. С. Матковский, В. С. Антонов, 1972) По основным клиническим проявлениям По тяжести По течению Генерализованная Тяжелая С рецидивами Абдоминальная Средней тяжести Без рецидивов Желтушная Легкая Артралгическая Экзантемная (скарлатиноподобная) Катаральная Смешанная Стертая Латентная Клинические формы выделены на основании преобладающего синдрома поражения органов, при каждой из них могут быть симптомы любой другой формы, но они не являются ведущими. Каждая из клинических форм дает ориентацию в подходе к этиотропному и патогенетическому лечению, позволяет определить комплекс лабораторных и функциональных исследований. Выделяются абдоминальная, желтушная, артралгическая, экзантемная, катаральная, смешанная, генерализованная, стертая и латентная формы. Абдоминальная форма протекает с преобладанием синдрома поражения желудочно-кишечного тракта (боли в животе, тошнота, рвота, понос, признаки терминального илеита, мезаденита, аппендицита). Желтушная — боли в правом подреберье, потемнение мочи, желтушность кожи и склер, увеличение печени, билирубинемия, гипертрансаминаземия. Артралгическая — выраженные артралгии, обездвиженность больных. Экзантемная — экзантема, симптомы «капюшона», «перчаток», «носков». Катаральная — кашель, насморк, першение и боли в горле, гиперемия и отек слизистой оболочки ротоглотки. Смешанная — к ней относятся заболевания, протекающие с четко выраженными признаками двух клинических форм. Например, абдоминальной и желтушной. Генерализованная — все синдромы или, по крайней мере, три выражены настолько ярко, что трудно выявить преобладание одного из них. Стертая и латентная формы — выявляются лишь при целенаправленном лабораторном обследовании в очаге псевдотуберкулеза. Осложнения. Наиболее частыми осложнениями псевдотуберкулеза являются аллергические симптомы: крапивница, отек Квинке, реактивные артриты, узловатая эритема, синдром Рейтера. Реже наблюдаются псевдотуберкулезный менингит и менингоэнцефалит, нефрит, острая почечная недостаточность, миокардит, пневмония. 11 Диагноз и дифференциальный диагноз. Клинический диагноз основывается на сочетании характерных для псевдотуберкулеза признаков: острое начало заболевания, синдром общей интоксикации, лихорадка, поражение кожи (экзантема, симптомы «капюшона», «перчаток», «носков»— см. цв. вклейку, рис. 12), катаральное воспаление слизистой оболочки ротоглотки, признаки поражения желудочно-кишечного тракта, синдром гепатита, поражение суставов, аллергические симптомы, изменения крови и мочи. Вспомогательное значение имеет эпидемиологический анамнез. В установлении окончательного диагноза решающую роль имеют лабораторные методы — бактериологический и серологический. Выделение возбудителя от больного в остром периоде болезни возможно из фекалий, мочи, мазков слизи из ротоглотки, удаленных аппендиксов и мезентериальных лимфатических узлов. Используется методика Паттерсона и Кука, основанная на способности Y. pseudotuberculosis расти при пониженной температуре в среде подращивания (стерильный фосфатносолевой буфер рН — 7,4, среда Серова и др.). При прямом посеве крови на питательные среды получить гемокультуру не удается, однако выделение возбудителя возможно путем биопробы на животных. В серологической диагностике используются реакции агглютинации (РА) и непрямой гемагглютинации (РИГА). Диагностическим титром может считаться для РА — 1: 200, для РИГА — 1:100. Достоверным диагностическим критерием при использовании данных методов является четырехкратное нарастание титра специфических антител в динамике заболевания при исследовании парных сывороток. Использование серологических методов, основанных на обнаружении специфических антител к антигенам иерсиний, имеет ряд серьезных недостатков, основные из которых — невысокая специфичность и поздние сроки подтверждения диагноза. Использование в качестве диагностикума очищенной псевдотуберкулезной гипериммунной сыворотки позволило создать несколько экспресс-методов обнаружения антигенов иерсиний в организме больных: РИГА, РНИФ (реакция непрямой иммунофлюоресценции), РКА (реакция коагглютинации), латекс-агглютинация, ИФА (иммуноферментный анализ). Эти методы позволяют обнаружить антигены иерсиний в различных биологических средах организма в первые дни заболевания. В настоящее время апробированы и в ближайшем будущем найдут широкое практическое применение для диагностики псевдотуберкулеза такие современные методы, как иммуноблотинг и полимеразная цепная реакция (ПЦР). Эти методы значительно увеличивают вероятность правильного лабораторного диагноза уже при первом обследовании больного. Так, для постановки диагноза при помощи ПЦР достаточно несколько молекул ДНК иерсиний в исследуемом материале. Дифференциальная диагностика псевдотуберкулеза зависит от клинической формы и периода болезни. Так, генерализованную форму приходится дифференцировать с тифопаратифозным заболеванием и сепсисом; абдоминальную — с локализованными формами сальмонеллеза, острой дизентерией, острым аппендицитом, геморрагической лихорадкой, энтеровирусными заболеваниями, брюшным тифом; желтушную — с вирусным гепатитом, лептоспирозом; артралгическую — с ревматизмом; экзантемную — со скарлатиной, краснухой, лекарственной болезнью; катаральную — с гриппом и другими острыми респираторными заболеваниями. Лечение. Комплекс терапевтических мероприятий проводится с учетом патогенеза, клинической формы и тяжести заболевания. Ведущее место отводится этиотропному лечению. Препаратом выбора является левомицетин внутрь (Chloramphenicol) по 0,5 г 4 раза в сутки. Курс лечения — 14 дней, при котором частота рецидивов сводится к минимуму. В случае отсутствия терапевтического эффекта или непереносимости левомицетина применяется стрептомицин (Streptomycini sulfas) no 0,5 г 2 раза в сутки внутримышечно либо гентамицин по 3 мг/кг в сутки внутримышечно в течение двух недель. При генерализованной форме антибиотики применяются парентерально. Цефалоспорины — по 1,0 г 4—6 раз в сутки внутримышечно или внутривенно, 12 фторхинолоны — ципрофлоксацин (Ciprofloxacin) по 0,2—0,4 г 2 раза в сутки внутривенно капельно. Патогенетическая терапия — дезинтоксикационные, общеукрепляющие, стимулирующие и десенсибилизирующие средства. В связи с возможными обострениями и рецидивами показано применение пентоксила, метилурацила, оротата калия, поливитаминов и иммуномодуляторов. При выраженной интоксикации применяются дезинтоксикационные средства (полиионные растворы, реопо-лиглюкин, гемодез и др.). В случаях развития у больных мезаденита, терминального илеита, аппендицита, сопровождающихся развитием симптомокомплекса «острого живота», они нуждаются в наблюдении хирурга, который определяет показания к операции. До операции и после нее в полном объеме проводится этиотропная и патогенетическая терапия. Прогноз благоприятный. Правила выписки. Реконвалесценты выписываются после клинического выздоровления при нормальных результатах общеклинических исследований, но не ранее 20-го дня от начала болезни. Диспансеризация. Сроки диспансерного наблюдения определяются в зависимости от тяжести перенесенного заболевания. После легких форм болезни — 1 мес., после среднетяжелых — 3 мес., а после тяжелых — до 6 мес. Профилактика и мероприятия в очаге. Проводятся с учетом его эпидемиологических особенностей, возможных источников и факторов передачи инфекции. Первостепенное значение в профилактике псевдотуберкулеза приобретает предупреждение заражения микробами овощей, фруктов и корнеплодов, для чего необходимо оградить пищевые продукты, принимаемые в пищу без термической обработки, от доступа грызунов, птиц, домашних животных. По возможности исключить из рациона сырую воду и молоко. Существенное значение имеют дератизационные мероприятия на объектах питания, водоснабжения и животноводческих комплексах. Бруцеллез. Этиология. Эпидемиология. Патогенез. Классификация. Клиническая картина. Дифференциальная диагностика. Лабораторная диагностика. Принципы лечения. Мероприятия в эпидемическом очаге. Эпидемиологический надзор. Профилактические мероприятия. 3. БРУЦЕЛЛЕЗ Бруцеллез (Brucellosis, синонимы: мальтийская лихорадка, болезнь Бан-га) — заболевание, обусловленное различными видами бруцелл, склонное к хроническому течению, характеризуется поражением опорно-двигательного аппарата, нервной, половой и других систем. Относится к группе зоонозов. Этиология. Бруцеллез человека может быть обусловлен четырьмя видами бруцелл. В последние годы наиболее частой причиной болезни является Br. melitensis, которая подразделяется на 3 биотипа, основными хозяевами являются овцы и козы. Несколько реже встречается Br. abortus, которая подразделяется на 9 биотипов, основной хозяин — крупный рогатый скот. Далее идет Br. suis, она подразделяется на 4 биотипа, основным хозяином типов 1, 2 и 3 являются свиньи (типа 2 — кроме того, и зайцы), хозяином биотипа 4 являются северные олени. Относительно редко наблюдается заболевание, обусловленное Br. canis, основным хозяином которой являются собаки. Еще два вида бруцелл (Br. ovis, Br. neotomae) для человека непатогенны, хозяевами их являются овцы и кустарниковые крысы. Бруцеллы отличаются выраженным полиморфизмом, они могут иметь различную форму (шаровидные, овальные, палочковидные). Размер их равен 0,3—0,6 мкм для 13 кокковых форм и 0,6—2,5 мкм для палочковидных форм. Они неподвижны, спор не образуют, жгутиков не имеют. Грамотрицательны, хорошо красятся анилиновыми красками. Растут медленно, на питательных средах рост бруцелл выявляется через 1—3 нед. Работа с культурами бруцелл разрешается только в лабораториях с особым строгим противоэпидемическим режимом, так как они относятся к особо опасным микроорганизмам. Военные специалисты США рассматривают бруцелл в качестве вероятного биологического оружия. Бруцеллы устойчивы во внешней среде. В воде они сохраняются свыше 2 мес., в сыром мясе — 3 мес., в засоленном — до 30 дней, в шерсти — до 4 мес. Бруцеллы погибают при нагревании и под воздействием многих дезинфицирующих веществ. Чувствительны к антибиотикам тетрациклиновой группы, стрептомицину, рифампицину, эритромицину. Эпидемиология. Бруцеллез относится к зоонозам. От больного человека здоровому бруцеллы не передаются. Хотя к бруцеллезу чувствительны некоторые дикие животные (зайцы, северные олени), природных очагов инфекции не наблюдается. Резервуаром и источником инфекции являются домашние животные (овцы, козы, коровы, свиньи, реже собаки). Бруцеллез широко распространен во многих странах мира, особенно в тех, где развито овцеводство. В СССР наибольшая заболеваемость наблюдалась в Казахстане и республиках Средней Азии. В России бруцеллез встречается в Краснодарском и Ставропольском краях, на Южном Урале и в других областях. Заражение человека от больных животных происходит контактным, алиментарным и аэрозольным путями. Контактный путь особенно часто реализуется при попадании на кожу околоплодной жидкости (помощь при отелах, ягнении, при уходе за новорожденными телятами и ягнятами). Часто заражаются ветеринарные работники, доярки, телятницы, чабаны и др. Заражение может наступить при контакте с навозом, а также с мясом инфицированных животных. Бруцеллы проникают через малейшие повреждения кожи. Алиментарное заражение часто происходит через сырое молоко, а также при употреблении молочных продуктов (брынза, творог, сыр, сметана, масло). Аэрогенное заражение может наступить при попадании в дыхательные пути пыли, содержащей бруцеллы (в местах выпаса и в загонах для содержания овец), а также в лабораториях при нарушении техники безопасности. Этот путь инфицирования наблюдается относительно редко. Чаще заболевают лица трудоспособного возраста (18—50 лет). В большинстве случаев бруцеллез является профессиональным заболеванием. Патогенез и патологическая анатомия. Инфицирующая доза при бруцеллезе очень мала. Для заражения достаточно от 10 до 100 микроорганизмов. Воротами инфекции являются микротравмы кожи, слизистые оболочки органов пищеварения и респираторного тракта. На месте ворот инфекции каких-либо изменений не развивается. По лимфатическим путям бруцеллы достигают регионарных лимфатических узлов, но и здесь не возникает выраженных изменений. Лимфаденопатия при бруцеллезе бывает генерализованной, что свидетельствует о гематогенной диссеминации микробов. Накопление и размножение микробов при бруцеллезе происходит преимущественно в лимфатических узлах, из которых бруцеллы периодически поступают в кровь. Для бруцеллеза характерна аллергическая перестройка организма, резко выражена гиперчувствительность замедленного типа, которая длительное время сохраняется после очищения организма от возбудителя. Аллергия играет большую роль в формировании вторичных очагов инфекции. Бруцеллез отличается склонностью к хроническому течению, что связано с длительным персистированием бруцелл в организме. После перенесенного бруцеллеза формируется иммунитет, но он не очень длительный, и через 3—5 лет возможна реинфекция. Не каждое инфицирование приводит к развитию болезни. Ответная реакция зависит от состояния иммунной системы. У некоторых лиц инфекция протекает без каких-либо клинических симптомов (первичнолатентная форма), у других развивается острый инфекционный процесс с выраженной 14 лихорадкой и клинической симптоматикой (острая форма), а у части больных бруцеллез с самого начала протекает как хронический. У лиц с очень слабым иммунитетом даже живая бруцеллезная вакцина может вызвать реакцию, напоминающую проявления бруцеллеза. На клиническое проявление бруцеллеза существенно влияет и вид бруцеллы, вызвавшей заболевание. Более тяжелое течение бруцеллеза связано с Br. mditensis тогда как остальные виды бруцелл вызывают более легкие заболевания. Острая фаза бруцеллеза характеризуется дегенеративно-некротическими изменениями в паренхиматозных тканях внутренних органов (печень, почки, надпочечники, мозг и др.), нередко с образованием некротических очагов, а также воспалительными и токсическими поражениями сосудов, сосудисто-соединительной стромы внутренних органов. В более поздние периоды болезни развиваются бруцеллезные гранулемы, состоящие из эпителиоидных и многоядерных клеток. Центральный некроз отсутствует. Гранулемы медленно подвергаются фиброзному превращению. Патоморфологические изменения при бруцеллезе наблюдаются почти во всех органах и тканях, в большей степени они выражены в лимфатической системе, соединительной ткани, сосудах и в нервной системе. Сосуды поражаются в виде эндопанваскулитов, тромбаваскулитов, аневризм и склероза. Симптомы и течение. Инкубационный период при остром начале бруцеллеза продолжается в среднем около 3 нед. (от 6 до 60 дней), однако если бруцеллез начинается как первично-латентный, который затем переходит в клинически выраженную форму, то инкубация может длиться много месяцев. Многообразие клинических проявлений болезни обусловило необходимость разработки классификации клинических форм. Только в нашей стране было предложено свыше 30 классификаций. Наиболее обоснованной и получившей широкое распространение является классификация клинических форм бруцеллеза, предложенная Н. И. Рагозой, который начал работу над ней в 1938 г. и в окончательном варианте опубликовал ее в 1952 г. В ней был использован клиникопатогенетический принцип. Н. И. Рагоза показал фазность динамики бруцеллезного процесса. Он выделил 4 фазы: фазу компенсированной инфекции (первично-латентная), фазу острого сепсиса без органных поражений (декомпенсация), фазу подострого или хронического рецидивирующего заболевания с образованием местных поражений (декомпенсация или субкомпенсация) и фазу восстановления компенсации с остаточными явлениями или без них (вторично-латентная). Выделено пять клинигеских форм бруцеллеза, связанных с этими фазами: 1) первично-латентная; 2) остросептическая; 3) первично-хроническая метастатическая; 4) вторично-хроническая метастатическая; 5) вторично-латентная. В качестве отдельного варианта выделена септико-метастатическая форма, к которой отнесены те случаи, когда на фоне остросептической формы появляются отдельные очаговые изменения (метастазы). В классификации указана динамика дальнейшего развития каждой клинической формы. Первично-латентная форма бруцеллеза характеризуется состоянием практического здоровья. Включение ее в классификацию клинических форм обусловлено тем, что при ослаблении защитных сил организма она может превратиться или в остросептическую, или в первично-хроническую метастатическую форму. Остросептическая форма характеризуется высокой лихорадкой (39—40° С и выше), температурная кривая имеет тенденцию к волнообразному течению, нередко неправильного (септического) типа с большими суточными размаха-ми, повторными ознобами, сменяющимися повышенной потливостью. Несмотря на высокую и очень высокую температуру тела, самочувствие больного остается хорошим (при температуре 39° С и выше больной может читать книги, играть в шахматы, смотреть телевизор и т. п.). Отсутствуют и другие признаки общей интоксикации. Эта форма не угрожает жизни больного, даже без этиотропного выздоровления она заканчивается выздоровлением. 15 Из других клинических проявлений остросептической формы бруцеллеза следует указать на генерализованную лимфаденопатию. Все группы лимфатических узлов умеренно увеличены, некоторые из них чувствительны при пальпации. К концу первой недели болезни отмечается увеличение печени и селезенки. При исследовании периферической крови отмечается лейкопения, СОЭ не повышена. Главным отличием этой формы является отсутствие очаговых изменений (метастазов). Без антибиотикотерапии длительность лихорадки может достигать 3—4 нед. и более. Хронигеские формы в одних случаях развиваются сразу, минуя острую фазу, в других случаях признаки хронического бруцеллеза появляются спустя какое-то время после остросептической формы. По клиническим проявлениям первично-хроническая и вторично-хроническая метастатические формы бруцеллеза ничем не различаются. Единственное отличие — наличие или отсутствие остросептической формы в анамнезе. Клинически хронические формы характеризуются синдромом общей интоксикации, на фоне которого выявляется ряд органных поражений. К общим симптомам можно отнести длительную субфебрильную температуру, слабость, повышенную раздражительность, нарушение аппетита, снижение работоспособности. Почти у всех больных отмечается генерализованная лимфаденопатия. Часто выявляется увеличение печени и селезенки. На этом фоне наблюдаются органные поражения, наиболее часто со стороны опорнодвигательного аппарата, несколько реже выявляются изменения нервной и половой систем. При хроническом бруцеллезе могут быть и другие органные поражения (пневмонии, миокардиты, аортиты, поражения глаз и др.), но наблюдаются они относительно редко. Поражение опорно-двигательного аппарата является наиболее частым проявлением хронического бруцеллеза. Больные жалуются на боли в мышцах и суставах, преимущественно в крупных. Для бруцеллеза характерен полиартрит, при каждом новом обострении появляются другие по локализации метастазы, это касается не только суставов, но и других органных поражений. Чаще поражаются коленные, плечевые и тазобедренные суставы, редко поражаются мелкие суставы кистей и стоп. Характерен периартрит, бурситы, экзостозы, не отмечается остеопорозов. Суставы опухают, подвижность в них ограничена, кожа над ними, как правило, нормальной окраски. Нарушения подвижности и деформация суставов обусловлены разрастанием костной ткани. Поражается позвоночник, чаще в поясничном отделе. Типичными для бруцеллеза являются сакроилеиты, диагностическое значение их очень велико, так как при других заболеваниях они встречаются крайне редко. Для выявления сакроилеитов существует ряд диагностических приемов (симптомы Эриксона, Нахласа и др.). Выявление симптома Эриксона производится следующим образом: больного укладывают на перевязочный стол на спину или на бок и давят на гребень подвздошной кости при положении на боку или сдавливают обеими руками передние верхние гребни подвздошных костей в положении на спине. При одностороннем сакроилеите появляются боли на пораженной стороне, при двухстороннем — отмечаются боли в крестце с двух сторон. Для выявления симптома Нахласа больного укладывают на стол лицом вниз и сгибают ноги в коленных суставах. При подъеме конечности появляется боль в пораженном крестцово-подвздошном сочленении. При хронических формах бруцеллеза часто поражаются не только суставы, но и мышцы. Миозиты проявляются болями в мышцах. Боли обычно тупые, продолжительные, интенсивность их нередко связана с изменениями погоды. При пальпации в мышцах конечностей и поясницы определяются более болезненные участки, в толще мышц прощупываются болезненные уплотнения различной формы и размеров. Чаще они пальпируются в виде тяжей, валиков, реже имеют округлую или овальную форму. Со временем в одном участке изменения мышц проходят, но появляются воспалительные очаги в других мышечных группах, и так продолжается до тех пор, пока хронические формы бруцеллеза не перейдут во вторично-латентную. После введения специфического 16 антигена (например, при постановке пробы Бюрне) болевые ощущения в области пораженных мышц заметно усиливаются, а иногда можно определить и увеличение размеров воспалительных инфильтратов. Помимо миозитов у больных бруцеллезом часто (до 50—60%) выявляются фиброзиты. Они локализуются в подкожной клетчатке на голенях, предплечьях, на спине и пояснице. Размеры их колеблются от 5—10 мм до 3—4 см. Вначале они прощупываются в виде мягких овальных образований, болезненных при пальпации, в дальнейшем они постепенно уменьшаются в размерах, могут полностью рассосаться или склерозируются и длительно сохраняются в виде небольших плотных образований, безболезненных при пальпации. Поражение нервной системы при хроническом бруцеллезе проявляется чаще всего в невритах, полиневритах, радикулитах. Поражение центральной нервной системы (миелиты, менингиты, энцефалиты) наблюдаются очень редко, но протекают довольно тяжело. Изменения половой системы у мужчин проявляются в орхитах, эпидиди-митах, снижении половой функции. У женщин наблюдаются сальпингиты, метриты, эндометриты. Отмечается аменорея, может развиться бесплодие. У беременных женщин часто возникают аборты, мертворождения, преждевременные роды, врожденный бруцеллез у детей. Иногда наблюдаются поражения глаз (ириты, хориоретиниты, увеиты, кератиты, атрофия зрительного нерва и др.). При аэрогенном заражении часто развиваются вялотекущие пневмонии, которые безуспешно лечатся обычно применяемыми при пневмониях антибиотиками. Могут развиться бруцеллезные миокардиты, эндокардиты, аортиты и другие поражения сердечно-сосудистой системы. Вторичная- латентная форма. После исчезновения клинических проявлений манифестных форм бруцеллеза (остросептической, первично- и вторично-хронических) процесс переходит во вторично-латентную форму, при которой возбудитель сохраняется в организме и может обусловить рецидив бруцеллеза. При этой форме рецидивы возникают значительно чаще, чем при первично-латентной форме. Кроме того, при вторичнолатентной форме могут быть различные резидуальные явления (ограничение подвижности суставов, бесплодие, нарушение зрения и др.). Течение бруцеллеза зависит и от вида возбудителя. При заражении от овец (Br. melitensis) болезнь чаще начинается с остросептической формы и протекает более тяжело. При заражении от коров (Br. abortus) болезнь чаще начинается как первично-хроническая или даже как первично-латентная. Осложнений не отмечается. Диагноз и дифференциальный диагноз. При распознавании бруцеллеза учитываются эпидемиологические предпосылки (пребывание в регионах, где распространен бруцеллез, контакт с животными, употребление молочных продуктов, которые могли быть от бруцеллезных животных и др.), а также клинические проявления отдельных форм бруцеллеза. Остросептическую форму бруцеллеза приходится дифференцировать от многих заболеваний, сопровождающихся высокой лихорадкой. Основное отличие этой формы бруцеллеза — хорошее самочувствие больных при температуре 39-40° С. Хронические формы бруцеллеза необходимо дифференцировать от ряда заболеваний, которые характеризуются появлением артритов. Бруцеллез является единственным инфекционным заболеванием, при котором развивается хронический полиартрит, поэтому приходится дифференцировать от полиартритов неинфекционной природы (ревматоидный артрит, системная красная волчанка, склеродермия системная, псориатические артриты и др.). Отличить их от бруцеллеза можно по комплексу клинических признаков, которые не являются характерными для бруцеллеза. Проводят также комплекс соответствующих лабораторных и инструментальных исследований для исключения этих заболеваний. 17 Лабораторное подтверждение бруцеллеза выделением бруцелл ограничено тем, что работа с возбудителем может проводиться только в специальных лабораториях, оборудованных с требованиями профилактики. При серологических и аллергологических исследованиях нужно учитывать, что у привитых против бруцеллеза (вакцинируются группы риска, профессионально контактирующие с животными) могут быть положительными как серологические, так и особенно аллергические реакции. Из серологических реакций используются реакции агглютинации, РСК, РИГА, опсонофагоцитарная, агглютинации на стекле и др. Наиболее информативной является реакция агглютинации (реакция Райта). Реакция агглютинации на стекле (Хеддльсона) часто дает ложноположительные результаты, поэтому используется при массовых обследованиях для выявления лиц, подлежащих дальнейшему обследованию на бруцеллез. При остросептической форме бруцеллеза антитела начинают появляться на 2-й неделе болезни и в дальнейшем титр их нарастает. Аллергическая проба становится положительной в конце 1-й и на 2-й неделе. При хронических формах бруцеллеза нарастания титра антител часто выявить не удается. Отрицательные результаты пробы Бюрне позволяют исключить бруцеллез (кроме ВИЧ-инфицированных, у которых исчезают все реакции ГЗТ). Лечение. Принципы и методы терапии зависят от клинической формы бруцеллеза. При первично-латентных формах бруцеллеза лечение не проводится. Антибиотикотерапия может дать эффект только при остросептической форме бруцеллеза. При хронических формах назначение антибиотиков играет подсобную роль, а основное значение имеет вакцинотерапия. Больным остросептической (острой) формой бруцеллеза необходимо назначать антибиотики в довольно больших суточных и курсовых дозах. Недостаточные дозы и преждевременная отмена препаратов приводят к развитию в дальнейшем вторичнохронической метастатической формы болезни. Антибиотики необходимо давать непрерывно. Длительное время во многих странах используют назначение тетрациклина со стрептомицином. Тетрациклин назначают по 0,5 г через 6 ч в течение 3—6 нед., в течение первых двух недель тетрациклин сочетают с введением стрептомицина (внутримышечно в дозе 1 г через 12 ч). Замена тетрациклина доксициклином и стрептомицина гентамицином не имеет преимуществ. Тетрациклин противопоказан беременным женщинам и детям до 8 лет. При невозможности использовать приведенную выше схему можно назначать котримоксазол (бисептол) по 6 таблеток в сутки в течение 4 нед. Лучшие результаты дает применение комбинации бисептол + рифампицин (по 900мг в сутки). При проведении полного курса рецидивы наблюдаются редко. Назначается комплекс витаминов и при необходимости проводится симптоматическая терапия. Лечение больных первично- и вторично-хронической формами бруцеллеза проводится одинаково. Антибиотики при этих формах оказались неэффективными. Они могут назначаться лишь некоторым больным с выраженной лихорадкой, однако эти формы протекают обычно при нормальной или субфебрильной температуре тела. Основную роль при лечении больных этими формами играет назначение препаратов, обладающих неспецифическим и специфическим десенсибилизирующим действием. При хронических формах наиболее эффективна вакцинотерапия, которая обладает не только десенсибилизирующим действием, но и стимулирует иммуногенез. Больным назначают комплекс витаминов, неспецифические стимуляторы кроветворения (пентоксил, нуклеиновокислый натрий, метацил). В зимнее время необходимо проводить общее ультрафиолетовое облучение субэритемными дозами (по 1/4—3/4 биодозы). Применяют антигистаминные препараты (димедрол, пипольфен, супрастин и др.). При выраженных воспалительных изменениях (орхит, неврит и др.) назначают кортикостероидные препараты (по 40—50 мг преднизолона в течение 2—3 нед.), которые снимают воспалительные явления, улучшают общее самочувствие, 18 оказывают противоаллергическое действие, но не улучшают отдаленных результатов лечения. Для специфической десенсибилизации и повышения иммунитета применяется вакцинотерапия. При резко выраженной аллергической перестройке для десенсибилизации иногда применяется бруцеллин (в различных разведениях), однако чаще всего — убитая лечебная вакцина. Живая вакцина используется только для профилактики. Предложены разные методы введения вакцины: внутривенный, внутримышечный, подкожный и внутрикожный. Большое значение имеет адекватная дозировка вакцины, так как передозировка может привести к декомпенсации и обострению болезни, а при недостаточной дозе слабо выражен или отсутствует терапевтический эффект. В связи с этим выбор метода введения и определение индивидуальной дозы играют большую роль. Наибольшее распространение получило подкожное и внутрикожное введение вакцины. Подкожно вакцина назначается при декомпенсации процесса и при выраженной клинической симптоматике. Важным принципом вакцинотерапии является индивидуальный подбор дозы препарата. Подкожное введение чаще начинают с 10—15 млн микробных тел (лечебная убитая вакцина обычно содержит 500 млн микробных тел в 1 мл). Если местная и общая реакции отсутствуют, то вакцину в увеличенной дозе вводят уже на следующий день. Для лечения подбирают такую дозу, которая вызывает умеренную общую и местную реакцию. Дозу вакцины постепенно увеличивают. Следующую инъекцию вакцины делают после того, как исчезнет реакция на предыдущее введение вакцины. Однократно вводимую дозу в конце курса лечения доводят до 1—5 млрд микробных клеток. Внутрикожная вакцинотерапия является более щадящей. Этот метод используется в стадии компенсации, а также при переходе заболевания в латентную форму. По выраженности кожной реакции подбирают рабочее разведение вакцины (оно должно вызывать местную реакцию кожи диаметром от 5 до 10 мм). Реакция выражается в виде гиперемии и инфильтрации кожи. Вакцину вводят внутрикожно в ладонную поверхность предплечья в первый день по 0,1 мл в 3 места, затем каждый день прибавляют по одной инъекции и доводят на 8-й день до 10 инъекций. Если реакция на вакцину уменьшается, то берут более концентрированные разведения. Прогноз. При современных методах лечения прогноз для жизни благоприятный. Однако даже при полном исчезновении всех клинических проявлений у 20—30% реконвалесцентов в дальнейшем наступает обострение болезни. После перенесенного бруцеллеза могут сформироваться стойкие резидуальные явления (ограничение подвижности суставов, остеохондроз, нарушения зрения и др.). Правила выписки. Реконвалесценты выписываются после завершения курса лечения. Диспансеризация продолжается не менее 3 лет. Контрольные обследования проводятся врачами КИЗ в первый год — через 3 мес., во 2-й — через 4 и в 3-й год — через 6 мес. Проводятся общие анализы крови и мочи. В зависимости от органных поражений 1 раз в год проводится консультация ортопеда, невропатолога или уролога. Основными лечебно-профилактическими мероприятиями являются рациональное трудоустройство, режим труда и отдыха, ЛФК, физиотерапия. По показаниям санаторнокурортное лечение (не ранее 3 мес. после острой фазы болезни). Профилактика и мероприятия в очаге. Борьба с бруцеллезом сельскохозяйственных животных. Соблюдение мер профилактики при уходе за животными. Вакцинация и ревакцинация живой противобруцеллезной вакциной лиц, входящих в группу риска по бруцеллезу. 19 Ботулизм. Этиология. Эпидемиология. Патогенез. Классификация. Клиническая картина. Осложнения. Дифференциальная диагностика. Лабораторная диагностика. Принципы лечения. Мероприятия в эпидемическом очаге. Эпидемиологический надзор. Профилактические мероприятия. 4. БОТУЛИЗМ Ботулизм (Botulismus) — острая инфекционная болезнь, обусловлена нарушением токсинами коринебактерий ботулизма иннервации поперечно-полосатых и гладких мышц, что проявляется периферическими парезами и параличами, иногда с синдромом гастроэнтерита в начальном периоде. Этиология. Возбудитель ботулизма — Clostridium botulinum существует в природе в виде вегетативных форм и спор. Вегетативные формы представляют собой анаэробные подвижные грамположительные в молодой культуре палочки. В стареющих культурах они грамотрицательные, с терминально расположенными спорами, что придает им вид ракетки или веретена (от лат. clostrum — веретено). По антигенным свойствам продуцируемых токсинов С, botulinum подразделяются на 7 серологических типов — А, В, С, Д, Е, F, G. Оптимальные условия роста вегетативных форм — крайне низкое остаточное давление кислорода (0,40...1,33 кПа) и температурный режим в пределах от 28 до 35° С. Гибель их происходит при температуре 80° С в течение 30 мин. Характерной особенностью возбудителей ботулизма является их бурное размножение в трупном материале, так их выделяли из тканей головного мозга через 24 ч после гибели от ботулизма. В неблагоприятных условиях вегетативные формы возбудителей ботулизма образуют споры. Они чрезвычайно устойчивы к различным физическим и химическим факторам, выдерживают кипячение в течение 4—5 ч, воздействие различных дезинфицирующих средств в высоких концентрациях, сохраняются в продуктах, содержащих до 18% поваренной соли. Интерес представляет феномен образования при недостаточном прогревании так называемых «дремлющих спор», способных к прорастанию лишь через 6 месяцев. Споры устойчивы к замораживанию и высушиванию, к прямому ультрафиолетовому облучению. Со временем они повсеместно контаминировали почву, придонный ил рек и озер. Их находят даже там, куда еще не ступала нога человека. В анаэробных или близких к ним условиях споры прорастают в вегетативные формы, которые продуцируют специфический летальный нейротоксин, являющийся исключительным по силе фактором патогенности. Специально очищенный, доведенный до кристаллической формы, ботулотоксин может содержать миллионы летальных доз. Ботулинические токсины белковой природы в обычных условиях внешней среды сохраняются до года, в консервированных продуктах — годами. Они устойчивы в кислой среде, не инактивируются ферментами пищеварительного тракта, а токсические свойства ботулотоксина Е под влиянием протеолитических ферментов могут усиливаться в десятки и сотни раз. Ботулинические токсины выдерживают высокие концентрации (до 18%) поваренной соли, не разрушаются в продуктах, содержащих различные специи. Но они быстро инактивируются под влиянием щелочей, при кипячении полностью теряют свои токсические свойства в течение нескольких, а под воздействием небольших концентраций марганцовокислого калия, хлора или йода — в течение 15—20 мин. Присутствие токсина в пищевых продуктах не изменяет их органолептических свойств. Эпидемиология. Возбудители ботулизма широко распространены в природе. Вегетативные формы и споры обнаруживаются в кишечнике различных домашних и диких животных, водоплавающих птиц, рыб. Попадая во внешнюю среду, они в 20 спорообразном состоянии длительно сохраняются и накапливаются. Таким образом, источником инфекции могут быть животные, рыбы, птицы, а факторами передачи — содержимое их кишечника и контаминированная спорами почва. Однако для развития заболевания нужны специфические анаэробные условия, способствующие прорастанию спор, размножению и токсинообразованию вегетативных форм. Практически все пищевые продукты, загрязненные почвой или содержимым кишечника животных, птиц, рыб, могут содержать споры или возбудители ботулизма. Однако заболевание возникает только при употреблении тех из них, которые хранились при анаэробных или близких к ним условиях без достаточной предварительной термической обработки. Это могут быть мясные, грибные, растительные консервы, особенно домашнего приготовления, копченые, вяленые мясные и рыбные изделия, а также другие продукты, в которых имеются условия для развития вегетативных форм микробов и токсинообразования. В России чаще регистрируются заболевания, связанные с употреблением грибов домашнего консервирования, копченой или вяленой рыбы, в европейских странах — мясных и колбасных изделий, в США — бобовых консервов. Характерны групповые, семейные вспышки. Если инфицированный продукт твердофазный (колбаса, копченое мясо, рыба), то в нем возможны гнездная инфицированность возбудителями ботулизма и образование токсинов. Поэтому не все лица, употреблявшие один и тот же продукт, могут заболеть. В настоящее время чаще регистрируются заболевания, обусловленные отравлениями токсинами А, В и Е. Ботулизма D у людей не отмечено. Редко встречаются раневой ботулизм и ботулизм младенцев. Особенностью их является то, что заражение происходит вследствие попадания в рану или желудочнокишечный тракт годовалых детей спор возбудителей ботулизма. В разможженных, некротизированных тканях, лишенных доступа кислорода, создаются условия, близкие к анаэробным, при которых происходит прорастание из спор вегетативных форм и продуцирование ими ботулотоксина. Эквивалентом раневого ботулизма является ботулизм у наркоманов вследствие инокуляции спор с наркотиками («черная смола», «черный героин»)' кустарного производства. В местах их введения образуются абсцессы, в которых прорастают вегетативные формы, продуцирующие токсины. Ботулизм у грудных детей возникает при попадании в желудочно-кишечный тракт спор вместе с прикормом. При расследовании случаев младенческого ботулизма споры выделяли из меда, входящего в искусственные питательные смеси, или находили в окружающей ребенка среде (пыль, почва). Таким образом, эпидемиология ботулизма весьма сложная и предусматривает поступление в организм как токсина и возбудителя (в большинстве случаев), так и только возбудителей с токсинообразованием в организме заболевшего. Патогенез и патологическая анатомия. Ключевая роль в патогенезе ботулизма принадлежит токсину. При обычном заражении он попадает в организм вместе с пищей. Всасывание ботулотоксина происходит через слизистую оболочку верхних отделов желудочно-кишечного тракта, начиная с полости рта. Возможно проникновение ботулотоксина через слизистую дыхательных путей. Все типы токсинов представляют собой белки со свойствами глобулинов с молекулярной массой от 60 000 до 150 000 кД. Механизм действия ботулинических токсинов остается недостаточно изученным, и только отдельные его стороны представлены с определенной ясностью: 1) протеолитическое действие; 2) активация АДФ-рибозилирования; 3) нейротоксическое действие; 4) гемолитическое действие; 5) активация синтеза и секреции провоспалительных факторов. Токсин, поступивший в кровь, достигает центральной нервной системы и прочно связывается нервными клетками. Молекула токсина представляет собой Zn2+-зависимую эндопептидазу, при протеолизе разлагающуюся на 2 связанных дисульфидной связью 21 фрагмента (L- и Н-цепи). Один из механизмов биологической активности (блокирование высвобождения нейропередатчиков: альфа-глутамата, ацетилхолина) реализуется через связывание Н-цепи с цито-плазматической мембраной, последующим проникновением в клетку и формированием пор в синаптических пузырьках. Каждую пору формируют четыре молекулы токсина. Такая перестройка мембран синаптических пузырьков блокирует их слияние с пресинаптической мембраной и сопровождается дисфункцией синапсов. Кроме того, под влиянием ботулотоксина: — нарушается регуляторный процесс АДФ-рибозилированием G-белка мембран нервных клеток; — тормозится фосфорилирование цитозольных белков, стимулированное деполяризацией холинэргических синапсов; — наблюдается ингибирование ацетилхолинтрансферазы. Главным образом поражаются мотонейроны передних рогов преимущественно шейного и верхнегрудного отделов спинного мозга. Под влиянием токсина прекращается выделение нейротрансмиттеров в синаптическую щель. Одним из следствий этого является нарушение нервно-мышечной передачи возбуждений; возникают парезы и параличи. Причем холинэстеразная активность в синапсах практически не изменяется. Угнетение холинэргических процессов сопровождается повышением содержания катехоламинов. Вследствие нарушения вегетативной иннервации снижается секреция пищеварительных желез (выделение слюны, желудочного сока), развивается стойкий парез желудочно-кишечного тракта. Патогенное действие ботулинических токсинов в значительной степени усиливается при их повторном поступлении в кровь, после радиоактивного облучения. Парезы или параличи межреберных мышц, диафрагмы приводят к острой вентиляционной дыхательной недостаточности с развитием гипоксии и респираторного ацидоза. Нарушению вентиляции легких способствуют парезы или параличи мышц глотки и гортани, скопление густой слизи в над- и подсвязочном пространстве, аспирация рвотных масс, пищи, воды. При ботулизме вследствие опосредованного или прямого действия токсина развиваются все разновидности гипоксии: гипоксическая, гистотоксическая, гемическая и циркуляторная. В конечном итоге она и определяет течение и исходы заболевания. На фоне гипосаливации воспаляется слизистая ротоглотки, вследствие восходящей инфекции может развиваться гнойный паротит. Кроме того, циркулирующий в крови ботулотоксин оказывает гемолитическое и гемагглютинирующее воздействие на эритроциты, резко снижает фагоцитарную активность лейкоцитов (микро- и макрофагов). Возникают трофические расстройства. Для ботулизма характерны нарушения микроциркуляции вследствие набухания эндотелия капилляров, изменения их формы, спазма артериол и расширения венул, образования микротромбов. Вместе с содержащей ботулинический токсин пищей в организм больного попадают и возбудители ботулизма. В создающихся вследствие пареза желудочнокишечного тракта условиях, близких к анаэробным, они могут продуцировать токсин, поступление которого в кровь вызывает потенциированный токсический эффект. Патогенез раневого ботулизма и ботулизма младенцев отличается тем, что заражение происходит спорами, которые в анаэробных условиях раны или вследствие особенностей флоры и ферментативной деятельности кишечника грудных детей прорастают в вегетативные формы, продуцирующие токсины. Патологоанатомические изменения при ботулизме неспецифичны. Обычно наблюдаются гиперемия и полнокровие внутренних органов, в том числе головного мозга и его оболочек. Выражены признаки нарушения микроциркуляции в головном мозге. Отмечаются довольно умеренные деструктивные изменения нервных клеток. Степень их соответствует микроциркуляторным расстройствам. Довольно характерны для ботулизма 22 дистрофические изменения в сосудистых стенках микроциркуляторного русла, множественные мелкие кровоизлияния в серозные и слизистые оболочки, преимущественно желудочно-кишечного тракта, которые скорее всего обусловлены гипоксией. Симптомы и течение. Инкубационный период при ботулизме продолжается до суток, реже до 2—3 дней и очень редко (в единичных описаниях) до 9 и даже 12 дней. Короткому инкубационному периоду соответствует, хотя и не всегда, более тяжелое течение болезни. Заболевание, как правило, начинается внезапно. Основными клиническими признаками ботулизма являются различные неврологические симптомы, совокупность которых может варьировать в широком диапазоне и различной степени выраженности. В то же время примерно у каждого второго больного наблюдаются и синдромы острого гастроэнтерита, общей инфекционной интоксикации. В таких случаях больные жалуются на острые боли в животе, преимущественно в эпигастральной области, после чего наступают повторная рвота и жидкий, без патологических примесей стул до 3—5 раз в сутки. Иногда на этом фоне появляются головная боль, недомогание, отмечается повышение температуры тела от субфебрильной до 39—40° С. Однако к концу суток гипермоторика желудочно-кишечного тракта сменяется, как правило, стойкой атонией, температура тела становится нормальной. Начинают появляться основные, неврологические, признаки болезни. В редких случаях между гастроинтестинальным и неврологическим синдромами самочувствие больного в течение короткого времени (до суток) может оставаться вполне удовлетворительным и лишь при целенаправленном осмотре выявляются признаки поражения нервной системы. Наиболее типичными и ранними проявлениями ботулизма являются нарушения остроты зрения, сухость во рту и мышечная слабость. Больные жалуются на «туман в глазах», «сетку перед глазами», плохо различают близлежащие предметы, не могут читать сначала обычный шрифт, а затем — крупный. Появляется двоение в глазах. Развивается птоз различной степени выраженности. Изменяются высота и тембр голоса, иногда отмечается гнусавость. Речь невнятная. При прогрессировании болезни голос становится сиплым, охриплость может перейти в афонию. Нарушается глотание, появляются ощущение инородного тела в глотке, поперхивание, затруднение глотания вначале твердой, а затем и жидкой пищи, воды. В тяжелых случаях наступает полная афагия. При попытке проглотить воду последняя выливается через нос. В этом периоде возможны аспирация пищи, воды, слюны с развитием аспирационной пневмонии, гнойного трахеобронхита. Все вышеуказанные неврологические симптомы появляются в различных сочетаниях, последовательности и степени выраженности. Некоторые из них могут отсутствовать, однако обязательными являются нарушение саливации (сухость во рту), прогрессирующая мышечная слабость, переходящая в парезы и параличи. Мышечная слабость нарастает соответственно тяжести болезни. В начале болезни она наиболее выражена в затылочных мышцах, вследствие чего у таких пациентов голова может свисать и они вынуждены поддерживать ее руками. В разгаре заболевания больные вялые, адинамичны. Лицо маскообразное, со сглаженными чертами. Одно-, а чаще двусторонний птоз. Зрачки расширены, вяло или совсем не реагируют на свет, иногда анизокория. Возможны нистагм, косоглазие. Нарушается конвергенция и аккомодация. Высовывание языка происходит с трудом, иногда толчками. Ухудшается артикуляция. Слизистая ротоглотки сухая, глотки — яркокрасная. В надгортанном пространстве возможно скопление густой, вязкой слизи, вначале прозрачной, а затем мутноватой. Отмечается парез мягкого неба, мышц глотки и надгортанника, голосовых связок. Голосовая щель расширена. Больные малоподвижны. Маскообразное застывшее лицо, закрытые вследствие птоза глаза, поверхностное дыхание, афония могут наводить на мысль об утрате сознания. Кашель отсутствует, дыхательные шумы ослаблены. Нарастают гиперкапния, респираторный ацидоз. 23 Изменения сердечно-сосудистой системы обнаруживаются преимущественно при среднетяжелом и тяжелом течении болезни в виде тахикардии, артериальной гипотензии, а иногда гипертензии, метаболических изменений ЭКГ. Периферическая кровь практически не меняется, за исключением моноцитоза, встречающегося не во всех случаях. В то же время лейкоцитоз, нейтрофилез и увеличенная СОЭ должны настораживать в отношении гнойных осложнений ботулизма, пневмонии. Заболевание может протекать в легкой, среднетяжелой и тяжелой формах. Легкие случаи характеризуются стертостью или моносимптомностью неврологических проявлений. Чаще наблюдаются лишь расстройства аккомодации, небольшой птоз, иногда изменения тембра голоса на фоне умеренной мышечной слабости, гипосаливации. Продолжительность — от нескольких часов до нескольких суток. При среднетяжелом ботулизме имеются все клинические неврологические симптомы, выраженность которых неодинакова, а поражение мышц глотки, гортани не достигает степени афагии и афонии. Опасных для жизни дыхательных расстройств нет. Продолжительность болезни составляет 2—3 нед. Тяжелые формы заболевания характеризуются стремительным нарастанием поражений глазодвигательной, глоточной и гортанной мускулатуры, резким угнетением функции основных дыхательных мышц. При отсутствии адекватной терапии летальный исход обычно наступает от дыхательной недостаточности на 2—3-й день болезни. Выздоровление происходит медленно. Одним из ранних признаков улучшения является восстановление саливации. Постепенно регрессирует неврологическая симптоматика. Перемежающиеся расстройства зрения могут наблюдаться в течение нескольких месяцев. Несмотря на тяжелейшие, иногда несовместимые с жизнью неврологические расстройства, у переболевших ботулизмом не остается каких-либо стойких нарушений функций нервной системы или внутренних органов. Некоторыми особенностями отличаются раневой ботулизм и ботулизм младенцев. В обоих случаях отсутствуют гастроинтестинальный синдром и общая инфекционная интоксикация. При раневом ботулизме более продолжительные сроки инкубационного периода (4—14 дней), но неврологическая симптоматика характерна для ботулизма. Следует отметить, что у этих пациентов нет факта употребления продуктов, которые могли бы содержать ботулинический токсин. Ботулизм у грудных детей (ботулизм младенцев) наблюдается чаще при искусственном вскармливани. Инкубационный период неизвестен и установить его не представляется возможным. Первыми проявлениями болезни могут быть вялость детей, слабое сосание или отказ от него, задержка стула. Появление офтальмоплегических симптомов, хриплый плач, поперхивание должны навести на мысль о возможности ботулизма с неотложным проведением соответствующих диагностических мероприятий. Осложнения. Ботулотоксин в значительной степени снижает иммунную резистентность организма, поэтому определенную опасность представляют осложнения, связанные с инвазивными методами лечения (интубация, трахеостомия, ИВЛ, катетеризация мочевого пузыря и др.) и обусловленные присоединением вторичной госпитальной инфекции. Типичными осложнениями являются аспирационная пневмония, ателектазы, гнойные трахеобронхиты или их сочетания. Об их развитии свидетельствуют повышение температуры тела, лейкоцитоз и увеличенная СОЭ. Диагноз подтверждается рентгенологическим методом обследования, диагностической и лечебной бронхоскопией. Значительно реже возможно развитие гнойного паротита. Процесс, как правило, односторонний, имеет все признаки бактериальной очаговой инфекции. Иногда при надавливании на воспаленную околоушную железу можно заметить выделение гноя из устья стенонова протока. 24 Редко встречается такое специфическое осложнение, как «ботулинический миозит», чаще поражаются икроножные мышцы. Может возникнуть сывороточная болезнь. Критическим состоянием при ботулизме является острая вентиляционная дыхательная недостаточность. Для ее своевременного выявления целесообразно проведение спирографических исследований, определение газов крови и ее кислотноосновного состояния. Диагноз и дифференциальный диагноз. Диагноз ботулизма основывается на всестороннем анализе клинической картины заболевания и эпидемиологических предпосылок. Основными критериями диагностики ботулизма являются: — периферический характер параличей; — нарушения иннервации мышц (всегда двусторонние, хотя не одинаково выраженные); — гипосаливация и парез желудочно-кишечного тракта в разгаре заболевания. При дифференциальной диагностике необходимо учитывать признаки, исключающие ботулизм. К ним относятся менингеальные симптомы, патологические изменения спинномозговой жидкости, центральные (спастические) параличи, нарушения чувствительности, болевые неврологические симптомы, судороги, нарушения сознания, психические расстройства, а также синдром общей инфекционной интоксикации при развитой картине неврологических расстройств. Они должны наводить на мысль о стволовых энцефалитах, бульбарных формах полиомиелита, нарушениях мозгового кровообращения, об отравлении атропиноподобными веществами. Для дифференциальной диагностики с миастеническим бульбарным синдромом используется проба с антихолинэстеразными препаратами (прозерин), которые при ботулизме не оказывают терапевтического эффекта. В настоящее время в связи с повышением заболеваемости дифтерией актуальна дифференциальная диагностика с дифтерийными полиневритами. Необходимо учитывать предшествовавшие неврологическим симптомам лихорадку и дифтеритическое поражение глотки, остаточные проявления которого могут еще сохраняться, а также нередкие одновременные тяжелые поражения миокарда, односторонний характер неврологических расстройств. При передозировке атропина или отравлении веществами со сходным действием (белладонна, белена, дурман и др.) развиваются мидриаз и сухость во рту, свойственные ботулизму. Но ботулиническую интоксикацию позволяют исключить нарушения психики, в тяжелых случаях — судороги. Для дифференциальной диагностики с миастеническим бульбарным синдромом используется проба с антихолинэстеразными препаратами (прозерин), которые при ботулизме не оказывают терапевтического эффекта. Для подтверждения диагноза решающее значение имеют обнаружение и идентификация ботулинического токсина в сыворотке крови больных, рвотных массах или промывных водах желудка, а также в пищевых продуктах, при употреблении которых, возможно, произошло отравление. Могут применяться реакции непрямой гемагглютинации, преципитации в геле, но они менее информативны. В стадии разработки и внедрения реакция энзиммеченых антител. Для выделения возбудителя ботулизма производят посевы содержимого желудка, испражнений, подозрительных продуктов на анаэробные питательные среды (Китта— Тароцци) казеиново-грибную, бульон Хоттингера и др.). Исследованиям на определение токсина и выделение возбудителя подлежит секционный материал, а в случаях раневого ботулизма — отделяемое из раны, кусочки отторгающейся омертвевшей ткани, тампоны из раны. Ботулизм младенцев подтверждается определением в их крови ботулотоксинов и (или) возбудителей и токсинов в испражнениях. Лечение. Терапия при ботулизме во всех случаях должна быть неотложной, а наблюдение за больными постоянным, обеспечивающим профилактику осложнений и 25 готовность к немедленной дыхательной реанимации. Всем больным, независимо от сроков заболевания, уже на догоспитальном этапе показано промывание желудка. Его проводят вначале кипяченой водой, чтобы получить материал для лабораторного исследования, а затем 2—5% раствором натрия гидрокарбоната с целью одновременной нейтрализации токсина. Для промывания желудка используют толстый желудочный зонд. Процедуру продолжают до получения чистых промывных вод. Если глотание не нарушено и сохранены механизмы рвотного рефлекса, то удаление содержимого желудка достигают рефлекторным вызыванием рвоты. С целью выведения из кишечника еще не всосавшегося токсина показаны высокие очистительные клизмы с 5% раствором гидрокарбоната, солевые слабительные. Одновременно с попытками механического удаления или нейтрализации ботулотоксина в желудочно-кишечном тракте щелочными водными растворами больным вводят антитоксическую противоботулиническую сыворотку. Введение антитоксических сывороток является обязательным и главным компонентом неотложной терапии больных ботулизмом. Оно должно осуществляться в каждом случае клинического диагноза этого опасного для жизни заболевания, не ожидая его лабораторного подтверждения. Для специфической антитоксической терапии обычно используются гетерологичные (лошадиные) антитоксические моновалентные сыворотки, одна лечебная доза которых составляет по 10 тыс. ME типов А, С и Е, 5 тыс. ME — типа В и 3 тыс. ME — типа F. До установления типа токсина в одном шприце вводят смесь моновалентных сывороток (А, В и Е) по 1 лечебной дозе в случаях легкого или среднетяжелого течения и по 2 лечебные дозы больным с тяжелой клинической картиной заболевания. Сыворотку подогревают до температуры 37° С и вводят внутримышечно или внутривенно (в 400 мл 0,9% раствора натрия хлорида) в зависимости от степени тяжести заболевания. Если тип токсина известен, то назначают моновалентную антитоксическую сыворотку. При легких и среднетяжелых формах ботулизма можно обойтись однократным введением антитоксической сыворотки. При отсутствии эффекта или ухудшении состояния, а также в случаях тяжелой формы заболевания повторные введения сывороток возможны уже через 6—8 ч, а продолжительность специфической антитоксической терапии составляет 4—5 дней с интервалами вначале через 8 ч, а затем 12—24 ч. Критерием эффективности антитоксических сывороток является обратное развитие клинических проявлений болезни. Обычно вначале исчезает сухость во рту, т. е. восстанавливается саливация. Перед введением сывороток, одновременно с промыванием желудка, обязательно ставят внутрикожную пробу к гетерогенному (лошадиному) белку. Вначале внутрикожно вводят 0,1 мл разведенной 1:100 лошадиной сыворотки. При отсутствии аллергической реакции, отрицательной внутрикожной пробе (диаметр папулы не превышает 0,9 см, а краснота ограничена) через 20 мин внутрикожно вводят 0,1 мл неразведенной противоботулинической сыворотки. При отсутствии реакции через 30 мин вводят всю лечебную дозу. При положительной внутрикожной пробе антитоксическую сыворотку вводят после десенсибилизации путем подкожного введения разведенной лошадиной сыворотки с интервалами в 20 мин в дозах 0,5—2,0—5,0 мл и под прикрытием глюкокортикостероидов, антигистаминных препаратов. Перспективным средством специфической антитоксической терапии является лечебная нативная гомологичная плазма и человеческий противоботулинический иммуноглобулин. С целью неспецифической дезинтоксикации назначают внутрь энтеросорбенты (полифепан, энтеродез, СКН и др.), осуществляют инфузионно-дезинтоксикационную терапию. Для этого ежедневно внутривенно вводят по 400 мл гемодеза (не более 4 сут. подряд), лактасол, растворы глюкозы с одновременной стимуляцией диуреза (фуросемид, 26 по 20—40 мг). Необходимо следить за соблюдением водно-электролитного баланса, энергообеспечением. Показаны витамины, особенно В1 и С, при необходимости назначают сердечно-сосудистые средства. Терапевтическая эффективность глюкокортикостероидов не доказана, их применение скорее всего оправдано для предупреждения аллергических реакций или сывороточной болезни. С целью улучшения синаптической проводимости может быть использован гуанидина-гидрохлорид по 15—35 мг/кг/сут. Антихолинэстеразные препараты (прозерин) в остром периоде эффекта не дают. Их можно назначать во время реконвалесценции, особенно при упорной атонии кишечника. Из специальных методов интенсивной терапии больным ботулизмом, учитывая сложный характер гипоксии, показана гипербарическая оксигенация. В случае появления признаков острой дыхательной недостаточности аналеп-тики дыхания не показаны. Необходимы обеспечение воздухопроводимости верхних дыхательных путей, перевод больного на ИВЛ. Всем больным для подавления жизнедеятельности возбудителей ботулизма в желудочно-кишечном тракте и возможного дополнительного образования токсина назначают левомицетин по 0,5 г 4 раза в сутки в течение 5 дней, тетрациклины в среднетерапевтических дозах. В случае гнойных осложнений проводят соответствующую антибактериальную терапию. Прогноз. Нейротоксическое воздействие ботулотоксинов обратимо, и со временем происходит полное восстановление иннервации. Однако летальность при ботулизме высокая, при отдельных групповых заболеваниях может достигать 30—40%. Смерть обычно наступает на 2—3-й день болезни вследствие вентиляционной дыхательной недостаточности. Диспансеризация. Переболевшие ботулизмом подлежат наблюдению в течение года. После перенесенных среднетяжелых и тяжелых форм болезни показаны общеукрепляющие средства, витамины группы В, АТФ. При необходимости проводятся функциональные исследования (ЭКГ, ЭМГ и др.). Профилактика и мероприятия в очаге. Профилактика ботулизма основана на строгом соблюдении правил приготовления и хранения рыбных и мясных полуфабрикатов, консервированных продуктов, копченостей и т. п. Домашние консервы перед употреблением необходимо прокипятить. При выявлении случаев заболевания подозрительные продукты подлежат изъятию и лабораторному контролю, а употреблявшие их вместе с заболевшими лицами — медицинскому наблюдению в течение 10—12 дней. Активная иммунизация осуществляется только лицам, имеющим или могущим иметь контакт с ботулотоксинами. Врачебная экспертиза. Лица, перенесшие тяжелую форму ботулизма, могут временно освобождаться от работы на период восстановительного лечения. Военнослужащим после среднетяжелых и тяжелых форм ботулизма предоставляется отпуск по болезни. В отдельных случаях проходящие военную службу по контракту могут быть переведены для реабилитации в военные санатории. Лептоспирозы. Этиология. Эпидемиология. Патогенез. Клиническая картина. Осложнения. Дифференциальная диагностика. Лабораторная диагностика. Принципы лечения. Мероприятия в эпидемическом очаге. Эпидемиологический надзор. Профилактические мероприятия. 5. ЛЕПТОСПИРОЗ Лептоспироз (Leptospirosis, синонимы: болезнь Вейля, болезнь Васильева— Вейля, водная лихорадка, нанукаями и др.) — острая инфекционная болезнь, относящаяся к 27 природноочаговым нетрансмиссивным зоонозам, вызываемая различными серотипами лептоспир, характеризуется лихорадкой, симптомами общей интоксикации, поражением почек, печени, нервной системы. При тяжелых случаях наблюдается желтуха, геморрагический синдром, острая почечная недостаточность и менингит. Этиология. Возбудитель лептоспироза входит в состав рода Leptospira, который объединяет два вида: паразитический (патогенный) — Leptospira interrogans и сапрофитический — L. biflexa. Морфологически эти виды неотличимы, их дифференцируют по серологическим, культуральным и биохимическим свойствам. Лептоспиры разделяют на серотипы (серологические варианты). В настоящее время известно около 200 патогенных серотипов и около 60 — сапрофитных. Серотипы с общими антигенами объединяют в серологические группы. Патогенные серотипы объединены в 23 серогруппы. Отдельные серогруппы обозначаются следующим образом: например, серогруппа Pomona вида L. interrogans или L. interrogans var. Pomona, но не I. pomona. Лептоспиры имеют спиралевидную форму, обладают прямолинейной и ротационной подвижностью. В жидких средах для лептоспир характерно вращение вокруг длинной оси, делящиеся клетки резко изгибаются в точке намеченного деления. Лептоспиры способны перемещаться в направлении среды, обладающей большей вязкостью. Концы лептоспир изогнуты в виде крючков, но могут быть и безкрючковые варианты. Длина лептоспир 6—20 мкм, а поперечник 0,1—0,15 мкм. Количество завитков зависит от длины лептоспиры (в среднем около 20). Лептоспиры культивируются на средах, содержащих сыворотку крови. Лептоспиры относятся к гидрофилам. Важным условием для их выживания во внешней среде является повышенная влажность и рН в пределах 7,0—7,4, оптимальный рост лептоспир наблюдается при температуре 28—30 °С. Растут лептоспиры медленно, рост их обнаруживается на 5—7-й день. В нашей стране выделялись лептоспиры 13 серологических групп, 27 серотипов. Наиболее часто выделялись следующие серологические группы: Pomona, Hebdomadis, Grippo-typhosa, Canicola, Tarasovi. Эпидемиология. Лептоспироз считается наиболее распространенным зоонозом в мире. Он встречается на всех континентах, кроме Антарктиды, особенно распространен в тропических странах. Источником инфекции являются различные животные. Носительство лептоспир доказано выделением их культур у 98 видов млекопитающих (в том числе у 58 видов грызунов), 6 видов птиц и 2 представителей рептилий. Источниками инфекции могут быть как дикие, так и домашние животные (лесная мышь, полевка, водяные крысы, серые крысы, собаки, свиньи, крупный рогатый скот и др.). В разные годы значение отдельных видов животных в эпидемиологии лептоспироза может меняться. Так, во время Великой Отечественной войны в блокированном Ленинграде основным источником лептоспироза были серые крысы, а основным возбудителем была I. Icterohaemorrhagiae. В последние годы в Санкт-Петербурге заражение людей чаще (до 60%) происходило от собак, а основным возбудителем стала связанная с ними L. Canicola. Передача инфекции у животных чаще происходит через воду и корм. Человек, больной лептоспирозом, источником инфекции не является. Заражение человека чаще всего происходит при контакте кожи и слизистых оболочек с водой, загрязненной выделениями животных. Имеет значение контактс влажной почвой, загрязненной животными. Заражение может наступить также при убое инфицированных животных, разделке мяса, при употреблении некоторых продуктов (молоко и др.), зараженных выделениями инфицированных грызунов. Заболевания часто имеют профессиональный характер. Чаще заболевают дератизаторы, лица, работающие на заболоченных лугах, рисовых полях, работники животноводческих ферм, боен, доярки, пастухи, ветеринары. Характерна выраженная сезонность с максимумом заболеваемости в августе. 28 Патогенез и патологическая анатомия. Воротами инфекции чаще является кожа. Для проникновения лептоспир достаточно малейших нарушений целостности кожи. В связи с этим заражение наступает даже при кратковременном контакте с водой, содержащей лептоспиры. Возбудитель может проникать также через слизистые оболочки органов пищеварения и конъюнктиву глаз. На месте ворот инфекции воспалительных изменений («первичного аффекта») не возникает. Дальнейшее продвижение лептоспир происходит по лимфатическим путям. Ни в лимфатических сосудах, ни в лимфатических узлах воспалительных явлений также не развивается. Барьерная роль лимфатических узлов выражена слабо. Лептоспиры легко их преодолевают и заносятся в различные органы и ткани (преимущественно в печень, селезенку, легкие, почки, центральную нервную системы), в которых происходит размножение и накопление лептоспир. По времени это совпадает с инкубационным периодом. Эта фаза патогенеза равняется длительности инкубационного периода (от 4 до 14 дней). Начало болезни (обычно острое) связано с массивным поступлением лептоспир и их токсинов в кровь (при микроскопии в темном поле в крови обнаруживаются десятки лептоспир в поле зрения). Тяжесть болезни и выраженность органных поражений зависят не только от серотипа возбудителя, но и от реактивности макроорганизма. Вторичная массивная бактериемия приводит к обсеменению различных органов, где продолжается размножение возбудителей. У погибших от лептоспироза отмечаются многочисленные кровоизлияния, наиболее интенсивные в области скелетных мышц, почек, надпочечников, печени, желудка, селезенки и легких. В печени лептоспиры прикрепляются к поверхности клеток, а также находятся в межклеточном пространстве. Часть лептоспир погибает. Лептоспиры, их токсины и продукты обмена приводят к выраженной интоксикации, которая особенно быстро нарастает в первые 2—3 дня от начала болезни. Лептоспиры обладают гемолизином, что приводит к разрушению (гемолизу) эритроцитов. Возбудители и их токсические продукты обладают выраженным действием на сосудистую стенку и на свертывающую систему крови. В тяжелых случаях развивается тромбогеморрагический синдром (ТГС). Желтуха при лептоспирозе носит смешанный характер. Имеет значение отек печеночной ткани, деструктивные и некротические изменения паренхимы, а также гемолиз эритроцитов. В отличие от вирусного гепатита В, несмотря на резко выраженную желтуху, острая печеночная недостаточность развивается редко. Особое место в патогенезе лептоспироза занимает поражение почек. В большинстве случаев летальные исходы связаны с развитием острой почечной недостаточности (уремическая кома). Она возникает в результате непосредственного действия лептоспир и их токсических продуктов жизнедеятельности на клеточную стенку, приводит к тяжелым повреждениям эпителия почечных канальцев, коркового и подкоркового вещества почек, что приводит к нарушению процессов мочеобразования. Следствием этого является олигурия с возможным развитием уремии. В генезе анурии может иметь значение и выраженное снижение АД, что иногда наблюдается при лептоспирозе. Именно в почках наиболее длительно сохраняются лептоспиры (до 40 дней). У части больных (10—35%) лептоспиры преодолевают гематоэнцефалический барьер, что приводит к поражению центральной нервной системы, обычно в виде серозных менингитов. Кровоизлияния в надпочечники могут привести к развитию острой недостаточности коры надпочечников. Своеобразным и патогномоничным проявлением лептоспироза является поражение скелетных мышц (рабдомиализис), особенно выраженное в икроножных мышцах. В мышцах обнаруживаются типичные для лептоспироза фокальные некротические и некробиотические изменения. В биоптатах, сделанных на ранних этапах болезни, выявляют отек и васкулизацию. С помощью иммунофлюоресцентного метода в этих очагах обнаруживается лептоспирозный антиген. 29 Заживление происходит за счет формирования новых миофибрилл с минимальным фиброзом. Распад мышечной ткани и поражение печени приводят к повышению активности сывороточных ферментов (АсАТ, АлАТ, щелочной фосфатазы и др.). Иногда в результате гематогенного заноса развивается специфическое лептоширозное поражение легких (лептоспирозная пневмония), глаз (ириты, иридоциклиты), реже других органов. В процессе болезни начинает формироваться иммунитет. Иммунитет при лептоспирозе типоспецифичен. Возможно повторное инфицирование другим серотипом лептоспир. Специфический иммунитет сохраняется длительно. В периоде ранней реконвалесценции (обычно после 5—10-дневной апирексии) возможен рецидив болезни с возобновлением основных клинических проявлений. При адекватной антибиотикотерапии рецидивы не развиваются. В процессе выздоровления наступает полное очищение организма от лептоспир. Хронических форм лептоспироза не развивается, хотя могут быть резидуальные явления, например снижение зрения после перенесенного лептоспирозного иридоциклита. Симптомы и течение. Инкубационный период продолжается от 4 до 14 дней (чаще 7—9 дней). Болезнь начинается остро, среди полного здоровья без каких-либо предвестников (продромальных явлений). Появляется озноб, нередко сильный, температура тела быстро достигает высоких цифр (39—40° С). Больные жалуются на сильную головную боль, бессонницу, отсутствие апетита, жажду. Очень характерным признаком являются сильные боли в мышцах, особенно в икроножных. В процесс могут вовлекаться мышцы бедра и поясничной области, пальпация их очень болезненна. У части больных миалгия сопровождается резко выраженной гиперестезией кожи (сильная жгучая боль). Мышечные боли настолько сильные, что больные с трудом передвигаются или не могут двигаться вовсе (при тяжелых формах). При объективном обследовании можно обнаружить гиперемию и одутловатость лица, гиперемирована также кожа шеи и верхних отделов грудной клетки (симптом «капюшона»). Отмечается также инъекция сосудов склер, однако нет признаков конъюнктивита (ощущение инородного тела в глазу, наличие отделяемого и др.). Температура тела держится на высоком уровне (лихорадка обычно постоянного типа) в течение 5—10 дней, затем снижается коротким лизисом. У части больных, особенно если не назначались антибиотики, через 3-12 дней наблюдается вторая волна лихорадки, которая обычно короче первой. Очень редко наблюдается 2—3 рецидива. У некоторых больных после снижения температуры тела длительно сохраняется субфебрилитет. При более тяжелом течении лептоспироза с 3—5-го дня болезни появляется иктеричность склер, а затем и желтушное окрашивание кожи, выраженность которого изменяется в широких пределах (билирубин сыворотки крови может достигать 200 мкмоль/л и более). В это же время у 20—50% больных появляется экзантема. Элементы сыпи полиморфны, располагаются на коже туловища и конечностей. Сыпь может иметь кореподобный, краснухоподобный, реже скарлатиноподобный характер. Могут встречаться и уртикарные элементы. Макулезная сыпь склонна к слиянию отдельных элементов. В этих случаях образуются эритематозные поля. Эритематозная экзантема встречается наиболее часто. При развитии геморрагического синдрома преобладает петехиальная сыпь. Нередко появляется герпетическая сыпь (на губах, крыльях носа). Тром-богеморрагический синдром проявляется помимо петехиальной сыпи кровоизлияниями в кожу в местах инъекций, носовыми кровотечениями, кровоизлияниями в склеру. Со стороны сердечно-сосудистой системы наблюдается брадикардия, гипотония, приглушение тонов сердца, на ЭКГ — признаки диффузного поражения миокарда, при более тяжелых формах может отмечаться развернутая клиническая картина лептоспирозного миокардита. У части больных развиваются умеренно выраженные изменения слизистой оболочки верхних дыхательных путей, чаще в виде ринофарингита. Специфическая лептоспирозная пневмония наблюдается редко. Почти у всех больных к 30 4—5-му дню болезни отмечается увеличение печени, у половины больных увеличивается селезенка. Печень умеренно болезненна при пальпации. В последние годы участились (с 10—12 до 30—35%) признаки поражения центральной нервной системы в виде выраженного менингеального синдрома (ригидность затылочных мышц, симптомы Кернига, Брудзинского и др.). При исследовании спинномозговой жидкости отмечается цитоз (чаще в пределах 400—500 клеток в 1 мкл) с преобладанием нейтрофилов. В некоторых случаях спинномозговая жидкость изменяется, как при гнойном менингите (с цитозом до 3—4 тыс. в 1 мкл) с преобладанием нейтрофилов. У большинства больных выявляются признаки поражения почек (до анурии). В моче появляется белок (1 г/л и более), при микроскопии можно обнаружить гиалиновые и зернистые цилиндры, клетки почечного эпителия. В крови увеличивается содержание остаточного азота, мочевины, креатинина. При тяжелом течении болезни нарастает токсикоз, могут появиться признаки уремии (язвенные поражения толстой кишки, шум трения перикарда, судороги, расстройства сознания, вплоть до развития уремической комы). Острая почечная недостаточность является основной причиной смерти больных лептоспи-розом. По клинтескому тегению различают легкие, среднетяжелые и тяжелые формы лептоспироза. Проявлениями, характерными для тяжелых форм лептоспироза, служат: 1) развитие желтухи; 2) появление признаков тромбогеморрагического синдрома; 3) острая почечная недостаточность; 4) лептоспирозный менингит. В связи с этим тяжелые формы лептоспироза могут быть желтушными (независимо от серогруппы, обусловившей заболевание), геморрагическими, ренальными, менингеальными и смешанными, при которых наблюдаются два и более критерия тяжести. Заболевания, характеризующиеся высокой лихорадкой, выраженной общей интоксикацией, анемией и желтухой, обозначают иногда термином «синдром Вайля». У отдельных больных тяжелые формы характеризуются быстрым развитием острой почечной недостаточности без появления желтухи и геморрагического синдрома и могут закончиться летально на 3—5-е сутки от начала болезни. Среднетяжелые формы лептоспироза характеризуются развернутой картиной болезни, выраженной лихорадкой, но без желтухи и других критериев тяжелых форм лептоспироза. Легкие формы могут протекать с 2—3-дневной лихорадкой (до 38-39° С), умеренными признаками общей интоксикации, но без выраженных органных поражений. При исследовании периферической крови в острый период болезни наблюдается нейтрофильный лейкоцитоз (12—20 х 109/л), повышение СОЭ (до 40-60 мм/ч). Осложнения. Менингиты, энцефалиты, полиневриты, миокардиты, ириты, иридоциклиты, увеиты. С наслоением вторичной инфекции связаны пневмонии, отиты, пиелиты, паротиты. Критическим состоянием при лептоспирозе является острая почечная недостаточность. Диагноз и дифференциальный диагноз. При распознавании лептоспироза необходимо учитывать эпидемиологические предпосылки (профессия, сезонность, контакт с грызунами и др.) и характерную симптоматику. Основными критериями диагностики является острое начало, высокая лихорадка, гиперемия кожи лица («симптом капюшона»), поражение икроножных мышц, нейтрофильный лейкоцитоз. Дополнительными критериями являются увеличение печени, появление желтухи, анемизация, геморрагические проявления, менингеальный синдром. Дифференциальный диагноз следует проводить в зависимости от клинической формы болезни и выраженности (преобладания) органных поражений. Тяжелые желтушные формы лептоспироза приходится дифференцировать с вирусными гепатитами 31 и желтушными формами других инфекционных болезней (псевдотуберкулез, инфекционный мононуклеоз, сальмонеллез, малярия, сепсис), реже с токсическими гепатитами. В отличие от гепатитов лептоспироз начинается остро (больные нередко указывают не только день, но и час начала заболевания), температура с ознобом повышается до 38—40° С и не снижается при появлении желтухи. Существенным отличием является гиперемия лица, поражение икроножных мышц и почек, а также высокий нейтрофильный лейкоцитоз и повышенная СОЭ. При появлении геморрагического синдрома лептоспироз необходимо дифференцировать от геморрагической лихорадки с почечным синдромом, при которой нет характерных для лептоспироза поражений мышц, желтухи, изменений периферической крови. При появлении менингеального синдрома нужно дифференцировать лептоспироз от менингитов различной этиологии (паротитный, энтеровирусный, туберкулезный, орнитозный и др.). Для подтверждения диагноза имеют значение данные обычных лабораторных исследований (нейтрофильный лейкоцитоз, изменения мочи, повышение количества билирубина, остаточного азота и др.). Наиболее информативными являются специфические методы. Диагноз подтверждается обнаружением возбудителя или нарастания титра специфических антител. Лептоспиры в первые дни болезни иногда можно обнаружить в крови с помощью прямой микроскопии в темном поле, с 7—8-го дня можно микроскопировать осадок мочи, а при появлении менингеальных симптомов и спинномозговую жидкость. Однако этот метод чаще дает отрицательные результаты (особенно, если больной уже получал антибиотики), кроме того, этот метод нередко дает и ошибочные результаты, поэтому не нашел широкого применения. Лучшие результаты дает посев крови, мочи, спинномозговой жидкости. В качестве среды можно использовать 5 мл воды с добавлением 0,5 мл сыворотки кролика. При отсутствии среды в кровь, взятую для исследования, следует добавить антикоагулянт (лучше оксолат натрия), и тогда лептоспиры сохраняются до 10 дней. Можно использовать заражение лабораторных животных (морских свинок, хомяков). Наибольшее распространение получили серологические методы (РСК, реакция микроагглютинации и др.). Для исследования берут парные сыворотки (первая до 5—7-го дня болезни, вторая — через 7—10 дней). Положительными считаются титры 1: 10—1: 20 и выше. Более достоверным является нарастание титров антител в 4 раза и выше. Можно обнаружить лептоспиры в биоптатах икроножных мышц (окраска методом серебрения). У погибших лептоспиры можно обнаружить в почках и печени. Лечение. Основным методом лечения является возможно раннее назначение антибиотиков. Используется также введение специфического иммуноглобулина. При лечении больных тяжелыми формами лептоспироза, осложненными острой почечной недостаточностью, большое значение приобретает патогенетическая терапия. Наиболее эффективными антибиотиками являются пенициллины, при непереносимости их можно использовать антибиотики тетрациклиновой группы. Наиболее эффективно лечение, начатое до 4-го дня от начала болезни. Назначают пенициллин в дозе 6—12 млн ЕД/сут., при тяжелых формах, протекающих с менингеальным синдромом, дозу увеличивают до 16—20 млн ЕД/сут. В начале лечения пенициллином в течение первых 4—6 ч может развиться реакция Яриша—Герксгеймера. Из тетрациклинов наиболее эффективным является доксициклин, который назначают в дозе по 0,1 г 2 раза в день в течение 7 дней. Препарат дают перорально. При выраженной общей интоксикации и появлении геморрагического синдрома антибиотики комбинируют с кортикостероидными препаратами (преднизолон по 40—60 мг с постепенным снижением дозы в течение 8—10 дней). Противолептоспирозный иммуноглобулин (гамма-глобулин) вводят после предварительной десенсибилизации. В первый день вводят ОД мл разведенного (1:10) 32 иммуноглобулина под кожу, при отсутствии аллергической реакции через 30 мин под кожу вводят 1 мл разведенного (1:10) иммуноглобулина и еще через 30 минут — 10 мл неразведенного иммуноглобулина внутримышечно. На 2-й и 3-й дни лечения вводят по 5 мл (при тяжелых формах по 10 мл) неразведенного иммуноглобулина внутримышечно. Введение иммуноглобулина является лишь дополнением антибиотикотерапии. При развитии острой почечной недостаточности проводят комплекс соответствующих лечебных мероприятий (см. Методы интенсивной терапии). Прогноз. Исход болезни зависит от тяжести клинической формы, наличия осложнений и сопутствующих заболеваний и возраста больного. Причиной гибели больных чаще бывает острая почечная недостаточность. Правила выписки. Больные выписываются после полного клинического выздоровления (нормализация температуры тела, размеров печени, восстановление нормального диуреза и др.) и нормализации лабораторных показателей (лейкоцитоз, СОЭ, количество билирубина, креатинина, остаточного азота). Диспансеризация. Переболевшие лептоспирозом подлежат диспансерному наблюдению в течение 6 мес. Обязательные контрольные обследования врачом кабинета инфекционных заболеваний проводятся один раз в два месяца, в эти же сроки проводятся общие анализы крови, мочи и ЭКГ. Консультации невропатолога, окулиста и терапевта проводятся по показаниям и перед снятием с учета. Основными лечебнопрофилактическими мероприятиями является ограничение физических и психоэмоциональных нагрузок в первые 1-3 мес., проводится витаминотерапия в эти же сроки. При наличии осложнений и резидуальных явлений проводится лечение у невропатолога (остаточные явления менингита, полиневрит и др.), окулиста (иридоциклит, увеит и др.), терапевта (пиелиты и др.). Профилактика и мероприятия в очаге. Охрана источников водоснабжения от загрязнения. Защита продуктов и воды от грызунов. Вакцинация животных. Персонал, ухаживающий за больными животными, должен быть обеспечен резиновой обувью и перчатками. Эти лица, а также работники убойных цехов мясокомбинатов, системы канализации подлежат вакцинации. По эпидемиологическим показаниям может проводиться вакцинация и других групп населения и военнослужащих. Больные лептоспирозом опасности для окружающих не представляют. Листериоз. Этиология. Эпидемиология. Патогенез. Клинически формы. Осложнения. Дифференциальная диагностика. Лабораторная диагностика. Принципы лечения. Мероприятия в эпидемическом очаге. Эпидемиологический надзор. Профилактические мероприятия. Особенности внутрибольничного распространения. 6. ЛИСТЕРИОЗ Листериоз (Listeriosis) — инфекционная болезнь из группы зоонозов. У человека может протекать в виде острого сепсиса с поражением многих органов и систем, а также в хронической форме. У беременных женщин возможно внутриутробное заражение плода с последующим тяжелым заболеванием новорожденных (гранулематоз новорожденных). Этиология. Возбудитель — Listeria monocytogenes — представляет собой короткие (0,5—0,6 мкм) палочки или коккобактерии, грамположительные, аэробы, подвижные, растут в виде гладких колоний. Капсул и спор не образуют, подразделяются на 4 серотипа (1—4) и на подтипы (а, Ь, с, е). В настоящее время в мире 90% всех случаев заболеваний вызываются возбудителями типов 4Ь, lb, la. Листерии устойчивы во внешней среде. Они длительно сохраняются в испражнениях, почве, зерне, во льду, могут размножаться при температуре холодильника (+4...+6° С), быстро погибают при нагревании, под воздействием дезинфицирующих 33 препаратов. Чувствительны к антибиотикам тетрациклиновой группы, пенициллинам, рифампицину, стрептомицину, эритромицину. Эпидемиология. Листериоз встречается во всех странах мира. По данным ВОЗ (1993) за год всего было зарегистрировано 1167 случаев листериоза, подтвержденных выделением возбудителя. В странах Европы зарегистрировано 818 случаев, в Северной Америке — 197, Южной Америке — 17, Океании — 65, Азии — 69. Смертность колебалась от 5 до 38%. Среди умерших 147 новорожденных. За последние годы число зарегистрированных случаев листериоза существенно увеличилось (только в США свыше 1000 в год), что объясняется улучшением диагностики. Резервуаром инфекции в природе являются многие виды грызунов. Листерии часто выделяются и от домашних животных (кролики, свиньи, лошади, коровы, куры, утки). Листерии можно обнаружить в кормах (силос, сено, зерно), в фекалиях человека (1—5%), а также в различных продуктах. При исследованиях продуктов, взятых из холодильников у 123 заболевших, листерии обнаружены у 79 (64%) хотя бы в одном из продуктов. Чаще листерии обнаруживались в говядине (36% образцов), птице (32%), свинине (27%) и в овощах (11%). Несмотря на широкое распространение листерии, заболеваемость относительно невелика. Основной путь инфицирования алиментарный, обычно от употребления загрязненных бактериями продуктов. Доказано внутриутробное инфицирование плода от матери. Патогенез и патологическая анатомия. Воротами инфекции является слизистая оболочка желудочно-кишечного тракта. Возможно проникновение возбудителя через миндалины. Для развития манифестной формы болезни большое значение имеет состояние иммунной системы. Листериозом заболевают преимущественно дети первого года жизни и лица в возрасте старше 55 лет. Возникновению болезни способствуют факторы, подавляющие иммунную систему (кортикостероиды, иммунодепрессанты, диабет, ВИЧ-инфекция и др.). Трансплацентарная передача инфекции приводит к генерализованной форме листериоза у плода. При попадании возбудителя в кровь возникает острое лихорадочное заболевание. В дальнейшем происходит фиксация возбудителя в ретикулоэндотелиальной системе (печень, селезенка, лимфатические узлы) и в нервной системе с развитием менингитов и менингоэнцефалитов. Листерии могут длительно сохраняться в почках. В пораженных органах развиваются гранулемы (листериомы), состоящие из ретикулярных, моноцитарных клеток, ядерного детрита и лейкоцитов. В центре гранулем отмечаются скопления листерии. В центральной нервной системе отмечаются преимущественно периваскулярные инфильтраты с разрушением глиозных клеток. Симптомы и течение. Инкубационный период продолжается 2—4 нед. Клиническое течение листериоза отличается разнообразием. Различают следующие формы болезни: 1) ангинозно-септическую; 2) глазожелезистую; 3) железистую; 4) нервные формы (менингиты, менингоэнцефалиты, энцефалиты); 5) тифоподобную; 6) листериоз беременных; 7) листериоз новорожденных (септическое течение). По течению различают острые, подострые и хронические формы. Возможно бессимптомное носительство листерии. Острые формы начинаются внезапно, с ознобом повышается температура тела, появляются симптомы общей интоксикации (головная боль, бессонница, боли в мышцах, раздражительность). Заболевание нередко протекает с экзантемой (крупнопятнистая или эритематозная сыпь, сгущающаяся в области крупных суставов; на лице иногда образуется фигура бабочки). При железистых формах кроме названных симптомов отмечается увеличение и болезненность лимфатических узлов (углочелюстных, шейных, подмышечных, мезентериальных). При нервных формах листериоза появляются менингеальные симптомы (эта форма наблюдается у 75% детей с бактериологически подтвержденным листериозом). Наблюдаются симптомы Кернига, Брудзинского, спинномозговая жидкость вытекает под повышенным давлением, отмечается цитоз, небольшое увеличение количества белка. Могут наблюдаться и симптомы энцефалита. 34 Иногда в клинической картине листериоза на первый план выступают симптомы острого гастроэнтерита, острого пиелита, острого эндокардита. При острых формах листериоза нередко увеличиваются печень и селезенка. Длительность лихорадки варьирует от 3 дней до 2 нед. Листериоз беременных. Выраженных проявлений листериоза у беременных, как правило, не наблюдается. За несколько недель до родов наблюдается неясная лихорадка, протекающая с болями в мышцах, иногда появляются признаки тонзиллита, гнойного конъюнктивита. В других случаях во время беременности отмечаются легкие гриппоподобные заболевания. Эти признаки можно рассматривать как активацию латентного листериоза, который часто отмечается у беременных женщин (при исследовании испражнений листерии обнаруживались у 12—44% обследованных беременных женщин). Листериоз новорожденных. Эту форму называют также септико-гранулематозной. Врожденный листериоз характеризуется тяжелым течением и нередко приводит к гибели детей. Эта форма является своеобразным септическим заболеванием, сопровождающимся образованием специфических гранулем в различных органах. При заражении плода рождается мертвый или недоношенный ребенок, который неизбежно погибает в течение первых 2 нед. жизни. При заражении новорожденного во время родов признаки листериоза появляются через 1—2 нед. после рождения. Листериоз новорожденных протекает тяжело, с высокой летальностью. Основные симптомы заболевания у них: высокая лихорадка, одышка, заложенность носа, цианоз. Поражаются не только верхние дыхательные пути, но и легкие. У большинства больных увеличена печень, наблюдается желтуха, увеличение селезенки встречается реже, у отдельных больных появляется экзантема. Появляются менингеальные симптомы, иногда судороги, неравномерность сухожильных рефлексов, параличи. Экзантема захватывает туловище и конечности. Вначале появляются темно-красные пятна, затем они превращаются в папулы, а некоторые в везикулы. Отдельные элементы сыпи могут сливаться. Мелкие гранулемы формируются во многих внутренних органах. Это своеобразно протекающий сепсис, который обычно приводит к летальному исходу. В более легких случаях сыпи может не быть, иногда наблюдается фарингит, конъюнктивит, ринит, понос. После выздоровления у 15—20% реконвалесцентов сохраняются резидуальные явления со стороны центральной нервной системы. При хронических формах листериоза возбудитель длительное время может находиться в организме, не вызывая заметных клинических проявлений. Иногда они дают обострение в виде легких гриппоподобных заболеваний или обострения хронического пиелита. При ослаблении организма (новообразования, лейкозы, прием кортикостероидов и др.) у этих лиц может наступить обострение листериоза в виде генерализованной инфекции. Осложнения: кома, септический шок — могут обусловить развитие критических состояний. Диагноз и дифференциальный диагноз. Клиническая диагностика трудна. Необходимо лабораторное подтверждение диагноза. Бактериологически исследуют кровь, смывы зева, спинномозговую жидкость, околоплодные воды, плаценту, органы мертворожденных или умерших. Серологическая диагностика недостаточно эффективна из-за ложноположительных результатов, что обусловлено антигенным родством листерий и стафилококков. Предложен аллерген для внутрикожной аллергической пробы, однако он не получил широкого распространения. Дифференциальный диагноз проводят в зависимости от клинической формы листериоза. Острые железистые формы дифференцируют от инфекционного мононуклеоза, острого токсоплазмоза, болезней крови. Листериозные гнойные менингиты дифференцируют от гнойных менингитов другой этиологии (менингококковых, пневмококковых, стафилококковых и др.). Врожденный листериоз дифференцируют от 35 пневмоний, ОРЗ, пилороспазма. Листериоз отличается наличием узелковых элементов экзантемы, желтухой, высокой лихорадкой. Учитываются и эпидемиологические предпосылки. Лечение. При проведении терапии необходимо учитывать, что листериоз развивается на фоне других заболеваний (чаще это болезни сердца, рак, ВИЧ-инфекция, диабет, болезни почек и др.), поэтому нужно лечить не только листериоз, но и сопутствующие заболевания. Этиотропную терапию листериоза проводят различными антибиотиками или их сочетаниями. Препаратом выбора является ампициллин по 1 г через 4 ч, доза для новорожденных 100 мг/кг/сут. Препаратом резерва является ко-тримоксазол, препаратами второго ряда — эритромицин и бензилпенициллин в высоких дозах. При тяжелых формах листериоза этиотропную терапию продолжают до 14—21-го дня нормальной температуры. При листериозе беременных тетрациклин противопоказан. Прогноз неблагоприятный у детей до 1 года и у взрослых старше 60 лет, а также у лиц с тяжелыми сопутствующими заболеваниями (рак, СПИД и др.). У беременных женщин даже легкие формы листериоза могут привести к тяжелым поражениям плода. После листериозных менингоэнцефалитов возможны резидуальные явления со стороны центральной нервной системы. Прогноз благоприятный у взрослых без тяжелых сопутствующих заболеваний. Правила выписки. Реконвалесценты выписываются из инфекционного стационара после исчезновения клинических проявлений листериоза и стойкой нормализации температуры тела. Диспансеризация. Реконвалесцент выписывается под наблюдение врачей различных специальностей, в зависимости от заболеваний, на фоне которых развился листериоз,— эндокринолога (при диабете), онколога (при наличии новообразований), инфекциониста (ВИЧ-инфицированные). Эти заболевания обусловливают и длительность диспансерного наблюдения. Профилактика и мероприятия в очаге. Борьба с листериозом домашних животных. Тщательная термическая обработка мяса, запрещение употребления сырого молока. Беременных женщин, работающих в животноводстве, временно переводят на работу, не связанную с постоянным контактом с животными. Профилактика в окружении больного не проводится. Для профилактики врожденного листериоза большое значение имеет своевременное выявление листериоза у беременных и проведение соответствующей терапии. Специфическая профилактика не разработана. Сальмонеллез. Этиология. Эпидемиология. Патогенез. Классификация. Клиническая картина. Осложнения. Дифференциальная диагностика. Лабораторная диагностика. Принципы лечения. Мероприятия в эпидемическом очаге. Эпидемиологический надзор. Профилактические мероприятия. Особенности внутрибольничного распространения сальмонеллеза. 7. САЛЬМОНЕЛЛЕЗ Сальмонеллез (Salmonellosis) — это полиэтиологическая инфекционная болезнь, вызываемая различными серотипами бактерий рода Salmonella, характеризуется разнообразными клиническими проявлениями от бессимптомного носительства до тяжелых септических форм. В большинстве случаев протекает с преимущественным поражением органов пищеварительного тракта (гастроэнтериты, колиты). Этиология. Возбудитель — большая группа сальмонелл (семейство Enterobacteriaceae, род Salmonella), насчитывающая в настоящее время более 2200 серотипов. По современной классификации, предложенной ВОЗ в 1987 г., род Salmonella включает 36 только один вид. В этом виде насчитывается семь подвидов, которые дифференцируются путем ДНК — ДНК-гибридизации или по биохимическим свойствам. Каждый подвид разделяется на серовары в соответствии с О- и Н-антигенной специфичностью штаммов. Большинство сальмонелл патогенны как для человека, так и для животных и птиц, но в эпидемиологическом отношении наиболее значимы для человека лишь несколько сероваров, которые обусловливают 85—91% сальмонеллезов человека на всех континентах мира: S. typhimurium, S. enteritidis, S.panama, S. in-fantis, S. newport, S. agona, S. derby, S. london и др. Клинические проявления, вызванные различными сероварами сальмонелл, существенно не отличаются друг от друга, поэтому в настоящее время в диагнозе указывают лишь клиническую форму болезни и серовар выделенной сальмонеллы, что имеет значение для выявления источника инфекции. Сальмонеллы представляют собой грамотрицательные палочки длиной 2—4 мкм и шириной 0,5 мкм; имеют жгутики, подвижны, хорошо растут на обычных питательных средах при температуре от +6 до +46° С (оптимум роста +37° С). Длительно сохраняются во внешней среде: в воде до 5 мес., в мясе и колбасных изделиях от 2 до 4 мес., в замороженном мясе — около 6 мес., (в тушках птиц — более года), в молоке — до 20 дней, кефире — до 2 мес., в сливочном масле — до 4 мес., в сырах — до 1 года, в яичном порошке — от 3 до 9 мес., в пиве — до 2 мес., в почве — до 18 мес. В некоторых продуктах (молоко, мясные продукты) сальмонеллы способны не только сохраняться, но и размножаться, не изменяя внешнего вида и вкуса продуктов. Соление и копчение оказывают на них очень слабое влияние, а замораживание даже увеличивает сроки выживания микроорганизмов в продуктах. Сальмонеллы имеют три основных антигена: 0-соматический (термостабильный), Н-жгутиковый (термолабильный) и К-поверхностный (капсульный). Кроме того, у некоторых серовар сальмонелл описаны и другие антигены: Vi-антиген, или антиген «вирулентности» (один из компонентов 0-антигена), и М-антиген (слизистый). Основными факторами патогенности сальмонелл являются холероподобный энтеротоксин и эндотоксин липополисахаридной природы. Некоторые штаммы обладают способностью инвазии в эпителий толстой кишки (S. enteritidis). Эпидемиология. Сальмонеллез встречается во всех регионах мира. В настоящее время — это один из наиболее распространенных зоонозов в развитых странах. Заболеваемость сальмонеллезами повсеместно имеет тенденцию к росту, особенно это касается крупных городов с централизованной системой продовольственного снабжения. Источниками инфекции являются в основном домашние животные и птицы, однако определенное значение играет и человек (больной, носитель) как дополнительный источник. Наибольшую эпидемиологическую опасность представляют животныебактерионосители из-за отсутствия у них каких-либо признаков заболевания. При неправильном забое и разделке туш таких животных возможно посмертное инфицирование мяса содержимым кишечника. При обследовании крупного рогатого скота и мяса этих животных сальмонеллы обнаруживаются у 1—5%, при обследовании свиней — у 3—20%, овец — у 2—5%, кур, уток, гусей — более 50%. Носительство сальмонелл наблюдается у кошек и собак (до 10%), а также среди грызунов (до 40%). Сальмонеллезная инфекция широко распространена среди диких птиц (голуби, воробьи, скворцы, чайки и др.). Наибольшую опасность человек как источник инфекции представляет для детей первого года жизни, которые высокочувствительны ко всем кишечным инфекциям. Бактериовыделитель может представлять опасность и для взрослых в том случае, если он имеет отношение к приготовлению пищи, раздаче ее или продаже пищевых продуктов. Механизм передачи возбудителя фекально-оральный. В последнее время регулярно регистрируются вспышки сальмонеллеза в лечебных учреждениях, особенно в родильных, педиатрических, психиатрических и гериатрических отделениях, обусловленные антибиотико-устойчивыми штаммами сальмонелл. Вспышки 37 часто характеризуются высокой летальностью и могут продолжаться длительное время. Этот вид сальмонеллеза приобрел черты госпитальной инфекции с контактно-бытовым путем передачи инфекции через руки ухаживающих за детьми лиц, постельное белье, предметы ухода и др. Основной путь заражения при сальмонеллезе — алиментарный, обусловленный употреблением в пищу продуктов, в которых содержится большое количество сальмонелл. Обычно это наблюдается при неправильной кулинарной обработке, когда инфицированные продукты, в основном мясные (мясной фарш, изделия из него, студень, мясные салаты, вареные колбасы), находились в условиях, благоприятных для размножения сальмонелл. В последние годы отмечается значительный рост заболеваемости сальмонеллезом, связанный с распространением возбудителя (S. enteritidis) через мясо птицы и яйца. Во многих странах этот путь заражения сейчас является ведущим. Заболеваемость сальмонеллезом несколько выше в теплое время года, что связано с ухудшением условий хранения продуктов. Госпитальные вспышки, преимущественно в детских стационарах, возникают чаще в холодные месяцы. Сальмонеллезы могут встречаться как в виде групповых вспышек (обычно алиментарного происхождения), так и в виде спорадических заболеваний. Патогенез и патологическая анатомия. Воротами инфекции является тонкая кишка, где происходит колонизация возбудителя и внедрение во внутреннюю фазу. До сих пор остается неясным, почему в большинстве случаев инфекционный процесс при сальмонеллезе ограничивается только этапом колонизации и инвазии в близлежащие ткани, что приводит к развитию гастроинтестинальной формы заболевания. Вместе с тем, в небольшом проценте случаев в местах фиксации сальмонелл могут формироваться очаги пролиферативного, реже гнойного воспаления, что характерно для развития соответственно тифоподобной и септической форм сальмонеллеза. Захват сальмонелл макрофагами не приводит к их фагоцитозу. Они обладают способностью не только сохраняться, но и размножаться в макрофагах, преодолевать внутри них барьер кишечного эпителия, проникать в лимфатические узлы и кровь. Бактериемия у больных сальмонеллезом встречается часто, но обычно бывает кратковременной и носит перемежающийся характер. Это объясняется чередованием размножения сальмонелл в макрофагах и последующим выходом в кровь. В собственном слое слизистой оболочки тонкой кишки наблюдается интенсивное разрушение бактерий с высвобождением энтеротоксина и эндотоксина. Эндотоксин оказывает многообразное действие на различные органы и системы организма. Наиболее важными из них являются индукция лихорадки и нарушений микроциркуляции вплоть до развития инфекционно-токсического шока. Энтеротоксин, активируя аденилатциклазу энтероцитов, приводит к нарастанию внутриклеточной концентрации циклического аденозинмонофосфата, фосфолипидов, простагландинов и других биологически активных веществ. Это приводит к нарушению транспорта ионов Na и С1 через мембрану клеток кишечного эпителия с накоплением их в просвете кишки. По возникающему осмотическому градиенту вода выходит из энтероцитов, развивается водянистая диарея. В тяжелых случаях заболевания вследствие потери жидкости и электролитов наблюдаются значительное нарушение водно-солевого обмена, уменьшение объема циркулирующей крови, понижение АД и развитие гиповолемического шока. Одновременно с потерей жидкости при сальмонеллезе развивается синдром диссеминированного внутрисосудистого свертывания, который является как следствием воздействия эндотоксина на свертывающую систему крови, так и гиповолемии. Страдает и сосудисто-нервный аппарат, что проявляется в понижении тонуса сосудов, нарушении терморегуляции. Иммунные реакции при сальмонеллезе представляются в виде сочетания так называемого местного (кишечного) иммунитета, который проявляется прежде всего 38 гуморальной иммунной реакцией (секреция IgA), и слабовыраженной клеточной реакцией. Общая гуморальная реакция выражается продукцией различных классов иммуноглобулинов, а клеточная — повышением фагоцитарной активности макрофагов, тесно связанной с активной выработкой антител и реакцией последних с бактериальными антигенами. Образование антител у больных сальмонеллезом нередко рассматривают как реакцию, протекающую по типу вторичного иммунного ответа, так как большинство взрослых людей неоднократно в течение жизни контактирует с сальмонеллами, в результате чего развивается сенсибилизация организма и возможны реакции гиперчувствительности. Развитие тифоподобной, септической, субклинической и хронических форм сальмонеллеза объясняется возникновением иммунологической толерантности к антигенам сальмонелл. Последняя является следствием либо мимикрии антигенов, либо результатом временного снижения функциональной активности фагоцитов и лимфоцитов макроорганизма (развития вторичного иммунодефицита). Симптомы и течение. Инкубационный период при пищевом пути заражения колеблется от 6 ч до 3 сут. (чаще 12—24 ч). При внутрибольничных вспышках, когда преобладает контактно-бытовой путь передачи инфекции, инкубация удлиняется до 3—8 дней. Выделяют следующие клинические формы сальмонеллеза: 1) гастроинтестинальная (локализованная), протекающая в гастритическом, гастроэнтерити-ческом, гастроэнтероколитическом и энтероколитическом вариантах; 2) генерализованная форма в виде тифоподобного и септического вариантов; 3) бактерионосительство: острое, хроническое и транзиторное; 4) субклиническая форма. Манифестные формы сальмонеллеза различаются и по тяжести течения. Гастроэтестинальная форма (острый гастрит, острый гастроэнтерит или гастроэнтероколит) — одна из самых распространенных форм сальмонеллеза (96—98% случаев). Начинается остро, повышается температура тела (при тяжелых формах до 39° С и выше), появляются общая слабость, головная боль, озноб, тошнота, рвота, боли в эпигастральной и пупочной областях, позднее присоединяется расстройство стула. У некоторых больных вначале отмечаются лишь лихорадка и признаки общей интоксикации, а изменения со стороны желудочно-кишечного тракта присоединяются несколько позднее. Наиболее выражены они к концу первых и на вторые и третьи сутки от начала заболевания. Выраженность и длительность проявлений болезни зависят от тяжести. При легкой форме сальмонеллеза температура тела субфебрильная, рвота однократная, стул жидкий водянистый до 5 раз в сутки, длительность поноса 1—3 дня, потеря жидкости не более 3% массы тела. При среднетяжелой форме сальмонеллеза температура повышается до 38—39° С, длительность лихорадки до 4 дней, повторная рвота, стул до 10 раз в сутки, длительность поноса до 7 дней; отмечаются тахикардия, понижение АД; могут развиться обезвоживание 1—2-й степени, потеря жидкости до 6% массы тела. Тяжелое течение гастроинтестинальной формы сальмонеллеза характеризуется высокой лихорадкой (выше 39° С), которая длится 5 и более дней, выраженной интоксикацией. Рвота многократная, наблюдается в течение нескольких дней; стул более 10 раз в сутки, обильный, водянистый, зловонный, может быть с примесью слизи. Понос продолжается до 7 дней и более. Отмечается увеличение печени и селезенки, может быть иктеричность кожи и склер. Наблюдаются цианоз кожи, тахикардия, значительное понижение АД. Выявляются изменения со стороны почек: олигурия, альбуминурия, эритроциты и цилиндры в моче, повышается содержание остаточного азота. Может развиться острая почечная недостаточность. Нарушается водносолевой обмен (обезвоживание 2—3-й степени), что проявляется в сухости кожи, цианозе, афонии, судорогах. Потери жидкости достигают 7—10% массы тела. В крови повышается 39 уровень гемоглобина и эритроцитов, характерен умеренный лейкоцитоз со сдвигом лейкоцитарной формулы влево. Наиболее частый клинический вариант при гастроинтестинальном сальмонеллезе гастроэнтерический. Деструктивные изменения в толстой кишке (катаральногеморрагические) регистрируются лишь в 5—8% случаев. Гастроэнтероколитические и колитические варианты заболевания должны диагностироваться только, если в клинической картине заболевания преобладают проявления колита и имеется бактериологическое или серологическое подтверждение диагноза, так как эти варианты сальмонеллеза весьма сходны по течению с острой дизентерией. Тифоподобный вариант генерализованной формы. Заболевание чаще начинается остро. У некоторых больных первыми симптомами болезни могут быть кишечные расстройства в сочетании с лихорадкой и общей интоксикацией, но через 1—2 дня кишечные дисфункции проходят, а температура остается высокой, нарастают симптомы общей интоксикации. У большинства больных по началу и течению заболевание сходно с брюшным тифом и паратифами А и В. Лихорадка может быть постоянного типа, но чаще волнообразная или ремиттирующая. Больные заторможены, апатичны. Лицо бледное. У некоторых больных на 2—3-й день появляется герпетическая сыпь, а с 6—7-го дня — розеолезная сыпь с преимущественной локализацией на коже живота. Наблюдается относительная брадикардия, понижение АД, приглушение тонов сердца. Над легкими выслушиваются рассеянные сухие хрипы. Живот вздут. К концу 1-й недели болезни появляется увеличение печени и селезенки. Длительность лихорадки 1—3 нед. Рецидивы отмечаются редко. Септическая форма — наиболее тяжелый вариант генерализованной формы сальмонеллеза. Заболевание начинается остро, в первые дни оно имеет тифоподобное течение. В дальнейшем состояние больных ухудшается. Температура тела становится неправильной — с большими суточными размахами, повторным ознобом и обильным потоотделением. Заболевание протекает, как правило, тяжело, плохо поддается антибиотикотерапии. Вторичные септические очаги могут образоваться в различных органах, вследствие чего клинические проявления этого варианта сальмонеллеза весьма разнообразны, а диагностика его трудна. Сформировавшийся гнойный очаг в симптоматике выступает на первый план. Гнойные очаги часто развиваются в опорнодвигательном аппарате: остеомиелиты, артриты. Иногда наблюдаются септический эндокардит, аортит с последующим развитием аневризмы аорты. Относительно часто возникают холецисто-холангиты, тонзиллиты, шейный гнойный лимфаденит, менингиты (последние обычно у детей). Реже наблюдаются гнойные очаги других локализаций, например абсцесс печени, инфицирование кисты яичника, сальмонеллезный струмит, мастоидит, абсцесс ягодичной области. Септический вариант сальмонеллеза характеризуется длительным течением и может закончиться летально, особенно в случаях сочетания с ВИЧ-инфекцией. Диагноз обычно устанавливают после выделения сальмонелл из гноя вторичного очага или из крови в первые дни болезни. У детей первого года жизни и лиц старше 60 лет наблюдается более тяжелое течение сальмонеллеза с более частым вовлечением в патологический процесс толстой кишки, продолжительным бактериовыделением, замедленной нормализацией стула и большей частотой развития генерализованных форм. Бактерионосительство. При этой форме отсутствуют клинические симптомы, и она выявляется при бактериологических и серологических исследованиях. Бактерионосителей сальмонелл разделяют на следующие категории: 1) острое бактерионосительство; 2) хроническое носительство; 3) транзиторное носительство. Острое носительство наблюдается у реконвалесцентов после манифестных форм сальмонеллеза; оно характеризуется выделением сальмонелл длительностью от 15 дней до 3 мес. 40 О хроническом носительстве говорят, если сальмонеллы выделяются более 3 мес. Для подтверждения диагноза хронического носительства необходимо наблюдение в течение не менее 6 мес. с повторными бактериологическими исследованиями кала, мочи, дуоденального содержимого. Из серологических реакций используют РИГА. О транзиторном бактериовыделении можно говорить в тех случаях, когда отсутствуют клинические проявления сальмонеллеза в момент обследования и в предыдущие 3 мес., когда положительные результаты бактериологического исследования отмечались 1—2 раза с интервалом один день, при последующих отрицательных исследованиях. Кроме того, должны быть отрицательными серологические исследования (РИГА) с сальмонеллезным диагностикумом в динамике. Субклинигеская форма салъмонеллеза диагностируется на основании выделения сальмонелл из фекалий в сочетании с выявлением диагностических титров противосальмонеллезных антител в серологических реакциях. Клинические проявления заболевания в этих случаях отсутствуют. Диагноз и дифференциальный диагноз. Сальмонеллезные заболевания распознаются на основании клинических, эпидемиологических и лабораторных данных. Типичные гастроэнтерические формы, особенно при групповых заболеваниях, можно диагностировать на основании клинико-эпидемиологических данных; при других формах необходимо лабораторное подтверждение диагноза. Гастроинтестинальные формы необходимо дифференцировать от острых гастроэнтеритов бактериальной и вирусной природы, пищевых отравлений ядовитыми продуктами растительного и животного происхождения, органическими и неорганическими веществами, а также некоторых хирургических и терапевтических заболеваний, при которых наблюдается сходная клиническая картина (острый аппендицит, инфаркт миокарда, субарахноидальное кровоизлияние и др.). При гастроинтестинальных формах производится бактериологическое исследование продуктов, которые больные употребляли за 12—24 ч до заболевания, рвотных масс и испражнений. Тифоподобные заболевания клинически трудноотличимы от брюшного тифа, и вопрос решает выделение сальмонелл из крови. Особенно трудно диагностировать септические формы сальмонеллеза, протекающие без кишечных поражений. При этих формах на первый план выступают вторичные гнойные очаги, которые могут симулировать эндокардит, остеомиелит, холецистит, острый аппендицит и другие заболевания. Подтверждением служит выделение сальмонелл из крови и гноя вторичных септических очагов. Клинические варианты сальмонеллеза с поражением толстой кишки дифференцируют от острой дизентерии. При сальмонеллезе более выражена и продолжительна лихорадка. В процесс вовлекается не только сигмовидная, но и другие отделы толстой кишки. Печень и селезенка увеличены, что очень редко бывает при дизентерии. Помимо выделения сальмонелл, используются серологические методы — реакция агглютинации и РНГА. Более информативна последняя реакция. Антитела выявляются с 4—6-го дня, достигая максимума на 2—3-й неделе. Диагностический титр 1:160 и выше. Более доказательно нарастание титра антител при повторном исследовании. Лечение. Больных сальмонеллезом госпитализируют по клиническим (тяжелое и средней тяжести течение) и эпидемиологическим (лица, живущие в общежитиях, декретированное население) показаниям. Остальные лечатся в домашних условиях. При гастроинтестинальных формах этиотропная терапия показана только при среднетяжелом и тяжелом течении заболевания. Назначаются фторхинолоны: ципрофлоксацин по 1,0 г/сут., норфлоксацин или офлоксацин по 0,8 г/сут. на 3—5 дней. Необходимо как можно раньше промыть желудок 2—3 л воды или 2% раствором гидрокарбоната натрия. Промывание проводят с помощью желудочного зонда до отхождения чистых промывных вод. При легких формах ограничиваются промыванием желудка, диетой и питьем солевых растворов. Обычно используют раствор следующего состава: натрия хлорида — 41 3,5 г, калия хлорида — 1,5 г, гидрокарбоната натрия — 2,5 г, глюкозы — 20 г на 1 л питьевой воды. Количество жидкости должно соответствовать ее потерям (не более 3% массы тела). При средней тяжести течения гастроинтестинальной формы сальмонеллеза, отсутствии рвоты и выраженных нарушений гемодинамики жидкость также можно вводить перорально. При повторной рвоте и нарастании обезвоживания растворы вводят внутривенно. Объем вводимой жидкости определяется степенью обезвоживания. Растворы вводят подогретыми до 38—40° С со скоростьк 40—48 мл в 1 мин. Наиболее эффективен раствор «Квартасоль», содержащю на 1 л апирогенной воды 4,75 г натрия хлорида, 1,5 г калия хлорида, 2,6 г на-трия ацетата и 1 г натрия гидрокарбоната. Можно использовать и другие полиионные растворы: «Трисоль», «Ацесоль», «Хлосоль», «Рингерлактат». Нельзя вводить изотонический раствор хлорида натрия или глюкозы, так как они не восполняют дефицит калия и оснований. При тяжелом течении гастроинтести-нальной формы сальмонеллеза больной помещается в палату интенсивной терапии. При выраженном обезвоживании лечение начинается с внутривенногс введения подогретых полиионных растворов («Квартасоль», «Ацесоль») со скоростью 60—80 мл/мин. Общий объем определяется степенью дегидратации. Внутривенное вливание отменяется после прекращения рвоты, стабилизации гемодинамических показателей и восстановления выделительной функции почек. Доказательством восстановления водно-электролитного обмена является значительное преобладание количества мочи над объемом испражнений в течение 4—8 ч. Общий объем вводимых растворов при тяжелых формах чаще колеблется в пределах 4—10 л. В случае развития инфекционно-токсигеского шока при отсутствии эффекта от инфузионной терапии дополнительно назначают 60—90 мг преднизолона или 125—250 мг гидрокортизона внутривенно струйно, через 4—6 ч переходят на капельное введение (до 120—300 мг преднизолона в сутки). Исходя из патогенетических механизмов развития диареи и интоксикации при сальмонеллезе, в последнее время предложено ввести в схемы лечения больных ряд препаратов, воздействующих на то или иное звено патогенеза заболевания. Средствами неспецифической дезинтоксикации являются энтеро-сорбенты: энтеродез, энтеросорб, полифепан, полисорб МП и др., которые принимаются перорально, разведенные водой, 3—6 раз в сутки. Патологическое действие эндотоксина сальмонелл опосредуется частично через усиление синтеза простагландинов. Поэтому патогенетически обоснованным является включение в комплексную терапию сальмонеллезов препаратов, обладающих антипростагландиновой активностью: индометацина или ацетилсалициловой кислоты. Индометацин рекомендуется применять внутрь по 50 мг 3 раза в течение первых 12 ч, аспирин — по 0,25—0,5 г 3 раза в первые сутки лечения в стационаре. К лекарственным препаратам, стимулирующим абсорбцию ионов натрия из просвета кишки, относятся производные морфина, в частности широко применяемый в последнее время лоперамид (имодиум). Его назначают однократно 4 мг (2 капсулы) и затем по 2 мг после каждой дефекации, но не более 16 мг в сутки. В случае отсутствия эффекта в течение 48 ч лечение прекращают. Однако препарат, снижая перистальтику кишки, увеличивает продолжительность контакта с сальмонеллами, что может усиливать интоксикацию и задерживать очищение от возбудителя. Широкое распространение в лечении диарей имеет комбинированный препарат висмута — субсалицилат. Фармакологически активными в данном препарате являются оба компонента. Сам висмут обладает вяжущим свойством и антимикробной активностью в отношении возбудителей кишечных инфекций, в том числе сальмонелл. Салициловая часть подавляет синтез простагландинов. Препарат назначают каждые 30 мин в виде 42 таблеток или суспензии (взрослым 30 мл или 2 таблетки, детям до 6 лет 5 мл или уз таблетки, а детям старше 6 лет в дозах, равных половине взрослой до 8 приемов). В случае тяжелой диареи дозы могут удваиваться. Антидиарейные препараты патогенетической направленности, способные снижать потери жидкости на 30% и более, делают эффективными другие способы лечения, в частности пероральную регидратацию. При подозрении на развитие генерализованных форм сальмонеллеза (лихорадка более 2 сут.) антибактериальная терапия обязательна. Большинство штаммов, выделяемых в настоящее время (особенно S. typhimurium), резистентны к ампициллину, котримоксазолу, хлорамфениколу. Поэтому рекомендуется терапия одним из следующих препаратов: цефтриаксон по 2,0 г/сут., ципрофлоксацин или офлоксацин по 0,8 г/сут. внутривенно в течение 10—14 дней. При септических формах комбинируют лечение антибиотиками с хирургической санацией гнойных очагов. При хронигеском бактерионосительстве сальмонелл назначают ципрофлоксацин в дозе — 1,5 г/сут. в течение 28 дней. Во всех случаях заболевания показаны препараты, повышающие реактивность организма и нормализующие кишечную микрофлору (витамины, пентоксил, эубиотические бактериальные препараты), проводится лечение сопутствующих заболеваний. Прогноз. При локализованных формах сальмонеллеза прогноз благоприятный. В случаях развития генерализованных форм, особенно септической, возможны летальные исходы. Правила выписки. Больные сальмонеллезом могут быть выписаны из стационара после полного клинического выздоровления и однократного бактериологического исследования кала (для работников пищевых предприятий — двукратного) с отрицательным результатом. Диспансеризация. Работники пищевых предприятий и дети, посещающие ясли, наблюдаются в течение 3 мес. с бактериологическим исследованием кала (1 раз в месяц). Бактерионосители не допускаются к работе на пищевых и приравненных к ним предприятиях. Профилактика и мероприятия в очаге. Ветеринарно-санитарный надзор за убоем скота и птицы, технологией обработки туш, приготовлением и хранением мясных и рыбных блюд. Организация вакцинации сельскохозяйственных животных и птиц сальмонеллезными вакцинами. После госпитализации больного наблюдают за очагом в течение недели. Работники пищевых и приравненных к ним предприятий, дети, посещающие детские учреждения, подвергаются однократному бактериологическому обследованию. Пищевые токсикоинфекции(Vibrio parahaemolytica). Этиология. Эпидемиология. Патогенез. Классификация. Клиническая картина. Осложнения. Дифференциальная диагностика. Лабораторная диагностика. Принципы лечения. Мероприятия в эпидемическом очаге. Эпидемиологический надзор. Профилактические мероприятия. Особенности внутрибольничного распространения. 8. ПИЩЕВЫЕ ТОКСИКОИНФЕКЦИИ Пищевые токсикоинфекции (Toxicoinfectiones alimentariae) — группа острых бактериальных кишечных инфекций и интоксикаций, обусловленных употреблением в пищу продуктов, инфицированных (контаминированных) патогенными и условнопатогенными микроорганизмами, в которых они размножились и накопились их токсины. 43 Пищевые токсикоинфекции — болезни полиэтиологические, объединенные общим, алиментарным, механизмом заражения, острым началом и бурным течением, основными клиническими проявлениями которого являются синдромы острого гастрита, острого гастроэнтерита и реже — острого гастроэнтероколита. Этиология. Возбудителями пищевых токсикоинфекции являются многие виды бактерий, способных размножаться и накапливаться в течение короткого времени в различных пищевых продуктах. Некоторые из них, в частности шигеллы Зонне, сальмонеллы, возбудители ботулизма, при определенных условиях вызывают заболевания, которые, начинаясь с синдрома гастроэнтерита, в дальнейшем трансформируются в определенную клиническую форму, в связи с чем рассматриваются в соответствующих разделах. Токсикоинфекции чаще вызываются условно-патогенными микробами, способными продуцировать экзотоксины, а при разрушении выделять эндотоксины. Большинство из них обитает в качестве сапрофитов в кишечнике практически здоровых людей и многих представителей животного мира. В силу условной патогенное™ для развития заболевания необходим ряд таких факторов, как достаточная инфицирующая доза (для большинства — не менее 10s—106 микробных тел в 1 г инфицирующего субстрата), относительные вирулентность и токсигенность штаммов микроорганизмов. Определенное значение может иметь и состояние макроорганизма (снижение барьерной функции желудка, сопутствующая патология и т. п.). Чаще заболевания возникают при инфицировании пищи штаммами бактерий, способных продуцировать энтеротоксины, усиливающие секрецию изотонической жидкости в просвет тонкой кишки. К таким возбудителям пищевых токсикоинфекций относятся энтеропатогенные кишечные палочки, Proteus vulgaris, Proteus mirabilis, Bacillus cereus, Klebsiella, Enterobacter, Aeromonas, Edwardsiella, Vibrio. Энтеротоксины вышеуказанных возбудителей являются термолабильными. Причиной пищевых токсикоинфекций могут быть Clostridium perfringens сероваров А, реже С и F, а также стафилококки (St. aureus, St. epidermidis). Энтеротоксин золотистого стафилококка термостабилен, выдерживает кипячение до 2 часов, поэтому может сохранять токсигенность и при отсутствии микробов. Некоторые возбудители пищевых токсикоинфекций способны продуцировать и цитотоксины. Этими свойствами обладают Klebsiella pneumoniae, Enterobacter cloacae, Aeromonas hydrophila, Vibrio parahaemolyticus, St. aureus, Cl. perfringens и многие другие. Разрушение бактерий как в пищевых продуктах, так и в желудочно-кишечном тракте сопровождается высвобождением липополисахаридных фракций микробов, относящихся к эндотоксинам, которые также могут участвовать в формировании симптомокомплекса токсикоинфекций. Эпидемиология. Источниками возбудителей пищевых токсикоинфекций являются люди и животные. Выделяясь с испражнениями, возбудители контаминируют продукты питания, попадают в почву, на различные предметы. Особую опасность представляют лица, работающие на предприятиях общественного питания. Источниками заболеваний, вызванных стафилококками, являются люди, страдающие пиодермией, ангинами, хроническими тонзиллитами, заболеваниями дыхательных путей. Зоонозными источниками пищевых токсикоинфекций, особенно стафилококковых, могут быть больные маститом коровы, козы, овцы и другие животные. Причиной заболеваний, обусловленных сальмонеллами, нередко бывает употребление мяса больных животных (вынужденный забой), инфицированных яиц или приготовленных из них кулинарных и кондитерских изделий. Некоторые возбудители, в частности С. perfringens, Вас. cereus, Proteus, выделяясь с испражнениями людей и животных, обсеменяют почву, воду открытых водоемов, содержатся на овощах и корнеплодах. Механизм передачи возбудителя фекально-оральный, несмотря на различие факторов передачи. Заболевания, как правило, возникают после употребления пищи, загрязненной в процессе приготовления, хранения или реализации готовой продукции, 44 при инфицировании ее лицами, работающими на пищевых предприятиях. Для развития заболевания необходимы не только контаминация продуктов питания возбудителями, но и условия, способствующие их размножению и накоплению токсинов. Оптимальной средой для развития стафилококков являются кондитерские изделия, молоко и молочные продукты, мясные овощные и рыбные блюда. Протей и клостридии хорошо размножаются в белковых продуктах, в частности в холодце, заливных рыбных блюдах, а Вас. cereus — в овощных салатах, супах, мясных и рыбных изделиях. Энтерококки быстро накапливаются в молоке, картофельном пюре, рыбных салатах, в котлетах, попадая в них не только с кишечным содержимым, но и воздушно-капельным путем. Галофильные парагемолитические вибрионы, хорошо сохраняясь и выживая в морском осадке, прижизненно инфицируют многие виды морских рыб, особенно обитающих в прибрежных водах, моллюсков, крабов и др. Условиями накопления микробов и их токсинов в пищевых продуктах являются нарушение технологии их приготовления, недостаточная термическая обработка, хранение при комнатной температуре. Пищевые токсикоинфекции чаще возникают в теплое время года. Восприимчивость к ним высокая. Обычно в той или иной форме заболевают все лица, употребившие инфицированный продукт. Вспышки часто имеют групповой, взрывной характер, когда в течение короткого времени заболевают все инфицированные. Патогенез и патологическая анатомия. В патогенезе пищевых токсикоинфекции ведущее значение имеет интоксикация бактериальными экзо- и эндотоксинами. Вместе с инфицированной пищей в организм попадают не только токсические субстанции, но и микробы, при разрушении которых в желудочно-кишечном тракте происходит дополнительное высвобождение эндотоксинов. Под воздействием комплекса токсинов развиваются как местные (острые гастрит, гастроэнтерит), так и общие (лихорадка, интоксикация, нарушения сердечно-сосудистой системы и др.) проявления болезни. Синдром гастрита связан с раздражающим действием токсинов. При попадании их в кровь происходит непосредственное возбуждение пусковой хеморецептивной зоны и рвотного центра, расположенных в нижней части дна четвертого желудочка. Раздражение рвотного центра может осуществляться импульсами с блуждающего и симпатического нервов. Так, рвота, вызванная в эксперименте пероральным введением стафилококкового энтеротоксина, исчезает после одновременных симпато- и ваготомий. Она, как известно, является защитной реакцией пищеварительной системы, направленной на удаление из желудка токсических или других повреждающих веществ. Однако продолжительная неукротимая рвота, кроме местных повреждений, может вызвать нарушения гомеостаза — гипохлоремический алкалоз. Гипохлоремия, в свою очередь, поддерживает и/или усиливает рвоту. Синдром энтерита является нарушением синтеза и равновесия биологически активных веществ в энтероцитах. Оно имеет сложный функциональный характер, сводящийся в конечном итоге к повышению активности аденилатциклазы. В связи с этим резко усиливается переход АТФ в цАМФ, а освобождающаяся энергия стимулирует секретирующую функцию энтероцитов. Происходит усиление выхода в просвет тонкой кишки изотонической, бедной белком жидкости, что проявляется профузной диареей. В итоге нарушается водно-электролитный баланс, развивается изотоническая дегидратация с синдромом дегидратационного (гиповолемического) шока при тяжелом течении болезни. Экзотоксины некоторых бактерий обладают специфическим нейротоксическим действием (ботулизм), способствуют резкому падению сосудистого тонуса с тяжелыми нарушениями гемодинамики (стафилококковые пищевые отравления). Эндотоксины стимулируют продукцию цитокинов (интерлейкины, фактор некроза опухолей и др.), появление которых в сыворотке крови в значительных концентрациях вызывает лихорадочную реакцию, активирует функцию гипоталамо-гипофизарной системы, нарушает сосудистый тонус, является причиной функциональных и 45 морфологических изменений в системе микроциркуляции. В случаях пищевых токсикоинфекции, вызваных шигеллами, сальмонеллами, энтероинвазивными кишечными палочками и клостридиями, на фоне гастроэнтерита развивается колитический синдром, усиливается общая инфекционная интоксикация, появляется симптомокомплекс соответствующей нозологической формы заболевания. Морфологических изменений, патогномоничных для пищевых токсикоинфекций, нет. Обычно отмечается картина выраженного гастроэнтерита: гиперемия слизистой оболочки желудка и тонкой кишки, отек и множественные точечные кровоизлияния, очаговые некроз и десквамация эпителия. Наблюдается набухание пейеровых бляшек. Имеются выраженное полнокровие внутренних органов, признаки нарушения микроциркуляции, дистрофия внутренних органов. В случаях токсикоинфекций, обусловленных патогенной флорой, патологоанатомические изменения соответствуют нозологическим формам заболеваний. Симптомы и течение. Клинической классификации пищевых токсикоинфекций нет. Для этих целей используют рекомендуемую директивными документами МЗ классификацию сальмонеллеза. С учетом особенностей течения, патогенеза и этиологии пищевые токсикоинфекций могут быть разделены по клиническим формам, по этиологии и осложнениям. 1. По клиническим формам: гастритическая, энтеритическая, гастроэнтеритическая и гастроэнтероколитическая. 2. По степени тяжести: легкая, средней тяжести, тяжелая. 3. По этиологии: бактериальная кишечная инфекция, бактериальное пище вое отравление (стафилококковое и др.). 4. По осложнениям: неосложненная и осложненная. Инкубационный период короткий, исчисляется часами, редко достигает 1— 2 сут. Заболевание, как правило, начинается остро, без предвестников. Основные клинические проявления ограничиваются гастроинтестинальным синдромом и реже — признаками общей инфекционной интоксикации. Гастроинтестинальный синдром характеризуется острыми гастритом, энтеритом или их сочетаниями, реже — острым гастроэнтероколитом. Острый гастрит проявляется тяжестью и болями, иногда достаточно интенсивными, в эпигастральной области, тошнотой. Ключевым признаком гастрита у больных пищевыми токсикоинфекциями является рвота, как правило повторная, а в тяжелых случаях — неукротимая. Рвота вначале съеденной накануне пищей, затем слизью с примесью желчи. Крови в рвотных массах не бывает, иногда могут быть ее прожилки, вследствие повреждения мелких сосудов пищевода, глотки. Язык обложен. При глубокой пальпации отмечается болезненность в эпигастральной области. При остром энтерите наблюдаются урчание, ощущение «переливания» в животе, периодические схваткообразные боли в животе, заканчивающиеся императивными позывами на дефекацию. Стул обильный, жидкий, вначале калового характера, светложелтоватый, иногда желтовато-зеленый. С увеличением количества дефекаций он приобретает вид полупрозрачной белесоватой жидкости с хлопьевидными или отрубевидными взвешенными частицами, которые выпадают в осадок после отстоя. Характер испражнений может изменяться (цвет, запах, примесь крови) в зависимости от вида возбудителя, вызвавшего заболевание. При пальпации органов брюшной полости определяются урчание, плеск. Изменений толстой кишки не отмечается. В случаях нарастания энтеритного синдрома в связи с невосполняемыми потерями жидкости развиваются признаки изотонической дегидратации — нарушение тургора кожи, тахикардия, падение артериального давления. Синдром острого колита сопровождается схваткообразными мучительными болями в нижних отделах живота, чаще в левой подвздошной области, ложными позывами на дефекацию, ощущениями ее незавершенности, тенезмами. Стул частый, 46 вначале калового характера, с примесью слизи, а в тяжелых случаях и крови. В дальнейшем он становится скудным, некаловым, состоящим из комочков слизи с кровью и гноем. При пальпации определяются уплотнение (инфильтрация), спазм и разной степени болезненность пораженных участков толстой кишки. Колит практически не приводит к тяжелым расстройствам водно-электролитного баланса, но, как правило, сопровождается общей инфекционной интоксикацией. Вышеперечисленные синдромы поражения желудочно-кишечного тракта чаще протекают в сочетаниях (гастроэнтерит, энтероколит, гастроэнтероколит), но все же для пищевых токсикоинфекций наиболее характерны гастрит, энтерит. Синдром общей инфекционной интоксикации наблюдается не во всех случаях. Он проявляется общей слабостью, головной болью, головокружениями. Иногда отмечаются познабливания или ознобы с повышением температуры тела от субфебрильной до фебрильной. Гепатолиенальный синдром не характерен. Увеличение селезенки иногда определяется в случае тяжелого течения болезни и свидетельствует о диссеминации возбудителя за пределы желудочно-кишечного тракта. Сердечно-сосудистые расстройства (тахикардия, артериальная гипотензия) наблюдаются при обезвоживании. В периферической крови может быть лейкоцитоз, нейтрофилез, умеренное увеличение СОЭ. В случаях изотонической дегидратации повышаются гематокрит и относительная плотность плазмы. Тяжесть токсикоинфекций определяется, в основном, по степени обезвоживания, иногда по выраженности общей интоксикации. Используются те же критерии, что и при других острых кишечных диарейных заболеваниях. При одинаковых симптомах и течении пищевых токсикоинфекций можно выявить, в частности при групповых заболеваниях, некоторые особенности в зависимости от их этиологии. Так, клостридиоз чаще начинается с довольно интенсивных колющих болей в животе. В испражнениях наблюдается примесь крови. В некоторых случаях на фоне гастроэнтеритического синдрома бурно развиваются геморрагический и некротический энтерит, энтероколит. Стул приобретает вид «мясных помоев». Болезнь может осложниться тяжелым анаэробным сепсисом. Во время вспышки стафилококкового отравления у некоторых больных наблюдается тонзиллит в сочетании с углочелюстным лимфаденитом и более выраженными признаками интоксикации. Инкубационный период короткий (иногда до 30—60 минут), начало бурное с преобладанием гастритического синдрома. Энтерит может отсутствовать. Довольно характерны нарушения сосудистого тонуса — адинамия, головокружение, коллапс, цианоз, судороги, потеря сознания. Колитоксикоинфекция, особенно вызванная энтерогеморрагически-ми штаммами, может протекать по дизентериеподобному варианту с преобладанием энтероколитного или даже колитного синдромов. Протейная токсикоинфекция характеризуется зловонным стулом, возможны случаи с крайне тяжелым, холероподобным течением и быстрым развитием обезвоживания. Осложнения. Тяжелое течение пищевой токсикоинфекции может осложниться инфекционно-токсическим шоком, дегидратационным (гиповолемиче-ским) шоком, тромбозом сосудов брыжейки. Некротический энтерит при тяжелом клостридиозе иногда является причиной перфорации кишечника и развития перитонита. Прорыв некоторых возбудителей (сальмонеллы, клостридии, стафилококки и др.) в кровь при определенных обстоятельствах может привести к пиелоциститу. Диагноз и дифференциальный диагноз. При диагностике пищевых токсикоинфекции руководствуются следующими критериями: связь с употреблением недоброкачественного пищевого продукта, короткий инкубационный период, острое начало, синдромы острого гастрита, энтерита, гастроэнтерита. Об инфекционной природе заболевания могут свидетельствовать такие симптомы общей интоксикации, как ознобы, повышение температуры тела, головная боль. Значение имеет групповой характер 47 заболеваний, когда все пострадавшие употребляли один и тот же продукт. Учитываются условия его приготовления, хранения и реализации. Дифференциальная диагностика проводится с острыми диарейными кишечными инфекциями, с острыми патологическими процессами в брюшной полости, с отравлениями химическими веществами. Вспышки шигеллеза, сальмонеллеза, холеры обычно растянуты во времени в силу продолжительного инкубационного периода, условий и времени инфицирования. Заболевания, даже начинаясь с гастрита, энтерита, в дальнейшем трансформируются в типичную клиническую картину той или иной инфекции. В то же время решающее значение, особенно в спорадических случаях, имеют результаты бактериологических исследований. С целью выделения предполагаемого возбудителя проводят посевы рвотных масс или промывных вод желудка, испражнений, крови при повышенной температуре тела, а также остатков пищевых продуктов. Диагностически значимыми являются выделение возбудителя из крови, обнаружение его в большом количестве в испражнениях, в рвотных массах или промывных водах желудка. При подозрении на отравление стафилококковыми энтеротоксинами, клостридиоз проводят идентификацию токсинов в рвотных массах, испражнениях, в подозрительных продуктах питания. В случаях выделения условно-патогенной флоры учитывают одновременное обнаружение возбудителя в различных субстратах, его фаговую и антигенную однородность, нарастание титров гомологичных антител в 4 раза и более. Результаты серологических методов диагностики оцениваются по нарастанию титров антител в динамике и поэтому являются ретроспективными. Групповой, часто семейный характер пищевой токсикоинфекции, протекающей при нормальной температуре тела, предполагает проведение дифференциальной диагностики с отравлениями суррогатами алкоголя или метиловым спиртом, ядовитыми грибами, солями некоторых тяжелых металлов. При этом необходимо иметь в виду более короткий инкубационный период, преобладание гастритического синдрома в начале заболевания, вслед за чем развивается клиническая картина той или иной специфической интоксикации. За пищевую токсикоинфекцию могут быть приняты инфаркт миокарда, острый панкреатит, аппендицит, холецистит, тромбоз артерий брыжейки. При заболеваниях органов брюшной полости боли в животе, тошнота, рвота со временем усиливаются, а болевой синдром локализуется в зоне пораженного органа, появляются симптомы раздражения брюшины, повышается температура тела. В периферической крови определяются высокая СОЭ, нарастание в динамике лейкоцитоза. В случаях диагностических затруднений больные подлежат наблюдению хирурга, гинеколога и др., при необходимости — проведению специальных (ЭКГ, УЗИ и др.) методов исследований. Лечение. Госпитализация больных пищевыми токсикоинфекциями проводится по клиническим и эпидемиологическим показаниям. Обязательной госпитализации подлежат больные тяжелыми и среднетяжелыми формами заболевания, резко ослабленные и отягощенные сопутствующей патологией лица. Эпидемиологическими показаниями являются: принадлежность больных к закрытым организованным коллективам, к декретированным группам населения (работникам пищевых предприятий и к ним приравненным), невозможность соблюдения противоэпидемического режима по месту жительства (неблагоприятные бытовые условия и т. п.). В очаге вспышки пищевой токсикоинфек-ции важно выявить больных с критическими состояниями, угрозой их развития и оказать им неотложную помощь. Они нуждаются в госпитализации в первую очередь. Лечение больных в домашних условиях организуется и проводится участковым (семейным) врачом совместно с врачом кабинета инфекционных заболеваний поликлиники. О лечении больных на дому ставится в известность территориальное учреждение Госсанэпиднадзора. Проводится инструктаж больных и членов семьи по соблюдению санитарно-противоэпидемического режима, по текущей и заключительной дезинфекции. 48 Основу терапевтических мероприятий при пищевых токсикоинфекциях составляют неспецифическая дезинтоксикация, коррекция нарушений водно-электролитного баланса, восстановление функции желудочно-кишечного тракта, а при проведении интенсивной терапии — поддержание органов и систем в режиме оптимального функционирования. Первоочередным компонентом лечебных мероприятий является удаление из желудочнокишечного тракта возбудителей и их токсинов путем повторных промываний желудка вначале кипяченой водой для отбора пробы с целью бактериологической диагностики, а затем 2% раствором натрия гидрокарбоната или 0,1% раствором марганцовокислого калия до чистых промывных вод. Для связывания и выведения токсинов (и частично микробов) из желудочно-кишечного тракта после промывания желудка назначают энтеросорбенты (активированный уголь, полифепан, полисорб МП, микрокристаллическая целлюлоза и др.). Для коррекции нарушений водно-электролитного баланса применяют водноэлектролитные растворы. При отсутствии рвоты назначают обильное питье. В домашних условиях могут быть использованы 1 ч. л. поваренной соли, 8 ч. л. сахара на 1 л кипяченой воды. Лучше применять готовые официнальные солевые составы для оральной регидратации (оралит, регидрон, гастролит, цитроглюкосалан и др.). Обычно используют следующий состав: натрия хлорида — 3,5 г, натрия гидрокарбоната — 2,5 г, калия хлорида — 1,5 г и глюкозы (пищевого сахара) — 20 г на 1л питьевой воды. Вышеуказанные растворы дают пить малыми порциями до утоления жажды, а затем в количествах, в 1,5 раза превышающих потери жидкости с испражнениями, мочой, рвотой. При неукротимой рвоте, обезвоживании II—IV степени регидратация осуществляется только внутривенными введениями таких водно-электролитных растворов, как квартасоль, трисоль, хлосоль, лактасол, а при их отсутствии — раствором Рингера или 0,9% раствором натрия хлорида в количествах, равных ориентировочным потерям жидкости до начала и определяемым потерям жидкости в процессе лечения. Больным с обезвоживанием противопоказаны адреномиметики, коллоидные инфузионные растворы. При стафилококковой интоксикации допустимо внутривенное введение гемодеза, глюкокортикостероидов, а в тяжелых случаях — дофамина в 0,9% растворе натрия хлорида. В остром периоде болезни рекомендуется лечебное дробное питание: подсушенный белый хлеб, чай, слизистые супы, неконцентрированные бульоны, омлет, картофельное пюре, каши (манная, рисовая, геркулесовая), блюда из молотого или протертого нежирного мяса. Нужна осторожность в употреблении цельного молока и молочных блюд. Показаны ферментные (фестал, панзинорм и др.) препараты. Антибактериальные средства для лечения больных пищевыми токсикоинфекциями не применяются. Их можно использовать лишь в случаях продолжительной лихорадки (более 2 дней), при наличии гепатолиенального синдрома, колита. Обычно назначают энтеросептол, левомицетин, нитрофурановые препараты. При тяжелых клостридиозах показаны метронидазол, а в случаях формирования псевдомембранозного колита — ванкомицин. Прогноз. Пищевые токсикоинфекции в подавляющем большинстве случаев протекают благоприятно. Летальные исходы крайне редки. Они чаще обусловлены неблагоприятным преморбидным фоном, несвоевременными или неполными мероприятиями регидратационной терапии. Правила выписки. Больные, перенесшие пищевую токсикоинфекцию без бактериологического подтверждения и пищевые отравления стафилококковым токсином, выписываются не ранее 3 дней после клинического выздоровления без повторного бактериологического контроля. Работников общественного питания и приравненных к ним, а также лиц из закрытых организованных коллективов перед выпиской подвергают однократному контрольному бактериологическому обследованию. Военнослужащие выписываются после полного клинического выздоровления, при необходимости — 49 контрольной ректороманоскопии и после получения отрицательных результатов трехкратных исследований на бактерии патогенной кишечной группы. Диспансеризация. В связи с кратковременностью течения перенесшие пищевую токсикоинфекцию не нуждаются в диспансерном наблюдении. Если заболевание вызвано патогенной флорой (шигеллы, сальмонеллы и др.), то порядок наблюдения за переболевшими осуществляется в соответствии с нозологической формой. Профилактика и мероприятия в очаге. Профилактические мероприятия при пищевых токсикоинфекциях направлены на предупреждение контаминации пищевых полуфабрикатов (продуктов) или готовой пищи микробами, предотварщение их размножения и продуцирования ими токсинов. К ним относятся: 1) внедрение современных методов обработки и хранения продуктов питания; 2) предупреждение заболеваний мясного и молочного скота; 3) санитарный контроль за соблюдением технологии переработки, хранения, транспортировки и реализации продуктов питания; 4) строгое соблюдение сроков хранения и реализации скоропортящихся продуктов (студень, зельц, заливные блюда, мясной фарш, вареные колбасы, паштеты, торты, заварные кремы и т. п.); 5) медицинский контроль за состоянием здоровья работников общественного питания. В очаге токсикоинфекции осуществляется выявление и устранение нарушений ветеринарных, санитарно-гигиенических и противоэпидемических требований к организации питания, выявление и устранение источников бактериального обсеменения пищевых продуктов, особенно готовой пищи. При необходимости проводятся бактериологические и серологические исследования у лиц декретированных профессий. В войсках профилактика пищевых токсикоинфекций приобретает особое значение в связи со специфическими условиями их размещения, быта, питания и деятельности. Наиболее частые причины заболеваний — нарушение правил термической обработки пищевых продуктов и хранения готовой пищи. В связи с этим вводятся дополнительные требования к организации питания. Фарш для котлет и котлеты разрешается готовить не позже чем за 1 ч до тепловой обработки и раздельно для каждой смены военнослужащих. В летнее время приготовление блюд из фарша не допускается. Консервы с нарушением герметичности или с бомбажом употреблять запрещается. При приготовлении блюд из консервов банки следует вскрывать непосредственно перед их закладкой в котел. Пищевые продукты подлежат хранению в холодильных камерах раздельно и с неукоснительно строгим соблюдением сроков. С целью предупреждения вторичного инфицирования вареных продуктов мясные порции и соусы непосредственно перед раздачей обязательно подвергаются в течение 15 мин повторной термической обработке. Температура первых блюд к моменту приема пищи должна быть не ниже 75° С, вторых — не ниже 65° С, холодных супов, киселя и компота — не выше 14° С. Кратковременное хранение готовой пищи на плите допускается не более 1,5 ч и при температуре не ниже 80° С. Запрещается хранить готовые блюда в духовом шкафу. При питании в несколько смен разрывы между ними не должны превышать 1 ч, если больше, то пища готовится для каждой смены отдельно. Хранение готовой пищи для отдельных групп военнослужащих (так называемые «расходы») должно осуществляться в холодильнике, мясо раздельно от гарнира, но не более 4 ч. Перед выдачей пища должна подвергаться повторной термической обработке. Изделия из фарша для хранения (расхода) не оставляются. Профилактика отравления стафилококковым токсином предполагает устранение носителей стафилококков, исключение условий, способствующих обсеменению ими пищевых продуктов и особенно готовой пищи. Для инактивации стафилококкового токсина требуется кипячение не менее 2 ч, поэтому хранение и реализация пищевых продуктов должны осуществляться в условиях, препятствующих токсикообразованию. 50 ПИЩЕВОЕ ОТРАВЛЕНИЕ (пищевая токсикоинфекция), вызванное VIBRIO PARAHAEMOLYTICUS Определение - зоонозная бактериальная природно-очаговая инфекционная болезнь, возбудитель которой передается через пищевые продукты. Характеризуется общей интоксикацией и нарушением функций пищеварительного тракта. Возбудитель - галофильный вибрион Vibrio parahaemolyticus из семейства Vibrionaceae рода Vibrio. Установлено 12 0-антагенных групп и около 60 К-антигенных типов этого вибриона. Патогенные штаммы обладают способностью продуцировать цитотоксин и давать характерную гемолитическую реакцию (феномен Канагавы). Нагревание до 70°С убивает вибрион в течение 15 мин. Резервуар и источники возбудителя: различные виды морских рыб и морепродуктов (креветки, устрицы и др.), морской ил (в холодное время), морская вода в прибрежной зоне (в теплое время). Больной человек не заразен. Период заразительности источника неопределенно долгий. Механизм передачи возбудителя. Путь передачи - пищевой; факторы передачи блюда из недостаточно термически обработанной рыбы или морепродуктов. Заражение наступает, когда в продукте в процессе его хранения происходит размножение и накопление вибриона, ведущее к образованию заражающей дозы более 106/г. Естественная восприимчивость людей точно не установлена, но, по-видимому, высокая. Основные эпидемиологические признаки. Болезнь встречается в разных странах, преимущественно в Японии, странах Юго-Восточной Азии и США. Отмечаются групповые и спорадические заболевания. Заболеваемость преобладает в теплое время года. Возрастно-половые или профессиональные эпидемиологические особенности не выявлены. Инкубационный период от 4 до 96 ч, обычно 12-24 ч. Основные клинические признаки: острое начало, общая интоксикация, водянистый частый стул, иногда с примесью крови, боли в животе, реже лихорадка, рвота. Заболевание может длиться от 1 до 7 дней. Лечение: промывание желудка, регидратация, симптоматическое. Лабораторная диагностика основана на выделении Канагава-положительных вибрионов из испражнений и рвотных масс больных, а также из продукта, послужившего фактором передачи возбудителя. Профилактические мероприятия сводятся к соблюдению санитарногигиенических правил и технологического режима приготовления, хранения и реализации пищевых продуктов. Меры иммунопрофилактики не разработаны. Мероприятия в эпидемическом очаге такие же, как при прочих острых кишечных инфекциях. Диспансерное наблюдение за переболевшим не регламентировано. Протозойные кишечные инфекции. Токсоплазмоз. Балантидиаз. Этиология. Эпидемиология. Патогенез. Классификация. Клиническая картина. Осложнения. Дифференциальная диагностика. Лабораторная диагностика. Принципы лечения. Эпидемиологический надзор. Профилактические мероприятия. 9. ТОКСОПЛАЗМОЗ (Toxoplasmosis) Определение. Паразитарное заболевание из группы протозойных зоонозов, протекающее в латентной или хронической форме. Поражает нервную, лимфоидную системы, печень, селезенку, мышечную ткань и миокард. 51 Этиология и патогенез. Возбудитель токсоплазмоза — Toxoplasma gondii — относится к простейшим (Protozoa). Существует в виде вегетативной формы и цист. Вегетативная форма при окраске по методу Романовского—Гимзы выглядит как полумесяц с голубой цитоплазмой и рубиново-красным ядром. Токсоплазмы неустойчивы к воздействию термических и химических факторов, нагревания, 2% раствора хлорамина, 1% раствора фенола, 50% спирта и др. Половой цикл развития токсоплазм происходит в эпителии кишечника представителей семейства кошачьих, в том числе домашних кошек. Бесполый цикл размножения паразитов осуществляется в организме человека или различных млекопитающих. Проникая через желудочно-кишечный тракт, паразиты с током крови попадают в регионарные лимфатические узлы, где провоцируют формирование гранулем и размножаются в них. В дальнейшем, распространяясь гематогенно, они оседают в органах и тканях системы мононуклеарных фагоцитов (печень, селезенка, лимфатические узлы), а также в нервной системе, скелетных мышцах, миокарде. В этих органах токсоплазмы размножаются, образуют новые популяции или длительно сохраняются в виде цист. Большое значение в патогенезе заболевания имеют реакции сенсибилизации и гиперсенсибилизации. Особую опасность представляет инвазия в ранние сроки беременности, поскольку при дальнейшем внутриутробном заражении плода в 40% случаев возможны выкидыши, мертворождения или дефекты развития плода. Эпидемиология. Резервуаром и источником инвазии являются домашние кошки и некоторые представители семейства кошачьих (рысь, пума, оцелот, бенгальский кот, ягуар и др.), в организме которых возбудитель проходит полный цикл развития (тканевый и кишечный) и в виде ооцист с их фекалиями выводится наружу. В почве в течение 1-5 дней в них развиваются инвазионные стадии — спорозоиты. Кошки выделяют возбудитель в среднем в течение 3 нед с момента заражения. За это время в окружающую среду поступает до 1,5 млрд токсоплазм. Около 1% домашних кошек являются бессимптомными носителями и постоянно с испражнениями выделяют ооцисты. Токсоплазмы или следы их присутствия обнаружены более чем у 200 видов млекопитающих и 100 видов птиц. Особенно часто поражаются мышевидные грызуны, зайцы, у которых токсоплазмоз приобретает характер эпизоотии. Становясь добычей кошек, грызуны поддерживают жизненный цикл токсоплазм. Заражение животных в природе происходит в результате заглатывания зрелых ооцист, содержащих спорозоиты. Промежуточные хозяева токсоплазм (собаки, сельскохозяйственные животные и др.), в том числе и человек, возбудитель во внешнюю среду не выделяют и эпидемиологической опасности для окружающих не представляют. Механизм передачи — фекально-оральный, пути передачи — пищевой, водный, бытовой. Возможна реализация контактного пути через микротравмы наружных покровов. Основной фактор передачи — сырое или недостаточно термически обработанное мясо (мясной фарш) с находящимися в них цистами токсоплазм. Баранина и свинина часто содержат цисты токсоплазм (10-25%) так же, как и мясо других животных. К дополнительным факторам передачи относятся плохо вымытая зелень, овощи, фрукты (с земли), грязные руки. Реже заражение токсоплазмами происходит трансплацентарно (не более 1% заболеваний), при переливании крови и пересадке органов. При заражении матери в I триместре беременности врожденный токсоплазмоз наблюдают в 15—20% случаев, он протекает тяжело. При аналогичной ситуации в III триместре беременности инфицированными оказываются 65% новорожденных, но инвазия, как правило, протекает малосимптомно. Если женщина инфицирована до беременности (за 6 мес и более), внутриутробного инфицирования не наступает, если заражение наступает незадолго до беременности, риск врожденного токсоплазмоза очень мал. 52 Проявления эпидемического процесса. Заболеваемость токсоплазмозом в связи с трудностями распознавания клинически выраженной, а тем более субклинически протекающей инвазии остается неизвестной. Пораженность или инвазированность токсоплазмами населения России в среднем составляет около 20%. Показатели распространенности инвазии выше в регионах с жарким климатом. Сезонность отсутствует. Инвазированными чаще оказываются лица определенных профессий (рабочие мясокомбинатов и звероводческих ферм, животноводы, ветеринары и др.). Инвазированность женщин, как правило, в 2—3 раза выше, чем мужчин, что объясняется широко распространенной привычкой дегустировать сырой мясной фарш. Восприимчивость к токсоплазмозу высокая, но клинические проявления инвазии отмечаются у ослабленных лиц, с явлениями приобретенного или врожденного иммунодефицита. Токсоплазмоз часто является оппортунистической инвазией при СПИДе. Клиника. Приобретенный токсоплазмоз может протекать в острой, хронической или латентной форме. Вероятно, наиболее частой, но плохо диагностируемой формой заболевания является латентная, длительно протекающая без клинических проявлений или с редкими обострениями. В большинстве случаев эту форму можно распознать лишь по серологическим реакциям или при обнаружении остаточных явлений — участков обызвествления (кальцификатов) в различных органах, снижения зрения вследствие образования рубцовых изменений сетчатки и др. При остром токсоплазмозе установить длительность инкубационного периода невозможно. Проявления заболевания разноплановы. Иногда возникает полиморфная экзантема без какой-либо иной симптоматики, или она сопровождается развитием энцефалитов и менингоэнцефалитов. Выделяют тифоподобное течение токсоплазмоза с симптоматикой тифопаратифозного заболевания. При крайне редкой генерализации токсоплазмоза с высокой лихорадкой, развитием гепатолиенального синдрома, энцефалитов и менингоэнцефалитов заболевание протекает тяжело и прогноз его часто неблагоприятен. Хронический токсоплазмоз развивается постепенно, больные жалуются на прогрессирующую слабость, плохой аппетит, тошноту, боли в животе и сердце, сердцебиение, нарушение сна и т.д. Характерны мышечные боли, которые иногда стесняют больного в движениях (специфический миозит). Заболевание протекает на фоне постоянной интоксикации, сопровождающейся поражениями органов (нервная система, глаза, миокард и др.). Повышенная, чаще субфебрильная, температура и лимфаденопатия сохраняются длительное время-, печень и селезенка увеличены. Часто изменения затрагивают ЦНС и сопровождаются эмоциональной лабильностью, раздражительностью, иногда неврастеническими приступами. Поражения глаз проявляются хориоретинитом, увеитом, прогрессирующей близорукостью. У женщин происходит нарушение менструального цикла, у мужчин развивается импотенция. Острая форма врожденного токсоплазмоза встречается относительно редко и протекает тяжело, в виде генерализованного заболевания. Отмечают выраженную интоксикацию, увеличение лимфатических узлов, печени и селезенки. Возможна макулопапулезная экзантема. В динамике заболевания наблюдают поражения глаз и проявления тяжелого энцефалита. При переходе врожденного токсоплазмоза в хроническую форму выявляются последствия в виде эпилепсии, поражений органов зрения, олигофрении, гидроцефалии и т.д. Дифференциальная диагностика осложняется из-за многообразия клинических вариантов заболевания. При неясной клинико-лабораторной картине инфекционного заболевания необходимо провести исследования на наличие токсоплазм. Лабораторная диагностика. В гемограмме больных, особенно при хроническом токсоплазмозе, можно отметить лейко- и нейтропению, относительный моноцитоз и нормальные показатели СОЭ. 53 Серологическая диагностика основывается на применении РСК с красителем Сэбина—Фельдмана. Отрицательные реакции позволяют исключить токсоплазмоз, а положительные результаты в сочетании с клиническими данными могут подтвердить диагноз. Применяют также внутрикожную пробу с токсоплазмином, реакцию повреждения нейтрофильных лейкоцитов и бласттрансформации лимфоцитов. Паразитологический метод основан на обнаружении токсоплазм в окрашенных препаратах, приготовленных из биологических жидкостей и сред организма: крови, ликвора, пунктатов лимфатических узлов и миндалин, околоплодных вод, плаценты и др. Положительный результат исследования является абсолютным подтверждением инвазии. Возможны биологические пробы на мышах. Осложнения. К осложнениям можно отнести последствия токсоплазмоза -см. раздел Клиника. Лечение. При острых формах токсоплазмоза применяют хлоридин по 0,025 г 3 раза в день в сочетании с сульфадимезином по 2—4 г/сут в течение 5—7 дней. Курсы лечения можно повторять 2—3 раза с 10—15-дневными интервалами. Подобные курсы можно проводить детям с учетом возрастных дозировок. При хронической форме токсоплазмоза применяют 5—7-дневный курс химиотерапии (хингамин или делагил в комбинации с тетрациклином) в сочетании с десенсибилизирующей терапией (антигистаминные средства) и кортикостероидные препараты. После этого курса проводят иммунотерапию токсоплазмином, индивидуально подбирая дозу с помощью титрационной пробы. Профилактика и меры борьбы. Профилактика приобретенного токсоплазмоза включает: предупреждение возможности заражения от кошек (ежедневная уборка и мытье туалета у домашних кошек, ограничение контакта с инфицированными и борьбу с беспризорными кошками, мышевидными грызунами), нейтрализация путей передачи инвазии (полноценная термическая обработка мясных продуктов, исключение дегустации сырого мясного фарша или сырого мяса, употребление в пищу вымытых овощей, зелени и фруктов, тщательное мытье рук после обработки сырого мяса, при контакте с землей, у детей после игры на детской площадке, особенно в песочнице). Специфическая профилактика токсоплазмоза не разработана. Профилактика врожденного токсоплазмоза включает мероприятия по предупреждению инфицирования женщин во время беременности (исключить контакт с кошками, не пробовать сырой мясной фарш, мыть руки после приготовления блюд из сырого мяса и др.). Специальные мероприятия должны включать диспансеризацию беременных женщин группы риска (лиц, отрицательно реагирующих на токсоплазмоз, т.е. неиммунных). На протяжении всей беременности с интервалом 1—2 мес их обследуют иммунологически. Для этого используют РСК, реакция непрямой иммунофлюоресценции, ИФА и другие серологические реакции. В случае выявления среди женщин первичносеронегативных лиц, положительно реагирующих на токсоплазмоз, им назначают экстренное превентивное лечение. Дети, родившиеся у этих женщин, подлежат обязательному клиническому и серологическому обследованию на токсоплазмоз и при наличии показаний — лечению. За детьми, родившимися от матерей с точно установленным первичным инфицированием во время беременности, устанавливают диспансерное наблюдение до 10-летнего возраста, включающее регулярное клиникоиммунологическое обследование, с целью выявления симптомов врожденного токсоплазмоза, который мог при рождении протекать бессимптомно. Профилактика токсоплазменных поражений улиц с ВИЧ-инфекцией включает скрининг ВИЧ-инфицированных на наличие латентной эндогенной инфекции и профилактическое лечение инвазированных лиц. Мероприятия в очаге инвазии не проводят. Мероприятия в эпидемическом очаге не регламентированы Эпидемиологический надзор основывается на оценке распространенности инвазии среди домашних животных (прежде всего кошек) и людей. Важную роль играет 54 анализ соотношения показателей инвазированности и заболеваемости среди различных социально-возрастных групп населения, с определением факторов риска заражения. БАЛАНТИДИАЗ (Balantidiasis) Определение. Острое зоонозное протозойное заболевание, характеризующееся язвенным поражением толстой кишки. Этиология и патогенез. Возбудитель — Balantidium соli, существующий в виде вегетативных и цистных форм. Во внешней среде вегетативные формы жизнеспособны несколько часов, цисты — 3—4 нед. Высыхание губительно действует на обе формы. Человек заражается, проглатывая цисты Balantidium coli. Развившиеся из них вегетативные формы возбудителя внедряются в слизистую оболочку толстой кишки. Чаще поражается слепая, сигмовидная и прямая кишка. На месте внедрения паразита образуется инфильтрат, затем эрозия, некроз и язва. Язвы имеют неправильные очертания, неровное дно, покрытое кровянисто-гнойным налетом. Они располагаются вдоль складок слизистой оболочки, вокруг язв слизистая отечна и гиперемирована. Заболевание сопровождается синдромом интоксикации. Эпидемиология. Резервуаром и источником инвазии являются свиньи. Иногда балантидии обитают в организме крыс, собак, обезьян, а также человека, которые могут стать дополнительными источниками инфекции. Механизм передани — фекально-оральный. Возбудитель попадает в желудочнокишечный тракт человека в виде цист, иногда вегетативных форм, чаще с загрязненной водой, а также с фруктами и овощами. Проявления эпидемического процесса. Заболевание выявляется относительно редко, однако инфицированность населения может быть довольно высокой. Так, в сельских районах заражено балантидиями 4—5% населения, преимущественно свиноводы. В очагах инвазии заражение может происходить как водным, так и контактно-бытовым путем. Как правило, регистрируют спорадические заболевания. Естественная восприимчивость, по-видимому, невысока. Клиника. Инкубационный период длится от нескольких дней до 3 нед. Заболевание протекает в субклинической, острой и хронической формах. Проявления субклинической формы нечеткие, диагноз возможен только при проведении паразитологических и эндоскопических исследований. Острая форма протекает с болями в животе и диареей. Стул может быть многократным, жидким и обильным, с гнилостным запахом, иметь зеленоватый цвет, часто с примесью крови и гноя. В более тяжелых случаях наблюдают повышение температуры неправильного характера, головную боль, общую слабость, тошноту и рвоту, больные быстро худеют. Продолжительность острой формы около 2 мес. При хронической форме заболевание протекает вяло, симптомы интоксикации выражены слабо, больного беспокоят постоянные длительные боли в животе, вздутие живота, диарея. При пальпации определяют болезненность слепой и сигмовидной кишки. Хроническая форма балантидиаза может быть рецидивирующей или непрерывной. При рецидивирующем течении обострения сменяются ремиссиями; непрерывная форма протекает монотонно. Без проведения антипаразитарной терапии заболевание может продолжаться годами, осложниться кахексией и анемией. Дифференциальная диагностика проводится с неспецифическим язвенным колитом, дизентерией, амебиазом, кишечным дисбактериозом. Лабораторная диагностика осуществляется путем обнаружения вегетативных форм В. coli при исследовании кала, биоптатов язв или их содержимого на простейшие. Анализ проводят не позже чем через 20 мин после взятия материала. В неясных случаях прибегают к эндоскопическому исследованию (обнаружение типичных язв в кишечнике). Осложнения. При современных методах лечения прогноз благоприятный. Однако при недиагностированных формах могут развиться кахексия, анемия, острый аппендицит 55 (при язвенном поражении червеобразного отростка), кишечное кровотечение и, в редких случаях, перфорация кишки. Лечение. Назначают 2—3 курса мономицина по 250 000 ЕД 4 раза в течение 5—6 сут. Возможно применение антибиотиков тетрациклинового ряда, ампициллина, метронидазола. При тяжелом течении болезни 3-й курс мономицина сочетают с окситетрациклином в дозе 0,25 г 4 раза в день. Одновременно проводят дезинтоксикационную и общеукрепляющую терапию. Профилактические мероприятия: предупреждение загрязнения окружающей среды фекалиями свиней и людей, соблюдение санитарно-гигиенических правил при строительстве и эксплуатации свинарников и уборных, соблюдение правил личной гигиены. Меры иммунопрофилактики не разработаны, Мероприятия в эпидемическом очаге Информация о заболевшем в течение 12 ч направляется в территориальный центр Госсанэпиднадзора, где регистрируется в графе «Другие протозойные болезни». Карантин не накладывается. Эпидемиологическое обследование направлено на выявление источника инвазии и возможных факторов передачи (свиньи и загрязненные их фекалиями продукты и вода). Обращают внимание на соблюдение заболевшим правил личной гигиены. Обследуют различные объекты внешней среды на загрязненность балантидиями. Меры иммунопрофилактики не разработаны. Меры в отношении источника возбудителя Госпитализация больного. Больные балантидиазом подлежат госпитализации и лечению. Выписка из стационара разрешается после трех отрицательных результатов анализа фекалий в течение 1 нед. Дератизация не проводится, Меры в отношении факторов передачи возбудителя Дезинфекция. Испражнения больных обезвреживают, смешивая с двукратным объемом 2% раствора лизола. Судна и унитазы обрабатывают этим же раствором. Белье больных кипятят или погружают на 3 ч в 5% раствор лизола. Дезинсекция не проводится. Меры в отношении других лиц в очаге Разобщение не проводится. Экстренная профилактика не проводится. Диспансерное наблюдение за переболевшим проводится в течение 1 года. Обследование проводят при признаках расстройства кишечника. 56