Рабочая программа по химии, 11 класс
advertisement
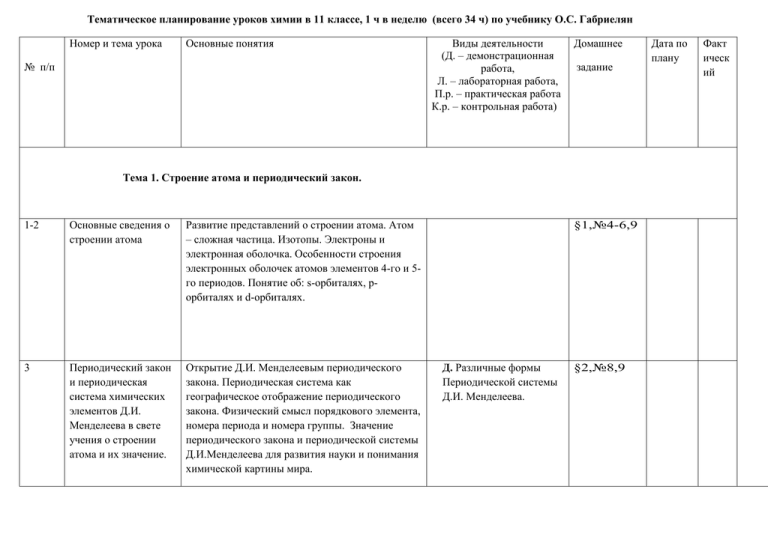
Тематическое планирование уроков химии в 11 классе, 1 ч в неделю (всего 34 ч) по учебнику О.С. Габриелян Номер и тема урока Основные понятия № п/п Виды деятельности (Д. – демонстрационная работа, Л. – лабораторная работа, П.р. – практическая работа К.р. – контрольная работа) Домашнее задание Тема 1. Строение атома и периодический закон. 1-2 Основные сведения о строении атома Развитие представлений о строении атома. Атом – сложная частица. Изотопы. Электроны и электронная оболочка. Особенности строения электронных оболочек атомов элементов 4-го и 5го периодов. Понятие об: s-орбиталях, pорбиталях и d-орбиталях. 3 Периодический закон и периодическая система химических элементов Д.И. Менделеева в свете учения о строении атома и их значение. Открытие Д.И. Менделеевым периодического закона. Периодическая система как географическое отображение периодического закона. Физический смысл порядкового элемента, номера периода и номера группы. Значение периодического закона и периодической системы Д.И.Менделеева для развития науки и понимания химической картины мира. §1,№4-6,9 Д. Различные формы Периодической системы Д.И. Менделеева. §2,№8,9 Дата по плану Факт ическ ий Тема 2.Строение вещества. 4 5 6 Ионная химическая связь и ионные кристаллические решетки Ионы и их классификация. Ионные кристаллические решетки. Свойства веществ с этим типом кристаллических решеток. Бинарные и более сложные органические и неорганические вещества с ионными кристаллическими решетками Ковалентная химическая связь. Атомные и молекулярные кристаллические решетки. Ковалентная связь как химическая связь, возникающая за счет образования общих электронных пар. Механизмы образования ковалентной связи. Классификация ковалентной связи. Молекулярные и атомные кристаллические решетки. Аллотропия углерода. Свойства веществ с молекулярными и атомными кристаллическими решетками. Д.1. Модель кристаллических решеток «сухого льда» алмаза, графита. Особенности строения атомов металлов и их кристаллов. Металлическая химическая связь и металлическая кристаллическая решетка. Д.1. Модели металлических кристаллических решеток. Металлическая химическая связь и металлическая кристаллическая решетка. Д. 1. Модель кристаллической решетки хлорида натрия §3,№9 §4,№9-13 2. Возгонка йода . Л. Определение типа кристаллической решетки. §5,№7-10 7 8 9 10 Водородная химическая связь. Межмолекулярная водородная связь. Механизм ее образования. Свойства веществ с этим типом связи. Внутримолекулярная водородная связь, ее биологическая роль. Д.1. Модель молекул ДНК Денатурация растворов яичного белка под действием: температуры §6,№7-9 Полимеры. Органические полимеры. Пластмассы, их классификаци. Представители пластмасс и их применение. Волокна их представители и применение. Натуральные и синтетические каучуки: представители, применение. Биополимеры. Неорганические полимеры. Д.1. Коллекция пластмасс. §7,№8,9 2. Коллекция волокон. 3. Коллекция неорганических полимеров. Газообразное состояние веществ. Три агрегатных состояния воды. Особенности Д.1 Таяние льда и строения газов. Молярный объем газов. Свойства испарение жидкой воды. газов. Природные газовые смеси: воздух и природный газ, их состав. Загрязнение атмосферы и борьба с ним. §8,стр Представители газов. Представители неорганических и органических газов: водород, кислород, углекислый газ, аммиак, этилен - их получение, собирание, распознавание и применение. §8,№3,4 Д.Получение, собирание, распознавание водорода,кислорода,углеки слого газа. 67-70 11 Жидкое состояние веществ. Особенности строения жидкостей. Строение, физические и химические свойства воды. Биологическая и геологическая роль воды. Использование воды в быту и на производстве. Д.Взаимодействие воды с натрием. Гашение извести.Взаимодействие воды с оксидом фосфора (V). §9,№5,6 12 Твердое состояние веществ Аморфные твердые вещества, их отличия от кристаллических Модели кристаллических решеток различных типов. §10,№5 13 Практическая работа №1 Получение, собирание и распознавание газов: водорода, кислорода, углекислого газа, аммиака. 14 Массовая доля компонента смеси Решение расчетных задач с использованием понятий «массовая доля растворенного вещества», «массовая доля примесей» §12,№6-8 15 Повторение по темам «Строение атома и периодический закон» и «Строение вещества» Решение задач и выполнение упражнений Стр.111№ 11,12 16 Контрольная работа №1 по темам «Строение атома и периодический закон» и «Строение вещества» 17 Классификации химических реакций Реакции, идущие без изменения состава вещества. Аллотропия и аллотропные видоизменения. Причины аллотропии на примере модификаций кислорода, углерода и фосфора. Озон, его биологическая роль. Изомеры. Реакции соединения, разложения, замещения и обмена. Экзо - и эндотермические реакции. Тепловой эффект термической реакции. Обратимые и необратимые реакции. Разложение перманганата калия.Взаимодействие натрия и кальция с водой.Взаимодействие цинка с соляной кислотой. Взаимодействие железа с раствором медного купороса. §13,14,№8 ,9 18 Скорость химической Понятие о скорости химической реакции и реакции и факторы, от единицах ее измерения. Зависимость скорости которых она зависит химической реакции от природы реагирующих веществ, их концентрации, температуры, площади соприкосновения реагирующих веществ и катализатора. Д.1. Зависимость скорости реакции от природы реагирующих веществ,концентрации,пло щади соприкосновения и катализатора. §15,№89,1 1 19 Обратимость химических реакций. Химическое равновесие и способы его смещения. Необратимые и обратимые реакции. Состояние химического равновесия для обратимых реакций. Способы смещения химического равновесия. Д.1. Необратимые реакции, идущие по правилу Бертолле. §16,№3-6 20 Роль воды в химических реакциях Электролиты и неэлектролиты. Электролитическая диссоциация как результат гидратации электролита. Основные положения теории электролитической диссоциации. Сильные и слабые электролиты. Д.Взаимодействие воды с натрием.Гашение извести.Взаимодействие воды с оксидом фосфора (V). §17,№ 10 21 Гидролиз. Необратимый гидролиз неорганических и органических соединений. . Понятие о рН.Обратимый гидролиз органических соединений как основа обмена веществ в живых организмах. Различные случаи гидролиза солей и демонстрация среды растворов с помощью индикаторов §18,№7 22 Окислительновосстановительная реакции (ОВР) Степень окисления и ее определение по формуле соединения. Понятие об ОВР. Окислитель и восстановитель, окисление и восстановление. Д. взаимодействия: щелочного металла с водой ,цинка с соляной кислотой;,железа с р-рам медного купороса. §19,стр.15 5-158,№3 23 Электролиз. Электролиз как ОВР. Электролиз расплавов и растворов на примере хлорида натрия. Электролитическое получение алюминия. Практическое применение электролиза. Д.1. Модель электролизной ванны для получения алюминия. §19,стр.15 8-162,№7 24 Металлы и их свойства. Положение металлов в Периодической системе и особенности строения их атомов и кристаллов; общие физические свойства металлов. Общие химические свойства металлов . Д.1. Коллекция образцов металлов. §20,стр.16 4-169,№5 2. Горение магния. Взаимодействие щелочных металлов и щелочноземельных металлов с водой. Взаимодействие железа с раствором сульфата меди 25 Коррозия металлов Понятие о коррозии металлов и способы защиты от нее. Д.1. Результаты коррозии металлов в зависимости от условия ее протекания. §20,стр.17 0-173,,№7 26 Неметаллы Положение неметаллов в Периодической системе и особенности строения их атомов и кристаллов; аллотропия и ее причины; электроотрицательность. Общие физические свойства неметаллов . Окислительные свойства неметаллов. Восстановительные свойства неметаллов. Ряд активности галогенов. Д.1. Коллекция образцов неметаллов. §21,№6,7 2. Горение серы, угля и фосфора в кислороде. 27 Кислоты неорганические и органические. Определение кислот в свете излученных теорий: атомно - молекулярного учения, теории электролитической диссоциации и в свете протонной теории. Классификация кислот по различным признакам: содержание кислорода, основности, силе, стабильности, растворимости. Общие химические свойства кислот Л. Химические свойства §22,№5 соляной и уксусной кислот: взаимодействие с металлом, щелочью, карбонатом, оксидами металлов, нерастворимым гидроксидом. 28 Основания неорганические и органические Определение оснований в свете изученных теорий: атомно – молекулярного учения, теории электролитической диссоциации и в свете протонной теории. Классификации оснований по различным признакам: содержанию кислорода, кислотности, силе, стабильности, растворимости. Общие химические свойства со щелочей, нерастворимых оснований Д.1. Коллекция щелочей и свежеполученных нерастворимых гидроксидов различных металлов. 2. Реакция нейтрализации Получение нерастворимого основания и растворения его в кислоте. §23,№5 29 Соли неорганических и органических кислот. Определение солей в свете изученных теорий: атомно – молекулярного учения и теории электролитической диссоциации. Классификация солей. Общие химические свойства солей. Представители солей и их значение. Д.1. Коллекция солей различной окраски. Коллекция природных минералов, содержащих соли. Гашение соды уксусом. §24,№5 30 Генетическая связь между классами неорганических соединений. Понятие о генетической связи и генетическом ряде. Генетический ряд металла и неметалла. Д.1 Практическое осуществление переходов §25,№6,7 31 Практическая работа №2 « Решение экспериментальных задач на идентификацию органических и неорганических соединений». Решение экспериментальных задач на идентификацию органических и неорганических соединений 32 Повторение и обобщение темы теме «Вещества и их свойства» 33 Контрольная работа №2 по теме «Вещества и их свойства» 34 Заключительный урок – конференция «Роль химии в моей жизни» Задание в тетради.