Календарный тематический план по химии 9 класс
advertisement
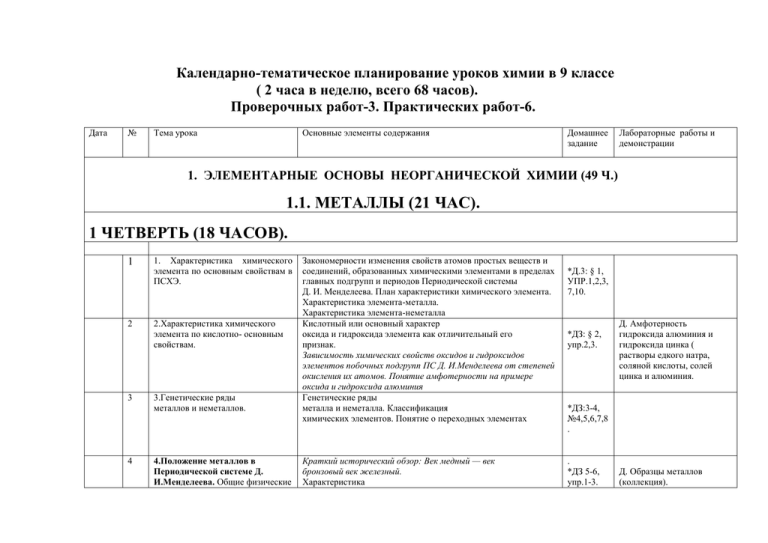
Календарно-тематическое планирование уроков химии в 9 классе ( 2 часа в неделю, всего 68 часов). Проверочных работ-3. Практических работ-6. Дата № Тема урока Основные элементы содержания Домашнее задание Лабораторные работы и демонстрации 1. ЭЛЕМЕНТАРНЫЕ ОСНОВЫ НЕОРГАНИЧЕСКОЙ ХИМИИ (49 Ч.) 1.1. МЕТАЛЛЫ (21 ЧАС). 1 ЧЕТВЕРТЬ (18 ЧАСОВ). 1 1. Характеристика химического элемента по основным свойствам в ПСХЭ. 2 2.Характеристика химического элемента по кислотно- основным свойствам. 3 4 3.Генетические ряды металлов и неметаллов. 4.Положение металлов в Периодической системе Д. И.Менделеева. Общие физические Закономерности изменения свойств атомов простых веществ и соединений, образованных химическими элементами в пределах главных подгрупп и периодов Периодической системы Д. И. Менделеева. План характеристики химического элемента. Характеристика элемента-металла. Характеристика элемента-неметалла Кислотный или основный характер оксида и гидроксида элемента как отличительный его признак. Зависимость химических свойств оксидов и гидроксидов элементов побочных подгрупп ПС Д. И.Менделеева от степеней окисления их атомов. Понятие амфотерности на примере оксида и гидроксида алюминия Генетические ряды металла и неметалла. Классификация химических элементов. Понятие о переходных элементах Краткий исторический обзор: Век медный — век бронзовый век железный. Характеристика *Д.3: § 1, УПР.1,2,3, 7,10. *ДЗ: § 2, упр.2,3. Д. Амфотерность гидроксида алюминия и гидроксида цинка ( растворы едкого натра, соляной кислоты, солей цинка и алюминия. *ДЗ:3-4, №4,5,6,7,8 . . *ДЗ 5-6, упр.1-3. Д. Образцы металлов (коллекция). 5 6 7 8 9 свойства металлов. положения элементов-металлов в периодической системе. Строение атомов металлов. Металлические кристаллические решетки. Металлическая химическая связь Физические свойства металлов простых веществ. Легкие и тяжелые металлы. Черные и цветные металлы. Драгоценные металлы 5.Сплавы (сталь, чугун, дюралюминий, бронза). Сплавы и их классификация. Черная металлургия: чугуны и стали. Цветные сплавы: бронза, латунь, мельхиор, дюралюминий. Характеристика сплавов, их свойства. Значение важнейших сплавов Восстановительные свойства металлов. Взаимодействие металлов с кислородом и другими неметаллами Характеристика общих химических свойств металлов на основании их положения в ряду напряжения в свете представления об ОВР. Правила применения электрохимического ряда напряжений при определении возможности взаимодействия с растворами кислот и солей. Поправки к правилам применения электрохимического ряда напряжения. Металлотермия Самородные металлы. Минералы. Руды, Металлургия и ее виды: пиро-, гидро-, электрометаллургия. Металлотермия. Микробиологические методы получения металлов Коррозия металлов, способы защиты металлов от коррозии 6. Свойства простых веществ металлов реакции с неметаллами, кислотами, солями. 7. Химические свойства металлов (продолжение). Ряд активности металлов. 8.Металлы в природе. Получение металлов. 9. Коррозия металлов. *ДЗ: § 7, упр.1-4 *ДЗ: §8 , упр.2,3,5,7 . *Д3: § 8 (до конца), зад. в тетради. *ДЗ: § 9; Упр.4-6. *ДЗ: § 10, упр. 1—4. 10 10. Щелочные металлы . Строение атомов элементов главной подгруппы первой группы. Щелочные металлы— простые вещества. Общие физические свойства щелочных металлов. *Д3. §11, упр.1,2. Л. Знакомство с образцами металлов и сплавов(по коллекциям). Д. Горение магния; взаимодействие натрия и кальция с водой (фенолфталеин); взаимодействие металлов с галогенами и с серой. Л .Растворение железа и цинка в соляной кислоте; вытеснение одного металла другим из раствора соли ( рр медного купороса и железа). Л. Знакомство с образцами металлов, рудами железа, соединениями алюминия(коллекция руд). Д. Образцы металлов и сплавов, подвергшихся коррозии. Д. Взаимодействие натрия с водой (фенолфталеин). 11 11.Соединения щелочных металлов. 12 12. Общая характеристика щелочно-земельных металлов. 13 13.Важнейшие соединения щелочно-земельных металлов 14 14.Алюминий. Химические свойства щелочных металлов: взаимодействие с простыми веществами, с водой. Природные соединения, содержащие щелочные металлы, способы получения металлов Обзор важнейших соединений щелочных металлов: щелочи, соли (хлориды, карбонаты, сульфаты, нитраты). Природные соединения щелочных металлов Строение атомов щелочноземельных металлов. Физические свойства. Химические свойства: взаимодействие с простыми веществами, с водой, с оксидами (магний, кальцийтермия) : §11, упр.1(б). *ДЗ: § 12, упр.3,4. Важнейшие соединения: оксид кальция — негашеная известь, оксид магния — жженая магнезия, гидроксид кальция, соли (мел, мрамор, известняк, гипс, фосфаты и др). Применение важнейших соединений. Роль химических элементов кальция и магния в жизнедеятельности живых организмов Строение атома алюминия. Физические, химические свойства алюминия: взаимодействие с простыми веществами, кислотами Алюмотермия. Природные соединения алюминия и способы его получения. Области применения алюминия 12, упр.5.7. * §13, упр. 1, 3, 4. 15 15.Соединения алюминия Соединения алюминия: амфотерность оксида и гидроксида. Важнейшие соли алюминия. Применение алюминия и его соединений 16 16.Железо, его строение, Физические и химические свойства Строение атома железа. Степени окисления железа. Физические, химические свойства железа: взаимодействие с простыми веществами, водой, кислотами, солями. Железо в природе, минералы железа *Д3: § 13, упр.5,6. *ДЗ: § 14, упр.1-3. Л. Распознавание катионов натрия и калия по окраске пламени. Д. Горение магния. Взаимодействие кальция с водой (фенолфталеин). Л Распознавание катионов кальция и бария (р-ры солей кальция и бария, серной кислоты, карбоната кальция). Д. Образцы алюминия (гранулы, пудра) и его природных соединений. Д. Амфотерность гидроксида алюминия (р-ры едкого натра, соляной кислоты, соли алюминия). Л. Знакомство с образцами сплавов железа(коллекция). Растворение железа в соляной кислоте( железные опилки, соляная кислота). Вытеснение одного металла другим из раствора соли(р-р медного купороса и железная кнопка). 17 17. Соединения железа. Генетические ряды железа(11) и железа(III). Важнейшие соли железа Соединения катионов железа Железо — основа современной техники Понятие коррозии. Роль химического элемента железа в жизнедеятельности живых организмов 18 18. Практическая Правила техники безопасности при выполнении данной работы. Объяснять результаты и записывать уравнения соответствующих реакций в молекулярной и ионной формах работа №1 « Получение соединений металлов и изучение их свойств». §14, упр. 4, 6, 5. Л. Получение гидроксидов железа и изучение их свойств (р-ры солей железа, р-р гидроксида натрия, серная кислота). Д. Качественные реакции на ионы железа( р-ры солей железа+2и +3, р-ры красной и желтой кровяной соли, роданид калия). *ДЗ: повторени е § 2—14 КОЛИЧЕСТВО ПРОВЕДЕННЫХ УРОКОВ ЗА 1 ЧЕТВЕРТЬ. 2 ЧЕТВЕРТЬ (14 ЧАСОВ). 19 19.Обобщение и систематизация знаний по теме «Металлы». Повторение ключевых моментов темы «Металлы»: Физические и химические свойства металлов и их важнейших соединений 20 20. Урок-упражнение по теме «Металлы». 21 21. Проверочная работа №1 по теме «Металлы» Тематический контроль знаний *ДЗ: повторить § 7—14. *Повтори ть § 5—14 1.2. НЕМЕТАЛЛЫ (28 ЧАСОВ). 22 1. Общая характеристика Кислород, озон, воздух. неметаллов. Положение элементов- неметаллов в ПСХЭ Д.И. Менделеева, особенности строения их *д3 § 15- Д. Образцы неметаллов( водород, кислород, хлор в 23 24 25 26 27 2.Водород и его свойства. Водородные соединения неметаллов 3.Общая характеристика галогенов. Галогены – простые вещества. 4.Галогеноводородные кислоты и их соли. 5. Получение галогенов. Биологическое значение и применение галогенов и их соединений 6.Общая характеристика халькогенов. Кислород. атомов. Свойства простых веществ неметаллов. Электроотрицательность как мера неметалличности, ряд электроотрицательность. Кристаллическое строение не метал лов — простых веществ. Аллотропия, состав воздуха. Физические свойства неметаллов .Относительность понятий «металл» — «неметалл» Двойственное положение водорода в Периодической системе Д. И. Менделеева. Физические свойства водорода. Химические свойства водорода —о. и в. Применение водорода Получение, собирание, распознавание водорода Строение атомов Г. и их степени окисления. Физ. свойства галогенов. Хим. свойства галогенов: взаимодействие с металлами, водородом, растворами солей галогенов. Изменение ок- вос. свойств у галогенов от фтора к йоду Галогеноводороды: Галогеноводородные кислоты: фтороводородная (плавиковая) хлороводородная(соляная). Бромоводородная, йодоводородная. Галогениды: фториды, хлориды,бромиды, йодкды. Качественные реакции на галогенид ионы. Природные соединения галогенов Получение галогенов электролизом расплавов или растворов солей. Дилогическое значение галогенов. Применение галогенов и их соединений Кислород в природе. Хим свойства кислорода: 16, упр.14. *Д3: § 17, упр.1,2,5. *ДЗ: § 18, упр.1,4,5. *ДЗ: § 19, упр.2,3,4. пробирках с пробками, бром в ампуле, сера, йод, красный фосфор, активированный уголь. Л. Знакомство с образцами неметаллов ( коллекция). Д. Получение, собирание и распознавание водорода.(гранулы цинка, соляная кислота). Д. Взаимодействие алюминия с йодом( смесь порошка алюминия и йода).Последовательное вытеснение галогенов из рров их солей. Йодокрахмальная проба( клейстер, спиртовая настойка йода). Л. Знакомство с образцами природных соединений неметаллов (фторидами, хлоридами). Д. Распознавание соединений хлора, брома, йода( р-ры хлорида, бромида, йодида калия. Нитрата серебра). *Д3. § 20, упр.1,2. *Д3 § Д. Получение кислорода и его взаимодействие с 28 29 30 31 7.Сера- простое вещество. Соединения серы.. 8. Серная кислота и ее соли. 9.Урок-упражнение по теме «Подгруппа кислорода». 10.Практическая работа№ 2 «Экспериментальные задачи по теме подгруппа кислорода». взаимодействие с прост. веществами (металлами и неметаллами) Сложн. вещ. Горение и медленное окисление. дыхание и фотосинтез. Получение кислорода. Применение кислорода Строение атомов серы и степени окисления серы. Аллотропия серы. Химические свойства серы: взаимодействие с металлами, кислородом, водородом. Демеркуризация. Сера в природе: самородная, сульфидная и сульфатная. Биологическое значение серы. Применение серы. Сероводород и сульфиды. Сернистый газ, сернистая кислота, сульфиты Серная кислота разбавленная и концентрированная. Применение серной кислоты. Соли серной кислоты: глауберова соль, гипс, сульфат бария, медный купорос. Производство серной кислоты. Качественная реакция на сульфатион Решение упражнений по теме «Подгруппа кислорода». Повторение ключевых понятий темы Правила техники безопасности при выполнении данной работы. Объяснять результаты и записывать уравнения 21,упр.1,2, 3.8. *ДЗ: § 22, упр.1-2; *ДЗ: §23, упр.1-5. *ДЗ: повторени е § 2 1— 23 простыми веществами( перманганат калия, древесный уголь, сера). Л. Знакомство с образцами природных соединений серы. Д. Аллотропия серы . Взаимодействие серы с металлами ( натрий). Д. Взаимодействие раз.серной кислоты с металлами, оксидами металлов, гидроксидами металлов ( гранулы цинка, алюминия, железные стружки, оксид магния, р-р гидроксида натрия, лакмус, свежеприготовленный гидроксид железа 3,разб. Серная кислота). Свойства конц серной кислоты ( обугливание бумаги и сахарной пудры). Л. Распознавание сульфат – иона( р-р сульфата натрия, нитрата бария). соответствующих реакций. 32 11. Азот- простое вещество. Строение атомов и молекул азота. Свойства азота. Взаимодействие с металлами, водородом и кислородом. Получение азота из жидкого воздуха. Азот в природе и его биологическое значение *ДЗ: § 24,упр.14. Д. Получение азота(кристал.бихромат аммония, нитрит натрия, спирт). КОЛИЧЕСТВО ПРОВЕДЕННЫХ УРОКОВ ЗА 2 ЧЕТВЕРТЬ 3 ЧЕТВЕРТЬ (20 ЧАСОВ). 33 12. Аммиак. 34 13. Соли аммония 35 36 14 – 15. Кислородные соединения азота. кислота и ее соли. Строение молекулы аммиака. Свойства аммиака: взаимодействие с водой, кислотами, кислородом. донорно- акцепторный механизм образования связи в ионе аммония. Получение, собирание и распознавание аммиака Свойства солей аммония, обусловленные ионом аммония и различными анионами. Разложение солей аммония. Хлорид, нитрат, карбонат аммония и их применение Азотная Несолеобразующие кислотные оксиды азота. Оксид азота (IУ). Свойства азотной кислоты как электролита и как окислителя. Взаимодействие концентрированной и разбавленной кислоты *ДЗ: §25, упр.1,7,8,1 0. *ДЗ: § 26, упр.1,2,4,5 . *ДЗ: § 27, упр.2,4,5. Д. Получение, собирание и распознавание аммиака 9 гидроксид кальция и хлорид аммония, влажная индикаторная бумага, конц соляная кислота). Д. Получение солей аммония( конц р-ры серной и азотной кислоты, соляная кислота, кристал. хлорид аммония и гидроксид кальция, влажная лакмусовая бумага). Л. Распознавание катионов аммония ( р-ры солей аммония и гидроксида натрия, влажная лакмусовая бумажка). Д. Получение оксида азота(4) и его взаимодействие с водой( медь, оксид меди. Конц. Азотная кислота). Взаимодействие азотной кислоты с основаниями, с медью. Применение азотной кислоты. Нитраты, селитры 37 16.Практическая работа№3 « Экспериментальные задачи по теме подгруппа азота». Правила техники безопасности при выполнении данной работы. Объяснять результаты и записывать уравнения реакций. 38 17. Фосфор. Соединения фосфора. Биологическое значение фосфора и его применение. 39 18. Решение задач и упражнений по теме «Подгруппа азота». Аллотропия фосфора: белый фосфор. Красный фосфор. Свойства фосфора: образование фосфидов, оксида фосфора (У). Фосфорная кислота и три ряда ее солей: фосфаты, гидрофосфаты и дигидрофосфаты. Биологическое значение фосфора (фосфат кальция, АТФ, ДНК и РНК) Применение фосфора и его соединений Решение упражнений по теме «Подгруппа азота». Повторение ключевых понятий темы 40 19. Обобщение и систематизация знаний по теме «Подгруппа азота». 41 20.Углерод, графит). 42 аллотропные модификации 21. Кислородные соединения углерода. Угольная кислота и ее соли. (алмаз, Решение упражнений и повторение ключевых понятий темы. Строение атома и степень окисления углерода. Аллотропия углерода: алмаз и графит. Древесный активированный уголь. Адсорбция и ее применение. Химические свойства углерода. Взаимодействие с кислородом, металлами, водородом с оксидами металлов. Карбиды кальция и алюминия. Ацетилен и метан. Круговорот углерода в природе Оксид углерода (1), или угарный газ: получение, свойства, применение. Оксид углерода(IУ), или углекислый газ. Получение, основными оксидами, солями ( р-ры азотной кислоты, гидроксида натрия, мрамор, свежеприготовленный р-р гидроксида меди). . *ДЗ: §28, упр.1,2, 3, 5. Д. Горение фосфора, образование фосфорной кислоты( красный фосфор, лакмус). Взаимодействие фосфорной кислоты с щелочами и солями (р-ры фосфорной кислоты, гидроксида натрия, нитрата серебра). * ДЗ: § 24—28 с. 101— 118 тест *ДЗ: § 29, упр.1-3, 8. *ДЗ: § 30, Д. Модели кристаллических решеток алмаза и графита. Адсорбция ( древесный уголь, таблетки карбогена, р-ры чернил, сока свеклы, одеколон). Д. Получение , распознавание и собирание углекислого газа( мрамор, соляная кислота, 43 22. Практическая работа №4 « Получение оксида углерода(4) и изучение его свойств .Распознавание карбонатов». 44 23. Кремний. Соединения кремния. Применение кремния и его соединений. 45 24.Обобщение и систематизация знаний по теме «Подгруппа углерода». 46 25. Практическая работа № 5 «Качественные реакции на газообразные вещества и ионы в растворе». 47 26. Решение задач по теме «Неметаллы». 48 27. Обобщение и систематизация знаний по теме «Неметаллы» свойства, применение. Угольная кислота и ее соли. Карбонаты и гидрокарбонаты. Превращение карбонатов в гидрокарбонаты и обратно. Понятие жесткости воды и способы ее устранения. Качественная реакция на соли угольной кислоты Правила техники безопасности при выполнении данной работы. Технологическая схема работы. Способы собирания газа . Объяснять результаты и записывать уравнения реакций. Природные соединения кремния: кремнезем, кварц, силикаты, алюмосиликаты, асбест. Биологическое значение кремния. Свойства кремния: полупроводниковые, взаимодействие с кислородом, металлами, щелочами. Оксид кремния (IУ): его строение и свойства. Кремниевая кислота и ее соли. Рас творимое стекло. Применение кремния и его соединений. Стекло. Цемент Решение упражнений по теме «Подгруппа углерода». Повторение ключевых понятий темы Правила техники безопасности при выполнении данной работы. Объяснять результаты и записывать уравнения реакций. Решение упражнений и задач по теме «Неметаллы» Обобщение, систематизация и коррекция знаний, умений и навыков учащихся по теме «Неметаллы» известковая вода). Л. Качественная реакция на карбонат –ион. . *ДЗ: §31, упр.1,3,4. Л. Знакомство с образцами природных соединений кремния. Д. Получение кремниевой кислоты ( силикат натрия, соляная кислота). Д/З: § 29— 31,задачи по тетради. . *Д3: повторить 29-30, задачи по тетради. *ДЗ: повторить § 29-30. . 49 28. Проверочная работа №2 по теме «Неметаллы». Контроль знаний, умений и навыков 2. Первоначальные представления об органических веществах ( 13 часов). 50 51 52 1.Первоначальные сведения о строении органических веществ. Особенности органических веществ 2. Предельные углеводороды (алканы). 3. Непредельные углеводороды (алкены, алкины). Первоначальные сведения о строении органических веществ. Теория витализма. Ученые, работы которых опроверг ли теорию витализма. Понятие об изомерии гомологическом ряде._ Строение алканов. Номенклатура алканов. Углеводороды: метан, этан, особенности физических и химических свойств Непредельные углеводороды: этилен. Химическое строение молекулы этилена. Двойная связь. Взаимодействие этилена с водой. Полимеризация. Полиэтилен и его значение ДЗ: 32, упр.1,2,6. ДЗ: § 33. Упр.4,5. ДЗ: § 34, упр.1,2. Д. Модели молекул органических соединений. Д. Образцы нефти, каменного угля и продуктов их переработки, горение углеводородов и обнаружение продуктов их горения. Д. Образцы изделий из полиэтилена, качественные реакции на этилен. КОЛИЧЕСТВО ПРОВЕДЕННЫХ УРОКОВ ЗА 3 ЧЕТВЕРТЬ 4 ЧЕТВЕРТЬ ( 16 ЧАСОВ ). 53 4. Ароматические углеводороды (арены). Бензол. 54 5. Практическая работа № 6 «Изготовление моделей углеводородов». 55 6. Спирты . Зад в тетради. Шаростержневые и другие виды моделей молекул веществ. Валентные углы, длины связей Спирты и их атомность. Метанол, этанол, этиленгликоль, глицерин —важнейшие представители класса спиртов, их строение и ДЗ: § 35, упр.1,4,5. Д. Качественная реакция на бензол ( бензол и хлорид железа (3)). Д. Образцы спиртов( этанол, глицерин). 56 7. Альдегиды. 57 8 Предельные одноосновные карбоновые кислоты. Сложные эфиры. 58 9.Биологически важные аминокислоты, белки. 59 вещества: жиры, 10. Углеводы. 60 11. Полимеры. 61 12.Повторение. Подготовка к проверочной работе №3 по теме «Органические вещества». 13.Проверочная работа №3 по теме «Органические соединения» 62 свойства. Понятие о карбонильной группе и альдегидах. Свойства альдегидов. Карбоксильная группа и общая формула предельных одноосновных карбоновых кислот. Муравьиная и уксусная кислоты — важнейшие представители класса предельных одноосновных карбоновых кислот, их строение и свойства Предельные и непредельные жирные кислоты. Жиры как сложные эфиры. Растительные и животные жиры, их применение. Понятие о мылах, синтетических моющих средствах Аминокислоты. Получение и свойства аминокислот. Биологическая роль Пептидная связь и полипептиды. Уровни организации структуры белка. Свойства белков и их биологические функции. Кач. реакции Углеводы: моносахариды, дисахариды, полисахариды. Глюкоза и фруктоза. Сахароза. Крахмал. Целлюлоза Основные понятия химии ВМС: «полимер», «мономер», «структурное звено», «степень полимеризации», «средняя молекулярная масса полимера». Краткий обзор важнейших полимеров 3. ХИМИЯ И ЖИЗНЬ (6 ЧАСОВ). Зад. в тетради. д/З: § 36, упр.1-3. Д .Образцы кислот (муравьиной, уксусной, стеариновой). Лакмус, гранулы цинка, р-р гидроксида натрия, оксид магния, свежеприготовленный гидроксид меди (2). Д. Образцы жиров. ДЗ: § 3738, вопросы. Д3: § 39, упр.1,3,5. ДЗ: § 40, упр.1,2,5. Повтор.с 32 по 40. Д. Глюкоза, сахароза, крахмал, целлюлоза (вата). Д .Образцы изделий из полиэтилена . Коллекция «Пластмассы». 63 1. Человек в мире веществ, материалов и химических реакций. Химические реакции в ОС. Роль химии в жизни современного человека 64 2.Химия и повседневная жизнь человека. 65 3.Химия и здоровье. Проблемы безопасного использования веществ и химических реакций в повседневной жизни . Токсичные, горючие и взрывоопасные вещества. Лекарства, ферменты, витамины, гормоны, минеральные воды. Проблемы, связанные с применением лекарственных препаратов. 66 4.Химия и пища. 67 5.Химия и сельское хозяйство. 68 6. Химическое загрязнение окружающей среды и его последствия. КОЛИЧЕСТВО ПРОВЕДЕННЫХ УРОКОВ ЗА 4 ЧЕТВЕРТЬ Итого за год количество проведенных уроков. Калорийность жиров, белков и углеводов. Консерванты пищевых продуктов (поваренная соль, уксусная кислота). Классификация удобрений , химическая мелиорация почв. Виды химического загрязнения гидросферы, атмосферы, почвы и его последствия. ДЗ: конспект. Самост. поиск хим. информац ии с использов анием различных источнико в Защита проектов Д. Образцы строительных и поделочных материалов. Д. Образцы средств гигиены и косметики. Д. Образцы лекарственных препаратов и витаминов. Защита проектов Защита проектов Защита проектов Д. Образцы упаковок пищевых продуктов с консервантами. Д. Образцы удобрений.