Рабочая программа по химии, 8 класс
advertisement
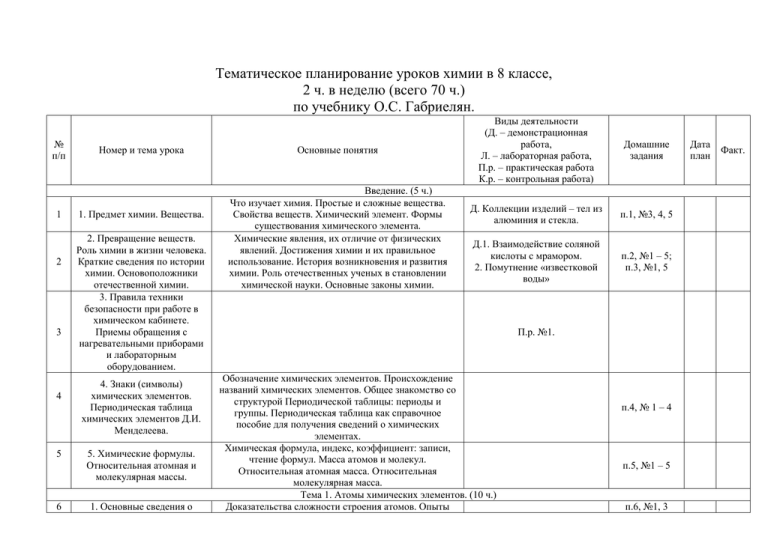
Тематическое планирование уроков химии в 8 классе, 2 ч. в неделю (всего 70 ч.) по учебнику О.С. Габриелян. № п/п 1 2 3 4 5 6 Номер и тема урока 1. Предмет химии. Вещества. 2. Превращение веществ. Роль химии в жизни человека. Краткие сведения по истории химии. Основоположники отечественной химии. 3. Правила техники безопасности при работе в химическом кабинете. Приемы обращения с нагревательными приборами и лабораторным оборудованием. 4. Знаки (символы) химических элементов. Периодическая таблица химических элементов Д.И. Менделеева. 5. Химические формулы. Относительная атомная и молекулярная массы. 1. Основные сведения о Основные понятия Введение. (5 ч.) Что изучает химия. Простые и сложные вещества. Свойства веществ. Химический элемент. Формы существования химического элемента. Химические явления, их отличие от физических явлений. Достижения химии и их правильное использование. История возникновения и развития химии. Роль отечественных ученых в становлении химической науки. Основные законы химии. Виды деятельности (Д. – демонстрационная работа, Л. – лабораторная работа, П.р. – практическая работа К.р. – контрольная работа) Домашние задания Д. Коллекции изделий – тел из алюминия и стекла. п.1, №3, 4, 5 Д.1. Взаимодействие соляной кислоты с мрамором. 2. Помутнение «известковой воды» п.2, №1 – 5; п.3, №1, 5 П.р. №1. Обозначение химических элементов. Происхождение названий химических элементов. Общее знакомство со структурой Периодической таблицы: периоды и группы. Периодическая таблица как справочное пособие для получения сведений о химических элементах. Химическая формула, индекс, коэффициент: записи, чтение формул. Масса атомов и молекул. Относительная атомная масса. Относительная молекулярная масса. Тема 1. Атомы химических элементов. (10 ч.) Доказательства сложности строения атомов. Опыты п.4, № 1 – 4 п.5, №1 – 5 п.6, №1, 3 Дата план Факт. 7 8 9 10 11 12 13 строении атомов. Состав атомных ядер: протоны, нейтроны. 2. Изменение числа протонов в ядре – образование новых химических элементов. Изменение числа нейтронов в ядре – образование изотопов. Электроны. Строение электронных оболочек атомов элементов №1-20. 4. Периодическая таблица химических элементов Д.И.Менделеева и строение атомов. 5. Изменение числа электронов на внешнем электронном уровне атома химического элемента образование положительных и отрицательных ионов. Ионная химическая связь. 6. Взаимодействие атомов элементов неметаллов между собой – образование молекул простых веществ. Ковалентная неполярная химическая связь. 7. Взаимодействие атомов элементов неметаллов между собой – образование молекул соединений. Электроотрицательность. Ковалентная полярная химическая связь. 8. Взаимодействие атомов Резерфорда. Планетарная модель строения атома. Характеристика нуклонов. Взаимосвязь понятий: протон, нейтрон, массовое число.п.6, №1, 3 Современное определение понятия «химический элемент». Изотопы как разновидность атомов одного химического элемента. п.7, №1 – 4 Характеристика электронов. Строение электронных оболочек атомов элементов № 1 – 20. Понятие о завершенном и незавершенном электронных уровнях. п.8, №1 – 5 Физический смысл порядкового номера элемента, номера группы, номера периода. Причины изменения свойств химических элементов в периодах и группах. п.9 до слов: «Каков же результат приема-отдачи электронов…», №1 Понятие иона. Ионы, образованные атомами металлов и неметаллов. Понятие об ионной связи. Схемы образования ионных соединений. п.9 до конца, №2, 3 Схемы образования двухатомных молекул (H2, CL2, S2, N2). Электронные и структурные формулы. Кратность химической связи. п.10, №1 – 4 Схемы образования молекул соединений (HCL, H2O, NH3 и др.). Электронные и структурные формулы. Понятие об ЭО и ковалентной полярной химической связи. п.11, №1 – 4 п.12, №1 – 3 элементов металлов между собой – образование металлических кристаллов. 14 15 9. Обобщение и систематизации знаний об элементах: металлах и неметаллах. О видах химической связи. 10. Контрольная работа №1 по теме «Атомы химических элементов». 16 1. Простые вещества – металлы. Общие физические свойства металлов. Аллотропия. 17 2. Простые вещества – неметаллы. Физические свойства неметаллов. 18 19 Понятие о металлической связи Выполнение упражнений. Подготовка к контрольной работе. К.р. №1. Тема 2. Простые вещества. (7 ч.) Характеристика положения элементов-металлов в Периодической системе. Строение атомов металлов. Металлическая связь (повторение); физические свойства металлов – простых веществ. Аллотропия на примере олова. Положение элементов-неметаллов в Периодической системе. Строение их атомов. Ковалентная связь (повторение). Физические свойства неметаллов – простых веществ. Химические формулы. Расчет относительной молекулярной массы (повторение). Понятие аллотропии на примере модификации кислорода. Аллотропия фосфора, углерода. Относительность понятий «металлические» и «неметаллические» свойства. Д. Коллекция металлов. п.13, №1, 3, 4 Д. Коллекция неметаллов. п.14, №3, 4 3. Количество вещества. Количество вещества и единицы его измерения: моль, ммоль, кмоль. Постоянная Авогадро. п.15 до слов: «Масса 1 моль называется молярной…», №1, 2 4. Молярная масса вещества. Расчет молярных масс веществ по их химическим формулам. Миллимолярная и киломолярная массы. Выполнение упражнений с использованием понятий «постоянная Авогадро», «количество вещества», «масса», «молярная масса». п.15 до конца, №3, 4 20 5. Молярный объем газообразных веществ. 21 6. Решение расчетных задач. 22 7. Обобщение и систематизация знаний по теме. Решение расчетных задач. 23 24 1. Степень окисления. Бинарные соединения металлов и неметаллов: оксиды, хлориды, сульфиды. 2. Важнейшие класс бинарных соединений – оксиды, летучие водородные соединения. 25 3. Основание. 26 4. Кислоты. 2728 5. 6. Соли как производные кислот и оснований. 29. 7. Обобщение знаний. 30 8. Аморфные и кристаллические вещества. Межмолекулярные взаимодействия. Понятие о молярном объеме газов. Нормальные условия. Миллимолярный и коломолярный объем. Выполнение упражнений с использованием понятий «объем», «молярный объем», «количество вещества», «масса», «молярная масса». Решение задач и упражнений с использованием понятий «количество вещества», «молярная масса», «молярный объем газов», «постоянная Авогадро». п.16, №1, 2 Решение задач и упражнений. Тема 3. Соединение химических элементов. (14 ч.) Понятие о степени окисления. Определение степени окисления элементов по формулам соединений. Д. Образцы оксидов, хлоридов, Составление формул бинарных соединений, общий сульфидов. способ их названий. Составление формул, их названия. Расчеты по формулам. Характеристика важнейших соединений. Их представители: H2O, CO2, CaO, HCL, NH3. Состав и названия оснований, их классификация. Расчеты по формулам оснований. Представители:NaOH, KOH, Ca(OH)2. Состав и названия кислот; их классификация. Расчеты по формулам кислот. Представители кислот. Состав и название солей. Расчеты по формулам солей. Представители: NaCL, CaCO3, Ca3(PO4)2. Классификация сложных веществ, определение принадлежности соединений к различным классам по их формулам. Упражнения в составлении формул по названиям и названий веществ по формулам. Расчеты по формулам соединений. Понятия о межмолекулярном взаимодействии и молекулярной кристаллической решетке. Свойства веществ с этим типом решетки. Свойства веществ с разным типом кристаллических решеток, их Д. Образцы оксидов, летучих водородных соединений. Д. Образцы щелочей. Изменение окраски индикаторов. Д. Образцы кислот. Изменение окраски индикаторов. п.17, №1, 2 п.18 до конца, №1,2 п.19, №1 – 4 п.20, № 1 – 3 Д. Образцы солей. п.21 №1 – 3 Д. Модели кристаллических решеток. п.22, №1, 5 Молекулярные, ионные, атомные и металлические кристаллические решетки. 31 9. Чистые вещества и смеси. 32 10. Очистка загрязненной поваренной соли. принадлежность к разным классам соединений. Взаимосвязь типов кристаллических решеток и видов химической связи. Понятия о чистом веществе и смеси, их отличия. Примеры жидких и газообразных смесей. Способы разделения смесей. Д. Образцы смесей. п.23, №1, 2, 4 П.р. №2. 33 11. Массовая и объемная доля компонентов смеси, в том числе и доля примесей. Понятие о доли компонента смеси. Вычисление ее в смеси и расчет массы или объема вещества по его доле. п.24, №1 – 2 3435 12. 13. Решение расчетных задач. Решение задач и упражнений на расчет доли (массовой или объемной) и нахождение массы (объема) компонента смеси. п.24, №4 – 5 36 14. Контрольная работа №2 по теме «Соединение химических элементов». 37 1. Физические явления. 38 2. Химические реакции. 39 3. Химические уравнения. Закон сохранения массы веществ. 40 4. Реакции разложения. 41 42 5. Получение кислорода. 6. Реакции соединения. К.р. №2. Тема 4. Изменения, происходящие с веществами. (13 ч.) Способы очистки веществ, основанные на их Д. Плавление парафина. физических свойствах. Очистка питьевой воды. Возгонка йода. Перегонка нефти. Понятие о химических явлениях их отличие от физических. Признаки и условия протекания химических реакций. Реакция горения. Экзо- и Д. Горение магния. эндотермические реакции. Количественная сторона Взаимодействие соляной химических реакций в свете учения об атомах и кислоты с мрамором. молекулах. Значение закона сохранения массы веществ. Роль М.В. Ломоносова и Д. Дальтона в открытии и утверждении закона сохранения массы веществ. Понятие о химическом уравнении как условной записи химической реакции с помощью химических формул. Значение индексов и коэффициентов. Составление уравнений химических реакций. Сущность реакций разложения и составление уравнений реакций, Д. Разложение нитрата калия. проделанных учителем. П.р. №3. Сущность реакций соединения. Составление уравнений п.25, №2 – 4 п.26, №1 – 5 п.27,№1 п. 29 , №1 п.30, № 1.2 реакций, проделанных учителем. 43 7. Реакции замещения. 44 8. Получение водорода. 45 9. Реакции обмена. 46 10. Признаки химических реакций. 47 48 49 50 11. Расчеты по химическим уравнениям. 12. Обобщение и систематизация знаний по теме. 13. Контрольная работа №3 по теме «Изменения, происходящие с веществами». 1.Растворение как физикохимический процесс. Растворение, типы растворов. 51 2. Электролитическая диссоциация. 52 3. Основные положения теории электролитической диссоциации. Сущность реакций замещения. Составление уравнений реакций, проделанных учителем. Сущность реакций обмена. Составление уравнений реакций, проделанных учителем. Реакции нейтрализации. Условия течения реакций между растворами кислот, щелочей и солей до конца. Д. Взаимодействие щелочных металлов с водой. Взаимодействие цинка с растворами кислот. П.р. №4. Взаимодействие растворов щелочей с растворами кислот. п.31,№ 2 п.32,№3,4 П.р. №5. Решение задач на нахождение количества, массы или объема продукта реакции по количеству, массе или объему исходного вещества. Те же расчеты, но с использованием понятии «доля» (исходное вещество дано в виде раствора заданной концентрации или содержит определенную долю примесей). п.28, №1,2 Решение задач и упражнений. Подготовка к контрольной работе. К.р. №3. Тема 5 Растворение. Растворы свойства растворов электролитов. (19 ч) Растворы. Гидраты. Кристаллогидраты. Тепловые явления при растворении. Зависимость растворимости Л. Растворение безводного веществ от температуры. Кривые растворимости. сульфата меди. Насыщенные, ненасыщенные и пересыщенные растворы. Различная растворимость веществ в воде. Электролиты и неэлектролиты. Механизм диссоциации Д. Испытание веществ и их веществ с разным видом связи. Степень растворов на электролитической диссоциации. Сильные и слабые электропроводность. электролиты. Ионы. Состав ионов. Классификация ионов по составу (простые и сложные), по заряду (катионы и анионы), по наличию водной оболочки (гидратированные и п.34 п.35, №1 – 6 п.36, №4 – 6 53 4. Ионные уравнения реакции. 54 5. Ионные реакции. 5556 6. 7. Кислоты в свете ТЭД, их классификация и свойства. 57 8. Основания в свете ТЭД, их классификация и свойства. 58 9. Оксиды в свете ТЭД, их классификация и свойства. 59 10. Соли в свете ТЭД, их классификация и свойства. 60 11. Генетическая связь между классами неорганических веществ. 61 12. Обобщение систематизация знаний по теме. 62 13. Контрольная работа №4 по теме «Растворение. негидратированные). Основные положения ТЭД. Реакции обмена, идущие до конца. Запись уравнений реакций (молекулярных и ионных) с использование таблицы растворимости. Д. Реакции, идущие до конца. п.37, №1 – 3 П.р. №6. Определение кислот как электролитов, их диссоциация. Классификация кислот по различным признакам. Взаимодействие кислот с металлами, условия течения этих реакций. Электрохимический ряд напряжения металлов. Взаимодействие кислот с оксидами металлов и основаниями. Реакция нейтрализации. Взаимодействие кислот с солями. Использование таблицы растворимости для характеристики химических свойств кислот. Определение оснований как электролитов, их диссоциация. Классификация оснований по различным признакам. Взаимодействие оснований с кислотами (повторение). Взаимодействие щелочей с солями (работа с таблицей растворимости) и оксидами неметаллов. Разложение нерастворимых оснований. Состав оксидов, их классификация: несолеобразующие и солеобразующие (кислотные и основные). Состав кислотных и основных оксидов. Определение солей как электролитов, их диссоциация. Взаимодействие солей с металлами, особенности этих реакций и взаимодействие солей с солями (работа с таблицей растворимости). Взаимодействие солей с кислотами и щелочами (повторение). Понятие о генетической связи и генетических рядах металлов и неметаллов. Л. Химические свойства кислот. п.38, №1 – 4 Л. Химические свойства оснований. п.39, №2,№ Л. Химические свойства оксидов. п.40, №1 – 3 Л. Химические свойства солей. п.41, №1 – 2 п.42, №2,3 Решение расчетных задач по уравнениям, характеризующим свойства основных классов соединений, и выполнение упражнений этого плана и на генетическую связь. Подготовка к контрольной работе. К.р. №4 Растворы свойства растворов электролитов». 63 14. Классификация химических реакций. Окислительновосстановительные реакции. 64 15. Окислительновосстановительные реакции. 6568 6970 16-19. Свойства изученных классов веществ в свете окислительновосстановительных реакций. 20. Повторение пройденного материала 21. Повторение пройденного материала. Различные признаки классификации химических реакций. Определение степеней окисления элементов, образующих вещества различных классов. Реакции окислительно-восстановительные и реакции ионного обмена, их отличия. Понятие об окислителе и восстановителе, окисление и восстановление. Составление уравнений ОВР методом электронного баланса. Характеристика свойств простых веществ металлов и неметаллов, а также кислот и солей в свете ОВР. Выполнение упражнений. Учет и контроль знаний по теме. Примеры реакций соединения, разложения, замещения. п.43, №1 – 3 п.43, №4 ,7
