Календарно-тематическое планирование по химии в 8 классе
advertisement
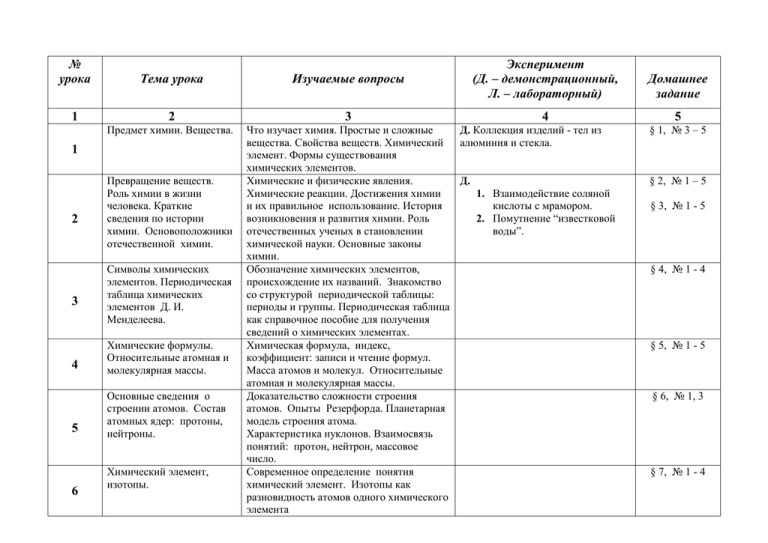
№ урока 1 Тема урока 2 Предмет химии. Вещества. 1 2 3 Превращение веществ. Роль химии в жизни человека. Краткие сведения по истории химии. Основоположники отечественной химии. Символы химических элементов. Периодическая таблица химических элементов Д. И. Менделеева. 4 Химические формулы. Относительные атомная и молекулярная массы. 5 Основные сведения о строении атомов. Состав атомных ядер: протоны, нейтроны. 6 Химический элемент, изотопы. Изучаемые вопросы Эксперимент (Д. – демонстрационный, Л. – лабораторный) 3 4 Что изучает химия. Простые и сложные Д. Коллекция изделий - тел из вещества. Свойства веществ. Химический алюминия и стекла. элемент. Формы существования химических элементов. Химические и физические явления. Д. Химические реакции. Достижения химии 1. Взаимодействие соляной и их правильное использование. История кислоты с мрамором. возникновения и развития химии. Роль 2. Помутнение “известковой отечественных ученых в становлении воды”. химической науки. Основные законы химии. Обозначение химических элементов, происхождение их названий. Знакомство со структурой периодической таблицы: периоды и группы. Периодическая таблица как справочное пособие для получения сведений о химических элементах. Химическая формула, индекс, коэффициент: записи и чтение формул. Масса атомов и молекул. Относительные атомная и молекулярная массы. Доказательство сложности строения атомов. Опыты Резерфорда. Планетарная модель строения атома. Характеристика нуклонов. Взаимосвязь понятий: протон, нейтрон, массовое число. Современное определение понятия химический элемент. Изотопы как разновидность атомов одного химического элемента Домашнее задание 5 § 1, № 3 – 5 § 2, № 1 – 5 § 3, № 1 - 5 § 4, № 1 - 4 § 5, № 1 - 5 § 6, № 1, 3 § 7, № 1 - 4 7 8 9 10 11 12 13 Электроны. Строение Характеристика электронов. Строение электронных оболочек электронных оболочек атомов элементов атомов элементов № 1 – 20. №№ 1 – 20. Понятие о незавершенном и завершенном энергетическом уровнях. Периодическая таблица Физический смысл порядкового номера химических элементов элемента, номера группы и периода. Д. И. Менделеева и Причины изменения свойств химических строение атомов. элементов в периодах и группах. Изменение числа Понятие “ион”. Ионы, образованные электронов на внешнем атомами металлов и неметаллов. энергетическом уровне Понятие об ионной химической связи. атома – образование Схемы образования ионных соединений. положительных и отрицательных ионов. Ионная химическая связь. Взаимодействие атомов Схемы образования двухатомных молекул. элементов-неметаллов Электронные и структурные формулы. между собой – образование Кратность химической связи. молекул простых веществ. Ковалентная неполярная химическая связь. Взаимодействие атомов Схемы образования молекул сложных элементов-неметаллов веществ. Электронные и структурные между собой – образование формулы. Понятие об ЭО и ковалентной молекул соединений. полярной связи. Электроотрицательность (ЭО). Ковалентная полярная химическая связь. Взаимодействие атомов Понятие о металлической связи. элементов-металлов между собой – образование металлических кристаллов. Обобщение и Выполнение упражнений, подготовка к § 8, № 1 - 5 § 9, № 1 § 9, № 2, 3 § 10, № 1 - 4 § 11, № 1 - 4 § 12, № 1 - 3 14 15 систематизация знаний об элементах: металлах и неметаллах, о видах химической связи. Контрольная работа №1 Простые вещества – металлы. Общие физические и химические свойства металлов. Аллотропия. Простые вещества – неметаллы. Физические свойства неметаллов. Аллотропия. 16 Количество вещества. 17 Молярная масса вещества. 18 19 Молярный объем газообразных веществ. контрольной работе. Характеристика положения элементовметаллов в ПСХЭ Д. И. Менделеева. Строение атомов металлов. Металлическая связь (повторение); физические свойства металлов – простых веществ. Аллотропия на примере олова Положение элементов-неметаллов в П. С. Х. Э. Д. И. Менделеева. Строение атомов, ковалентная связь (повторение). Физические свойства неметаллов – простых веществ. Химические формулы, расчет относительной молекулярной массы (повторение). Понятие аллотропии на примере модификаций кислорода, фосфора, углерода. Относительность понятий металлические и неметаллические свойства. Количество вещества и единицы его измерения: моль, моль, кмоль. Постоянная Авогадро. Расчет молярных масс веществ по их химическим формулам. Решение расчетных задач с использованием понятий: “постоянная Авогадро”, “количество вещества”, “масса”, “молярная масса”. Понятие о молярном объеме газов. Нормальные условия. Миллимолярный и киломолярный объем.. Решение расчетных § 13, № 1, 3, 4 Д. 1. Коллекция металлов: Са, К, Нg, Fe, Al ,Mg, Na. 2. Образцы белого и серого олова. § 14, № 3,4 Д. 1. Коллекция неметаллов: кислород, водород, уголь, сера, фосфор и т.д. 2. Получение и свойства белого и красного фосфора. Д. Некоторые металлы и неметаллы количеством вещества 1 моль, 1 ммоль, 1 кмоль. § 15, № 1, 2 § 15, № 3,4 Урок – упражнение. 20 21 22 23 Обобщение и систематизация знаний по теме. Степень окисления и валентность химических элементов. Бинарные соединения. Важнейшие классы бинарных соединений: оксиды и летучие водородные соединения. Основания 24 Кислоты 25 задач с использованием понятий: “постоянная Авогадро”, “количество вещества”, “масса”, “молярная массa”, “объём”, “молярный объем”. Решение расчетных задач и упражнений с использованием понятий: “постоянная Авогадро”, “количество вещества”, “масса”, “молярная масса”, “объём”, “молярный объем”. Решение расчетных задач и упражнений. Задания по выбору Задания по выбору Понятие о степени окисления и валентности элемента. Определение валентности и степени окисления. Составление формул бинарных соединений, их номенклатура. Составление формул, их названия. Расчёты по формулам. Характеристика важнейших соединений. Их представители: H2O, CO2, CaO, HCl, NH3 Д. Некоторые образцы оксидов, сульфидов, хлоридов металлов. Состав и названия оснований, их классификация. Расчёты по формулам оснований. Представители: NaOH, KOH, Ca(OH)2 Д. Состав и названия кислот; их классификация. Расчёты по формулам кислот. Представители кислот Д. Д. 1. Образцы оксидов: P2O5, CO2, SiO2, H2O. 2. Образцы летучих водородных соединений: HCl и NH3 (газы и растворы) § 17, № 1, 2 § 18 до конца, №1-6 § 19, № 1 – 6 1. Образцы щелочей (твёрдых и в растворе) и нерастворимых оснований. 2. Изменение окраски индикаторов § 20, № 1 – 5 1. Образцы кислот: HCl, HNO3, H2SO4, H3PO4, некоторых других минеральных и органических кислот. 2. Изменение окраски индикаторов Соли как производные кислот и оснований Состав и названия солей. Расчёты по формулам солей. Представители: NaCl, CaCO3, Ca3(PO4)2 Урок – упражнение Классификация сложных веществ, определение принадлежности соединений к различным классам по их формулам. Упражнения в составлении формул по названиям и названий веществ по формулам. Расчёты по формулам соединений Понятия о межмолекулярном взаимодействии и молекулярной кристаллической решётке. Свойства веществ с этим типом решётки. Свойства веществ с разным типом кристаллических решёток, их принадлежность к разным классам соединений. Взаимосвязь типов кристаллических решёток и видов химической связи Понятия о чистом веществе и смеси, их отличия. Примеры жидких и газообразных смесей. Способы разделения смесей 26 - 27 28 29 Аморфные и кристаллические вещества. Межмолекулярные взаимодействия. Молекулярные кристаллические решётки. Ионные, атомные и металлические решётки Чистые вещества и смеси 30 31 32 – 33 Массовая и объёмная доля компонентов смеси, в том числе и доля примесей Расчёты, связанные с понятием «доля» Понятие о доли компонента смеси. Вычисление её в смеси и расчёт массы или объёма вещества в смеси по его доле Решение задач и упражнений на расчёт доли (массовой или объёмной) и § 21, № 1 -3 Д. 1. Образцы солей кислородосодержащих и бескислородных кислот. 2. Кальцит и его разновидности § 22, № 1, 4, 5 Д. 1. Модели кристаллических решёток NaCl, алмаза, графита, металлов, CO2 и йода. 2. Возгонка бензойной кислоты ил нафталина § 23, №1, 2, 4 Д. 1. Взрыв смеси водорода с воздухом. 2. Различные образцы смесей. 3. Способы разделения смесей, в том числе и с помощью делительной воронки. 4. Дистилляция воды § 24, № 1 - 3 § 24, № 4 - 7 нахождение массы (объёма) компонента смеси 34 Контрольная работа № 2 Физические явления Способы очистки веществ, основанные на их физических свойствах. Очитка питьевой воды. Перегонка нефти 35 Химические реакции. Закон сохранения массы веществ 36 Химические уравнения. Реакции разложения 37 Понятие о химических явлениях, их отличие от физических. Признаки и условия протекания химических реакций. Реакция горения. Экзо- и эндотермические реакции. Количественная сторона химических реакций в свете учения об атомах и молекулах. Значение закона сохранения массы веществ. Роль М.В. Ломоносова и Д.Дальтона в открытии и утверждении закона сохранения массы веществ Понятие о химическом уравнении как об условной записи химической реакции с помощью химических формул. Значение индексов и коэффициентов. Составление уравнений химических реакций. Сущность реакций разложения и составление уравнений реакций, проделанных учителем Д. 1. Плавление парафина. 2. Возгонка I2 (йода) или бензойной кислоты. 3. Диффузия душистых веществ с горячей лампочки накаливания. 4. Способы разделения смесей. Л. Сравнение скорости испарения капель воды и спирта с фильтровальной бумаги Д. 1. Горение магния. 2. Взаимодействие HCl с мрамором, получение Cu(OH)2 и последующее растворение его в кислоте. 3. Взаимодействие CuCO4 с Fe, помутнение «известковой воды». 4. Опыты, подтверждающие закон сохранения массы веществ в результате химических реакций Д. 1. Электролиз воды. 2. Разложение нитратов калия, перманганата калия, азотной кислоты, гидроксида меди (II) § 25, № 2 - 4 § 26, № 1 – 5 § 27 до слов: «С помощью уравнений химических реакций можно определить и тип…», № 1 Реакции соединения Сущность реакций соединения. Составление уравнений реакций, проделанных учителем Д. Осуществление переходов: S SO2 H2SO3; P 38 Ca Реакции замещения Сущность реакций замещения. Составление уравнений реакций, проделанных учителем 39 Реакции обмена Сущность реакций обмена. Составление уравнений реакций, проделанных учителем. Реакции нейтрализации. Условия течения реакций между растворами кислот, щелочей и солей до конца Расчёты по химическим уравнениям Решение задач на нахождение количества, массы или объёма продукта реакции по количеству, массе или объёму исходного вещества. Те же расчёты, но с использованием понятия «доля» (исходное вещество дано в виде раствора заданной концентрации или содержит определённую долю примесей) Решение задач и упражнений. Подготовка к контрольной работе 40 41 - 42 43 Обобщение и систематизация знаний по теме P2O5 CaO § 27 – реакции соединения H3PO4; Ca(OH)2 Д. 1. Взаимодействие щелочных металлов с водой. 2. Взаимодействие цинка и алюминия с растворами соляной и серной кислот. Л. Взаимодействие металлов (Fe, Al,Zn) с растворами солей (CuSO4, AgNO3) Д. Взаимодействие вне растворов щелочей, окрашенных фенолфталеином, с растворами кислот. Л. Взаимодействие H2SO4 и BaCl2, HCl и AgNO3, NaOH и Fe2(SO4)3 и т.д. § 27 – реакции замещения § 27 – реакции обмена, № 3 - 4 § 28, задачи 1 5 44 Контрольная работа № 3 Простейшие операции с веществами. Химический практикум 45 46 47 48 49 50 51 52 53 54 Правила по технике безопасности при работе в химическом кабинете. Приёмы обращения с нагревательными приборами и лабораторным оборудованием. Признаки химических реакций. Наблюдения за изменениями, происходящими с горящей свечой, и их описание. Анализ почвы и воды. Получение водорода и изучение его свойств. Получение кислорода и изучение его свойств. Приготовление раствора сахара и определение массовой доли сахара в растворе. Растворение как физикоРастворы. Гидраты. Кристаллогидраты. § 34 Д. химический процесс. Тепловые явления при растворении. 1. Мгновенная кристаллизация Растворимость. Типы Зависимость растворимости веществ от пресыщенного раствора растворов температуры. Кривые растворимости. глауберовой соли. Насыщенные и пересыщенные растворы. 2. Растворимость веществ при Различная растворимость веществ в воде разных температурах. Тепловые явления при растворении. Л. Растворение безводного сульфата меди (II) в воде Электролитическая Электролиты и неэлектролиты. Механизм Д. § 35, № 1 – 6 диссоциация диссоциации веществ с разным видом 1. Испытание веществ и их связи. растворов на Степень электролитической диссоциации. электропроводность. Сильные и слабые электролиты 2. Зависимость электролитической диссоциации уксусной кислоты от разбавления Основные положения Ионы. Свойства ионов. Классификация Д. Движение окрашенных ионов в § 36, № 1 - 5 теории электролитической ионов по составу (простые и сложные), по электрическом поле диссоциации заряду (катионы и анионы), по наличию водной оболочки (гидратированные и негидратированные). Основные положения ТЭД Ионные уравнения реакций Реакции обмена, идущие до конца. Запись Л. Примеры реакций, идущих до § 37, № 1 - 5 Кислоты в свете ТЭД, их классификация и свойства 55 – 56 Основания в свете ТЭД, их классификация и свойства 57 Оксиды 58 Соли в свете ТЭД, их свойства 59 60 Генетическая связь между классами неорганических уравнений реакций (молекулярных и ионных) с использованием таблицы растворимости Определение кислот как электролитов, их диссоциация. Классификация кислот по различным признакам. Взаимодействие кислот с металлами, условия течения этих реакций. Электрохимический ряд напряжения металлов. Взаимодействие кислот с оксидами металлов и основаниями. Реакции нейтрализации. Взаимодействие кислот с солями. Использование таблицы растворимости для характеристики химических свойств кислот Определение оснований как электролитов, их диссоциация. Классификация оснований по различным признакам. Взаимодействие оснований с кислотами (повторение). Взаимодействие щелочей с солями (работа с таблицей растворимости) и оксидами неметаллов. Разложение нерастворимых оснований Состав оксидов, их классификация: несолеобразующие и солеобразующие (кислотные и основные). Свойства кислотных и основных оксидов Определение солей как электролитов, их диссоциация. Взаимодействие солей с металлами, особенности этих реакций и взаимодействие солей с солями (работа с таблицей растворимости). Взаимодействие солей с кислотами и щелочами (повторение) Понятие о генетической связи и генетических рядах металлов и неметаллов конца Л. Химические свойства кислот (на примере HCl, H2SO4) § 38, № 1 - 6 Д. § 39, № 1 – 5 1. Взаимодействие CO2 и NaOH. 2. Разложение Cu(OH)2. Л. Реакции, характерные для щелочей и нерастворимых оснований Л. Изучение свойств основных оксидов для CaO и кислотных для CO2 или SO2 § 40, № 1 – 5 Л. Химические свойства солей § 41, № 1 – 5 Д. Осуществление переходов: a) P P2O5 H3PO4 § 42, № 1 – 5 веществ 61 62 Обобщение и систематизация знаний по теме Контрольная работа № 4 Классификация химических реакций. Окислительно – восстановительные реакции 63 64 65 66 67 Упражнения в составлении Окислительно – восстановительных реакций Свойства изученных классов веществ в свете Окислительно – восстановительных реакций Обобщение и систематизация знаний по теме Практическая работа Ca3(PO4)2; b) Ca CaO Ca3(PO4)2 Ca(OH)2 Решение расчётных задач по уравнениям, характеризующим свойства основных классов соединений, и выполнение упражнений этого плана и на генетическую связь. Подготовка к контрольной работе Различные признаки классификации химических реакций. Определение степеней окисления элементов, образующих вещества различных классов. Реакции Окислительно – восстановительные реакции ионного обмена, их отличия. Понятие об окислителе и восстановителе, окислении и восстановлении Составление уравнений ОВР методом электронного баланса Характеристика свойств простых веществ металлов и неметаллов, а также кислот и солей в свете ОВР Выполнение упражнений. Учёт и контроль знаний по теме § 43, № 1 - 3 Д. 1. Примеры реакций соединения, разложения, замещения, обмена, гомо- и гетерогенных; экзо- и эндотермических; каталитических и некаталитических. 2. Взаимодействие Zn с HCl, S, CuCO4. 3. Горение магния. 4. Взаимодействие хлорной и сероводородной воды § 43, № 4 - 8 68 «Решение экспериментальных задач на распознавание катионов и анионов» Контрольная работа № 5