Рабочая программа по химии, 9 класс
advertisement
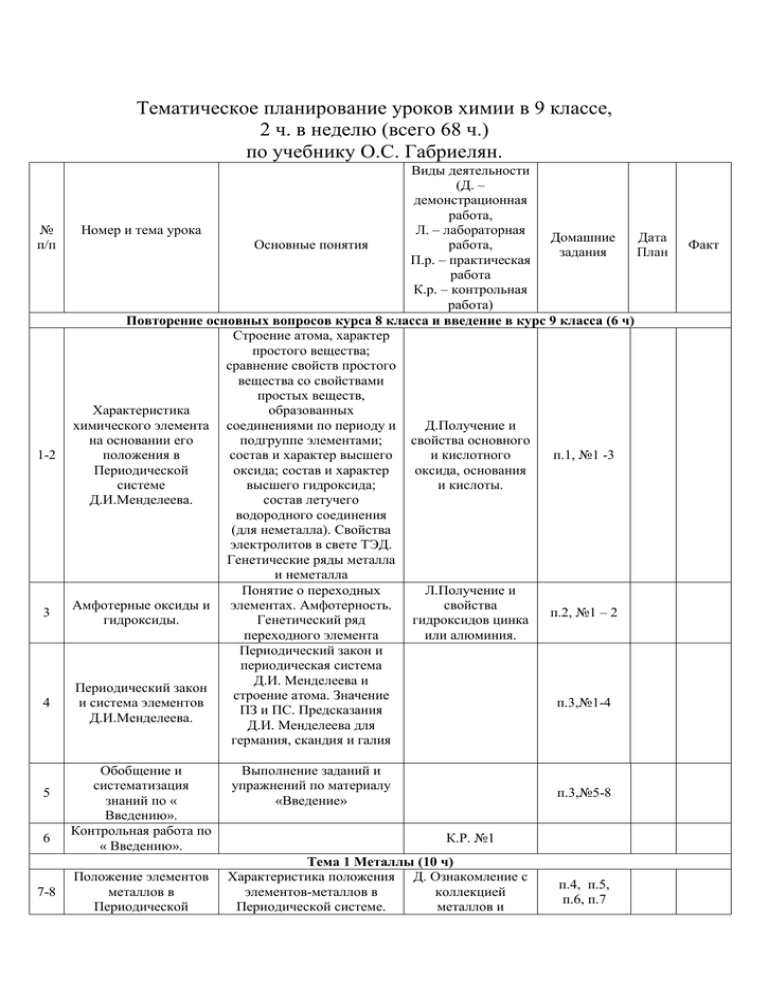
Тематическое планирование уроков химии в 9 классе, 2 ч. в неделю (всего 68 ч.) по учебнику О.С. Габриелян. № п/п 1-2 3 4 5 6 7-8 Виды деятельности (Д. – демонстрационная работа, Номер и тема урока Л. – лабораторная Домашние Дата Основные понятия работа, задания План П.р. – практическая работа К.р. – контрольная работа) Повторение основных вопросов курса 8 класса и введение в курс 9 класса (6 ч) Строение атома, характер простого вещества; сравнение свойств простого вещества со свойствами простых веществ, Характеристика образованных химического элемента соединениями по периоду и Д.Получение и на основании его подгруппе элементами; свойства основного положения в состав и характер высшего и кислотного п.1, №1 -3 Периодической оксида; состав и характер оксида, основания системе высшего гидроксида; и кислоты. Д.И.Менделеева. состав летучего водородного соединения (для неметалла). Свойства электролитов в свете ТЭД. Генетические ряды металла и неметалла Понятие о переходных Л.Получение и Амфотерные оксиды и элементах. Амфотерность. свойства п.2, №1 – 2 гидроксиды. Генетический ряд гидроксидов цинка переходного элемента или алюминия. Периодический закон и периодическая система Д.И. Менделеева и Периодический закон строение атома. Значение и система элементов п.3,№1-4 ПЗ и ПС. Предсказания Д.И.Менделеева. Д.И. Менделеева для германия, скандия и галия Обобщение и систематизация знаний по « Введению». Контрольная работа по « Введению». Положение элементов металлов в Периодической Выполнение заданий и упражнений по материалу «Введение» п.3,№5-8 К.Р. №1 Тема 1 Металлы (10 ч) Характеристика положения Д. Ознакомление с элементов-металлов в коллекцией Периодической системе. металлов и п.4, п.5, п.6, п.7 Факт системе Д.И.Менделеева и особенности строения их атомов. Физические свойства металлов. Сплавы. 9 Химические свойства металлов. 10 Осуществление цепочки химических превращений. 11 Металлы в природе. Общие способы их получения. 12 Общие понятия о коррозии металлов. 13 Щелочные и щелочноземельные металлы. 14 15 16 17 18 Алюминий. Железо. Решение экспериментальных задач на распознавание и получение веществ. Контрольная работа по теме « Металлы». Общая характеристика неметаллов. Строение атомов металлов. Металлические кристаллические решетки. Металлическая химическая связь. Физические свойства металлов – простых веществ. Характеристика сплавов, их свойства. Важнейшие сплавы и их значение Характеристика общих химических свойств металлов на основании их положения в электрохимическом ряду напряжений в свете представлений об окислительновосстановительных реакциях Самородные металлы и основные соединения металлов в природе. Важнейшие руды. Понятие о металлургии и ее разновидностях: пиро-, гидро-, электрометаллургии Коррозия металлов. Способы защиты металлов от коррозии сплавов. Д. Взаимодействие металлов с водой, неметаллами, растворами кислот и солей. п.8, №1, 3 П.Р. №1 п.8, №5-7 Д. Ознакомление с коллекцией руд. п.9, № 1 – 6 п.10, №2, 6 Д. Демонстрация щелочных и щелочноземельных металлов и их соединений. п.11,№1,п12 п.13, №6 п.14, №4 П.Р. №2. К.Р. №2. Тема 2 Неметаллы (25 ч) Положение элементовнеметаллов в Периодической системе, Д. Ряд ЭО. Модели особенности строения их атомных и атомов. молекулярных Электроотрицательность кристаллических как мера неметалличности, решеток. ряд ЭО. Кристаллическое строение неметаллов – п.15, №1 – 3 19 Общие химические свойства неметаллов. 20 Неметаллы в природе и способы их получения. 21 Водород. 22 Общая характеристика галогенов. 23 24 простых веществ. Аллотропия. Озон. Состав воздуха. Физические свойства неметаллов. Относительность понятий «металл» и «неметалл» Химические свойства неметаллов. Окислительные свойства: взаимодействие с металлами, водородом, менее отрицательными металлами, некоторыми сложными веществами. Восстановительные свойства неметаллов в реакциях с кислородом, сложными веществамиокислителями Задание в тетради. Неметаллы в природе и способы их получения. Положение в Периодической системе Д.И. Менделеева. Строение атома и молекулы. Физические и химические свойства водорода, его получение и применение Строение атомов галогенов, их степени окисления. Строение молекул галогенов. Галогены – простые вещества. Закономерности в измерении их физических и химических свойств в зависимости от увеличения порядкового номера химического элемента. Краткие сведения о хлоре, броме, йоде и фторе Соединения галогенов. Хлороводород и соляная кислота. Хлориды, их применение в народном хозяйстве Кислород. Строение атома кислорода. Аллотропия кислорода. Характеристика химических свойств кислорода в свете представлений об окислительновосстановительных реакциях. Применение Задание в тетради. Д. Получение водорода и демонстрация его свойств. п.17, №2, 4 Д. Образцы галогенов простых веществ. п.18, №2,4, п.20, № 1 Д. Получение и свойства хлороводорода, качественные реакции на галогенид- ионы. п.19, №2-4 п.21, №1 – 3 25 Сера, ее физические и химические свойства. 26 Сероводород, сульфиды. 27 Оксиды серы. 28 Серная кислота. 29 Решение экспериментальных задач по теме « Подгруппа кислорода». 30 Азот и его свойства. 31 Аммиак и его свойства. 32 Получение, собирание и распознавание аммиака. 33 Соли аммония. 34 Оксиды азота. кислорода Строение атома серы. Аллотропия. Физические свойства ромбической серы. Характеристика химических свойств серы в свете представлений об окислительновосстановительных реакциях Получение и свойства сероводорода. Сульфиды Получение и свойства оксидов серы как кислотных оксидов. Характеристика состава и свойств серной кислоты в свете представления об электролитической диссоциации и ОВР. Соли серной кислоты. Их применение в народном хозяйстве. Распознавание сульфат-иона Д. Взаимодействие серы с кислородом. п.22, №2, 3 п.23 Д, Взаимодействие меди с конц. серной кислотой. п.23 оксиды серы, №1, 2, 6 Д. Свойства серной кислоты. Качественные реакции на сульфат- ионы. п.23 до конца, №3, 4, 8 П.Р. №3. Строение атомов азота. Строение молекулы азота. Физические и химические свойства азота в свете представлений об окислительновосстановительных реакциях Строение молекулы аммиака. Физические свойства, получение, собирание, распознавание аммиака. Химические свойства аммиака: восстановительные и образование иона аммония по донорно-акцепторному механизму п.24, №1 – 4 п.25, № 7,8 П.Р. №4. Соли аммония: состав, получение, физические и химические свойства. Представители. Применение в народном хозяйстве Получение и свойства Качественная реакция на ионы аммония. п.26, №1 – 3 п.27 35 Азотная кислота как электролит, ее применение. 36 Азотная кислота как окислитель, ее получение. 37 38 39 Соли азотистой и азотной кислот. Азотные удобрения. Фосфор. Соединения фосфора. Понятия о фосфорных удобрениях. 40 Углерод. 41 Оксиды углерода. оксидов азота Состав и свойства азотной кислоты как электролита. Применение азотной кислоты в народном хозяйстве Особенности окислительных свойств азотной кислоты, ее взаимодействие с медью. Получение азотной кислоты из аммиака Нитраты и нитриты, их свойства (разложение при нагревании) и представители. Применение в народном хозяйстве. Проблема повышенного содеожания нитратов и нитритов в сельскохозяйственной продукции Д. Химические свойства азотной кислоты как электролита. п.27 Д. Взаимодействие концентрированной азотной кислоты с медью. п.27 Л. Знакомство с коллекцией азотных удобрений. Качественное обнаружение нитратов и нитритов. п.27 до конца, №6, 7 Строение атома. Аллотропия. Сравнение свойств и применения красного и белого фосфора. Химические свойства фосфора Оксид фосфора и ортофосфорная кислота. Соли ее. Фосфор в природе. Фосфорные удобрения Строение атома углерода. Аллотропия, свойства модификаций – алмаза и графита. Их применение. Аморфный углерод и его сорта: кокс, сажа, древесный уголь. Адсорбция и ее практическое значение. Химические свойства углерода Строение молекул СО и CO2. Физические и химические свойства п.28 до кислолродн ых соединений фосфора, №1 – 3 Д. Горение фосфора. Растворение оксида фосфора в воде. Свойства фосфорной кислоты. Качественные реакции на фосфат ионы. Знакомство с коллекцией фосфорных удобрений. п.28 до конца, №4 ,5 Модели кристаллических решеток алмаза и графита. п.29, №2,5,8 Л. Получение и распознавание углекислого газа. п.30 до угольной кислоты, 42 Угольная кислота и ее соли. 43 Кремний. 44 Кислородные соединения кремния. 45 Силикатная промышленность. 46 Решение экспериментальных задач по теме « Подгруппа азота и углерода». 47 Обобщение по теме « Неметаллы». 48 Контрольная работа по теме « Неметаллы». 49 Предмет органической химии. Валентность. 50 Предельные углеводороды. 51 Непредельные углеводороды. оксидов углерода. Получение и применение СО и СО2 Угольная кислота. Важнейшие карбонаты: кальцит, сода, поташ – их значение и применение. Распознавание карбонатов. Переход карбонатов в гидрокарбонаты и обратно Строение атома. Сравнение его свойств со свойствами атома углерода. Кристаллический кремний, сравнение его свойств с углеродом. Природные соединения кремния: SiO2, силикаты и алюмосиликаты Оксид кремния: нахождение в природе, физические и химические свойства. Кремниевая кислота. Силикаты Производство и применение стекла, фарфора, цемента №1, –5 Д. Знакомство с коллекцией карбонатов. Качественная реакция на карбонат ион. п.30 до конца, №6,7 п.31 до применения кремния, №1, 4 п.31 п.31 до конца, №5, 6 П.Р. №5. Решение задач и упражнений по теме «Цепочки переходов» К.Р. №3. Тема 3. Органические вещества ( 8 ч.) Вещества органические и неорганические. Причина многообразия Д. Образцы неорганических органических соединений. Валентность соединений, Химическое строение материалов и органических соединений. изделий из них. Молекулярные и структурные формулы органических соединений Метан строение Д. молекулы. Горение метана Шаростержневые Применение метана. модели молекул. Химическое строение молекулы этилена. Д. Двойная связь. Шаростержневые Взаимодействие этилена с модели молекул. водой Полимеризация этилена. Полиэтилен и его п.32,№1,2 п.33,№4 п.34,№2 52 53 54 55 56 57 5859 6061 значение Понятие о предельных Д. Качественная одноатомных спиртах на реакция на Спирты примере метанола и многоатомные этанола. Трехатомный спирты. спирт глицерин Понятие об альдегидах на примере уксусного альдегида. Окисление альдегида в кислоту. Одноосновные предельные карбоновые кислоты на Карбоновые кислоты. примере уксусной кислоты. Л.Свойства Сложные эфиры. Ее свойства, применение. уксусной кислоты. Стеариновая кислота как представитель жирных карбоновых кислот. Реакция этерификации. Понятие о сложных эфирах. Реакция этерификации. Понятие о сложных Д. Получение Жиры. эфирах. Жиры как сложные уксусно-этилового эфиры глицерина и эфира. жирных кислот Понятие об аминокислотах. Реакции поликонденсации. Д. Цветные Аминокислоты. Белки Белки, их строение и реакции белков. биологическая роль Понятие об углеводах. Глюкоза. Ее свойства и Л. Качественная Углеводы. значение. Крахмал и реакция на целлюлоза (в сравнении), крахмал. их биологическая роль Полимеры природные и синтетические. Реакции Д. Образцы Полимеры. полимеризации и полимеров. поликонденсации. Пластмассы и волокна Тема 4. Обобщение знаний за курс основной школы. (11 ч) Физический смысл порядкового номера элемента, номер периода и Периодический закон группы, закономерности и Периодическая изменения свойств система химических элементов и их соединений элементов в периодах и группах в Д.И.Менделеева в свете представлений о свете учения о строении атомов строении атома. элементов. Значение Периодического закона Строение вещества: виды химических связей и типы кристаллических Виды химических связей и типы кристаллических решеток. Взаимосвязь строения и свойств веществ п.35,№2,5 п.36 ,№1 п.37,№1,2 п.38 п.39 п.40 Задание в тетради. Задание в тетради. решеток. 62 Химические реакции. 6364 Классы химических соединений в свете ТЭД. 65 6668 Контрольная работа по темам « Органические вещества» и « Обобщение знаний по химии за курс основной школы». Повторение пройденного материала Классификация химических реакций по разным признакам (число и состав реагирующих и образующихся веществ; наличие границы раздела фаз; тепловой эффект; изменение степеней окисления атомов; использованию катализатора, направлению протекания). Обратимость химических реакций и способы смещения химических равновесия. Скорость химических реакций и факторы, влияющие на нее Простые и сложные вещества. Металлы и неметаллы. Генетические ряды металла, неметалла и переходного металла. Оксиды и гидроксиды (основания, кислоты, амфотерные гидроксиды), соли. Их состав, классификация и общие химические свойства в свете ТЭД Задание в тетради. Задание в тетради. К.Р.№ 4. Задание в тетради.
