Семинары
advertisement
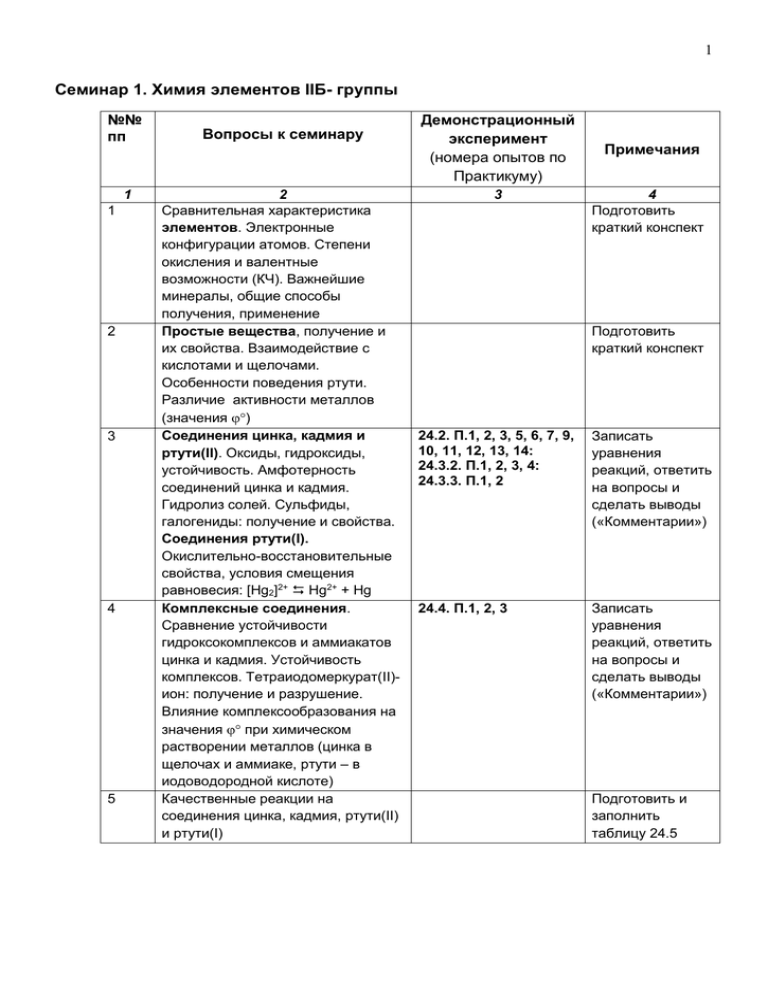
1 Семинар 1. Химия элементов IIБ- группы №№ пп 1 1 2 3 4 5 Вопросы к семинару 2 Сравнительная характеристика элементов. Электронные конфигурации атомов. Степени окисления и валентные возможности (КЧ). Важнейшие минералы, общие способы получения, применение Простые вещества, получение и их свойства. Взаимодействие с кислотами и щелочами. Особенности поведения ртути. Различие активности металлов (значения ) Соединения цинка, кадмия и ртути(II). Оксиды, гидроксиды, устойчивость. Амфотерность соединений цинка и кадмия. Гидролиз солей. Сульфиды, галогениды: получение и свойства. Соединения ртути(I). Окислительно-восстановительные свойства, условия смещения равновесия: [Hg2]2+ Hg2+ + Hg Комплексные соединения. Сравнение устойчивости гидроксокомплексов и аммиакатов цинка и кадмия. Устойчивость комплексов. Тетраиодомеркурат(II)ион: получение и разрушение. Влияние комплексообразования на значения при химическом растворении металлов (цинка в щелочах и аммиаке, ртути – в иодоводородной кислоте) Качественные реакции на соединения цинка, кадмия, ртути(II) и ртути(I) Демонстрационный эксперимент (номера опытов по Практикуму) 3 Примечания 4 Подготовить краткий конспект Подготовить краткий конспект 24.2. П.1, 2, 3, 5, 6, 7, 9, 10, 11, 12, 13, 14: 24.3.2. П.1, 2, 3, 4: 24.3.3. П.1, 2 Записать уравнения реакций, ответить на вопросы и сделать выводы («Комментарии») 24.4. П.1, 2, 3 Записать уравнения реакций, ответить на вопросы и сделать выводы («Комментарии») Подготовить и заполнить таблицу 24.5 2 Семинар 2. Химия элементов IБ- группы №№ пп 1 1 2 3 4 5 6 Вопросы к семинару 2 Сравнительная характеристика элементов. Электронные конфигурации атомов. Степени окисления и валентные возможности (КЧ). Важнейшие минералы, общие способы получения, применение Простые вещества, получение и свойства. Взаимодействие металлов с кислотамиокислителями. Различие свойств меди, серебра и золота Соединения меди, серебра и золота. Оксид и гидроксид меди(II), оксид меди(I). Соли. Термическая устойчивость солей кислородных кислот. Условия смещения равновесия: 2Cu + Cu2+ + Cu Особенности соединений меди(I) и меди(II). Склонность соединений меди(I) к дисмутации Комплексные соединения меди, серебра и золота. Перевод в раствор металлов и их соединений за счет комплексообразования. Эффект Яна-Теллера. Изменение значений потенциалов при комплексообразо-вании (химической растворение металлов в аммиачной или цианидной среде) Окислительновосстановительные свойства ионов и комплексных соединений Качественные реакции на соединения меди и серебра Демонстрационный эксперимент (номера опытов по Практикуму) 3 Примечания 4 Подготовить краткий конспект 25.1. П. 3, У.1 Подготовить краткий конспект 25.2. П.1, 2, 3, 4, 5, 6, 7 Записать уравнения реакций, ответить на вопросы и сделать выводы («Комментарии») 25.4. П.1, 2, 3, 4 Записать уравнения реакций, ответить на вопросы и сделать выводы («Комментарии») 25.3.3. П.1 Записать уравнения реакций, ответить на вопросы и сделать выводы («Комментарии») Подготовить и заполнить таблицы 25.5 и 25.6 3 Семинар 3. Химия элементов VIIIБ- группы №№ пп 1 1 2 3 4 5 6 Вопросы к семинару 2 Сравнительная характеристика элементов. Электронные конфигурации атомов. Степени окисления и валентные возможности (КЧ). Важнейшие минералы. Чугун, сталь, их производство. Понятие о выплавке железа (пирометаллургия). Простые вещества. Различие коррозионной устойчивости металлов семейства железа. Взаимодействие с кислотами. Пассивация металлов. Различие устойчивости высших степеней окисления. Соединения железа, кобальта, никеля. Кислотно-основные свойства оксидов и гидроксидов железа, кобальта и никеля. Гидролиз солей М(II) и М(III). Сульфиды, различие их растворимости Комплексные соединения железа, кобальта и никеля. Аммиачные, цианидные, тиоцианатные комплексы. Строение комплексов, способы их получения и разрушения Окислительновосстановительные свойства соединений железа(II) и железа(III). Получение и свойства соединений железа(VI) – ферраты Качественные реакции на железо, кобальт, никель. Демонстрационный эксперимент (номера опытов по Практикуму) 3 Примечания 4 Подготовить краткий конспект Подготовить краткий конспект 26.2. П.1, 2, 3, 4, 5, 6, 7, 8; 26.3.1. П.1, 2, 4, 5 26.3.2. П. 1, 2, 3, 4 Записать уравнения реакций, ответить на вопросы и сделать выводы («Комментарии») 26.5. П. 1, 2, 5, 7, 11, 12, 14 Записать уравнения реакций, ответить на вопросы и сделать выводы («Комментарии») 26.3.3. П.1, 5, 6 Записать уравнения реакций, ответить на вопросы и сделать выводы («Комментарии») 4 Семинар 4. Химия элементов VIIБ- группы №№ пп 1 1 2 3 4 Вопросы к семинару 2 Сравнительная характеристика элементов. Электронные конфигурации атомов. Степени окисления и валентные возможности (КЧ). Важнейшие минералы, общие способы получения, применение Простые вещества, получение и свойства. Взаимодействие металлов с кислотамиокислителями. Различие свойств марганца, технеция и рения Соединения марганца. Оксиды марганца. Гидроксид марганца(II). Диоксид марганца. Марганцовая кислота. Изменение кислотноосновных свойств в ряду соединений от Mn(II) до Mn(VII). Окислительновосстановительные свойства соединений марганца (II), марганца (III), марганца (IV) Манганаты и перманганаты, получение, окислительновосстановительные свойства. Дисмутация манганатов, зависимость от рН среды. Демонстрационный эксперимент (номера опытов по Практикуму) 3 Примечания 4 Подготовить краткий конспект Подготовить краткий конспект 27.2. П.1, 2, 3, 4, 5, 6, 7 27.3.1. П.1, 2, 3, 4, 5 Записать уравнения реакций, ответить на вопросы и сделать выводы («Комментарии») 27.3.2. Оп.1, П.1, 2, 3, 4 27.3.3.: П.1, 2, 3, 4, 5, 6 Записать уравнения реакций, ответить на вопросы и сделать выводы («Комментарии») 5 Семинар 5. Химия элементов VIБ- группы №№ пп 1 1 2 3 4 5 6 Вопросы к семинару 2 Сравнительная характеристика элементов. Электронные конфигурации атомов. Степени окисления и валентные возможности (КЧ). Важнейшие минералы, общие способы получения, применение Простые вещества, получение и свойства. Взаимодействие металлов с кислотами и щелочами. Различие свойств хрома, молибдена и вольфрама Соединения хрома. Оксид и гидроксид хрома(II) и хрома(III). Сравнение кислотных и основных свойств соединений хрома в различных степенях окисления. Окислительновосстановительные свойства соединений хрома. Равновесие в системе хромат – дихромат. Зависимость окислительновосстановительных свойств от рН раствора Комплексные соединения хрома(III). Гидратная изомерия. Кластерные производные хрома. Ацетатный комплекс хрома(II). Пероксокомплекс хрома. Структура комплексов Качественные реакции на соединения хрома Демонстрационный эксперимент (номера опытов по Практикуму) 3 Примечания 4 Подготовить краткий конспект Подготовить краткий конспект 28.2.1. У1, П. 1, 2 28.2.2. Оп. 1, П. 1, 2, 3, 4, 5, 6 28.3.1. П.1, 2 28.2.3. Оп. 3, Оп. 4 28.3.2. П.1, 2, 3 28.3.3. П.1, 2, 3 28.4. П. 1, 2, 3, 4 Записать уравнения реакций, ответить на вопросы и сделать выводы («Комментарии») Записать уравнения реакций, ответить на вопросы и сделать выводы («Комментарии») Записать уравнения реакций, ответить на вопросы и сделать выводы («Комментарии») Подготовить и заполнить таблицу 28.5