Календарно- тематический план
advertisement
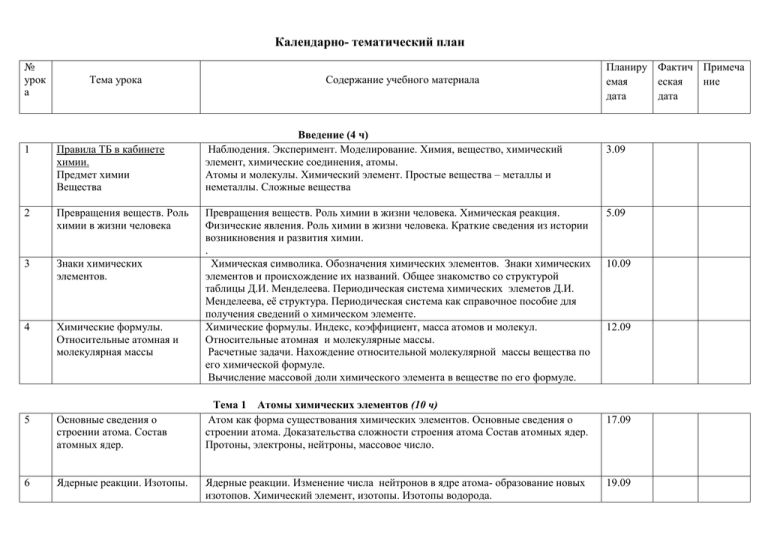
Календарно- тематический план № урок а Тема урока 1 Правила ТБ в кабинете химии. Предмет химии Вещества 2 Превращения веществ. Роль химии в жизни человека 3 Знаки химических элементов. 4 Химические формулы. Относительные атомная и молекулярная массы 5 Основные сведения о строении атома. Состав атомных ядер. 6 Ядерные реакции. Изотопы. Содержание учебного материала Введение (4 ч) Наблюдения. Эксперимент. Моделирование. Химия, вещество, химический элемент, химические соединения, атомы. Атомы и молекулы. Химический элемент. Простые вещества – металлы и неметаллы. Сложные вещества Превращения веществ. Роль химии в жизни человека. Химическая реакция. Физические явления. Роль химии в жизни человека. Краткие сведения из истории возникновения и развития химии. . Химическая символика. Обозначения химических элементов. Знаки химических элементов и происхождение их названий. Общее знакомство со структурой таблицы Д.И. Менделеева. Периодическая система химических элеметов Д.И. Менделеева, её структура. Периодическая система как справочное пособие для получения сведений о химическом элементе. Химические формулы. Индекс, коэффициент, масса атомов и молекул. Относительные атомная и молекулярные массы. Расчетные задачи. Нахождение относительной молекулярной массы вещества по его химической формуле. Вычисление массовой доли химического элемента в веществе по его формуле. Планиру Фактич Примеча емая еская ние дата дата 3.09 5.09 10.09 12.09 Тема 1 Атомы химических элементов (10 ч) Атом как форма существования химических элементов. Основные сведения о строении атома. Доказательства сложности строения атома Состав атомных ядер. Протоны, электроны, нейтроны, массовое число. 17.09 Ядерные реакции. Изменение числа нейтронов в ядре атома- образование новых изотопов. Химический элемент, изотопы. Изотопы водорода. 19.09 7 Строение электронных оболочек атомов элементов 8 Изменение числа электронов на внешнем электронном уровне 9 Периодический закон и периодическая система химических элементов Д.И. Менделеева и строение атома Взаимодействие атомов элементов – неметаллов между собой. Ковалентная связь 10 11 12 13 14 15 Взаимодействие атомов элементов – металлов между собой. Ионная связь Взаимодействие атомов элементов – металлов между собой. Металлическая связь Обобщение и систематизация знаний об элементах, видах химической связи. Контрольная работа №1 Атомы химических элементов Простые вещества – Планетарная модель атома. Строение электронных оболочек атомов элементов. Завершенный и незавершенный электронный уровень. Строение электронных оболочек атомов элементов № 1-20. Изменение числа электронов на внешнем электронном уровне. Элементыметаллы. Элементы-неметаллы. Изменение числа электронов на внешнем электронном уровне. Ионы, ионная связь. Изменение свойств химических элементов. Периодический закон и периодическая система химических элементов Д.И. Менделеева и строение атома. Физический смысл порядкового номера элемента, номера группы, номера подгруппы элементов, номер периода. 24.09 Взаимодействие атомов элементов – неметаллов между собой. Ковалентная связь. Неполярная химическая связь. Схемы образования двухатомных молекул Н2, О2, N2. Электронные и структурные формулы. 3.10 Взаимодействие атомов элементов – металлов между собой. Строение молекул. Химическая связь, Понятие об ЭО, ковалентная полярная связь, ионная связь 8.10 Взаимодействие атомов элементов – металлов между собой. Атом- ионы. Обобществленные электроны. Металлическая связь. 10.10 Обобщение и систематизация знаний об элементах, видах химической связи. 15.10 Взаимодействие атомов элементов – неметаллов между собой. Ковалентная связь. Неполярная химическая связь. Взаимодействие атомов элементов – металлов между собой. Строение молекул. Металлическая связь. 17.10 Тема 2 Простые вещества (7 ч) Простые вещества – металлы. Важнейшие простые вещества - металлы: железо, 26.09 1.10 22.10 металлы. Общие физические свойства металлов. Аллотропия 16 Простые вещества – неметаллы. Физические свойства неметаллов – простых веществ 17 Количество вещества. 18 Молярная масса вещества 19 Молярный объем газов. Закон Авогадро. Решение расчетных задач и упражнений Обобщение и систематизация знаний по теме « Простые вещества». 20 21 24 Степень окисления, валентность. Бинарные соединения металлов и неметаллов Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения Основания 25 Кислоты 22 23 алюминий, кальций, магний, натрий, калий. Общие физические свойства металлов. Положение в периодической системе химических элементов Д.И. Менделеева. Аллотропия на примере олова Ознакомление с коллекцией металлов. Простые вещества – неметаллы. Важнейшие простые вещесва – неметаллы, образованные атомами кислорода, водорода, азота, серы, фосфора, углерода. Физические свойства неметаллов – простых веществ Расчет относительной молекулярной массы (повторение), аллотропия на примере кислорода, фосфора, углерода. Расчетные задачи Вычисление молярной массы вещества по химическим формулам. Количество вещества. Моль, постоянная Авогадро. Молярная масса.Кратные еденицы количества вещества. Молярная масса вещества. Расчет молярных масс веществ по их химическим формулам, выполнение упражнений с использованием понятий «молярная масса», «моль». Закон Авогадро. Молярный объем газов, нормальные условия. Расчетные задачи. Расчеты с использованием понятий «количество вещества», «молярная масса», «молярный объем газов», «постоянная Авогадро». Решение задач и упражнений с использованием понятий «количество вещества», «молярная масса», «молярный объем газов», «постоянная Авогадро». Тема 3 Соединения химических элементов (13 ч) Степень окисления, валентность. Бинарные соединения металлов и неметаллов Валентность, степень окисления, формула вещества. Химическая номенклатура. Составление формул бинарных соединений по степеням окисления элементов. Определение степени окисления элементов по химической формуле соединения. Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения. Гидриды. Хлороводород и соляная кислота. Аммиак и нашатырный спирт. Основания. Состав и названия оснований, их классификация. Номенклатура оснований. Расчеты по формулам оснований. Индикаторы. Качественные реакции . Кислоты. Состав и названия кислот, их классификация. Кислотные остатки и 24.10 29.10 31.10 12.11 14.11 19.11 21.11 26.11 28.11 3.12 основность кислот. Шкала рН. Номенклатура кислот. Расчеты по формулам кислот. Изменение цвета индикатора. Соли как производные кислот и оснований Соли как производные кислот и оснований Обобщение и систематизация знаний по теме «Классификация неорганических веществ» Соли как производные кислот и оснований. Номенклатура солей, их состав. Составление формул солей. Растворимость солей в воде. Соли как производные кислот и оснований. Названия солей, их состав. Составление формул солей. Карбонат кальция. Фосфат кальция. Хлорид натрия. Классификация сложных веществ, упражнения на составление формул веществ по названиям, расчеты по формулам соединений. Состав и названия оснований, их классификация. Состав и названия кислот, их классификация. Соли. Составление формул солей. Лабораторная работа № 1 Знакомство с образцами веществ разных классов. 29 Аморфные и кристаллические вещества. Молекулярные кристаллические вещества 30 Чистые вещества и смеси 31 Массовая и объемная доли компонентов в смеси, в том числе и доля примесей Расчеты с понятием « доля». Решение задач. Тренинг по решению задач, связанных с понятием « доля» Аморфные и кристаллические вещества. Молекулярные кристаллические вещества 17.12 Свойства кристаллических решеток. Взаимосвязь кристаллических решеток и видов химической связи. Физические свойства веществ с различными типами кристаллических решеток. Зависимость свойств веществ от типа кристаллических решеток. Чистые вещества и смеси. Химический анализ. Примеры жидких, твердых, и 19.12 газообразных смесей. Свойства чистых веществ и смесей. Их состав. Ознакомление с образцами горных пород. Лабораторный опыт №2 Разделение смесей. Массовая и объемная доли компонента. Объемная доля и объемный состав 24.12 воздуха. 26 27 28 32 33 34 Контрольная работа №2 по теме «Соединения химических элементов» 5.12 10.12 12.12 Расчетные задачи. Вычисление массовой и объемной доли компонентов в смеси. 26.12 Вычисление массовой и объемной доли компонентов Расчетные задачи. Вычисление массовой доли вещества в растворе по известной массе растворенного вещества и массе растворителя. Вычисление массы растворенного вещества и растворителя, необходимых для приготовления определенной массы раствора с известной массовой долей растворенного вещества. Степень окисления, валентность. Основания. Состав и названия оснований , кислот и солей , их классификация. Расчеты по формулам соединений. Расчетные задачи. Вычисление массовой доли вещества в растворе по известной массе растворенного вещества и массе растворителя. 14.01 16.01 35 Физические явления 36 Химические реакции 37 Химические уравнения. Реакции разложения 38 Реакции соединения. 39 Реакции замещения 40 Реакции обмена 41 Решение задач на нахождение количества, массы, объема продукта реакции по количеству, массе, объему исходного Тема 4 Изменения, происходящие с веществами (10ч) Физические явления. Способы очистки веществ. Дистилляция, или перегонка Кристаллизация и выпаривание. Фильтрование. Отстаивание. Делительная воронка. Ценрифугирование. Лабораторный опыт №3 Сравнение скорости испарения воды и спирта по исчезновению их капель на фильтровальной бумаге. Химическая реакция; признаки химической реакции, реакции горения, экзо- и эндотермические реакции. Закон сохранения массы веществ. Условия течения химических реакций Химические уравнения. Уравнения химических реакций; индексы и коэффициенты. Сущность реакций разложения. Катализаторы. Ферменты. Скорость химической реакций. Реакции соединения. Обратимые и необратимые реакции. Цепочки переходов, или превращений. Осуществление переходов: S—SO2—H2SO3 Р—Р2О5—Н3РО4 Са—СаО—Са(ОН)2 Лабораторный опыт №4 Окисление меди в пламени спиртовки или горелки. Лабораторный опыт № 5 Помутнение известковой воды от выдыхаемого углекислого газа. Д. 1.Взаимодействие щелочных металлов с водой. 2.Взаимодействие цинка и алюминия с растворами соляной и серной кислот. 3.Взаимодействие металлов ( железа, алюминия, цинка) с растворами солей. Ряд активности металлов Условия взаимодействия металлов с растворами кислот и солей. Лабораторный опыт № 6 Замещение меди в растворе хлорида меди (11) железом. Реакции обмена. Реакция нейтрализации .Условия протекания реакций обмена в растворах до конца. Лабораторный опыт №7 Получение углекислого газа взаимодействием соды и кислоты. Решение задач на нахождение количества, массы, объема продукта реакции по количеству, массе, объему исходного вещества. Те же расчеты с понятием «доля» 21.01 23.01 28.01 30.01 4.02 6.02 11.02 42 43 44 45 46 47 48 49 вещества. Типы химических реакций на Электролиз. Фотолиз. Фотосинтез. Условия взаимодействия оксидов металлов и примере свойств воды. неметаллов с водой. Гидролиз. Обобщение и Решение задач и упражнений, подготовка к контрольной работе. Химические систематизация знаний по реакции. Реакции разложения. Реакции соединения. Реакции замещения Решение теме «Изменения, задач на нахождение количества, массы, объема продукта реакции по количеству, происходящие с массе, объему исходного вещества. веществами» Контрольная работа №3 по Химические реакции. Реакции разложения. Реакции соединения. Реакции теме «Изменения, замещения Решение задач на нахождение количества, массы, объема продукта происходящие с реакции по количеству, массе, объему исходного вещества. веществами» Тема 5 Практикум № 1 Простейшие операции с веществом (5 ч) Практическая работа №1 Правила техники безопасности при работе в химической лаборатории. Приемы обращения Лабораторное оборудование. Приемы обращения с нагревательными приборами и лабораторным лабораторным оборудованием оборудованием 13.02 18.02 20.02 25.02 Практическая работа №2 Наблюдения за изменениями, происходящими с горящей свечой и их описание. Практическая работа №3 Анализ почвы и воды. Практическая работа №4 Признаки химических реакций. Правила техники безопасности при работе в химической лаборатории. Признаки химических реакций. Физические явления при горении свечи. Наблюдения за изменениями, происходящими с горящей свечой. Обнаружение продуктов горения в пламени. Влияние воздуха на горение свечи. 27.02 Правила техники безопасности при работе в химической лаборатории. Анализ почвы и воды. Механический анализ почвы. Определение прозрачности воды. Правила техники безопасности при работе в химической лаборатории Признаки химических реакций. 4.03 Практическая работа №5 Приготовление раствора сахара и определение массовой доли сахара в растворе Правила техники безопасности при работе в химической лаборатории. Приготовление раствора сахара и определение массовой доли сахара в растворе. Вычисление массы растворенного вещества и растворителя, необходимых для приготовления определенной массы раствора с известной массовой долей растворенного вещества. 11.03 Тема 6 Растворение. Растворы. Свойства растворов электролитов (14 ч) 6.03 50 51 52 53 54 55 56 57 58 59 60 Растворение. Растворимость веществ в воде. Электролитическая диссоциация Основные положения теории электролитической диссоциации (ТЭД) Ионные уравнения реакций Практическая работа №6 Ионные реакции. Практическая работа №7 Условия протекания химических реакций до конца. Кислоты в свете ТЭД, их классификация и свойства Растворение – как физико – химический процесс. Физическая и химическая теория 13.03 растворов.Растворы, гидраты, кристаллогидраты, кривые растворимости, насыщенные, ненасыщенные, пересыщенные растворы. Электролитическая диссоциация .Электролиты и неэлектролиты, степень 18.03 электролитической диссоциации, сильные и слабые электролиты. Степень электролитической диссоциации. Основные положения теории электролитической диссоциации (ТЭД). Ионы, катионы, 20.03 анионы. Ионные уравнения реакций Реакции обмена, идущие до конца. Молекулярные, ионные полные и сокращенные уравнения. Реакции нейтрализации. Правила техники безопасности при работе в химической лаборатории. Ионные реакции. Молекулярные и ионные уравнения. Правила техники безопасности при работе в химической лаборатории Условия протекания химических реакций до конца. Кислоты в свете ТЭД, их классификация и свойства. Условия протекания типичных реакций кислот. Ряд напряжения металлов. Лабораторная работа №8 Реакции, характерные для растворов кислот (соляной и ли серной ). Основания в свете ТЭД, Основания в свете ТЭД, их классификация и свойства. Типичные свойства их классификация и оснований. Условия протекания типичных реакций оснований. свойства Лабораторная работа №9 Реакции, характерные для растворов щелочей. Лабораторная работа №10 Получение и свойства нерастворимого основания ( гидроксида меди). Классификация и свойства Классификация оксидов. Солеобразующие (кислотные и основные), оксидов. несолеобразующие оксиды Типичные свойства кислотных оксидов. Типичные свойства основных оксидов. Условия протекания кислотных и основных оксидов с водой. Лабораторная работа №11 Реакции, характерные для основных оксидов. Лабораторная работа №12Реакции, характерные для кислотных оксидов. Соли в свете ТЭД Соли в свете ТЭД. Соли средние, кислые и основные. Типичные свойства средних солей: взаимодействие их с кислотами, щелочами, другими солями металлами. Два правила ряда напряжения металлов. Лабораторная работа №13 Реакции характерные для растворов солей. Практическая работа №8 Правила техники безопасности при работе в химической лаборатории Генетическая 1.04 3.04 8.04 10.04 15.04 17.04 22.04 24.04 61 62 63 64 65 66 67 68 69 Свойства кислот, оснований оксидов и солей. Генетическая связь между классами неорганических веществ Практическая работа №9 Решение экспериментальных задач Контрольная работа №4 Теория электролитической диссоциации Окислительно – восстановительные реакции Урок – упражнение в составлении окислительно – восстановительных реакций Свойства веществ изученных классов соединений в свете окислительно – восстановительных реакций Обобщение и систематизация знаний. Окислительно – восстановительные реакции Строение атома. Периодическая система химических элементов.Классификация неорганических веществ. Итоговая контрольная связь между классами соединений Свойства кислот, оснований, оксидов и солей Генетическая связь между неорганическими веществами. Генетический ряд металлов и его разновидности. Генетический ряд неметаллов и его разновидности Осуществление переходов между классами неорганических соединений. Условия протекания реакций солей с металлами. Правила техники безопасности при работе в химической лаборатории Решение экспериментальных задач. 29.04 Ионные уравнения реакций. Кислоты в свете ТЭД, их классификация и свойства. Основания в свете ТЭД, их классификация и свойства. Соли в свете ТЭД. Типичные свойства средних солей: взаимодействие их с кислотами, щелочами, другими солями металлами. Два правила ряда напряжения металлов. Окислительно – восстановительные реакции. Окислитель, восстановитель, уравнения электронного баланса. 8.05 Окислительно – восстановительные реакции. Составление уравнений ОВР методом электронного баланса 15.05 Характеристика свойств металлов, неметаллов, кислот, солей в свете ОВР. Составление уравнений ОВР методом электронного баланса 20.05 Окислительно – восстановительные реакции. Характеристика свойств металлов, неметаллов, кислот, солей в свете ОВР 22.05 Периодический закон и периодическая система химических элементов Д.И. Менделеева и строение атома. Порядковый номер элемента, номер группы, подгруппы элементов, номер группы. Классификация неорганических веществ. 27.05 Строение атома. 29.05 6.05 13.05 работа. 70 Периодическая система химических элементов .Классификация неорганических веществ Окислительно – восстановительные реакции. Ионные уравнения реакций. Типы химических реакций Резерв График контрольных работ контрольных работ Контрольная работа №1 Атомы химических элементов Контрольная работа №2 Соединения химических элементов Контрольная работа №3 по теме «Изменения, происходящие с веществами» Контрольная работа №4 Теория электролитической диссоциации Дата проведения 17.10 16.01 20.02 8.05 Итоговая контрольная работа. 29.05
