Фазовые равновесия в двухкомпонентных системах
advertisement
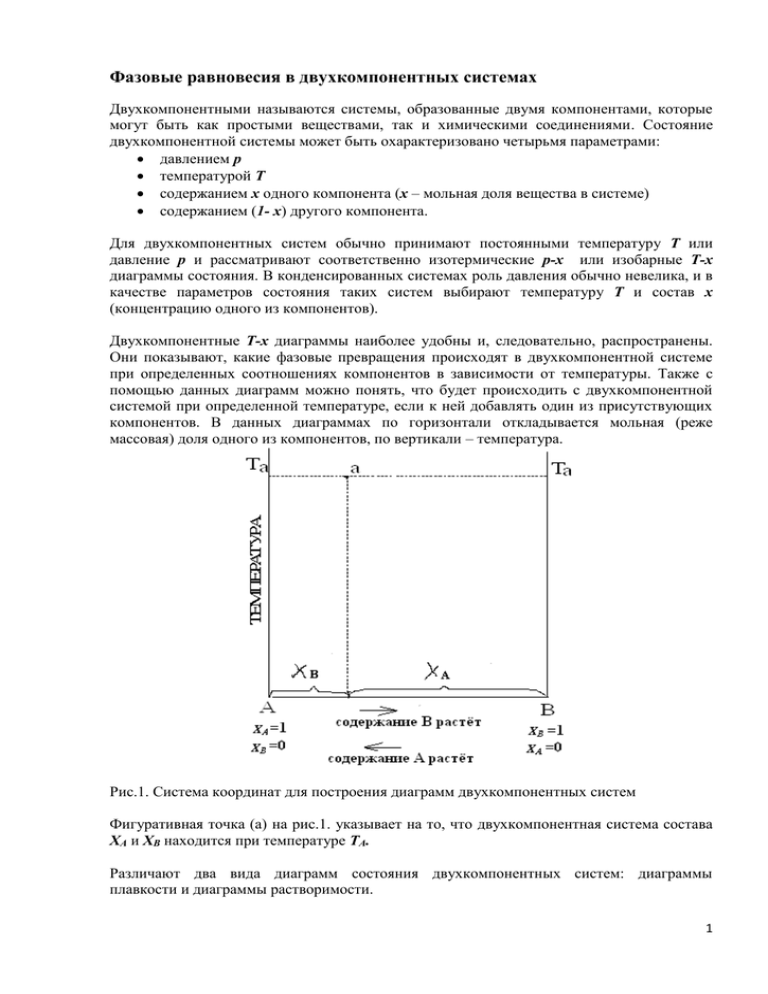
Фазовые равновесия в двухкомпонентных системах Двухкомпонентными называются системы, образованные двумя компонентами, которые могут быть как простыми веществами, так и химическими соединениями. Состояние двухкомпонентной системы может быть охарактеризовано четырьмя параметрами: давлением p температурой T содержанием х одного компонента (х – мольная доля вещества в системе) содержанием (1- х) другого компонента. Для двухкомпонентных систем обычно принимают постоянными температуру T или давление p и рассматривают соответственно изотермические p-x или изобарные T-x диаграммы состояния. В конденсированных системах роль давления обычно невелика, и в качестве параметров состояния таких систем выбирают температуру T и состав x (концентрацию одного из компонентов). Двухкомпонентные Т-х диаграммы наиболее удобны и, следовательно, распространены. Они показывают, какие фазовые превращения происходят в двухкомпонентной системе при определенных соотношениях компонентов в зависимости от температуры. Также с помощью данных диаграмм можно понять, что будет происходить с двухкомпонентной системой при определенной температуре, если к ней добавлять один из присутствующих компонентов. В данных диаграммах по горизонтали откладывается мольная (реже массовая) доля одного из компонентов, по вертикали – температура. Рис.1. Система координат для построения диаграмм двухкомпонентных систем Фигуративная точка (а) на рис.1. указывает на то, что двухкомпонентная система состава XА и XB находится при температуре ТА. Различают два вида диаграмм состояния двухкомпонентных систем: диаграммы плавкости и диаграммы растворимости. 1 Диаграммы плавкости Такие диаграммы служат для установления условий равновесия между твёрдыми и жидкими фазами (система т-ж). Равновесия в системах твёрдое вещество-жидкость встречаются при изучении различных металлических сплавов, силикатов (стекло), водных растворов солей, систем, состоящих из органических соединений и т.д. Особое значение имеют исследования зависимости температур начала и конца кристаллизации твёрдого вещества от состава системы. Графики, выражающие эту зависимость, называются диаграммами плавкости. По таким диаграммам можно судить о наличии тех или иных фаз, их числе, температуре кристаллизации смеси определённого состава и т.д. Рассмотрим наиболее простую диаграмму плавкости (рис.2.). Простейший вариант соответствует случаю, когда компоненты А и В образуют одну жидкую фазу (расплав или раствор), при охлаждении которой выделяются (кристаллизуются) только индивидуальные вещества (не образуются ни твердые растворы, ни химические соединения). Диаграммы такого типа встречаются при изучении равновесий в системах Sn-Pb, Zn-Cd, бензол-нафталин, NaCl-вода, KCl-вода и др. Рис. 2. Диаграмма плавкости двухкомпонентной системы А-В (диаграмма состояния системы с простой эвтектикой). TA – температура кристаллизации вещества А; TB – температура кристаллизации вещества В. На диаграмме каждое поле является областью в координатах температуры и состава, в которых существует одна или две фазы. На данном рисунке все поля подписаны. Для начала давайте попробуем эту диаграмму описать. Что мы на ней можем увидеть? Большую часть диаграммы занимает однофазная жидкость L (она представляет собой смесь жидких веществ А и В). При определенных температурах в данной жидкости начинают образовываться различные твердые фазы. Линия на фазовой диаграмме, отделяющая полностью жидкую систему от системы, в которой присутствуют твердые фазы, называется ликвидусом или линией начала кристаллизации. Она состоит из двух ветвей ТАЕ и ТВЕ. Линия ликвидуса (или линия жидкости) – линия, изображающая зависимость от состава температуры начала выделения из жидкой фазы твёрдого компонента (начала равновесной кристаллизации). Выше линии ликвидуса находится область жидкости L. 2 Линия, отделяющая полностью твердофазную систему от системы, в которой присутствуют жидкие фазы, называется солидусом или линией конца первичной кристаллизации. На диаграмме это линия MN. Линия солидуса (или линия твёрдой фазы, или эвтектическая прямая) – линия, изображающая зависимость от состава температуры окончания равновесной кристаллизации при охлаждении (или начала плавления при нагревании). Ниже линии солидуса расположено фазовое поле твёрдого состояния системы (поле SA + SB), отвечающее условиям существования механической смеси твёрдых веществ А и В Между линиями ликвидуса и солидуса находятся поля сосуществования жидкой фазы с твёрдыми А и В (поля L + SA и L + SB). Точка пересечения линий ликвидуса ТАЕ и ТВЕ называется точкой эвтектики Е. Эвтектическая точка показывает температуру ТЕ и состав расплава, который одновременно находится в равновесии с кристаллами вещества А и вещества В. Расплав, соответствующий точке Е, называется эвтектическим расплавом (эвтектической смесью или эвтектикой). Эвтектика – это смесь веществ, имеющая минимальную температуру замерзания. Температура ТЕ называется эвтектической температурой; это минимальная температура замерзания смеси веществ. Смесь кристаллов А и В, которая одновременно выпадает при температуре ТЕ, называется твёрдой эвтектикой. Твёрдая эвтектика состоит из двух твёрдых фаз (кристаллов А и В). Таким образом, диаграмма плавкости разделена на четыре участка: L (расплав или жидкость), L + SA (расплав + кристаллы вещества А), L + SB (расплав + кристаллы вещества В), SA + SB (кристаллы вещества А + кристаллы вещества В). Рассмотрим процесс охлаждения расплава, заданного фигуративной точкой С на диаграмме. (Фигуративной называется любая точка на диаграмме, характеризующая температуру и состав системы в целом). Рис.3. Процесс охлаждения расплава, заданного фигуративной точкой С. При охлаждении жидкой фазы из начального состояния С фигуративная точка системы в целом движется вниз по прямой. В точке К её пересечения с линией ликвидуса начинается кристаллизация компонента В. Система становится двухфазной. По мере кристаллизации 3 вещества B жидкость обогащается компонентом А. Состав жидкости изменяется по ветви ликвидуса ТВЕ. При дальнейшем охлаждении системы продолжается понижение температуры и выпадение кристаллов B из расплава. Для определения состава расплава в фигуративной точке D проведём через эту точку горизонтальную линию OQ, которая называется коннодой (нодой). По точкам O и Q определяют температуру и состав равновесных фаз. Точка Q – состав твёрдой фазы (100% кристаллы B), точка O – состав расплава (жидкой фазы). Состав фаз, находящихся в равновесии, определяется правилом рычага: если одна фаза при изменении параметров системы разлагается на две другие фазы, то количественное соотношение образующихся фаз будет обратно пропорционально длинам отрезков от точки состава исходной фазы до точек состава образующихся фаз. содержание жидкой фазы длина отрезка 𝐷𝑄 = содержание твёрдой фазы длина отрезка 𝑂𝐷 содержание жидкой фазы = длина отрезка 𝐷𝑄 ∙ 100% длина отрезка 𝑂𝑄 содержание твёрдой фазы = длина отрезка 𝑂𝐷 ∙ 100% длина отрезка 𝑂𝑄 В точке F пересечения прямой CF с линией солидуса MN начинается кристаллизация компонента А. Система становится трёхфазной (жидкость и две твёрдые фазы А и В). Происходит эвтектическая кристаллизация. Раствор имеет эвтектический состав, кроме того, соотношение масс кристаллов А и В в выпадающей эвтектике должно быть таким же, как и массовое содержание веществ А и В в расплаве эвтектического состава. В связи с тем, что кристаллы А и В при кристаллизации твёрдой эвтектики выпадают одновременно и у них нет условий для роста, твёрдая эвтектика имеет мелкокристаллическое строение. Застывший расплав состава F при температуре ниже TE состоит из сравнительно крупных кристаллов В, которые выпадали в интервале температур между точками K и F, и мелкокристаллической смеси кристаллов А и В в твёрдой эвтектической смеси. В точке G продолжается охлаждение двух твёрдых фаз. Линия CKOE называется путь кристаллизации. Она показывает изменение состава жидкой фазы от начала процесса охлаждения расплава до её исчезновения. Определим число степеней свободы различных точек на диаграмме (рис. 4.). Для конденсированных систем правило фаз можно записать следующим образом: С = К - Ф + 1. Точка C - чистый компонент А, К=1, Ф=2, С=1-2+1=0, система безвариантна. Точка D - чистый компонент В, К=1, Ф=2, С=1-2+1=0, система безвариантна. 4 Рис. 4. Иллюстрация к определению степеней свободы. Точка m: К=2 (вещества А и В), Ф=1 (жидкая фаза), С=2-1+1=2, система бивариантна, т.е. можно в определённых пределах вводить любой из двух компонентов и изменять температуру – система будет оставаться гомогенной. Точка n: К=2 (вещества А и В), Ф=2 (жидкая и твёрдая фазы), С=2-2+1=1, система одновариантна, т.е. без изменения числа фаз можно менять только один параметр – либо температуру, либо состав смеси. Точка k: К=2 (вещества А и В), Ф=2 (твёрдое вещество А и твёрдое вещество В), С=22+1=1, система одновариантна. Точка Е: К=2 (вещества А и В), Ф=3 (твёрдое вещество А, твёрдое вещество В и жидкая фаза), С=2-3+1=0, система безвариантна. Точка Е характеризуется строго определённым составом XA и XB, а также температурой TE. Таблица 1 Процесс охлаждения расплава, заданного точкой С Точка на Что происходит Число Число Что означает число рис.3 фаз Ф степеней степеней свободы свободы С С Охлаждение расплава 1 2 Можно менять температуру и состав расплава К Появляются первые 2 1 Можно менять кристаллы компонента В только температуру D Продолжают выпадать 2 1 Можно менять или кристаллы компонента В, температуру, или состав расплава выражается состав расплава точкой О, состав твёрдой фазы – точкой Q F Одновременно 3 0 Система инвариантна кристаллизуются (безвариантна) компоненты А и В G Охлаждение механической 2 1 Можно менять смеси компонента А и только температуру компонента В 5 Диаграммы состояния системы с эвтектикой характерны и для охлаждающих смесей (рис.5). Рис.5. Диаграмма состояния системы вода – хлорид натрия При смешении льда/снега ( температура плавления 273К или 0оС) с кристаллами NaCl лёд начинает таять, соль растворяется в воде, и образуется трёхфазная система, состоящая из льда, кристаллов NaCl и раствора NaCl. Три фазы могут сосуществовать при эвтектической температуре -21,2оС и составе раствора 23,1% NaCl. Поэтому, пока в системе имеется три фазы, в равновесной смеси поддерживается температура -21,2оС. На этом принципе основано применение охлаждающих смесей. Эвтектическая смесь льда и хлорида кальция, в составе которой 29,9% CaCl2, плавится при температуре -55оС. При температурах ниже эвтектической смеси льда и соли могут существовать только в твёрдом состоянии. Таблица 2 Системы вода – соль, образующие эвтектические смеси Соль, образующая с водой эвтектическую смесь Na2SO4 NH4Cl NaCl CuCl2 CaCl2 Температура плавления эвтектики, оС -1,2 -16,0 -21,2 -40,0 -55,0 Состав эвтектической смеси, масс % соли 3,9 19,4 23,1 36,3 29,9 Диаграммы растворимости с неограниченной растворимостью компонентов Если два компонента неограниченно растворяются в твёрдом и жидком состоянии, то возможно существование только двух фаз – жидкого раствора (расплава) и твёрдого раствора. Диаграмма состояния с неограниченной растворимостью компонентов А и В в жидком и твёрдом состоянии представлена на рис. 6. 6 Рис.6. Диаграмма состояний с неограниченной растворимостью компонентов Компоненты сплавов: компонент А и компонент В; фазы: жидкий раствор Ж и кристаллы твердого раствора α. Линия С1Д – линия ликвидуса, линия С2Д – линия солидуса. Ниже линии солидуса находится область существования твёрдых растворов, выше линии ликвидуса – область жидких растворов, между линиями ликвидуса и солидуса – область равновесного существования твёрдых и жидких растворов. Число компонентов системы равно двум, но твёрдый раствор, состоящий из двух компонентов, образует в твёрдом виде гомогенную однофазную (Ф=1) систему. Рассмотрим кристаллизацию расплава, заданного точкой I. При температуре t1 образуются первые кристаллы твердого раствора состава точки m, т.е. содержащие Вm´ компонента А и Аm´ компонента В. Ввиду того, что в образовавшемся твердом растворе компонента В больше, он является растворителем. Значит в начале кристаллизации выделяются кристаллы В(А) – твердого раствора компонента А в компоненте В. С понижением температуры кристаллы твердого раствора продолжают выделяться. При этом их состав меняется по линии солидуса. Одновременно с изменением состава твердого раствора изменяется и состав жидкой фазы по линии ликвидуса. Следовательно происходит перераспределение атомов компонентов А и В между жидкой составляющей и кристаллами твердого раствора. Так, при температуре, соответствующей точке О, состав твердого раствора определяется точкой n, а жидкой фазы – точкой p. К концу кристаллизации (в условиях равновесия) все кристаллы становятся однородными и имеют состав, соответствующий точке К. Выравнивание состава кристаллов происходит за счет диффузии, т.е. перемещения атомов компонента А из жидкого расплава (в котором концентрация А более высокая) в имеющиеся кристаллы В(А). 7 Таблица 3 Процесс охлаждения расплава, заданного точкой I Точка Что происходит на рис. 6 Охлаждение расплава I 1 О 2 3 Появляются первые кристаллы твёрдого раствора состава m´ из расплава состава К Продолжается кристаллизация твёрдого раствора состава n´ из расплава состава p´ Исчезает последняя капля расплава. Состав твёрдого раствора равен составу расплава К Продолжается охлаждение твёрдого раствора Число фаз Ф 1 Число степеней свободы С 2 2 1 2 1 2 1 1 2 Что означает число степеней свободы Можно менять температуру и состав расплава Можно менять или температуру или состав расплава Можно менять или температуру или состав расплава Можно менять или температуру или состав расплава Можно менять температуру и состав твёрдого раствора Диаграммы кипения Диаграмма кипения – частный случай диаграммы состояния. Диаграмма кипения (рис.7.) содержит две кривые – линию жидкости и линию пара, построенные при постоянном давлении. Нижняя линия – линия жидкости – показывает зависимость температуры кипения жидкой смеси от её состава. Верхняя линия – линия пара – показывает зависимость температуры конденсации насыщенного пара от состава паровой смеси. Рис. 7. Диаграмма кипения смеси бензола и толуола 8 По оси ординат отложена температура. Температура кипения чистого бензола обозначена tБ , температура кипения чистого толуола обозначена tТ. Линии жидкости и пара делят диаграмму на три поля. Поле (1) – область пара. В этой области существует только одна фаза – насыщенный пар. В каждой точке этой области плотность системы и другие характеристики одинаковы, поэтому эта область называется гомогенной. Поле (2) – область жидкости. В этой области существует тоже одна фаза, но эта фаза – жидкость. Область жидкости – тоже гомогенная область. Поле (3) - область существования кипящей жидкой смеси и равновесного с ней пара. Здесь сосуществуют две фазы. Это гетерогенная область. Рассмотрим состояние системы, заданной фигуративной точкой (а) на диаграмме. Состав системы в этой точке: 51% масс. бензола и 49% масс. толуола. При нагревании системы с постоянным составом её фигуративная точка движется вертикально на фазовой диаграмме. Точка (а) находится в гетерогенной области (3), где существуют в равновесии жидкость и насыщенный пар. В гетерогенной области составы жидкости и находящегося с ней в равновесии пара не совпадают с общим составом. Для определения составов жидкости и находящегося с ней в равновесии пара нужно провести ноду (отрезок изотермы вс в двухфазной области диаграммы). Пересечение ноды с линией жидкости (точка в) определяет состав жидкой фазы: 40% масс. бензола и 60% масс. толуола. Пересечение ноды с линией пара (точка с) определяет состав паровой фазы: 62% масс. бензола и 38% масс. толуола. Как видно, при кипении в двухфазной области пар обогащается легкокипящим (низкокипящим) компонентом – бензолом. Этот факт находится в соответствии с первым законом Коновалова, согласно которому пар обогащается (по сравнению с жидкостью) легкокипящим компонентом. Диаграмма кипения позволяет также найти массовое соотношение между жидкой и паровой фазами с помощью правила рычага. Согласно этого правила произведение массы жидкой фазы на плечо, соединяющее точку опоры (а) с линией жидкости, равно произведению массы пара, на плечо, соединяющее точку (а) с линией пара: 𝒎жидкости ∙ 𝒂𝒃 = 𝒎пара ∙ 𝒂𝒄 Если известна общая масса системы m, то, используя правило рычага, можно найти массы сосуществующих фаз. Выразим массу пара через общую массу системы и массу жидкости: 𝒎пара = 𝒎 − 𝒎жидкости Правило рычага в этом случае примет вид: 𝒎жидкости 𝒂𝒄 = 𝒎 − 𝒎жидкости 𝒂𝒃 Определив по диаграмме размер отрезков ab и ac, можно найти массу жидкости, а затем и массу пара в двухфазной области. Правило рычага используют только в двухфазной области. 9 Диаграмма кипения позволяет описать процесс простой перегонки жидкости. Для примера рассмотрим простую перегонку смеси, содержащей 40% масс. бензола и 60% масс. толуола. При нагревании такой смеси до температуры 95оС (точка b на рис. 7.) образуется пар, обогащённый по сравнению с жидкостью, бензолом (точка c). Если пар отвести из системы, то с паром уйдёт больше бензола, чем толуола, и в системе останется жидкость, обеднённая бензолом. Оставшаяся жидкость будет кипеть уже при более высокой температуре. При её кипении вновь образуется пар, обогащённый, по сравнению с ней, бензолом. Отвод пара вновь оставит в системе жидкость, обеднённую бензолом (следовательно, обогащённую толуолом). Продолжая этот процесс, можно получить в жидкой фазе чистый толуол (точка tТ). Описанный процесс и является сущностью простой перегонки, с помощью которой из раствора можно выделить трудно кипящий компонент. Изображённая на рис.7 диаграмма описывает идеальные растворы. Свойства реальных жидких смесей отклоняются от идеальных. Линии пара и линии жидкости могут прогнуться вниз (рис.8, а) или, наоборот, выгнуться вверх (рис. 8, б). Рис. 8. Диаграммы кипения неидеальных систем Отклонения систем от идеальности могут быть столь велики, что на диаграммах кипения появляется минимум (рис.9, а) или максимум (рис.9, b). Рис. 9. Диаграммы кипения с азеотропными точками 10 В точке максимума или минимума линии пара и жидкости соприкасаются. Состав смеси, отвечающий минимуму или максимуму на диаграмме кипения, называется азеотропным (нераздельнокипящим), т.е. азеотропными называются растворы, у которых составы пара и жидкости одинаковы. При кипении азеотропной смеси состав жидкой фазы и находящейся с ней в равновесии насыщенной паровой фазы одинаков, как и при кипении индивидуальных веществ (второй закон Коновалова). Поэтому азеотропную смесь невозможно разделить на компоненты простой перегонкой. Для разделения азеотропов проводят перегонку азеотропной смеси с добавлением третьего компонента, или осуществляют перегонку азеотропной смеси при другом давлении, поскольку при изменении давления азеотропная точка смещается. Таблица 4 Примеры азеотропных смесей Компоненты смеси Состав азеотропной смеси, масс.% Температура кипения компонента, оС Вода 4,37 100 Этанол Вода 95,63 79,8 78,4 100 Температура кипения азеотропной смеси, о С 78,13 110 HCl Вода 20,2 32 -84 100 68 61 86 80,1 122 HNO3 Бензол 58 Метанол 39 64,7 Сведения о равновесии особенно важны для химической и нефтехимической отраслей промышленности, так как в исходных материалах, промежуточных и конечных продуктах очень часто есть системы с азеотропными смесями. При изучении равновесия между летучей жидкой смесью используют не только зависимость температур кипения от состава при постоянном давлении (изобары T-x), но и зависимость давления пара от состава при постоянной температуре (изотермы p-x), также зависимость состава пара y от состава летучей смеси x (x-y диаграммы). Рис.10. T-x, p-x и x-y диаграммы смесей без азеотропа 11 Рис. 11. T-x, p-x и x-y диаграммы азеотропных смесей с минимумом и максимумом температуры кипения 12 Фазовые диаграммы частично смешивающихся жидкостей К частично смешивающимя жидкостям относятся многие технически важные смеси, например, вода – изобутиловый спирт, вода – анилин, водонефтяные эмульсии и другие. Для частично смешивающихся жидкостей (жидкости с ограниченной взаимной растворимостью) возможны четыре типа фазовых диаграмм. У них в определённой области температур и составов возможно расслоение на две фазы, тогда как вне этой области жидкости образуют гомогенный раствор (рис. 12). Рис. 12. Диаграммы состав-температура для двухкомпонентных ситем с различной взаимной растворимостью. Эти диаграммы построены при давлении, превышающем давление насыщенного пара в данной системе, поэтому область пара на диаграммах отсутствует. В самом общем случае граница между гомогенной и гетерогенной областями является замкнутой кривой (рис. 12 а). Вне этой кривой система представляет собой одну гомогенную жидкую фазу – раствор, компонентами которой являются жидкости А и В. Внутри этой кривой система гетерогенна: в ней существуют две жидкие фазы – насыщенный раствор компонента В в жидкости А и насыщенный раствор компонента А в 13 жидкости В. Составы равновесных фаз при любой заданной температуре можно определить, проведя ноду. В этих системах взаимная растворимость жидкостей увеличивается как с повышением, так и с понижением температуры. Составы равновесных фаз постепенно сближаютмя и становятся одинаковыми при достижении верхней или нижней критической температуры растворения (ВКТР и НКТР). Системы, обладающие обеими критическими точками растворения, встречаются редко. Примеры: никотин-вода, метилэтилкетон-вода. Диаграмма, изображённая на рис. 12 в), характерна для систем, в которых кристаллизация одной из жидких фаз начнётся прежде, чем температура системы опустится до НКТР. Примеры: анилин-вода, фенол-вода. На рис. 12 с) изображена диаграмма, характерная для систем, в которых один из компонентов достигнет критического состояния раньше, чем температура системы поднимется до ВКТР. Примеры: диэтиламин-вода, триэтиламин-вода. Если не удаётся наблюдать ни ВКТР, ни НКТР, то диаграмма примет вид, изображённый на рис. 12 d). Примеры – хлороформ-вода, диметиловый эфир-вода. В пределах гомогенной зоны этих диаграмм можно одновременно и произвольно изменять два параметра – температуру и состав раствора, не вызывая при этом изменеия числа и характера равновесных фаз (число степеней свободы С= 2). А в пределах гетерогенной зоны каждой температуре соответствует определённый состав сопряжённых фаз, и произвольно можно менять только один из параметров – либо температуру, либо состав раствора (число степеней свободы С=1). 14